前言
免疫细胞化学(Immunocytochemistry)又称免疫组织化学(Immunohistochemistry)是组织化学的分支,它是用标记的特异性抗体(或抗原)对组织内抗原(或抗体)的分布进行细胞和组织原位的检测技术。Coons及其同事们于1941年首次用荧光素标记抗体检测肺组织内肺炎双球菌获得成功,开创了细胞化学中“免疫细胞化学”这一新篇章 。免疫细胞化学的迅猛发展是在近10余年。继Nakan建立的酶标记抗体技术后, Sternberger在此基础上改良并建立了辣根过氧化物酶-抗过氧化物酶(PAP)技术,使免疫细胞化学得到日益广泛的应用。80年代,Hsu等建立了抗生物素-生物素(ABC)法之后,免疫金-银染色法、半抗原标记法、免疫电镜技术等相继问世,使免疫细胞化学技术成为当今生物医学中形态、功能、代谢综合研究的一项有力工具,近年来,随着抗原的提纯和抗体标记技术的改进,特别是单克隆抗体技术的引入,使免疫细胞化学在生物基础研究如病理学、神经科学、发育生物学、细胞生物学和微生物、寄生虫、病毒等病原体的诊断和研究中日益显示出巨大的实用价值,并使实验向临床,向定量和分子水平深入。鉴于免疫细胞化学的发展极为迅速,我们在原编写的“实用免疫细胞化学”一书的基础上汇入了免疫细胞化学国内外最新进展并增编核酸分子杂交技术。希望本书能有益于我国生命科学的研究,并能给读者新的信息和启示。
本书以理论与开发技术相结合,实用为主 ,尽力兼顾技术方法的先进性和科学性,全书正文廿三章 及附录1~4,计约84万字,105幅插图。第一章 为总论,简述免疫细胞化学的发展概况、有关基础理论和技术。第二章 叙述了抗原和抗体的制备。第三至八章 分别详述了免疫荧光细胞化学、免疫酶细胞化学、免疫金、银和铁标记细胞化学、亲和免疫细胞化学。电子显微镜免疫细胞化学和蛋白质及多肽激素的放射免疫测定步骤、原位投射自显影技术等第十一至十七章 分别介绍免疫细胞化学在神经科学、肿瘤病学、消化器官、皮肤病学、自身免疫性疾病和病原体的快速检查方法及应用。
近10多年来,相继发现了多种亲合物质,如植物凝集素(lectins)与糖结合物(glycol conju-gates)、葡萄球菌A蛋白(staphylococal protein A)与IgG、生物素( biotin)与卵白素(亲合素)(A-vidin)、激素、脂质与受体等。这些物质是一些有多价结合能力的物质,不但亲和物质之间有高度亲合力,而且可以与标记物如荧光素、酶、同位素、铁蛋白等相结合。Bayer(1976)将这种利用两种物质之间的高度亲合力而相互结合的化学反应,进行细胞化学检测,称为亲合细胞化学(affinity cytochemistry)。它和免疫细胞化学的区别是亲合物质之间的结合不是抗原和抗体反应。然而抗原和抗体反应也是一种物质间的亲合反应,是一种特殊的亲合细胞化学。由于引入亲合细胞化学,提高和增加了免疫细胞化学的敏感性和检测范围,是免疫细胞化学的新发展,本书第六章 予详述。
原位分子杂交(In situ hybridization)技术引入免疫细胞化学,是现代免疫细胞化学向基因水平深入发展的重要标志。近年来,分子杂交与免疫细胞化学的结合日益紧密,尤其是在杂交后信号的检测技术中,引入了免疫细胞化学的免疫放大和显色技术,已经形成了杂交免疫细胞化学或称原位杂交免疫细胞化学(In situ hybridizationimmunocytochemistry),成为免疫细胞化学中又一新的分支。分子杂交与免疫细胞化学的结合,形成了在细胞、亚细胞和分子水平同时检测基因及其表达产物的完整体系,把基因探针(基因工程)和单克隆抗体技术结合起来,成为当代生物科学和医学在分子水平研究和诊断的新兴技术。尤其是近年来与PCR技术结合的原位PCR技术和原位免疫PCR技术敏感性很高。本书第十八至二十三章 对有关分子生物学基础理论、核酸分子探针制备、原位分子杂交技术、聚合酶链式反应(PCR)、核酸分子杂交电镜技术、杂交与免疫细胞化学双标记技术、分子杂交的FISH技术和PRINS技术及其在染色体制片的应用和分子杂交基因诊断的应用等方面,由有关专家分别作出了专章 叙述。
定量免疫细胞化学技术是这个领域发展很快的一个方面,由于流式细胞仪,激光共聚焦显微仪和图像分析仪在免疫细胞化学中的应用,使免疫细胞化学的定量检测成为可能,从而提高了免疫细胞化学的定量水平。本书第九和十章 作了详细叙述。
本书附录列有一些常用的试剂配制方法,以便实际应用时参考。
由于本书编者都具有实际操作和应用免疫细胞化学与核酸分子杂交技术的经验,对某些方法的操作技术多结合编者的经验和在国内条件下应用的体会加以叙述,实用性强,能指导操作和启发读者如何应用。本书既有基础理论又有本领域国内外最新进展,对生物科学,尤其对医学科学工作者具有重要的参考价值,又可作为研究生、进修生的教材。
本书编写过程中,得到第三、四军医大学领导及广大同行的鼓励和支持;第三军医大学学报编辑室及张吉强、孙榆等同志在协助本书的出版、校对和抄写等方面做了大量的工作,在此深表感谢。
本书中难免有不当多处,恳切希望读者批评指正。
第一章 总论
免疫细胞化学又称免疫组织化学、其主要原理是用标记的抗体(或抗原)对细胞或组织内的相应抗原(或抗体)进行定性、定位或定量检测,经过组织化学的呈色反应之后,用显微镜、荧光显微镜或电子显微镜观察。凡是能作抗原、半抗原的物质,如蛋白质、多肽、核酸、酶、激素、磷脂、多糖、受体及病原体等都可用相应的特异性抗体的组织、细胞内将其用免疫细胞化学手段检出和研究。
免疫细胞化学的突出优点是:
1.高度特异性 抗原抗体反应是特异性最强的反应之一,免疫细胞化学所用的抗体必须是特异性强的多价或单价抗体,具有高度的识别能力,在抗原识别上可达到单个氨基酸的水平,这是其它组织化学难以相比的。
2.敏感性高 现代免疫细胞化学采用各种有效方法最大限度保存细胞和组织内待检物质的抗原性,或采用各种增敏方法,使用高度敏感的和高亲和力的抗体,保证可检出细胞内超微量的抗原成分,用显微镜或电子显微镜观察结果,因此,它是在细胞、分子水平或基因水平的检测技术。
3.方法步骤统一 若掌握一种技术操作方法步骤,则一通百通。
4.形态、机能和代谢密切结合 是一种综合定性、定位和定量密切结合;形态、机能和代谢密切结合为一体的研究和检测技术。
免疫细胞化学技术在细胞、染色体或亚细胞水平原位检测抗原分子,是其它任何生物技术难以达到和代替的,它以在细胞、基因和分子水平同时原位显示基因及其表达产物,形成了新的检测系统,为生物学、医学和各个领域分子水平的研究与诊断,开拓了广阔的前景。
免疫细胞化学技术日新月异,以惊人的速度发展。尤其是和分子生物学的理论和技术日益结合密切,基因探针、核酸分子杂交技术、原位PCR技术、核酸杂交和免疫细胞化学双标记技术、电镜杂交技术等成为免疫细胞化学技术的新发展成员,标志着免疫细胞化学又进入一个新的发展阶段。核酸分子探针-杂交-免疫细胞化学放大和显示杂交信号,可以称为杂交免疫细胞化学。所以,核酸分子探针的研制已成为免疫细胞化学实验室中必需的试剂生产技术,需要学习引进分子生物学的有关技术和设备,建立相应的基因工程实验条件,把基因重组技术、单克隆抗体技术和免疫细胞化学技术融合在一起,就形成了现代免疫细胞化学的新主体。更高倍电镜技术和图像分析,流式细胞仪技术和激光共聚焦显微技术和不断更新,把原位定性、定位和定量技术提高到了更新的水平,形成了免疫细胞化学发展的两翼,向着生命科学更广阔领域飞翔。
免疫细胞化学的全过程包括:①抗原提取和纯化;②免疫动物或细胞融合(单克隆抗体);③抗体效价检测和提取;④标记抗体;⑤细胞和组织切片标志的制备;⑥免疫细胞化学反应和显色;⑦观察和记录结果。
由此可见,免疫细化学的基本理论是抗原抗体反应,标记化学反应和呈色化学反应。由于免疫细胞化学和原位核酸分子杂交是在细胞和组织上进行抗原抗体反应,所以,必须熟练掌握显微标本制备的全过程,要求待检标本形态结构和抗原性保存良好,抗原不从原位扩散或丢失。所以从事免疫细胞化学的工作者必须了解以下有关理论及掌握有关细胞和组织学技术。
第一节 有关的免疫学理论(缺)
第二节 免疫细胞化学的有关技术概述
根据标记物的不同,免疫细胞化学技术可分为免疫荧光细胞化学技术,免疫酶细胞化学技术,免疫铁蛋白技术,免疫金-银细胞化学技术,亲和免疫细胞化学技术,免疫电子显微镜技术等。近些年来,核酸分子原位杂交技术采用生物素、地高辛等非放射性物质标记探针,和免疫细胞化学技术密切结合,发展为杂交免疫细胞化学技术。不同的免疫细胞化学技术,各具有独特的试剂和方法,但其基本技术方法是相似的,都包括抗休的制备,组织材料的处理、免疫染色、对照试验、显微镜观察等步骤。还有双重和多重标记技术也有重要的用途。
一、抗体的制备和配制
(一)抗体的制备
这是免疫细胞化学技术的首要试剂,必需制备具有很高特异性和敏感性的高效价抗体,这将在本书第二章 中详述。目前国内外市场各种特异性抗体日益增多,许多实验室直接应用市售产品,现在我国自制抗体种类少,发展抗体生产十分必要。尤其要定位一种新的抗原物质,能够自制较好。
(二)抗体的配制
包括抗体贮存液和抗体使用液的配制方法。新制备或购进的是原液或冻干品,抗血清为全血清,单克隆抗体是培养上清液或腹水。
1.抗体贮存获得新抗体后,应先根据生产厂家提供的抗体效价,将其分装,可每10μl或100μl/支分装入安瓿或0.25ml带盖塑料管中,密封。放入-20。C~40。C冰箱中保存备用,一般可保存1~2年。小量分装的抗体可1次用完,避免反复冻融而影响效价的降低。一般用前新鲜配制使用液体,稀释的抗体不能长时间保存,在4。C可存入1~3天,超过7天效价显著降低。
2.抗体使用液的配制这是任何免疫细胞化学方法中最重要的一环,无论是一抗、二抗和各种标记抗体,用前都必须按不同免疫染色方法和抗原性强弱与抗原的多少,稀释使用的各种抗体原液,以便获得最佳免疫染色结果。
(1)抗体最佳稀释度的测定方法:用已知阳性抗原切片,进行免疫染色,将其阳性强度与背景染色强度以“+”表示,可分为++++、+++、++、+、(-)。++++为最强阳性,+++为强阳性,++为较强阳性,+为弱阳性,(-)为阴性。
①直接测定法:用于测定第一抗体的最佳稀释度,其它条件稳定可靠。将一抗稀释为1:50、1:100、1:2001:400、1:500等5个稀释度滴加在阳性抗原切片上,同时设一替代和阴性对照,结果如表1-1:
表 1-1 选择最佳稀释抗血清方法
| 一抗稀释度 | 特异性染色强度 | 非特异性背景染色度 |
| 1:50 | ++++ | ++ |
| 1:100 | ++++ | ++ |
| 1:200 | ++++ | ++ |
| 1:400 | +++ | + |
| 1:500 | ++ | (-) |
| 阴性对照 | (-) | (-) |
从表中结果可见,第一抗体稀释到1:400时阳性结果呈强阳性,背景染色减少,其最佳稀释度在1:400~500之间。再作1:420、1:440、1:460、1:480、1:500稀释后染色,找出最佳稀释度。
②棋盘(方阵)测定方法:当测定两种以上抗体的最佳配合稀释度时,必须采用此法(见表1-2)。
表1-2 两种以上抗体最佳配合稀释度选择表
| 第二抗体 | 第 一 抗 体 | |||
| 1:500 | 1:1000 | 1:2000 | 1:4000 | |
| 1:100 | ++++(++) | ++++(+) | +++(±) | +(-) |
| 1:200 | ++++(+) | +++(-) | ++(-) | ++(-) |
| 1:400 | ++(-) | +(-) | - | - |
括号内为背景染色结果
从表中可见第一抗体1:1000,第二抗体1:2000接近最佳稀释度,再将一 抗体作1:600、1:700、1:800、1:900和1:1000稀释,即可找出最佳稀释度。
(2)抗体稀释液的配制:常用0.01mol/l pH7.4PBS或TBS缓冲液作抗体稀释液。可用以下方法配制专用的抗体稀释液,防止抗体效价下降,减少抗体在组织上的非特异性吸附:取0.05mol/l pH7.4 TBS100ml,加温到60。C,再加入优质明胶100mg,搅拌溶解后,冷却至室温,加入1g牛血清白蛋白,加入NaN3200mg溶解后,过滤,分装,4。C保存。
抗体的最佳稀释度由于各种抗体的效价不同,组织中抗原强弱不一,应根据不同情况作适当的调整,以取得中等阳性稀释度为佳,因其既适合于抗原性强和含量多的标本,也可用于抗原性弱的标本。
二、组织材料的处理
组织材料的处理是获得良好免疫组织化学结果的前提,必需保证要检测的细胞或组织取材新鲜,固定及时,形态保存完好,抗原物质的抗原性不丢失、不扩散和被破坏(下节 详述)。
三、免疫染色
可在细胞涂片或组织切片上进行免疫染色。一般程序是:①标记抗体与标本中抗原反应结合;②用PBS洗去未结合的成分;③直接观察结果(免疫荧光直接法);或显色后再用显微镜观察(免疫酶直接法)。在此基础上发展出间接法,多层法,双标记法等各种方法,将在本书各有关章 节 内详述。
在免疫染色中应特别注意增强特异性染色,减少或消除非特异性染色。在各种免疫染色中都必须注意以下几个问题:
1.增强特异性染色的方法
(1)蛋白酶消化法:其作用是暴露抗原,增加细胞和组织的通透性,以便抗体与抗原最大限度的结合,增强特异性染色和避免非特异性染色。这种方法已广泛用于各种免疫细胞化学染色,常用的蛋白酶有胰蛋白酶、胃蛋白酶以及链霉蛋白酶(pronase)等;也可用3mol/L尿素处理切片,达到酶消化的目的。各种酶的配制和使用方法详见附录。酶消化的时间和温度因各种抗原对消化的敏感性不同,应根据酶的活性通过预试验确定,消化的时间还与组织固定的时间有关,一般是陈旧固定组织所需时间长,以37。C为宜。消化时间短的组织可在室温中进行。消化处理时间过长能损伤组织,易使切片脱落,应使用切片粘附剂,消化时间尽量缩短。
(2)合适的抗体稀释度:抗体的浓度是免疫染色的关键,如果抗体浓度过高,抗体分子过多于抗原决定簇,可导致抗体结合减少,产生阴性结果。此阴性结果并不一定缺少抗原,而是由于抗体过量。这种现象类似于凝集反应中的前带效应(Prozone effect )。因此,必须使用一系列稀释作“棋盘式效价滴定”检测抗体的合适稀释度,以得到最大强度的特异性染色和最弱的背景染色。抗体稀释度应根据:①抗体效价高,溶液中特异性抗体浓度越高,工作稀释度越高;②一般讲,应用的抗体稀释度越大,温育时间越长。③抗体中非特异性蛋白含量、只有高稀释度时才能防止非特异性背景染色;④稀释用缓冲液的种类、标本的固定和处理过程等也可影响稀释度。所以合适的稀释度应根据自己的情况测定。抗体的稀释主要是指第一抗体,因为第一抗体中特异性抗体合适的尝试是关键,应用高稀释度第一抗体仅显示主亲和力的特异性染色反应,减少或消除其中交叉抗体反应。
(3)温育时间:大部分抗体温育时间为30-60min,必要时可4。C过夜(约18h)。温育的温度常用37。C,也可在室温中进行,对抗原抗体反应强的以室温为佳。37。C可增强抗原抗体反应;适用于多数抗体染色,但应注意在湿盒中进行,防止切片干燥而导致失败。
(4)多层染色法:对弱的抗原可用间接法(双层)、PAP和ABC法(三层)、四或五层PAP法或ABC法,或PAP和ABC联合染色法等,可以很大程度的提高敏感性,获得良好结果。
(5)显色增敏剂的应用,如在过氧化物酶底物中加入氯化镍,可提高显色敏感度4倍。
2.减少或消除非特异性染色的方法组织中非抗原抗体反应出现的阳性染色称为非特异性背景染色,最常见的原因是蛋白吸附于高电荷的胶元和结缔组织成分上。最有效方法是在用第一抗体前加制备第二抗体动物之非免疫血清(1:5-1:20)封闭组织上带电荷基团而除去与第一抗体非特异性结合。必要时可加入2%-5%牛血清白蛋白,可进一步减少非特异性染色。作用时间为10-20min。也可用除制备第一抗体以外的其它动物血清(非免疫的)。有明显溶血的血清不能用,以免产生非特异性染色。免疫荧光染色时,可用0.01%伊文氏兰(PBS溶液)稀释荧光抗体,对消除背景的非特异性荧光染色有很好的效果。当然使用特异性高、效价高的第一抗体是最重要的条件。洗涤用的缓冲液中加入0.85%~1%NaCl成为高盐溶液,充分洗涤切片,能有效的减少非特异性结合而减少背景染色。
3.显色反应的控制免疫酶染色应注意控制:①成色质浓度和温育时间可调节 ,增加成色质的量和/或增加底物温育时间,可增加反应产物强度。着色太深可减少温育反应时间。②过氧化物酶显色时,H2O2较大浓度将使显色反应过快而致背景加深;过量H2O2可能抑制酶的活性。
4.复染根据所用的染色方法和呈显颜色等,可选用适当的复染方法。如阳性结果呈红或棕色,则用苏木素将细胞核染成兰色,以便定位检测。也可用1%~2%甲基绿复染。
四、对照
其目的在于证明和肯定阳性结果的特异性,排除非特异性疑问。主要是针对第一抗体对照,常用的对照方法包括:①阳性对照;②阴性对照;③阻断试验;④替代对照;⑤空白对照;⑥自身对照;⑦吸收试验。
(一)阳性对照
用已知抗原阳性的切片与待检标本同时进行免疫细胞化学染色,对照切片应呈阳性结果,称为阳性对照。证明全过程均符合要求,尤其当待检标本呈阴性结果时,阳性对照尤为重要。
(二)阴性对照
用确证不含已知抗原的标本作对照,应呈阴性结果,称阴性对照,是阴性对照的一种。其实空白、替代、吸收和抑制试验都属阴性对照。当待检标本呈阳性结果时,阴性对照就更加重要,用以排除假阳性。对照的具体方法步骤,在有关章 节 详述。
五、免疫细胞化学结果的判断
对免疫细胞化学结果的判断应持科学的慎重态度,要准确判断阳性和阴性,排除假阳性和假阴性结果,必须严格对照实验,对新发现的阳性结果,除有对照试验结果之外,应进行多次重复实验,要求用几种方法进行验证,如用PAP法阳性,可再用ABC法验证。必须学会判断特异性染色和非特异性染色,对初学者更为重要,否则会得出不科学的结论。特异性染色与非特异性染色的鉴别点主要在于特异性反应产物常分布于特定的部位,如胞浆内,也有分布在细胞核和细胞表面的,即具有结构性。特异性染色表现为在同一切片上呈现不同程度的阳性染色结果。非特异性染色表现为无一定的分布规律,常为某一部位成片的均匀着色,细胞和周围的结缔组织均无区别的着色,或结缔组织呈现很强的染色。非特异性染色常出现在干燥切片的边缘,有刀痕或组织折叠的部位。在过大的组织块,中心固定不良也会导致非特异性染色。有时可见非特异性染色和特异性染色同时存在,由于过强的非特异性染色背景不但影响对特异性染色结果的观察和记录,而且令人对其特异性结果产生怀疑。
(一)阳性细胞的染色特征
免疫细胞化学的呈色深浅可反映抗原存在的数量,可作为定性、定位和定量的依据。
(1)阳性细胞染色分布有三种类型:①胞浆;②细胞核;③细胞膜表面。大部分抗原见于细胞浆,可见于整个胞浆或部分胞浆。
(2)阳性细胞分布可分为烟性和弥漫性。
(3)由于细胞内含抗原量的不同,所以染色强度不一。如果细胞之间染色强度相同,常提示其反应为非特异性。
(4)阳性细胞染色定位于细胞,且与阴性细胞相互交杂分布;而非特异性染色常不限于单个细胞,而是累及一片细胞。
(5)切片边缘、刀痕或皱折区域,坏死或挤压的细胞区,胶原结缔组织等,常表现为相同的阳性染色强度,不能用于判断阳性。
(二)染色失败的几种原因
(1)所染的全部切片均为阴性结果:包括阳性对照在内,全部呈阴性反应,原因可能是:①染色未严格按操作步骤进行;②漏加一种抗体,或抗体失效;③缓冲液内含叠氮化钠,抑制了酶的活性;④底物中所加H2O2量少或失效;⑤复染或脱水剂使用不当。
(2)所有切片均呈弱阳性反应:①切片在染色过程中抗体过浓,或干燥了;②缓冲液配制中未加氯化钠和pH值不准确,洗涤不彻底;③使用已变色的呈色底物溶液,或呈色反应时间过长;④抗体温育的时间过长;⑤H2O2浓度过高,呈色速度过快;⑥粘附剂太厚。
(3)所有切片背景过深;①未用酶消化处理切片;②切片或涂片过厚;③漂洗不够;④底物呈色反应过久;⑤蛋白质封闭不够或所用血清溶血;⑥使用全血清抗体稀释不够。
(4)阳性对照染色良好,检测的阳性标本呈阴性反应,固定和处理不当是最常见的原因。
对于阳性结果的定量判断常规方法是根据呈色深浅和阳性细胞数量分类计数,以(-)、+、++、+++等分级和计数统计。现在已采用图象分析计量,本书第九章 将详细叙述这种使免疫细胞化学的定量成为可能的先进的形态定量方法。另外,第十章 将详细途述另一种先进的免疫细胞化学计量分类术-流式细胞光度计技术。
第三节 有关细胞和组织学技术
一、细胞和组织
免疫组织化学技术是用标记物或显色物标记的抗体检测细胞和组织内的抗原,从而达到诊断和研究疾病的目的。抗原的准确显示和定位与制备的细胞和组织标本质量的好坏有着密切的联系。由于各种抗原的生化、物理性质不同,如温度高低、酸碱度强弱及各种化学试剂的作用均可影响抗原的免疫学活性,良好的细胞和组织学结构将有助于抗原的准确定位。因此,细胞和组织标本的采集制备在免疫组织化学技术中占有十分重要的位置。
(一)细胞标本的取材
目前,免疫组化技术已经应用于细胞学诊断,如鉴别低分化癌与恶性淋巴瘤、黑色素瘤、低分化肉瘤等。CEA应用于胸腹水中间皮瘤与癌的鉴别。McAb应用于淋巴白血病和恶性淋巴瘤的分类分型。近年来,培养细胞的免疫组化技术在鉴定细胞的种类、分化程度、表面抗原特点以及肿瘤结构成分改变等方面的研究均起到了积极作用。
细胞标本的取材有以下3种方法:
1.印片法主要应用于活组织检查标本和手术切除标本。新鲜标本以最大面积剖开,充分暴露病变区,将载玻片轻轻压于病变区,脱落的细胞便粘附在玻片上,立即浸入细胞固定液内5-10min,取出后自然干燥,低温保存备用。
优点是简便省时,细胞抗原保存较好。缺点是细胞分布不均匀,玻片上细胞重叠,影响标记效果。
2.穿刺吸取涂片法主要应用于实质器官的病变区,如肝、肾、肺、淋巴结、软组织等。用细针穿刺吸取病变区内液体成分,如穿刺液较少,可直接涂抹在载玻片上,力求细胞分布均匀。如穿刺液较多,细胞丰富,可用洗涤法:将穿刺液滴入盛有1-2ml Hanks液(RPMi 1640液)的试管内,轻轻搅拌,以500rpm低速离心5-10min后,弃上清液,将沉淀制成细胞悬液(浓度约2×106细胞/ml),吸取1滴于载玻片上,轻轻涂抹,待涂片略干即可固定。
该法穿刺吸取直接涂片的优点是操作简便,细胞形态保持较好。缺点是细胞分布不均匀。洗涂法片虽可弥补这一缺点,但操作复杂,细胞常常发生变形。
3.体液沉淀涂片法主要用于胸水、腹水、尿液、脑脊液等体液多、细胞少的标本。体液采取后,必须及时处理,更不宜加固定液。根据标本内细胞数量的多少选用不同的处理方法:①细胞数量极多者,可吸取少量液体直接涂在玻片上。②细胞数量较少者,可将液体自然沉淀,然后吸取5ml左右沉淀液,以1500rpm离心10min,弃上清液,将沉淀涂片,略干后固定备用。
如用细胞离心涂片器(Cytospin ),可将标本用上述离心沉淀法制成2×106细胞/ml的细胞悬液,吸取50μl加入涂片器内,离心后即制成分布均匀的细胞涂片,细胞分布在直径约6mm的小圆圈内,每个圆圈内的细胞数约105个(Danos,1976)。
培养细胞标本的取材可根据培养的细胞特性分别采取不同的方法。某些细胞有贴壁生长的特性,如纤维母细胞、粘液癌细胞等,只需将载玻片或盖玻片插入培养液内即可收集到理想的细胞标本。某些细胞只能在培养液中生长,可用上述体液沉淀离心涂片法处理。
制备细胞涂片应注意:①标本反复离心洗涤,细胞的粘附性降低,在免疫组化染色过程中容易脱片,因此,在制备涂片前载玻片上应涂粘附剂。②为节 省试剂和便于镜下观察和记数,应将细胞集中到直径0.6-1.0cm的圆圈内,细胞总数以105个为宜。③粘液丰富的标本,如痰液,胃液等,未经特殊处理,一般不宜作免疫组化标记。
(二)组织标本的取材
组织标本主要取之于活组织检查标本、手术切除标本、动物模型标本以及尸体解剖标本等。前三者均为新鲜组织,后者是机体死亡2h以上的组织,可能有不同程度的自溶,其抗原可能有变性消失,严重弥散现象,因此,尸检组织应尽快固定处理,以免影响免疫组化标记效果。但有些较稳定性抗原,如HBsAg、HBcAg等在尸检标本中,抗原显示仍较好。
组织标本的取材常常受到各种因素的影响,如各种内窥镜钳取的组织,常因过度挤压而变形,严重者组织结构被破坏。大组织标本病变分布广泛,抗原在组织中分布不均一,常出现人为的组织取材不准确。为了避免上述缺点,组织取材时应注意:①活检钳的刃口必须锋利,以免组织受挤压;②取材部位必须是主要病变区;③必须取病灶与正常组织交界区;④必要时取远距病灶区的正常组织作对照。
为充分保存组织的抗原性,标本离体后庆立即作处理,或立即速冻成冻块进行冰冻切片,或立即用固定液固定进行脱水、浸蜡、包埋、石蜡切片。如不能迅速制片,可贮存于液氮罐内或-70。C冰箱内备用。
二、细胞和组织的固定
(一)固定
为了更好的保持细胞和组织原有的形态结构,防止组织自溶,有必要对细胞和组织进行固定。固定的作用不仅是使细胞内蛋白质凝固,终止或抑制外源性和内源性酶活性,更重要的是最大限度的保存细胞和组织的抗原性,使水溶性抗原转变为非水溶性抗原,防止抗原弥散。
不同抗原,其稳定性也不相同,因而对固定剂的耐受性差异较大。如T淋巴细胞表面抗原属不稳定性抗原,对固定剂的耐受较差,抗原活性容易丧失。而HBsAg属稳定性抗原,其抗原活性很少受固定剂种类、固定时间、温度等因素的影响。
(二)固定剂
用于免疫组织化学的固定剂种类较多,性能各异,在固定半稳定性抗原时,尤其重视固定剂的选择,介绍如下。
1.醛类固定剂双功能交联剂,其作用是使组织之间相互交联,保存抗原于原位,其特点是对组织穿透性强,收缩性小。有人认为它对IgM、IgA、J链、K链和λ链的标记效果良好,背景清晰,是常用的固定剂。
(1)10%钙-福尔马林液(浓甲醛10ml,饱和碳酸钙90ml)。
(2)10%中性缓冲福尔马林液(浓甲醋10ml,0.01mol/l pH7.4 PBS 90ml)。
(3)4%多聚甲醛磷酸缓冲液pH7.4(多聚甲醛40g,0.1mol/L PBS液pH7.4500ml,两者混
合加热至60℃,搅拌并滴加1nNaOH至清晰为止,冷却后加PBS液至总量1000ml)。
(4)戊二醛-甲醛液(戊二醛1ml,浓甲醛10ml,蒸馏水加至100ml)。
戊二醛是二醛基化合物,交联结合力比甲醛大,Bullock认为交联过强,可出现组织改变和空间遮蔽现象,影响组织的抗原性。但McDonald等认为,该试剂用于PAP法免疫酶标记效果仍满意。
(5)甲醛升汞固定液(即B5固定液。浓甲醛10ml,氯化汞6g,醋酸钠1.25g,蒸馏水90ml)。
有人认为此固定液悬液是较理想的固定液,标记IgA、IgM、IgG等抗原效果良好。也有人认为它减弱细胞的抗原性,上皮细胞可产生非特异性荧光,故不宜用于免疫荧光标记。氯化汞是一种强蛋白凝固剂,但对组织穿透性弱,且使组织收缩,故与甲醛混合使用。
(6)醋酸-甲醛液(浓甲醛10ml,冰醋酸3ml,生理盐水加至100ml)。
Bullock等认为此液固定效果良好,组织可不经消化,胞浆IgA、IgG、IgM、IgD和K、λ、J链标记均呈阳性,且背景染色极淡。如标记IgG用PAP法第一抗体仅为甲醛升汞液的1/10。此液内醋酸既可防止组织收缩,又可暴露胞浆免疫球蛋白抗原决定簇。
(7)Bouin’s液。
该固定液为组织学、病理学常用固定剂之一,对组织穿透力较强而收缩性较小,比单独醛类固定更适合免疫组化染色。Kayhko认为用于标记B细胞的J链较好,但Bullock则认为它可导致Igg γ重链变性,故必需加大第一抗体的浓度。
(8)Zamboni’s液。
该固定液可用于电镜免疫细胞化学,对超微结构的保存优于纯甲醛,也适用于光镜免疫细胞化学研究。采用2.5%多聚甲醛和30%饱和苦味酸,更可增加对组织穿透力和固定效果,以保存更多的组织抗原。固定时间6-18h。
(9)PLP液(过碘酸盐-赖氨酸-多聚甲醛固定液)。
该固定剂适用于富含糖类的组织,对超微结构及许多抗原的抗原性保存较好。其机制是过碘酸氧化组织中的糖类形成醛基,通过赖氨酸的双价氧基与醛基结合,从而与糖形成交联。组织抗原大多数是由蛋白质和糖两部分构成,抗原决定簇位于蛋白部分,故该固定液有选择性地使糖类固定,既稳定缺的,又不影响其在组织中的位置(固定剂7-9配制法见附录1)。
2.非醛类固定剂Pe等人比较几种非醛类双功能试剂指出,碳化二亚胺、二甲基乙酰胺、二甲基辛酰亚胺、和对苯醌等均适用于多肽类激素的组织固定,单独使用时,边缘固定效应重,但与戊二醛或多聚甲醛混合使用,效果明显改善。
(1)碳化二亚胺(1-ethyl-3(3-dimethyl-aminopropyl)cardodiimi-HCI)液:2g溶于100ml0.01mol/L,pH7.4PBS中。此液宜用于标记多肽类激素的组织,对标记IgA、IgG效果不佳。
(2)碳二亚胺-戊二醛液(ECD-G液):配制法见附录一。
ECD-[1-ethyl-3(3-dimethyl-aminopropyl)carbodiimideHydrochloride],即乙基-二甲基氨基丙基碳亚胺盐酸盐,简称乙基-CDI。
该液常用于多肽类激素的固定,对酶等蛋白质固定效果良好,对细胞内抗原定位,超微结构保存好,是一种培养细胞电镜免疫细胞化学研究的良好固定剂。
(3)Zenker’s 液(重铬酸钾2.5g,氯化汞5g,硫酸钠1g,蒸馏水100ml,混合溶解后,临用时加水醋酸5ml)。
该固定液对免疫球蛋白染色最佳,固定时间约2-4h,染色前必须脱汞色素。
3.丙酮及醇类固定剂系最初免疫细胞化学染色的固定剂,其作用是沉淀蛋白质和糖,对组织穿透性很强,保存抗原的免疫活性较好。但醇类对低分子蛋白质、多肽及胞浆内蛋白质保存效果较差,解决的办法是和其它试剂混合使用,如加冰醋酸、乙醚、氯仿、甲醛等。
(1)Clarke氏改良剂(100%酒精95ml,冰醋酸5ml),用于冰冻切片的后固定。
(2)乙醚(或氯仿)与乙醇等量混合液。
Danos(1976)等认为其组织穿透性极强,即使涂片上富于过多的粘液,固定效果仍然良好,是理想的细胞固定液。
(3)AAF液:95%-100%酒精85ml,冰醋酸5ml,浓甲醛10ml。
(4)Carnoy氏液:100%酒精60ml,氯仿30ml,冰醋酸10ml,混合后4。C保存备用。
(5)Methacarn氏液:甲醇60ml,氯仿30ml,冰醋酸10ml,混合后4。C保存备用。
以上两种固定液适宜某些抗原,癌基因蛋白产物检测的 固定,P53抗癌基因蛋白产物,PC-NA等抗原的保存。
丙酮的组织穿透性和脱水性更强,常用于冰冻切片及细胞涂片的后固定,保存抗原性较好,平时4。C低温保存备用,临用时,只需将涂片或冰冻切片插入冷丙酮内5-10min,取出后自然干燥,贮存于低温冰箱备用。
以上介绍了免疫组织化学中常用的固定液,用于免疫组化的固定剂种类很多(见附录),不同的抗原和标本需经过反复试验,选用最佳固定液。不少学者认为,迄今尚无一种标准固定液可以用于各种不同的抗原固定。而且同一固定液固定的组织,免疫组化染色标记结果可截然不同,致使人们无所适从。选择最佳固定液标准是:①最好地保持细胞和组织的形态结构。②最大限度地保存抗原的免疫活性。一些含重金属的固定液在免疫组化技术中是禁用的。实际经验告诉我们,中性缓冲福尔马林(或多聚甲醛)是适应性较广泛的固定液,但固定时间不宜过长。必要时,可作多种固定液对比,从而选出理想的标准固定液。
固定组织时应注意:①应力求保持组织新鲜,勿使其干燥,尽快固定处理。②组织块不易过大过厚,必须小于2cm×1.5cm×0.3cm,尤其是组织块厚度必须控制在0.3cm以内。③固定液必须有足够的量,在体积上一般大于组织20倍以上,否则组织中心固定不良影响效果。④组织固定后应充分水洗,去除固定液造成的人为假象。
(三)固定方法
1.浸入法(Immersionmethod)将组织浸泡在固定液内,必要时可在低温(4。C)环境下进行,固定时间可根据抗原的稳定性以及固定液性质而定,一般在2-12h之间。
2.灌注法(Irrigationmethod)此法适用于动物实验研究。自左心室插入主动脉,先以krebs或生理盐水冲冼血液后,以泵、吊筒或50-100ml注射器注入固定液。置灌注动物于4。C冰箱内,次日取出脑组织或其它组织。外周组织一般在灌注后30min内取材,取组织置同一固定剂中浸入1-3h,然后修整组织块。有主张用冷固定剂(4。C)进行灌注。我们的体会是一般光镜下观察的标本,室温固定即可获满意效果。应该强调,保持组织新鲜是很重要的,据报告,肽类抗原活性在断绝血液供应后24h几乎完全丧失。
灌注法固定可使固定液迅速达到全身各组织。达到充分固定之目的。灌注冲洗还能排除红细胞内假过氧化物酶的干扰。浸入法主要用于活检和手术标本,以及其它不能进行灌注的组织固定。
三、组织切片技术
应用于光镜的免疫组织化学染色的切片厚度一般要求5μm左右,神经组织的研究要求切片厚度在20-100μm,有利于追踪神经纤维的走行。
1.冰冻切片是免疫组织化学染色中最常用的一种切片方法。其最突出的优点是能够较完好地保存多种抗原的免疫活性,尤其是细胞表面抗原更应采用冰冻切片。新鲜的组织及已固定的组织均可作冰冻切片。
冰冻时,组织中水份易形成冰晶,往往影响抗原定位。一般认为冰晶少而大时,影响较小,冰晶小而多时,对组织结构损害较大,在含水量较多的组织中上述现象更易发生。冰晶的大小与其生长速率成正比,而与成核率(形成速率)成反比,即冰晶形成的数量愈多则愈小,对组织结构影响愈严重。因此,应尽量降低冰晶的数量。Fish认为冰冻开始时,冰晶成核率较慢,以后逐渐增加,其临界温度为-33。C,从-30。C降至-43。C之间,成核率急剧增加达1018,然后再减慢。基于上述理论可采取以下措施减少冰晶的形成。
(1)速冻,使组织温度骤降,缩短从-33。C43。C的时间,减少冰晶的形成。其方法有二:
①干冰-丙酮(酒精)法:将150-200ml丙酮(酒精)装入小保温杯内,逐渐加入干冰,直至饱和呈粘稠状,再加干冰不再昌泡时,温度可达-70℃C,用一小烧杯(50-100ml)内装异戊烷约50ml,再将烧杯缓慢置入干冰丙酮(纯酒精)饱和液内,至异戊烷温度达-70℃时即可使用。将组织(大小为1cm×0.8cm×0.5cm)投入异戊烷内速冻30-60s后取出,或置恒冷箱内以备切片,或置-80℃低温冰箱内贮存。
②液氮法:将组织块平放于软塑瓶盖或特制小盒内(直径约2cm),如组织块小可适量加OCT包埋剂浸没组织,然后将特制小盒缓缓平放入盛有液氮的小杯内,当盒底部接触液氮时即开始气化沸腾,此时小盒保持原位切勿浸入液氮中,大约10-20s组织即迅速冰结成块。取出组织冰块立即置入-80℃冰箱贮存备用,或置入恒冷箱切片机冰冻切片。
(2)将组织置于20%-30%蔗糖溶液1~3天,利用高渗吸收组织中水分,减少组织含水量。
影响冰冻切片的因素较多,因此,技术难度较大,选择好的冰冻切片机是保证切片质量的关键。目前冰冻切片机有两类:
①恒慢冰冻切片机(Cryastat):为较理想的冰冻切片机,型号很多,但其基本结构是将切片机置于-30℃C低温密闭室内,故切片时不受外界温度和环境影响,可连续切薄片至2-4μm,完全能满足免疫组织化学标记要求。切片时,低温室内温度以-15℃~18℃为宜,温度过低组织易破碎,抗卷板的位置及角度要适当,载玻片附贴组织切片,切勿上下移动。
②开放式冰冻切片机:包括半导体致冷切片机和甲醇致冷切片以及老式的CO2、氯乙烷等冷冻切片机。切片时暴露空气中,温度不易控制,切片技术难度大,在高温季节 ,切片更加困难,且切片厚8~15μm,不易连续切片,但其优点是价廉,国内有生产。
冰冻切片后如不染色,必须吹干,贮存低温冰箱内,或进行短暂预固定后贮存冰箱保存。
2.石蜡切片其优点是组织结构保存良好,在病理和回顾性研究中有较大的实用价值,能切连续薄片,组织结构清晰,抗原定位准确。用于免疫组化技术的石蜡切片制备与常规制片略有不同:①脱水、透明等过程应在4℃。C下进行,以尽量减少组织抗原的损失。②组织块大小应限于2cm×1.5cm×0.2cm,使组织充分脱水、透明、浸蜡。③浸蜡、包埋过程中,石蜡应保持在60℃以下,以溶点低的软蜡最好(即低温石蜡包埋)。
组织块脱水、透明、浸蜡时间参考表1-3:
表 1-3 组织块处理时间表
| 1 | 70%乙醇 | 4℃ | 3~4h |
| 2 | 80%乙醇 | 4℃ | 3~4h |
| 3 | 90%乙醇 | 4℃ | 2~3h |
| 4 | 95%乙醇Ⅰ | 4℃ | 2~3h |
| 5 | 95%乙醇Ⅱ | 4℃ | 1~2h |
| 6 | 100%乙醇Ⅰ | 4℃ | 1.5h |
| 7 | 100%乙醇Ⅱ | 4℃ | 1.5h |
| 8 | 二甲苯Ⅰ | 4℃ | 0.5~1h |
| 9 | 二甲苯Ⅱ | 4℃ | 0.51~1h |
| 10 | 石蜡Ⅰ | 60℃ | 1h |
| 11 | 石蜡Ⅱ | 60℃ | 2h |
以上全过程为18-24h,也可在室温内使用自动脱水机代替。如组织块小,直径小于0.5cm,可用快速石蜡包埋切片,全过程只需4h左右。
石蜡切片为常规制片技术,切片机多为轮转式,切片厚度2~7μm,应用范围广,不影响抗体的穿透性,染色均匀一致。由于甲醛固定、有机熔剂和包埋剂对组抗原有一定的损害及遮蔽,使抗原特征发生改变。有人报告经蛋白酶消化,可以改善光镜免疫组化染色强度,常用的有胰蛋白酶、链霉蛋白酶及胃蛋白酶等消化法。石蜡切片应入37℃恒温箱过夜,这样烤片可减少染色中脱片现象。切片如需长期贮存,可存放于4℃冰箱内备用。
石蜡切片优点较多,但在制片过程中要经过酒精、二甲苯等有机溶剂处理,组织内抗原活性失去较多,有人采用冷冻干燥包埋法(Freeze drying embedding methed),可以保存组织内可溶性物质,防止蛋白变性和酶的失活,从而减少了抗原的丢失。该法是将新鲜组织低温速冻,利用冷冻干燥机(Freezing dryer)在真空、低温条件下排除组织内水分 ,然后用甲醛蒸气固定干燥的组织,最后将组织浸蜡、包埋、切片。此法可用于免疫荧光标记、免疫酶标记及放射自显影。
3.振动切片用振动切片机(Vibratotme),可以把新鲜组织(不固定不冰冻)切成厚片20~100μm,以漂浮法在反应板进行免疫组织化学染色,然后在解剖显微镜下检出免疫反应阳性部位,修整组织进行后固定,最后按电镜样品制备、脱水、包埋、超薄切片、染色观察等。组织不冰冻,无冰晶形成和组织抗原破坏,在免疫组化染色前避免了组织脱水、透明、包埋等步骤对抗原的损害,能较好地保留组织内脂溶性物质和细胞膜抗原,主要用于显示神经系统抗原分布研究。这种包埋前染色,尤其实用于免疫电镜观察。
4.塑料切片塑料包埋切片常用包埋剂有甲基丙烯酸盐类(Glycolmethacrylate, GMA)及环氧树脂类(Epon 812,618),其优点是可以同时作光镜和电镜检测,能相互对照所查抗原,定位准确。塑料包埋切片可切出比石蜡切片更薄的切片,光镜切片可薄至0.5~2um,故称半薄切片(Semithinsection)。GMA保存抗原较好,不与组织产生共聚合,但形态学结构欠佳。环氧树脂如Fpon和Araldite能较好地保存形态学结构,但在聚合过程中易和组织起作用,改变抗原结构。塑料包埋切片由于处理程序繁多,抗原活性易丢失。同时半薄切片进行免疫染色时,抗血清不易穿透树脂,因此,塑料切片主要用于免疫电镜的超微切片前定位。包埋前染色的标本,切片薄切片后不需染色,直接在相差显微镜下观察免疫反应部位呈黑点状,定位后进一步作超薄切片,这样,可以明显提高免疫电镜阳性检出率。
5.超薄切片电镜标本制作见第七章 ,应用超薄切片机(Ultrotome)进行切片。
6.碳蜡切片碳蜡(Carbowax),学名聚乙烯二醇(Polyethlene glycol, PEG)为水溶性蜡。根据其分子量不同,碳蜡有多种,如400、800、1000、1500、4000、6000等,用于组织包埋的有1500、4000两种,其熔点分别38℃C和52。C左右,常温下为固体石蜡状,加温熔化呈液体状。
本法的特点是组织固定水洗后,不需脱水透明可直接浸蜡包埋,且切片方法与常规石蜡切片相同。切下的组织片漂浮水面后自然展开,碳虹迅速深化,组织片即可展平,制片过程简单易行。
具体操作简述如下:组织块不宜过大,一般限定在1.5cm×1cm×0.1cm以内。①组织固定后充分水洗去除固定液,用滤纸吸干组织表面水。②将组织浸入碳蜡(1500)内,45℃30min。③再次浸入混合混合碳蜡液(1500和4000等量混合液),52℃30min。④浸入等量混合碳蜡液(或根据气温、湿度变化调整4000和5000混合比例,如气温高湿度大可以4000:1500=3:2混合,反之,则2:3混合)。⑤用等量混合碳蜡或调整混合碳蜡包埋成组织蜡块。⑥切片与石蜡切片相同。在操作过程中,碳蜡组织块应尽量避免与水或冰接触,贮存时应密封干燥冷藏。
本法优点是操作程序减少,时间缩短,组织不经有机溶剂损害、温度低、抗原性保存比石蜡切片好,组织结构清晰。缺点是夏季室温高时切片较困难,连续切片不如石蜡切片顺利;由于碳蜡有强吸湿性,不易长期保存。
7.玻片处理和涂胶在免疫组化染色过程中由于各种原因常造成标本(细胞制片和组织切片)脱片现象,影响了工作质量和速度。一般采取两种方法即可防止脱片现象出现。
(1)载玻片和盖玻片处理:新载玻片上有油污,必须经过清洁液浸泡12~24h,流水充分漂洗后用蒸馏水清洗5遍以上,浸泡在95%酒精内2h,用绸布擦干或用红外线烤箱烤干均可,贮放于玻片盒内备用。盖玻片很薄,以上处理程序必须缩短,清洁液浸泡只需2h,流水冲洗注意勿损伤玻片等。
(2)载玻片上涂粘附剂:粘附剂种类较多,常用的有以上几种:①树脂胶(Resin glue)又称白色乳胶,为木工用,有进口,国产之分,有人认为进口白色树脂胶较稳定,我们认为国产白乳胶(聚醋酸乙烯乳液J-北京产)质量尚稳定。使用浓度为1%~2%,以蒸馏水稀释即可。②甘油明胶,混匀后涂在载玻片上,切片贴附后置有副醛的干燥器内,加热80℃1h。③甲醛明胶, 混合后即可涂片。④铬明矾明胶, 混合后即可涂片,置37℃温箱烤干。⑤多聚赖氨酸液:多聚赖氨酸0.1g,加蒸馏水10ml,混合后即可涂片。此液不宜多配制。⑥3-Amino propy Eri-ethoxy Silame(APES)。
粘附剂2~5配制法见附录一。
参考文献
1.Bullock CR, etal . Techniques in immunocytochemistry, Vol 1. London New York: Academic Press,1982
2.Coleman DV, et al.Immunoperoxidase staining tumor marker distribution studies in cytologicspecimens. Acta Cytologica, 1981:25:205~206
3.Jacobsen M, etal .The effectof fixation and trypsinization on the immunohistochemical demonstration ofintracellular immunoglobulin in paraffin embedded material .Acto Path.Microbiol . Scand . ,Sect. A, 1980;88:369~376
4. Kayhko?K. Optimal fixation ofthe immunoperoxidase identification of human J chain from tissue sections.Histochemistry, 1980;70:23-27
5.Leathem A, et al .Fixation andimmunohistochemistry of lymphoid tissue.J. Clin Path, 1980;33:1010-1012
6.Martin SE,et al Immunologicmethods in cytology:definitive diagnosis of non-Hodgkin’s lymphomas usingimmunologic markers for T-and B-cells .Am . Clin . Path.,1984;82:666~673
7.Mason DY,et al, Technicalaspects of lymphoma immunohistology.J. Histochem. Cytochem., 1980;28:731-745
8.Montero C.Immunocytochemistry.2nd ed. New York; John Wiley and Sons, 1979
9.Walts AE, et al.SPecial tumormarkers in diagnostic cytology:immunoperoxidase of carinoembryonicantigen,lysozyme and other tissue antigen in effusions, washes and aspirates.Acta Cytologica, 1983;27:408~416
10.Wordinger RJ, et al. Manual ofimmunoperoxidase techniques. Chicago; Americal Society of Pathologists Press,1983
11.施达仁,等。B淋巴细胞双PAP法免疫定位方法学的探讨及其在恶性淋巴瘤诊断上的应用。肿瘤,1982;2:11-14
12.Nuovo GJ.Comparison of Bouin solution and buffered formalin fixation on the detectionrate by in hybridization of human papillomavins DND in qenital tract lesions.
第二章 抗原和抗体的制备
第一节 抗原的制备(缺)
第二节 抗体的制备
一、抗血清的制备
有了质量好的抗原,还必须选择适当的免疫途径,才能产生质量好(特异性强和效价高)的抗体。
(一)用于免疫的动物
作免疫用的动物有哺乳类和禽类,主要为羊、马、家兔、猴、猪、豚鼠、鸡等,实验室常用者为家兔、山羊和豚鼠等。动物种类的选择主要根据抗原的生物学特性和所要获得抗血清数量,如一般制备抗r-免疫球蛋白抗血清,多用家兔和山羊,因动物反应良好,而且能够提供足够数量的血清,用于免疫的动物应适龄,健壮,无感染性疾患,最好为///雄性,此外还需十分注意动物的饲养,以消除动物的个体差异以及在免疫过程中死亡的影响。若用兔,最好用纯种新西兰兔,一组三只,兔的体重以2~3kg为宜。
(二)免疫途径
免疫途径有多种多样,如静脉内、腹腔内、肌肉内、皮内、皮下、淋巴结内注射等,一般常用皮下或背部多点皮内注射,每点注射0.1ml左右。途径的选择决定于抗原的生物学特性和理化特性,如激素、酶、毒素等生物学活性抗原,一般不宜采用静脉注射。
(三)佐剂
由于不同个体对同一抗原的反应性不同,而且不同抗原产生免疫反应的能力也有强有弱,因此常常在注射抗原的同时,加入能增强抗原的抗原性物质,以刺激机体产生较强的免疫反应,这种物质称为免疫佐剂。
佐剂除了延长抗原在体内的存留时间,增加抗原刺激作用外,更主要的是,它能刺激网状内皮系统,使参与免疫反应的免疫活性细胞增多,促进T细胞与B细胞的相互作用,从而增强机体对抗原的细胞免疫和抗体的产生。
常用的佐剂是福氏佐剂(Freund adjuvant),其成分通常是羊毛脂1份、石腊油5份,羊毛脂与石腊油的比例,视需要可调整为1:2~9(V/V),这是不完全福氏佐剂,在每毫升不完全佐剂加入1~20mg卡介苗就成为完全佐剂。
配制方法:按比例将羊毛脂与石蜡油置容器内,用超声波使之混匀,高压灭菌,置4℃下保存备用。免疫前取等容积完全或不完全佐剂与免疫原溶液混合,用振荡器混匀成乳状,也可以在免疫前取需要量佐剂置乳钵中研磨,均匀后再边磨边滴加入等容积抗原液(其中加卡介苗3~4mg/ml或不加),加完后再继续研磨成乳剂,滴于冰水上5~10min内完全不扩散为止。为避免损失抗原,亦可用一注射器装抗原液,另一注射器装佐剂,二者以聚乙烯塑料管连接,然后二者来回反复抽吸,约数十分钟后即能完全乳化。检查合格后即以其中一注射器作注射用。
(四)免疫方法
抗原剂量,首次剂量为300~500μg,加强免疫的剂量约为首次剂量为1/4左右。每2~3周加强免疫一次。加强免疫时用不完全佐剂,首次免疫时皮下注射百日咳疫苗0.5ml,加强免疫时不必注射百日咳疫苗。
在第2次加强免疫后2周,从耳缘静脉取2~3ml血,制备血清,检测抗体效价(见后)。如未达到预期效价,需再进行加强免疫,直到满意时为止(图2-3)。当抗体效价达到预期水平时,即可放血制备抗血清。

图2-3 抗体反应
(五)抗血清的采集与保存
家兔是最常用以产生抗体的动物,因此这里主要讨论兔血的收集。羊等较大动物以颈静脉、动脉取血,鼠等小动物取血可参阅有关资料。取兔血有两种方法,一是耳缘静脉或耳动脉放血,一是颈动脉入血,也可心脏采血。取动脉或静脉放血时,将兔放入一个特造的木匣或笼内,耳露于箱(笼)外,也可由另一人捉住兔身。剪去耳缘的毛,用少许二甲苯涂抹耳廓,30s后,耳血管扩张、充血。用手轻拉耳尖,以单面剃须刀或尖的手术刀片,快速切开动脉或静脉,血液即流出,每次可收集30~40ml 。然后用棉球压迫止血,凝血后洗去二甲苯。二星期后,可在另一耳放血。此法可反复多次放血。颈动脉放血时,将兔仰卧,固定于兔台,剪去颈部的毛,切开皮肤,暴露颈动脉,插管,放血。放血过程中要严格按无菌要求进行。
收集的血液置于室温下1h左右,凝固后,置4℃下,过夜(切勿冰冻)析出血清,离心,4000rpm,10min。在无菌条件,吸出血清,分装(0.05~0.2ml),贮于-40℃以下冰箱,或冻干后贮存于4。C冰箱保存。
(六)抗血清质量的评价
在免疫期间,不仅各个不同的动物,而且同一动物在不同的时间内抗血清效价、特异性、亲合力等都可能发生变化,因而必须经常地采血测试。只有在对抗血清的效价、特异性、亲合力等方面作彻底的评价后,才可使用所取得的抗血清。
1.效价 抗血清的效价,就是指血清中所含抗体的浓度或含量。效价测定的方法常用的是放射免疫法,此法对所有的抗体均适用。某些由大分子(如蛋白类)抗原所产生的抗体,可用双扩散等方法测定。前者测定的效价极为精确。而后者则粗糙得多。
(1)放射免疫法: 以不同稀释度的抗血清与优质标记抗原混合,孵育24h后,测定其结合率。通常以结合率为50%的血清稀度和为效价。如某抗血清的结合率为50%时的稀释度为1:15000,则该血清的效价就是1:15000。抗血清的效价,除由抗血清本身的性质决定外,还受标记抗原的质量、孵育时间,所用稀释液的成分及其pH等因素的影响,在工作中必须引起注意。(测定方法见第8章 )
(2)双向扩散法:利用大分子抗原和抗体在琼脂平板上扩散,两者在相交处产生沉淀线,以观察和判断抗血清中是否有抗体及其浓度。
球脂板的制备:100ml pH7.1 的磷酸盐缓冲液加到15g的琼脂内,于水浴中加温,搅拌,使琼脂完全溶解,趁热用纱布过滤,待溶液冷却到65℃左右时,加入叠氮钠(NaN3),使其在溶液中的浓度为0.1%。用移液管把琼脂放在干净平皿或玻片上,约3mm厚,待其冷却,完全凝固后,用打孔器打孔(图2-4)。中央孔内加适量抗原(容量为50μl),周围各孔内分别加入50μl 1:2、1:4、1:8、1:16、1:32及不稀释的抗血清,37℃下孵育24h,观察有无沉淀线产生,以判断血清的稀释度(图2-5)。

图2-4 双向扩散模型

图2-5 免疫扩散试验
2.特异性测定 抗血清的特异性或称专一性是指抗血清对相应的抗原及近似的抗原物质的识别能力。特异性好就是抗血清的识别能力强。通常,特异性是以交叉反应率来表示的。交叉反应率低,表示抗血清的特异性好,反之则特异性差。交叉反应率一般是用竞争抑制曲线来判断的。以不同浓度的抗原和近似抗原物质分别做竞争抑制曲线,计算各自的结合率(B/T或B/B0),求出各自在IC50时的浓度,按下列公式计算交叉反应率。
S=y/Z×100%
S:交叉反应率,y:IC50时抗原浓度,Z:IC50时近似抗原物质的浓度。
如某抗原的IC50浓度为90Pg/管,而一些近似抗原物质IC50浓度几乎是无限大,可以说这一抗血清与其它抗原物质的交叉反应率近似零,即无交叉反应,该抗血清的特异性是好的。
3.亲合力 在免疫学中, 亲合力是指抗体与结合抗原体的活度或牢固度。抗体与抗原结合疏松,结合后会迅速解离,称为亲合力低,反之,亲合力高。亲合力的高低是由抗原分子的大小,抗体分子的结合位点与抗原的决定基之间的立体结构型的合适程度决定的。亲合力常以亲合常数K表示。K的单位是升/摩尔(L/mol)。在RIA中,K是该抗血清能达到的最小检出量(灵敏度)的倒数,K=1/[H],[H]是最小检出量,通常,K的范围在108~1012L/mol之间,也有高达1014L/mol的。
计算亲合常数的方法20余种,计算出的K都不能真实反映实验情况,只能作为参考。
(七)免疫失败的可能原因及应采取的措施
有时不能获得满意的抗血清,可从下列几方面找原因,并改进之。
(1)免疫动物的种属及品系是否合适,可考虑改变动物的种属或品系,或扩大免疫动物的数量。
(2)抗原质量是否良好,可改用其它厂家的产品或改用同一厂家的其它批号,也可考虑改变抗原分子的部分结构,或改进提取方法。
(3)制备的免疫原是否符合要求,可从偶联剂,载体、抗原或载体的比例、反应时间等多方面去考虑,并加以改进。
(4)所用的佐剂是否合适,乳化是否完全,可改用其它佐剂,或加强乳化。
(5)免疫的方法、剂量,加强免疫的间隔时间和次数,免疫的途径是否合适。
(6)动物的饲养是否得当,如营养(饲料、饮水)、环境卫生(通风、采光、温度)是否符合要求,动物的健康情况是否良好等。
二、单克隆抗体的制备
1975年Kohler和Milstein发现将小鼠骨髓瘤细胞与和绵羊红细胞免疫的小鼠脾细胞进行融合,形成的杂交瘤细胞既可产生抗体,又可无性繁殖,从而创立了单克隆抗体杂交瘤技术。这一技术上的突破使血清学的研究进入了一个高度精确的新纪元。
免疫细胞化学的 技术关键之一是制备特异性强、亲合力大、滴度高的特异性抗体,由于每种抗原都有几个抗原决定簇,用它免疫动物将产生对各个决定簇的抗体,即多克隆抗体。单克隆抗体则是由一个产生抗体的细胞与一个骨髓瘤细胞融合而形成的杂交廇细胞经无性繁殖而来的细胞群所产生的,所以它的免疫球蛋白属同一类型,质地纯一,而且它是针对某一抗原决定簇的,因此特异性强,亲合性也一致。单克隆抗体(McAb)的特性和常规血清抗体的特性比较见2-3。
表2—3 单克隆抗体(McAb)和常规免疫血清抗体的特性比较
| 项目 | 常规免疫血清抗体 | McAb |
| 抗体产生细胞 | 多克隆性 | 单克隆性 |
| 抗体的结合力 | 特异性识别多种抗原决定簇 | 特异性识别单一抗原决定簇 |
| 免疫球蛋白类别及亚类 | 不均一性,质地混杂 | 同一类属,质地纯一 |
| 特异性与亲合力 | 批与批之间不同 | 特异性高,抗体均一 |
| 有效抗体含量 | 0.01~0.1mg/ml(小鼠腹水) | 0.5~5.0mg/ml(小鼠腹水) 0.5~10.0μg/ml(培养物上清液) |
| 用于常规免疫学实验 | 可用 | 单抗组合应用 |
| 抗原抗体形成格子结构(沉淀反应) | 容易形成 | 一般难形成 |
| 抗原抗体反应 | 抗体混杂,形成2分子反应困难,不可逆 | 可形成2分子反应,可逆 |
单克隆抗体的制备方法如下。
(一)动物的选择与免疫
1.动物的选择 纯种BALB/C小鼠,较温顺,离窝的活动范围小,体弱,食量及排污较小,一般环境洁净的实验室均能饲养成活。目前开展杂交瘤技术的实验室多选用纯种BALA/C小鼠。
2.免疫方案 选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb至关重要。一般在融合前两个月左右根据确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定。
(1)可溶性抗原免疫原性较弱,一般要加佐剂,半抗原应先制备免疫原,再加佐剂。常用佐剂:福氏完全佐剂、福氏不完全佐剂。
初次免疫 抗原1~50μg加福氏完全佐剂皮下多点注射或脾内注射(一般0.8~1ml,0.2ml/点)
↓3周后
第二次免疫 剂量同上,加福氏不完全佐剂皮下或ip(腹腔内注射)(ip剂量不宜超过0.5ml)
↓3周后
第三次免疫 剂量同一,不加佐剂,ip(5~7天后采血测其效价)
↓2~3周
加强免疫,剂量50~500μg为宜,ip或iv(静脉内注射)
↓3天后
取脾融合
目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如:①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。②改变抗原注入的途径,基础免疫可直接采用脾内注射。③使用细胞因子作为佐剂,提高机体的免疫应答水平,增强免疫细胞对抗原的反应性。
(2)颗粒抗原免疫性强,不加佐剂就可获得很好的免疫效果。以细胞性抗原为例,免疫时要求抗原量为1~2×107个细胞。
初次免疫 1×107/0.5ml ip
↓2~3周后
第二次免疫 1×107/0.5ml ip
↓3周后
加强免疫(融合前三天)1×107/0.5ml ip或iv
↓
取脾融合
(二)细胞融合
1.细胞融合前准备
(1)骨髓瘤细胞系的选择:骨髓瘤细胞应和免疫动物属于同一品系,这样杂交融合率高,也便于接种杂交瘤在同一品系小鼠腹腔内产生大量McAb。常用的骨髓瘤细胞系见表2-4。
表2-4用于融合试验的主要骨髓瘤细胞系
| 名 称 | 来 源 | 耐 受 药 物 | Ig链 |
| H L | |||
| P3/X63-Ag8(X63) | BALB/C骨髓瘤MOPC-21 | 8-氮鸟嘌呤 | r1 K |
| P3/X63-Ag8.653(X63-Ag8.653) | P3/X63-Ag8 | 8-氮鸟嘌呤 | - - |
| P3/NSI-1-Ag4-1(NS-1) | P3/X63-Ag8 | 8-氮鸟嘌呤 | - K(不分泌型) |
| P3/X63-Ag8.Ul(P3Ul) | (X63×BALB/C脾细胞)杂交瘤 | 8-氮鸟嘌呤 | - - |
| SP2/0-Ag14(SP2/0) | (X63×BALB/C脾细胞)杂交瘤 | 8-氮鸟嘌呤 | - - |
| F0 | BALB/C骨髓瘤 | 8-氮鸟嘌呤 | - - |
| S194/5.XXO.BU.1 | P3/X63-Ag8 | 5-溴脱氧尿嘧啶核苷 | - - |
| MPC11-45.6TG1.7 | BALB/C骨髓瘤MPC-11 | 6-巯鸟嘌呤 | r2b K |
| 210.RCY3.Ag1.2.3 | LOU大鼠骨髓瘤R210 | 8-氮鸟嘌呤 | - K |
| GM15006TG-A12 | 人骨髓瘤GM1500 | 6-巯鸟嘌呤 | r1 K |
| U-266AR | 人骨髓瘤U-266 | 8-氮鸟嘌呤 | ελ |
骨髓瘤细胞的培养可用一般的培养液,如RPMI1640,DMEM培养基。小牛血清的浓度一般在10%~20%,细胞浓度以104~5×105/ml为宜,最大浓度不得超过106/ml。当细胞处于对数生长的中期时,可按1:3~1:10的比例传代。每3~5天传代一次。细胞在传代过程中,部分细胞可能有返祖现象,应定期用8-氮鸟嘌呤进行处理,使生存的细胞对HAT呈均一的敏感性。
(2)饲养细胞:在组织培养中,单个或少数分散的细胞不易生长繁殖,若加入其它活细胞,则可促进这些细胞生长繁殖,所加入的这种细胞数被称为饲养细胞。在制备McAb的过程中,许多环节 需要加饲养细胞,如在杂交瘤细胞筛选、克隆化和扩大培养过程中,加入饲养细胞是十分必要的。常用的饲养细胞有:小鼠腹腔巨噬细胞(较为常用)、小鼠脾脏细胞或胸腺细胞。也有人用小鼠成纤维细胞系3T3经放射线照射后作为饲养细胞。饲养细胞的量为一般为2×104或105细胞/孔。
2.细胞融合的步骤
(1)制备饲养细胞层:一般选用小鼠腹腔巨噬细胞。
与免疫小鼠相同品系的小鼠,常用BALB/C小鼠,6~10周龄
↓
拉颈 处死,浸泡在75%酒精内,3~5min
↓
用无菌剪刀剪开皮肤,暴露腹膜
↓
用无菌注射器注入5~6ml预冷的培养液(严禁刺破肠管)
↓
反复冲洗,吸出冲洗液
↓
冲洗液放入10ml离心管,1200rpm/分离5~6min
↓
用20%小牛血清(NCS)或胎牛血清(FCS)的培养液混悬,调整细胞数至1×105/ml
↓
加入96孔板,100μl/孔
↓
放入37。c CO2孵箱培养
(2)制备免疫脾细胞
最后一次加强免疫3天后小鼠拉颈处死
↓
无菌取脾脏,培养液洗 一次
↓
脾脏研碎,过不锈钢筛网
↓
离心,细胞用培养液洗2次
↓
计数
↓
取108脾淋巴细胞悬液备用
(3)制备骨髓瘤细胞
取对数生长骨髓瘤细胞离心
↓
用无血清培养液洗2次
↓
计数,取得×107细胞备用
(4)融合
①将骨髓瘤细胞与脾细胞按1:10或1:5的比例混合在一起,在50ml离心管中用无血清不完全培养液洗1次,离心,1200rpm,8min;弃上清,用吸管吸净残留液体,以免影响聚乙二醇(PEG)浓度。轻轻弹击离心管底,使细胞沉淀略松动。
②90s内加入37℃预温的1ml 45%PEG(分子量4000)溶液,边加边轻微摇动。37℃水浴作用90s。
③加37。C预温的不完全培养液以终止PEG作用,每隔2min分别加入1ml、2ml、3ml、4ml、5ml和6ml。
④离心,800rpm, 6min。
⑤充上清,用含20%小牛血清HAT选择培养液重悬。
⑥将上述细胞,加到已有饲养细胞层的96孔板内,每孔加100μl。一般一个免疫脾脏可接种4块96孔板。
⑦将培养板置37℃、5%CO2培养箱中培养。
(三)选择杂交瘤细胞及抗体检测
1.HAT选择杂交瘤细胞 脾细胞和骨髓瘤细胞经PEG处理后,形成多种细胞的混合体,只有脾细胞与骨髓细胞形成的杂交瘤细胞才有意义。在HAT选择培养液中培养时,由于骨髓瘤细胞缺乏胸苷激酶或次黄嘌呤鸟嘌呤核糖转移酶,故不能生长繁殖,而杂交瘤细胞具有上述两种酶,在HAT选择培养液可以生长繁殖。
在用HAT选择培养1~2天内,将有大量瘤细胞死亡,3~4天后瘤细胞消失,杂交细胞形成小集落,HAT选择培养液维持7~10天后应换用HT培养液,再维持2周,改用一般培养液。在上述选择培养期间,杂交瘤细胞布满孔底1/10面积时,即可开始检测特异性抗体,筛选出所需要的杂交瘤细胞系。在选择培养期间,一般每2~3天换一半培养液。
2.抗体的检测 检测抗体的方法应根据抗原的性质、抗体的类型不同,选择不同的筛选方法,一般以快速、简便、特异、敏感的方法为原则。
常用的方法有:(1)放射免疫测定(RIA)可用于可溶性抗原、细胞McAb的检测。(2)酶联免疫吸附试验(ELISA)可用于可溶性抗原、细胞和病毒等McAb的检测。(3)免疫荧光试验适合于细胞表面抗原的McAb的检测。(4)其它如间接血凝试验、细胞毒性试验、旋转粘附双层吸附试验等。
(四)杂交瘤的克隆化
杂交瘤克隆化一般是指将抗体阳性孔进行克隆化。因为经过HAT筛选后的杂交瘤克隆不能保证一个孔内只有一个克隆。在实际工作中,可能会有数个甚至更多的克隆,可能包括抗体分泌细胞、抗体非分泌细胞、所需要的抗体(特异性抗体)分泌细胞和其它无关抗体的分泌细胞。要想将这些细胞彼此分开就需要克隆化。克隆化的原则是,对于检测抗体阳性的杂交克隆尽早进行克隆化,否则抗体分泌的细胞会被抗体非分泌的细胞所抑制,因为抗体非分泌细胞的生长速度比抗体分泌的细胞生长速度快,二者竞争的结果会使抗体分泌的细胞丢失。即使克隆化过的杂交瘤细胞也需要定期的再克隆,以防止杂交瘤细胞的突变或染色体丢失,从而丧失产生抗体的能力。
克隆化的方法很多,最常用的是有限稀释法和软琼脂平板法。
1.有限稀释法克隆
(1)克隆前1天制备饲养细胞层(同细胞融合)。
2)将要克隆的杂交瘤细胞从培养孔内轻轻吹干,计数。
(3)调整细胞为3~10个细胞/ml。
(4)取头天准备的饲养细胞层的细胞培养板,每孔加入稀释细胞100μl。孵育于37℃、5%CO2孵箱中。
(5)在第7天换液,以后每2~3天换液1次。
(6)8~9天可见 细胞克隆形成,及时检测抗体活性。
(7)将阳性孔的细胞移至24孔板中扩大培养。
(8)每个克隆应尽快冻存。
2.软琼脂培养法克隆
(1)软琼脂的配制:含有20%NCS(小牛血清)的2倍浓缩的RPMI1640。
①1%琼脂水溶液:高压灭菌,42℃预热。
②0.5%琼脂:由1份1%琼脂加1份含20%小牛血清的2倍浓缩的RPMI1640配制而成。置42℃保温。
(2)用上述0.5%琼脂液(含有饲养细胞)15ml倾注于直径为9cm的平皿中,在室温中待凝固后作为基底层备用。
(3)按100/ml,500/ml或5000/ml等浓度配制需克隆的细胞悬液。
(4)1ml 0.5%琼脂液(42℃预热)在室温中分别与1ml不同浓度的细胞悬液相混合。
(5)混匀后立倾注于琼脂基底层上,在室温中10min,使其凝固,孵育于37℃、5%CO2孵箱中。
(6)4~5天 后即可见针尖大小白色克隆,7~10天后,直接移种至含饲养细胞的24孔中进行培养。
(7)检测抗体,扩大培养,必要是地再克隆化。
(五)杂交瘤细胞的冻存与复苏
1.杂交瘤细胞的冻存 及时冻存原始孔的杂交瘤细胞每次克隆化得到的亚克隆细胞是十分重要的。因为在没有建立一个稳定分泌抗体的细胞系的时候,细胞的培养过程中随时可能发生细胞的污染、分泌抗体能力的丧失等等。如果没有原始细胞的冻存,则可因上述意外而前功尽弃。
杂交瘤细胞的冻存方法同其他细胞系的冻存方法一样,原则上细胞应在每支安瓿含1×106以上,但对原始孔的杂交瘤细胞可以因培养环境不同而改变,在24孔培养板中培养,当长满孔底时,一孔就可以装一支安瓿冻存。
细胞冻存液:50%小牛血清;40%不完全培养液;10%DMSO(二甲基亚砜)。
冻存液最好预冷,操作动作轻柔、迅速。冻存时从室温可立即降至0℃后放入-70℃超低温冰箱,次日转入液氮中。也可用细胞冻存装置进行冻存。冻存细胞要定期复苏,检查细胞的活性和分泌抗体的稳定性,在液氮中细胞可保存数年或更长时间。
2.细胞复苏方法 将玻璃安瓿自液氮中小心取出,放37℃水浴中,在1min内使冻存的细胞解冻,将细胞用完全培养液洗涤两次,然后移入头天已制备好的饲养层细胞的培养瓶内,置37℃、5%CO2孵箱中培养,当细胞形成集落时,检测抗体活性。
(六)单克隆抗体的大量生产
大量生产单克隆抗体的方法主要有两种:
(1)体外使用旋转培养管大量培养杂交瘤细胞,从一清液中获取单克隆抗体。但此方法产量低,一般培养液内抗体含量为10~60μg/ml,如果大量生产,费用较高。
(2)体内接种杂交瘤细胞,制备腹水或血清。
①实体瘤法:对数生长期的杂交瘤细胞按1~3×107/ml接种于小鼠背部皮下,每处注射0.2ml,共2~4点。待肿瘤达到一定大小后(一般10~20天)则可采血,从血清中获得单克隆 抗体的含量可达到1~10mg/ml。但采血量有限。
②腹水的制备:常规是先腹腔注射0.5mlPristane (降植烷)或液体石蜡于BALB/C鼠,1~2周后腹腔注射1×106个杂交瘤细胞,接种细胞7~10天后可产生腹水,密切观察动物的健康状况与腹水征象,待腹水尽可能多,而小鼠频于死亡之前,处死小鼠,用滴管将腹水吸入试管中,一般一只小鼠可获5~10ml腹水。也可用注射器抽提腹水,可反复收集数次。腹水中单克隆抗体含量可达到5~10mg/ml,这是目前最常用的方法,还可将腹水中细胞冻存起来,复苏后转种小鼠腹腔则产生腹水块、量多。
(七)单克隆抗体的鉴定
对制备的McAb进行系统的鉴定是十分必要的,应做下述几个方面的鉴定:
1.抗体特异性的鉴定 除用免疫原(抗原)进行抗体的检测外,还应该用与其抗原成分相关的其它抗原进行交叉试验,方法可用ELISA、IFA法。例如:①制备抗黑色素瘤细胞的McAb,除用黑色素瘤细胞反应外,还应该用其它脏器的肿瘤细胞和正常细胞进行交叉反应,以便挑选肿瘤特异性或肿瘤相关抗原的单克隆抗体。②制备抗重组的细胞因子的单克隆抗体,应首先考虑是否与表达菌株的蛋白有交叉反应,其次是与其它细胞因子间有无交叉。
2.McAb的Ig类与亚类的鉴定一般在用酶标或荧光素标记的第二抗体进行筛选时已经基本上确定了抗体的Ig类型。如果用的是酶标或荧光素标记的兔抗鼠IgG或IgM,则检测出来的抗体一般是IgG类或IgM类。至于亚类则需要用标准抗亚类血清系统作双扩或夹心ELISA来确定。在作双扩试验时,如加入适量的PEG(3%),更有利于沉淀线的形成。
3.McAb中和活性的鉴定 用动物或细胞的保护实验来确定McAb的生物学活性。例如,如果确定抗病毒McAb的中和活性,则可用抗体和病毒同时接种于易感的动物或敏感的细胞,来观察动物或细胞是否得到抗体的保护。
4.McAb识别抗原表位的鉴定用竞争结合试验,测相加指数的方法,测定McAb所识别抗原位点,来确定McAb的识别的表位是否相同。
5.McAb亲合力的鉴定 用ELISA或RIA竞争结合试验来确定McAb与相应抗原结合的亲合力。
第三节 抗体的提取与纯化(缺)
第三章 免疫荧光细胞化学技术
免疫荧光细胞化学是现代生物学和医学中广泛应用的技术之一,是由Coons等(1950)建立,经过近43年的发展,免疫荧光技术与形态学技术相结合发展成免疫荧光细胞(或组织)化学。它与亲合化学技术如葡萄球菌A蛋白(SPA)、生物素与卵白素、植物血凝素(ConA等)相结合拓宽了领域;与激光技术、电子计算机和扫描电视等技术结合发展为定量免疫荧光细胞化学技术;荧光激活细胞分类器(FACS)的应用使免疫荧光细胞化学技术发展到更高的阶段,开创了免疫荧光技术的新领域。细胞显微分光亮度计与与图像分析仪的结合使免疫荧光组织化学的定量检测更加准确。在免疫荧光细胞化学中应用单克隆抗体日益增多,将会不断提高特异性、敏感性和应用范围。激光扫描等聚集显微镜的应用又开创了新的发展时代。
由于免疫荧光细胞化学的特异性,快速性和在细胞和分子水平定位的敏感性与准确性,在免疫学、微生物学、细胞和组织学、病理学、肿瘤学以及临床检验学等生物学和医学许多方面得到广泛应用,日益发挥重要的作用。
第一节 免疫荧光细胞化学的原理
免疫荧光细胞化学是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素制成荧光标记物,再用这种荧光抗体(或抗原)作为分子探针检查细胞或组织内的相应抗原(或抗体)。在细胞或组织中形成的抗原抗体复合物上含有荧光素,利用荧光显微镜观察标本,荧光素受激发光的照射而发出明亮的荧光(黄绿色或桔红色),可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量(图3-1)。

图3-1 紫外光激发荧光物质放射荧光示意图
用荧光抗体示踪或检查相应抗原的方法称荧光抗体法;用已知的荧光抗原标记物示踪或检查相应抗体的方法称荧光抗原法。这两种方法总称免疫荧光技术,以荧光抗体方法较常用。用免疫荧光技术显示和检查细胞或组织内抗原或半抗原物质等方法称为免疫荧光细胞(或组织)化学技术。
免疫荧光细胞化学分直接法、夹心法、间接法和补体法。
一、直接法
1.检查抗原法 这是最早的方法,用已知特异性抗体与荧光素结合,制成荧光特异性抗体,直接与细胞或组织中相应抗原结合,在荧光显微镜下即可见抗原存在部位呈现特异性荧光。此法很特异和简便,但一种荧光抗体只能检查一种抗原,敏感性较差(图3-2)。

图3-2 直接法
2.检查抗体法 将抗原标记上荧光素,即为荧光抗原,用此荧光抗原与细胞或组织内相应抗体反应,而将抗体定位检测出来。
二、间接法
1.检查抗体法(夹心法)此法是先用特异性抗原与细胞或组织内抗体反应,再用此抗原的特异性荧光抗体与结合在细胞内抗体上的抗原相结合,抗原夹在细胞抗体与荧光抗体之间,故称夹心法。
2.检查抗体法用已知抗原细胞或组织标本的切片,加上待检血清,如果其中含有切片中某种抗原的抗体,抗体便沉淀结合在抗原上,再用间接荧光抗体(抗种属特异性IgG荧光抗体)与结合在抗原上的抗体反应(如检测人血清中的抗体必需用抗人IgG荧光抗体等),在荧光显微镜下可见抗原抗体反应部位呈现明亮的特异性荧光。此法是检验血清中自身抗体和多种病原体抗体的重要手段(图3-3)

图3-3 间接法
3.检查抗原法双薄片此法是直接法的重要改进,先用特异性(对细胞或组织内抗原)抗体(或称第一抗体)与细胞标本反应,随后用缓冲盐水洗去未与抗原结合的抗体,再用间接荧光抗体(也称第二抗体,种特异性)与结合在抗原上的抗体(是第二抗体的抗原)结合,形成抗原-抗体-荧光抗体的复合物。由于结合在抗原抗体复合物上的荧光抗全显著多于直接法,从而提高了敏感性。如细胞抗原上每个分子结合3~5个分子抗体,当此抗体作为抗原时又可结合3~5分子的荧光抗体,所以和直接法相比荧光亮度可增强3至4倍。此法除灵敏性高外,它只需要制备一种种属间接荧光抗体,可以适用于多种第一抗体的标记显示。这是现在最广泛应用的技术。
三、补体法
1.直接检查组织内免疫复合物法用抗补体C3等荧光抗体直接作用组织切片,与其中结合在抗原抗体复合物上的补体反应,而形成抗原抗体补体复合物---抗补体荧光抗体复合物,在荧光显微镜下呈现阳性荧光的部位就是免疫复合物的存在处,此法常用于肾穿刺组织活检诊断等。

图3-4 补体法
2.间接检查组织内抗原法常将新鲜补体与第一抗体混合同时加在抗原标本切片上,经37℃孵育后,如发生抗原补体抗体反应,补体就结合在此复合物上,再用抗补体荧光抗体与结合的补体反应,形成抗原抗体—抗补体荧光抗体的复合物,此法优点是只需一种荧光抗体可适用于各种不同种属来源的第一抗体的标记显示。
四、双重免疫荧光标记法
在同一细胞组织标本上需要同时检查两种抗原时,要进行双重荧光染色,一般均采用直接法,将两种荧光抗体(如抗A和抗B)以适当比例混合,加在标本上孵育后,按直接法洗去未结合的荧光抗体,抗A抗体用异硫氰酸荧光素标记,发黄绿色荧光;抗B抗体用TMRITC或RB200标记,发红色荧光,可以明确显示两种抗原的定位。
五、对照试验
为了保证免疫荧光细胞化学染色的准确性,排除某些非特异性染色,必须在初次试验时进行以上对照试验:
1.直接法需设下述对照试验
(1)标本自发荧光对照:标本只加PBS或不加PBS,缓冲甘油封片,荧光显微镜观察应呈阴性荧光(无与特异性荧光相似的荧光)。
(2)抑制试验:可分为二步法和一步法。
①二步抑制法:标本先加未标记的特异性抗体,再加标记荧光抗体,结果应呈阴性或明显减弱的荧光。
②一步抑制法:先将荧光抗体用未标记抗体作适量混合,再加在标本上染色,结果应为阴性。此法效果较二步法好,并且简便。
(3)阳性对照:用已知阳性标本作直接法免疫荧光染色,结果应呈阳性荧光。
如对照(1)和(2)无荧光或弱荧光,(3)和待检查标本呈强荧光即为特异性阳性荧光。
2.间接法
(1)自发荧光对照:同上(一)。
(2)荧光抗体对照:标本只加间接荧光抗体染色,结果阴性。
(3)抑制试验:同上。
(4)阳性对照:同上。
如对照(1)、(2)、(3)均呈阴性,阳性对照和待检标本阳性则为特异性荧光。
3.补体法
(1)自发荧光对照
(2)荧光抗体对照
(3)抑制试验
(4)补体对照:取新鲜豚鼠血清1:10稀释先作用标本,再用抗补体荧光抗体染色,结果阴性。
(5)抑制试验:标本加灭活的第一抗体,再用1:10稀释度的新鲜豚鼠血清孵育后,再加未标记的抗补体血清与抗补体荧光抗体等量混合稀释液,结果应为阴性。
(6)阳性对照:(1)~(5)结果阴性,(6)和待检标本阳性时,则为特异性荧光。
第二节 荧光抗体的制备
荧光抗体是免疫荧光细胞化学的重要技术之一,制备高特异性和高效价的荧光抗体必须选用高质量的荧光素和高特异性高效价的免疫血清。
一、荧光素
荧光是指一个分子或原子吸收了给予的能量后即刻引起发光,停止能量供给,发光也瞬时停止(一般持续10-7~10-8s)。可以产生明亮荧光的染料物质,称荧光色素。目前主要常用的荧光色素有以下3种:
(一)异硫氰酸荧光素(Fluoresceinisothiocyanate, GITC)
呈黄色、橙黄或褐黄色粉末或结晶,性质稳定,在室温下能保存2年以上,在低温中可保存多年。易溶于水和酒精。最大吸收光谱为490~495nm,最大发射光谱为520~530nm,呈现黄绿色荧光,分子量为398.4(图3-5)。
在碱性条件下,FITC的异硫氰酸基在水溶液中与免疫球蛋白的自由氨基经碳酰胺化而形成硫碳氨基键,成为标记荧光免疫球蛋白,即荧光抗体。反应式如下(图3-6):
一个Ig分子上最多能 标记15~20个FITC分子。

图3-5 FITC的吸收光谱和发射光谱

图3-6 抗体的FITC标记反应式
(二)四乙基罗达明(tetraethylrodamineB200, RB200)
呈褐红色粉末,不溶于水,易溶于酒精和丙酮,性质稳定,可长期保存。最大吸收光谱为570nm,最大发射光谱为595~600nm,呈明亮橙红色荧光。分子量为580(图3-7)。
RB200在五氯化磷(PCl5)作用下转变成磺酰氯(SO2Cl),在碱性条件下易与蛋白质的赖氨酸ε-氨基反应结合而标记在蛋白分子上。化学反应式如下(图3-8)。

图3-7 RB200在可见光区的吸收

图3-8 RB200标记抗体反应光谱和荧光光谱
(三)四甲基异硫氰酸罗达明(tetramethylrhodamineisothiocyanate, TMRITC)
它是一种紫红色粉末,较稳定。其最大吸收光谱为550nm,最大发射光谱620nm,呈橙红色荧光,与FITC的黄绿色荧光对比清晰(图3-9),与蛋白质结合方式同TITC。它可用于双标记示踪研究。化学结构式如下(图3-10)。

图3-9 TMRITC在可见光区的吸收光谱和发射光谱

图3-10 TMRITC结构式
二、荧光素标记抗体的方法
(一)FITC标记抗体的方法
1.Marsshall 氏法
(1)材料:抗体球蛋白溶液、0.5mol/l pH9.0碳酸盐缓冲液、无菌生理盐水、异硫氰酸荧光素、1%硫柳汞水溶液、三角烧瓶(25~50ml)、冰及冰槽(或1000ml烧杯)、电磁搅拌器、灭菌吸管、透析袋、玻棒、棉线及烧杯(500ml)、pH7.2或8.0的0.01mol/L PBS等。
(2)方法及步骤:
①抗体的准备:取适量已知球蛋白浓度之溶液,置入三角烧瓶中,加入生理盐水及碳酸盐缓冲液,使最后蛋白浓度为20mg/ml,缓冲液容量为总量的1/10,混匀,将三角烧瓶置冰槽中,电磁搅拌(速度适当以不起泡沫为宜)5~10min。
②荧光素的准备:根据欲标记的蛋白质总量,按每毫克蛋白加0.01mg 荧光素,用分析天平准确称所取所需的异硫氰酸荧光素粉末。
③结合(或称标记):边搅拌边将称取的荧光色素渐渐加入球蛋白溶液中,避免将荧光素粘于三角烧瓶壁或搅拌玻棒上(大约5~10min内加完),加毕后,继续搅拌12~18h。结合期间应保持蛋白溶液于4℃左右,故须及时添冰去水;亦可将结合装置安放在4℃冰箱或冰库中。
④透析:结合完毕后,将球蛋白的溶液离心(2500r/min)20min,除去其中少量之沉淀物,装入透析袋中后再置于烧杯中,用pH8.0缓冲盐水透析(0~4℃)过夜。
⑤过柱:取透析过夜的标记物,过葡聚糖凝胶G-25或G-50柱,分离游离荧光素,收集标记的荧光抗体进行鉴定(图3-11,图-3-12)。

图3-11 Sephadex G-25 对FITC

图3-12 FITC与家兔IgG球蛋白在25℃和2℃时结合的动力学(Kawamura 1964)
洗脱液:0.01mol/L磷酸盐缓冲液(pH7.2);过滤量:12ml标记全球蛋白液(过滤前未透析);收集量:20ml(稀释1.7倍)。
分别以1mgFITC溶于2份1mol 0.5mol/L碳酸重碳酸盐缓冲液(分别为pH9.5和pH9.0),于2℃下搅拌将其各加入100mg家兔IgG生理盐水溶液中,搅匀后立即将每份分为两半。一半保留于2℃下,另一半置25℃下。间隔一定时间后各取出0.5ml通过sephadex G-25去游离FITC,由上计算出5mg家兔IgG结合的FITC量。
2.Chadwick 氏法
(1)材料:抗原球蛋白溶液、异硫氰酸荧光素、3%重碳酸钠水溶液、0.01mol/l Ph8.0磷酸盐缓冲盐水、1%硫柳汞、离心机及离心管、三角烧瓶(25ml)、冰槽、无菌吸管及毛细滴管、烧杯(500ml)、透析袋、棉线、玻棒等。
(2)方法及步骤:
①抗体准备:用0~4℃pH8.0磷酸盐缓冲盐水将球蛋白溶液稀释至浓度为30~40mg/ml,置入三角烧瓶内,放于冰槽中。
②荧光色素准备:按每毫克蛋白加入荧光素0.01mg计算,称取所需之荧光素量,用3%重碳酸钠水溶液溶解。
③将准备之抗体与荧光色素溶液等量混合,充分搅匀,在0~4℃,冰箱中结合18~24h。
④透析和柱层析:方法同Marshall 氏法。
3.改良法(1963年) 根据Marshall 氏法取高价的抗人球蛋白兔免疫血清,分离球蛋白,用盐水(0.15mol/l NaCl)及缓冲液(0.15mol/l NaHCO3 –Na2CO3 PH9.0) 稀释使每毫升内含蛋白10mg,缓冲液为总量的10%,降温至4℃,加入异硫氰酸盐荧光素,(蛋白:荧光素=50~80mg:1mg),在0~4℃下电磁搅拌12~14h。然后用半饱和和硫酸铵将标记球蛋白沉淀分离,除去未结合的荧光素,再用缓冲盐水透析,除去硫酸铵(用Nessler氏试剂测验至隔夜透析之盐水无氨离子及荧光色素为止)。将制备好的荧光抗体加叠氮钠0.01%,分装在1ml安瓿中,或冻干,保存于冰箱中(4℃)可以用半年以上,-20℃保存可达2年以上。
【附一】0.01mol/L pH7.2 PBS 配法:NaCl 18g 、Na2HPO41.5g、KH2PO40.2g,溶于2000ml蒸馏水中,校定pH至7.2。
【附二】0.5mol/L pH9.0碳酸盐缓冲液配法:取0.5mol/l Na2CO3(5.3%)10ml加入0.5mol/l NaHCO3(4.2%)90ml,混合后,校定pH至9.0。
【附三】3%重碳酸钠水溶液配法:称1.5g无水重碳酸钠充分溶解于50ml灭菌蒸馏水中即成。
4.透析标记法 此法适用于小量抗体的荧光素标记,标记简便,非特异性染色较少。
(1)用0.025mol/L碳酸盐缓冲液pH9.0,将欲标记免疫球蛋白稀释成1%浓度,装入透析袋中。
(2)用同一缓冲液将FITC配成0.1mg/ml的溶液,按1%球蛋白液体积的10倍,将FITC稀释液盛于圆柱形容器内,并使透析袋浸没于FITC液中。容器顶端盖紧,底部放搅拌棒,在4℃电磁搅拌下,透析标记24h。取出透析袋中标记液,即刻用sephadex G-50 凝胶过滤,去除游离荧光素,分装、贮存于4℃中(图3-13)。

图3-13 标记抗体溶液通过sephadex 产胶柱层析分布
(二)四乙基罗达明标记抗体方法
取1g RB200及PCL52g放在乳钵中研磨5min(在通风橱中)。然后加入10ml无水丙酮,放置5min,不断搅拌。过滤,用滤液进行标记抗体。剩余部分吸附在滤纸上,4℃干燥保存。
取抗体(20mg/ml)每毫升加入生理盐水和0.5mol/l pH9.0的碳酸盐缓冲液各1ml稀释。逐滴加入0.1ml RB200溶液,边加入边搅拌,在0~4℃中结合12~18h,再用生理盐水透析5~7h,经葡聚糖凝胶G-50柱层析,除去游离荧光素,分装,贮存于4℃备用。
(三)四甲基异硫氰酸罗达明标记抗体方法
(1)Igg 10ml (6mg/ml)在0.01mol/l pH9.5碳酸盐缓冲液中透析过夜。
(2)将四甲基异硫近氰酸罗达明(每毫克IgG加入5~20μg)溶于二甲亚砜(1mg/ml),取此溶液300μl,一滴一滴加入蛋白质溶液中,同时电磁搅拌。
(3)在室温中搅拌2h,避光。
(4)把结合物移入直径3cm,高30cm大小的Bio –Gel P-6层析柱(用0.01mol/l pH8.0的PBS平衡过),流速为1.5ml/min。
(5)收集先流出的红色结合物,即为标记抗体,分装,4℃保存备用。
(四)藻红蛋白标记抗体的方法
1.巯基化藻红蛋白(phycoerthrin PE)的制备,600μl的15.5mg/ml盐酸巯醇亚胺(iminothiolane hydrochloride)加到1.2ml的3.6mg/ml的PE中,和1.2ml PB、pH6.8 混合,装入透析袋置入50mmol/l pH6.8 PB中透析,4℃过夜,再换用pH7.5PB透析6h。每个PE分子中可结合8个巯基。
2.PE-IgG制备异双功能试剂SPDP[n - Succ - inimdyl3-(2-pyridyldlthio) propinate ] 30μl (1.1mg/ml)的乙醇溶液,加入700μl的4.2mg/ml IgG PB溶液(50mmol/l pH7.5),在室温中反应2.5h。再加入巯基化Pe 400μl(1.7mg/ml)加到500μl反应混合液中,室温反应12h,加入100μl的50mmol/L碘乙酸钠封闭残余巯基,用PB透析过夜,4℃。加入0.01%Na3N3分装,4℃保存半年。
(五)PE-标记蛋白A方法
(1)取4.08mg PE溶于0.1mol/l pH7.4PB(含0.1mol/l NaCl)1ml中,溶解后,取出0.5ml,再加入10μlSPDP无水甲醇液(2.65mg/ml),SPDP/蛋白摩尔比为10,22℃反应5min,过Sephadex G-50(1×17cm),用100mmol/l pH7.4 PBS(含0.1mol/l NaCl)平衡和洗脱。
(2)0.5ml蛋白(2mg/ml)100mmol/l PB(含有100mmol/l NaCl) pH7.4,加入2.6μl上述SPDP甲醇液,SPDP:蛋白=9.5,22℃,40min ,加入25μmol/L二硫苏糖醇(DTT)pH7.4缓冲液,22℃,25min,同上过Sephadex G-50,收集蛋白A峰。
(3)取0.77mg/ml的PE和0.27mg/ml蛋白A等量混合,22℃反应6h,混合物4℃保存备用。
以上两种PE标记制品,可最后溶于0.01mol/l pH7.4PB(含有0.1mol/l DETA、1mol/L碘乙酰胺、1%BSA 和0.1%NaN3),0~5℃保存。
(六)蓝色荧光素标记抗体方法
Kbaffan等(1986)首先创立了蓝色荧光素标记和染色技术,可进行双标记或多标记。
(1)取7-氨基-4-甲基香豆素(7-amino-4-methyl coumarin, AMC)260μg溶于二甲亚砜25μl中。
(2)将上液加入10ml IgG的 巴比妥缓冲液(0.5mol/L,pH8.5,内含50~100mg IgG)中,室温反应2h,过Sephadex G-50除去游离荧光素。
AMC呈黄色结晶固体,最大吸收波长354nm,最大荧光波长430nm。
三、荧光抗体质量控制
对制备的荧光抗体必须进行质量鉴定,主要进行特异性和敏感性两个方面的鉴定。
(一)染色特异性和敏感性的测定
1.特异性染色效价的测定直接染色以倍比稀释荧光抗体溶液如1:2,1:4,1:8……,与相应抗原标本作一系列染色,荧光强度在“+++”的最大释释度,即为该荧光抗体的染色滴度(效价)或单位。实际染色应用时,可取低一个或两个稀释度(即2~4个单位),如染色效价为1:64,实际应用时可取1:32或1:16。间接染色效价可按抗核抗体荧光染色法步骤,先用不同稀释度的荧光抗体染色,结果以抗核抗体荧光强度“++”为标准,染色用效价和直接法相同。
2.非特异性染色测定根据荧光抗体的用途不同,可用相类似的抗原切片或涂片,倍比稀释荧光抗体,按常规染色,结果在标本上出现的非特异染色应显著低于特异染色滴度,否则应采取消除非特异性染色的方法处理荧光抗体。
3.吸收试验在荧光抗体中加入过量相应抗原,于室温中搅拌2h后,移入4℃中过夜,3000r/min,离心30min,收集上清液,再用以染相应抗原阳性标本,结果应不出现明显阳性荧光。
4.抑制试验如前述。
(二)F/P比值的测定
F(荧光素)和P(抗体蛋白)的克分子比值反映荧光抗体的特异性染色质量,一般要求F/P的克分子比值为1~2。过高时,非特异性染色增强;过低时,荧光很弱,降低敏感性。
1.蛋白质定量 测定荧光抗体的蛋白质mg/ml量。
2.结合荧光素定量 先制作荧光素定量标准曲线,即准确称取FITC1mg,溶于10ml 0.5mol/L pH9.0碳酸盐缓冲液中,再用0.01mol/l pH7.2PBS稀释到100ml,此时荧光素含量为10 μg/ml,以此为原液,再倍比稀释9个不同浓度的溶液,用分光亮度计在490nm波长测定光密度值(OD),以光密度为纵坐标,荧光素含量为横坐标,作标准函数图。
荧光素与蛋白质结合后,其吸收光谱峰值向长波方向位移约5nm,FITC和蛋白质结合后由490nm变为493~495nm,RB200和蛋白质结合后变为595nm。
F/P比值的计算:可按以下公式计算。

式中160000为抗体蛋白质的分子量,390为FITC的分子量。蛋白质从克换算为毫克需再乘以103,而荧光素从克换算为微克需要再乘以106。
测定RB200荧光抗体的克分子比值公式如下:

按图3-4测定法更为简便,即先用276nm波长测得蛋白质的OD值,再用493波长测得FITC的OD值,将这两个OD值在图3-14上连成一直线,直线与各纵线交叉处,即可查出标记抗体的以下数值:FITc μg/ml ,F/P 的μg/mg,F/P的克分子比值,蛋白mg/ml等。

图3-14 FITC标记物中球蛋白、荧光色素和E/P比值计算图
四、荧光抗体的保存
以0~4℃或-20℃低温保存,防止抗体活性降低和蛋白变性。最好加入浓度为1:5000~10000的硫柳汞或1:1000~5000的叠氮钠防腐,小量分装如0.1~1ml,真空干燥后更易长期保存。
第三节 免疫荧光细胞化学染色方法
一、标本制作
可制作涂片、印片、细胞单层培养物、组织切片,经适当固定或不固定,作免疫荧光染色用。
二、荧光抗体染色方法
(一)直接法
1.染色 切片经固定后,滴加经稀释至染色效价如1:8或1:16的荧光抗体(如兔抗人γ-球蛋白荧光抗体或兔抗人IgG或IgA荧光抗体等),在室温或37℃染色30min,切片置入能保持潮湿的染色盒内,防止干燥。
2.洗片 倾去存留的荧光抗体,将切片浸入pH7.4或pH7.2PBS中洗两次,搅拌,每次5min,再用蒸馏水洗1min,除去盐结晶。
3.用50%缓冲(0.5mol/L碳酸盐缓冲液pH9.0~9.5)甘油封固、镜检
4.对照染色
①正常免荧光血清染色,如上法处理切片,结果应为阴性。②染色抑制试验(一步法):将荧光抗体和未标记的抗体球蛋白或血清(相同)等量混合,如上法处理切片。结果应为阴性。为证明此种染色抑制不是由于荧光抗体被稀释所致,可用盐水代替未标记抗血清,染色结果应为阳性。此法结果较二步法稳定。③类属抗原染色试验,前面已作叙述。
直接法比较简单,适合做细菌、螺旋体、原虫、真菌及浓度较高的蛋白质抗原如肾、皮肤的检查和研究。此法每种荧光抗体只能检查一种相应的抗原,特异性高而敏感性较低。
(二)间接法
(1)切片固定后用毛细滴管吸取经适当稀释的免疫血清滴加在其上,置于染色盒中保持一定的湿度,37℃作用30min。然后用0.01mol/l pH7.2PBS洗两次,10min,用吸水吸去或吹干余留的液体。
(2)再滴加间接荧光抗体(如兔抗人γ-球蛋白荧光抗体等),同上步骤,染色30min,37℃,缓冲盐水洗两次10min,搅拌,缓冲甘油封固,镜检。
对照染色:①抗体对照:用正常兔血清或人血清代替免疫血清,再用上法进行染色,结果应为阴性。②抗原对照:即类属抗原染色,亦应为阴性。③阳性对照。
间接法中上述方法称双层法(Double Layer Method)。另一种称夹心法,即用未标记的特异性抗原加在切片上先与组织中之相应抗体结合,再用该抗原之荧光抗体重叠结合其上,而间接地显示出组织和细胞中抗体的存在,方法步骤如下:
①切片或涂片固定后,置于染色湿盒内。
②滴加未标记的特异性抗原作用切片于37℃,30min。
③缓冲盐水洗2次,每次5min,吹干。
④滴加特异性荧光抗体再用切片于37℃,30min。
⑤如③水洗。
⑥缓冲甘油封固,镜检。
间接法只需制备一种荧光抗体可以检出多种抗原,敏感性较高,操作方法较易掌握,而且能解决一些不易制备动物免疫血清的病原体(如麻疹)等的研究和检查,所以已被广泛应用于自身抗体和感染病人血清的试验。
(三)补体法
1.材料
(1)免疫血清60℃灭活20min,用Kolmers 盐水作2倍稀释成1:2,1:4,1:8……。补体用1:10稀释的新鲜豚鼠血清,抗补体荧光抗体等,按下述的补体法染色。免疫血清补体结合的效价,如为1:32则免疫血清应作1:8稀释。
(2)补体用新鲜豚鼠血清一般作1:10稀释或按补体结合反应试管法所测定的结果,按2单位的比例,用Kolmers盐水稀释备用。Kolmers盐水配法:即在pH7.4、0.1mol/L的磷酸缓冲盐水中,溶解MgSO4的含量为0.01%浓度。
(3)抗补体荧光抗体:在免疫血清效价为1:4,补体为2单位的条件下,用补体染色法测定免疫豚鼠球蛋白荧光抗体的染色效价,然后按染色效价1:4的浓度用Kolmers盐水稀释备用。
2.方法步骤
(1)涂片或切片固定。
(2)吸取经适当稀释之免疫血清及补体之等量混合液(此时免疫血清及补体又都稀释一倍)滴于切片上,37℃作用30min,置于保持一定湿度的染色盒内。
(3)用缓冲盐水洗2次,搅拌,每次5min,吸干标本周围水液。
(4)滴加经过适当稀释之抗补体荧光抗体30min,37℃,水洗同(3)。
(5)蒸馏水洗1min,缓冲甘油封固。
3.对照染色
(1)抗原对照。
(2)抗血清对照:用正常兔血清代替免疫血清。
(3)灭活补体对照:将补体经56℃30min处理后,按补体同样比例稀释,与免疫血清等量混合后,进行补体法染色。
本法之荧光抗体不受免疫血清的动物种属的限制,因而一种荧光抗体可作更广泛的应用,敏感性亦较间接法高,效价低的免疫血清亦可应用,节 省免疫血清,尤其是对检查形态小的如立克氏体、病毒颗粒等或浓度较低的抗原物质时甚为理想。
(四)膜抗原荧光抗体染色法
本法应用直接法或间接法的原理和步骤,可对活细胞在试管内进行染色,常用于T和B细胞、细胞培养物、瘤细胞抗原和受体等的检查和研究,阳性荧光主要在细胞膜上。FACS即采用此法原理。
(五)双重染色法
在同一标本上有两个抗原需要同时显示(如A抗原和B抗原),A抗原的抗体用FITC标记,B抗原的抗体用罗达明标记,可采用以下染色方法:
1.一步法双染色 先将两种标记抗体按适当比例混合(A+B),按直接法进行染色。
2.二步法双染色 先用RB200标记的B抗体染色,不必洗去,再用FITC标记的A抗体染色,按间接法进行。
结果:A抗原阳性荧光呈现绿色,B抗原阳性呈现桔红色荧光。
(六)荧光抗体再染色法
若切片或其他标本经某种荧光抗体染色后,未获得阳性结果,而又疑有另外的病原体存在时,可用相应的荧光抗体再染色。
有时存档蜡块不能再用以切片,也可用存档的HE染色标本,褪去盖片和颜色,再作免疫荧光或其它免疫细胞化学的染色。
三、荧光抗原染色法
某些抗原可以用荧光素标记,制成荧光抗原,标记荧光素的方法与制备荧光抗体方法相同。用荧光抗原可以直接检查细胞或组织内的相应抗体,特异性较好,敏感性较差。染色方法同荧光抗体染色的直接法。由于多数抗原难以提纯或量少不昂贵,一般很少采用此法。
第四节 荧光显微镜检查法
一、荧光显微镜
荧光显微镜是免疫荧光细胞化学的基本工具。它是由光源、滤板系统和光学系统等主要部件组成。是利用一定波长的光激发标本发射荧光,通过物镜和目镜系统放大以观察标本的荧光图像(图3-15)。

图3-15 荧光显微镜的结构和主要部件
(一)光源
现在多采用200W的超高压汞灯作光源,它是用石英玻璃制作,中间呈球形,内充一定数量的汞,工作时由两个电极间放电,引起水银蒸发,球内气压迅速升高,当水银完全蒸发时,可达50~70个标准大气压力,这一过程一般约需5~15min。超高压汞灯的发光是电极间放电使水银分子不断解离和还原过程中发射光量子的结果。它发射很强的紫外和蓝紫光,足以激发各类荧光物质,因此,为荧光显微镜普遍采用。
超高压汞灯也散发大量热能。因此,灯室必须有良好的散热条件,工作环境温度不宜太高。
新型超高压汞灯在使用初期不需高电压即可引燃,使用一些时间后,则需要高压启动(约为15000V),启动后,维持工作电压一般为50~60V,工作电流约4A左右。200W超高压汞灯的平均寿命,在每次使用2h的情况下约为200h,开动一次工作时间愈短,则寿命愈短,如开一次只工作20min,则寿命降低50%。因此,使用时尽量减少启动次数。灯泡在使用过程中,其光效是逐渐降低的。灯熄灭后要等待冷却才能重新启动。点燃灯泡后不可立即关闭,以免水银蒸发不完全而损坏电极,一般需要等15min。由于超高压汞灯压力很高,紫外线强烈,因此灯泡必须置灯室中方可点燃,以免伤害眼睛和发生爆炸时造成操作。
超高压汞灯(100W或200W)光源的电路和包括变压、镇流、启动几个部分。在灯室上有调节 灯泡发光中心的系统,灯泡球部后面安装有镀铝的凹面反射镜,前面安装有集光透镜。
国产超高压汞灯GCQ-200型性能良好,可以代替HBO-200等型的进口灯泡,平均寿命在200h以上,价格也比较低。
我国研制的一种简易轻便型高色温溴钨荧光光源装置,体积小,重量轻,功率小,交、直流两用(自带直流电源),易于携带,使用方便,已推广应用。
(二)滤色系统
滤色系统是荧光显微镜的重要部位,由激发滤板和压制滤板组成。滤板型号,各厂家名称常不统一。滤板一般都以基本色调命名,前面字母代表色调,后面字母代表玻璃,数字代表型号特点。如德国产品(Schott)BG12,就是种蓝色玻璃,B是蓝色的第一个字母,G是玻璃的第一个字母;我国产品的名称已统一用拼音字母表示,如相当于BG12的蓝色滤板名为QB24,Q是青色(蓝色)拼音的第一个字母,B是玻璃拼音的第一个字母。不过有的滤板也可以透光分界滤长命名,如K530,就是表示压制滤长530nm以下的光而透过530nm以上的光。还有的厂家的滤板完全以数字命名,如美国Corning厂的NO:5-58,即相当于BG12。
用于荧光显微镜的主要滤板如表3-1。
表3-1 荧光显微镜常用滤板型号和透光特点
| 基本色调 | 相应名称 | 2mm厚透光范围(峰值)nm | |||
| 上海电器元件厂 | 德国(Schott) | 苏联 | 日本 | ||
| 黑紫 | ZWB-1 | UG-1 | yΦC-2 | DV-1 | 300~400(365) |
| 黑紫 | ZWB-2 | UG-5 | yΦC-1 | 280~240(360) | |
| 靛蓝 | ZB-2 | BG-1 | ΦC-1 | BG-1 | 300~500(380) |
| 靛蓝 | ZB-3 | BG-3 | CC-4 | BG-3 | 260~520(400) |
| 靛蓝 | QB-24 | BG-12 | CC-8 | BG-12 | 310~570(420) |
| 淡蓝 | QB-10 | BG-38 | C3C-5 | 310~720(460) | |
| QB-12 | -8 | ||||
| -11 | |||||
| 橙黄 | CB-3 | OG-1(K530) | OC-11 | OG-1 | 530以上 |
| 橙黄 | JB-8 | OG-4(K510) | ЖC-18 | FY-5 | 510以上 |
| 绿橙 | JB-7 | GG-11(K490) | ЖC-17 | FY-3 | 480以上 |
| FY-4 | |||||
| 淡绿 | JB-4 | GG-3(K430) | жC-11 | US-10 | 420以上 |
引自:五九一节 五部队编:荧光显微术,见参考资料)
1.激发滤板 根据光源和荧光色素的特点,可选用以下三类激发滤板,提供一定波长范围的激发光。
紫外光激发滤板:此滤板可使400nm以下的紫外光透过,阻挡400nm以上的可见光通过。常用型号为UG-1或UG-5,外加一块BG-38,以除去红色尾波。
紫外蓝光激发滤板:此滤板可使300~450nm范围内的光通过。常用型号为ZB-2或ZB-3,外加BG-38。
紫蓝光激发滤板:它可使350~490nm的光通过。常用型号为QB24(BG12)。
最大吸收峰在500nm以上者的荧光素(如罗达明色素)可用蓝绿滤板(如B-7)激发。
近年开始采用金属膜干涉滤板,由于针对性强,波长适当,因而激发效果比较玻璃滤更好。如西德Leitz厂的FITC专用KP490滤板和罗达明的S546绿色滤板,均远比玻璃滤板效果好。
激发滤板分薄厚两种,一般暗视野选用薄滤板,亮视野荧光显微镜可选用厚一些。基本要求是以获得最明亮的荧光和最好的背景为准。
2.压制滤板 压制滤板的作用是完全阻挡激发光通过,提供相应滤长范围的荧光。与激发滤板相对应,常用以下3种压制滤板:
紫外光压制滤板:可通过可见光、阻挡紫外光通过。能与UG-1或UG-5组合。常用GG-3K430或GG-6K460。
紫蓝光压制滤板:能通过510nm以上滤长的荧光(绿到红),能与BG-12组合。通常用OG-4K510或OG-1K530。
紫外紫光压制滤板:能通过460nm以上波长的荧光(蓝到红),可与BG-3组合,常用OG-11K470AK 490,K510。
(三)反光镜
反光镜的反光层一般是镀铝的,因为铝对紫外光和可见光的蓝紫区吸收少,反射达90%以上,而银的反射只有70%;一般使用平面反光镜。
(四)聚光镜
专为荧光显微镜设计制作的聚光器是用石英玻璃或其他透紫外光的玻璃制成。分明视野聚光器的暗视野聚光器两种。还有相差荧光聚光器。
1.明视野聚光器 在一般荧光显微镜上多用明视野聚光器,它具有聚光力强,使用方便,特别适于低、中倍放大的标本观察。
2.暗视野聚光器 暗视野聚光器在荧光显微镜中的应用日益广泛。因为激发光不直接进入物镜,因而除散射光外,激发光也不进入目镜,可以使用薄的激发滤板,增强激发光的强度,压制滤板也可以很薄,因紫外光激发时,可用无色滤板(不透过紫外)而仍然产生黑暗的背景。从而增强了荧光图像的亮度和反衬度,提高了图像的质量,观察舒适,可能发现亮视野难以分辨的细微荧光颗粒。
3.相差荧光聚光器 相差聚光器与相差物镜配合使用,可同时进行相差和荧光联合观察,既能看到荧光图像,又能看到相差图像,有助于荧光的定位准确。一般荧光观察很少需要这种聚光器。
(五)物镜
各种物镜均可应用,但最好用消色差的物镜,因其自体荧光极微且透光性能(波长范围)适合于荧光。由于图像在显微镜视野中的荧光亮度与物镜镜口率的平方成正比,而与其放大倍数成反比,所以为了提高荧光图像的亮度,应使用镜口率大的物镜。尤其在高倍放大时其影响非常明显。因此对荧光不够强的标本,应使用镜口率大的物镜,配合以尽可能低的目镜(4×,5×,6.3×等)。
(六)目镜
在荧光显微镜中多用低倍目镜,如5×和6.3×。过去多用单筒目镜,因为其亮度比双筒目镜高一倍以上,但目前研究型荧光显微镜多用双筒目镜,观察很方便。
(七)落射光装置
新型的落射光装置是从光源来的光射到干涉分光滤镜后,波长短的部分(紫外和紫蓝)由于滤镜上镀膜的性质而反射,当滤镜对向光源呈45。倾斜时,则垂直射向物镜,经物镜射向标本,使标本受到激发,这时物镜直接起聚光器的作用。同时,滤长长的部分(绿、黄、红等),对滤镜是可透的,因此,不向物镜方向反射,滤镜起了激发滤板作用,由于标本的荧光处在可见光长波区,可透过滤镜而到达目镜观察,荧光图像的亮度随着放大倍数增大而提高,在高放大时比透射光源强。它除具有透射式光源的功能外,更适用于不透明及半透明标本,如厚片、滤膜、菌落、组织培养标本等的直接观察。近年研制的新型荧光显微镜多采用落射光装置,称之为落射荧光显微镜。
二、荧光显微镜标本制作要求
(一)载玻片
载玻片厚度应在0.8~1.2mm之间,太厚的坡片,一方面光吸收多,另一方面不能使激发光在标本上聚集。载玻片必须光洁,厚度均匀,无明显自发荧光。有时需用石英玻璃载玻片。
(二)盖玻片
盖玻片厚度在0.17mm左右,光洁。为了加强激发光,也可用干涉盖玻片,这是一种特制的表面镀有若干层对不同波长的光起不同干涉作用的物质(如氟化镁)的盖玻片,它可以使荧光顺利通过,而反射激发光,这种反射的激发光女可激发标本。
(三)标本
组织切片或其他标本不能太厚,如太厚激发光大部分消耗在标本下部,而物镜直接观察到的上部不充分激发。另外,细胞重迭或杂质掩盖,影响判断。
(四)封裱剂
封裱剂常用甘油,必须无自发荧光,无色透明,荧光的亮度在pH8.5~9.5时较亮,不易很快褪去。所以,常用甘油和0.5mol/l pH9.0~9.5的碳酸盐缓冲液的等量混合液作封裱剂。
(五)镜油
一般暗视野荧光显微镜和用油镜观察标本时,必须使用镜油,最好使用特制的无荧光镜油,也可用上述甘油代替,液体石蜡也可用,只是折光率较低,对图像质量略有影响。
三、使用荧光显微镜的注意事项
(1)严格按照荧光显微镜出厂说明书要求进行操作,不要随意改变程序。
(2)应在暗室中进行检查。进入暗室后,接上电源,点燃超高压汞灯5~15min,待光源发出强光稳定后,眼睛完全适应暗室,再开始观察标本。
(3)防止紫外线对眼睛的损害,在调整光源时应戴上防护眼镜。
(4)检查时间每次以1~2h为宜,超过90min,超高压汞灯发光强度逐渐下降,荧光减弱;标本受紫外线照射3~5min后,荧光也明显减弱;所以,最多不得超过2~3h。
(5)荧光显微镜光源寿命有限,标本应集中检查,以节 省时间,保护光源。天热时,应加电扇散热降温,新换灯泡应从开始就记录使用时间。灯熄灭后欲再用时,须待灯泡充分冷却后才能点燃。一天中应避免数次点燃光源。
(6)标本染色后立即观察,因时间久了荧光会逐渐减弱。若将标本放在聚乙烯塑料袋中4℃保存,可延缓荧光减弱时间,防止封裱剂蒸发。
(7)荧光亮度的判断标准:一般分为四级,即“一”—无或可见微弱荧光。“+”—仅能见明确可见的荧光。“++”—可见有明亮的荧光。“+++”—可见耀眼的荧光。
四、荧光图像的记录方法
荧光显微镜所看到的荧光图像,一是具有形态学特征,二是具有荧光的颜色和亮度,在判断结果时,必须将二者结合起来综合判断。结果记录根据主观指标,即凭工作者目力观察。作为一般定性观察,基本上可靠的。随着技术科学的发展,在不同程度上采用客观指标记录判断结果,如用细胞分光亮度计,图像分析仪等仪器。但这些仪器记录的结果,也必须结合主观的判断。
荧光显微镜摄影技术对于记录荧光图像十分必要,由于荧光很易褪色减弱,要即时摄影记录结果。方法与普通显微摄影技术基本相同。只是需要采用高速感光胶片如ASA200以上或24。以上。因紫外光对荧光猝灭作用大,如FITC的标记物,在紫外光下照射30s,荧光亮度降低50%。所以,曝光速度太慢,就不能将荧光图像拍摄下来。一般研究型荧光显微镜都有半自动或全自动显微摄影系统装置。
第五节 非特异性染色的消除方法
一、非特异性染色的主要因素
组织的非特异性染色的机理很复杂,其产生的原因主要可分为以下几点:
(1)一部分荧光素未与蛋白质结合,形成了聚合物和衍化物,而不能被透析除去。
(2)抗体以外的血清蛋白与荧光素结合形成荧光素脲蛋白,可与组织成分结合。
(3)除去检查的抗原以外,组织中还可能存在类属抗原(如Forssman氏抗原),可与组织中特异性抗原以外之之相应抗体结合。
(4)从组织中难于提纯抗原性物质,所以制备的免疫血清中往往混杂一些抗其他组织成分的抗体,以致容易混淆。
(5)抗体分子上标记的荧光素分子太多,这种过量标记的抗体分子带过多的阴离子,可吸附于正常组织上而呈现非特异性染色。
(6)荧光素不纯,标本固定不当等。
二、消除非特异性染色的方法
消除荧光抗体非特异性染色的方法应根据产生的原因采取适当的方法,常用的方法有以下几种:
(一)动物脏器粉末吸收法
常用肝粉(猪、大白鼠或小白鼠),其次是骨髓粉、鼠脑粉和鸡胚粉等。每毫升荧光抗体中加入肝粉50~100mg,在离心管中充分混匀,在室温中振动2h,4℃中过夜,再搅拌10min,高速离心(3000~15000r/min)30min,1~2次后,即可使用其上清液。吸收一般应在临用前进行,吸收后之荧光抗体保存冰箱中勿超过2周。染色应作吸收前后之比较,吸收时可先用缓冲盐水将组织干粉浸湿,离心(3000~15000r/min)30min,除去上清液,再加入荧光抗体进行吸收,以免消耗过多的抗体。
肝粉或新鲜细胞吸收是一种非特异性的消除方法,对荧光抗体的荧光色素和蛋白都有吸附作用。如检查组织中的病毒抗原时,也可用相同的组织干粉或匀浆沉淀物吸收之。
用脏器肝粉吸收对荧光抗体损失较多,如果根据Hiramotos氏等的方法将组织的20%生理盐水匀浆液,用生理盐水洗2~3次,12000r/min 10min离心沉淀,用其沉淀物吸收其荧光抗体即能完全达到目的,京极方久氏认为这样吸收对荧光抗体几乎没有损失,他们常用此法,效果甚佳,吸收后放置一周左右,用时有必要再吸收一次。
【肝粉的制法】
(1)将若干只小白鼠或大白鼠放血杀死,取出肝脏,用生理盐水洗2~3次,除去血液,剥掉表面的结缔组织的脂肪。
(2)剪碎,用生理盐水反复洗涤至无血色止,然后再加生理盐水少许,用组织捣碎机或匀浆器作成匀浆。
(3)将肝匀浆装入离心管内(1/3左右),交换地用2~3倍量生理盐水和丙酮反复洗涤各三次,至上清无血色止,每次完毕先用2000r/min离心沉淀15min后,再除去上清液。
(4)最后用丙酮洗涤肝浆,再用布氏漏斗过滤,或离心沉淀,将沉淀物平铺在洁净的玻璃板上,37℃烤干(过夜)。
(5)在乳钵中充分研磨,用120目铜筛筛选过后,分装,密封,低温干燥保存。
(二)透析法
荧光素如FITC分子可以通过半透膜,而蛋白质大分子不能透过,可将未与蛋白结合的荧光素透析除去。
(1)将标记完毕的荧光蛋白液装入一透析袋或玻璃纸袋内,液面稍留空隙,紧扎。
(2)浸入0.02mol/ph 7.1~7.4的PBS中(悬于大于标记物体积约50~100倍的PBS内),在4℃中透析,每日更换3~4次PBS,约5~7天,透析液中无荧即可(在荧光光源照射下)。
(三)葡聚糖凝胶G-50柱层析法
除游离荧光素可用2×46cm柱层析法,详细方法参阅第二章 。加入荧光抗体15~18ml(按床体积的5%~10%加样),使其缓慢渗入柱内,待即将全部入柱时,加入PBS少许,关闭下口,停留30~40min ,使游离荧光充分进入细筛孔中,然后再接通洗脱瓶开始滴入洗脱液。加入洗脱液一定量后,荧光抗体即向下移行,逐渐与存留于上端的游离荧光素之间拉开明显的界线,随着大量洗脱液的不断加入,二者分离距离越来越大,荧光抗体最先流出,分前、中、后三部分收集,测F/P比值,合格者合并,浓缩,分装。洗脱液用20%磺基水杨酸测定蛋白(发生沉淀反应),继续洗脱,游离荧光素则相继被洗脱下来,至洗脱液中无蛋白和荧光素后,此层析柱即可再用。
若用以除去荧光抗体中的游离荧光素和硫酸铵等盐类,可先在过柱前透析一夜,否则,NH4+太浓,在蛋白未完全洗脱时即出现NH4+,因而影响提纯与回收蛋白,一般待洗脱液出现蛋白时,即进行收集,之后出现SO4++(用1%BaCl2检查发生白色沉淀)。最后是NH4+,(用纳氏试剂检查呈黄棕色沉淀),待洗脱液无SO4++及NH4+后可再用。
如仅用小量荧光抗体,可用1×20cm的柱层析柱,取2g Sephadex G-50装柱,即可过滤2~3.5ml荧光抗体。
(四)DEAE纤维素柱层析法
标记过多或过少荧光素的抗体分子可用DEAE-纤维素柱层析法除去。方法如下:
DEAE-纤维素柱的装柱,洗脱、再生方法等与提纯IgG方法相同。装柱所需DEAE-纤维素量以干重每克交换20~50mg标记蛋白量为宜。常用梯度洗脱法如下:
(1)层析柱用0.01mol/L、pH7.2PB平衡,标记物上柱后,先用0.01mol/L、pH7.2PB洗脱,洗出无色或淡绿色液体,洗脱液量(根据床体积大小每梯度乘3),然后依下列各种离子强度洗脱液,分别洗脱和收集:
0.01mol/L、pH7.2PBS(0.05mol/l NaCl)……洗脱部分1。
0.01mol/L、pH7.2PBS(0.01mol/l NaCl)……洗脱部分2。
0.01mol/L、pH7.2PBS(0.02mol/l NaCl)……洗脱部分3。
将此三部分收集液(每管5ml)分别测定其F/P比值,0.05mol/l NaCl pH7.2PB洗脱液280nm光密度高峰管合并,浓缩保存备用。因这部分非特异性染色荧光最少,是比较好的荧光抗体。其他两部分可以废弃。
(2)柱上吸附的过度标记蛋白可继续增加NaCl的浓度至2.0mol/L洗脱完。
经过DEAE-纤维素层析后的标记抗体,其抗体量一般约损失50%,因此有些要求不太高的抗体,如抗细菌荧光抗体,不一定要这样处理,可用染色效价测定的稀释法除去非特异性染色。
(五)荧光抗体稀释法
先测定荧光抗体特异性染色与非特异性染色的效价,若二者效价相差较大,则可将荧光抗体稀释至一临界浓度,使特异性染色呈阳性,而使非特异性染色保持阴性,稀释方法和染色效价测定方法相同。
(六)纯化抗原法
用各种方法提纯单一成分的抗原是产生单价特异性抗体的最主要条件。近代免疫化学技术(免疫吸收法)和柱层析法等提供了很大的可能性,可参考有关专着。
(七)纯化抗体法---免疫吸收法
例如抗IgA血清的纯化方法---免疫吸收法。如分泌型IgA(SIgA)抗原纯度不高,所制的抗血清常与IgG呈交叉反应,为此需要吸收,常采用纯化的人IgG戊二醛聚合物加以吸收纯化。方法如下:
1.人IgG聚合物的制备在5ml含40mg/ml人IgG的0.1mol/l pH7.0磷酸缓冲溶液中,加入2.5%戊二醛溶液1ml,边加边搅,5min即出现混浊,逐现大块胶块,放置30min后,用研钵将凝胶磨细,继用1.0mol/l pH7.0磷酸缓冲溶液反复洗涤3次,末次加蒸馏水至20ml,即为人IgG聚合物悬液。
2.免疫吸收法将待吸收的抗SIgG血清加入待量IgG聚合物悬液,置室温搅拌60min,离心沉淀,上清液即稀释1倍的纯化抗SIgA血清。如用IgG聚合物作少量分次吸收,其效果更好。
(八)伊文氏蓝(Evans blue)衬染法
用0.01%伊文氏蓝的0.01mol/l pH7.2PBS稀释荧光抗体,可将背景细胞和组织染色,呈红色荧光,与特异性黄绿色荧光形成鲜明的对比,减少了非特异性荧光,宜作常规应用。伊文氏蓝一般先配成1%溶液,保存于4℃,用前再稀释至0.01%用以和然释荧光抗体。
此外,还可以用胰酶消化组织切片或用10%牛血清蛋白封闭法等消除非特异性染色,提高特异性染色。
参考文献
1.Coons AH, et al. Localization ofantigen in tissue cell.II. Improvements in a method for the detection ofantigen by means of fluorescent an-tibody. J Exp Med, 1950;91:1-3
2.RiggsJL, Seiwald RI, Burckhulter J, Powns CM and Metcalf TG. Iosthiocyanatecompounds as fluorescent labeling agents for immune serum. Am J Path,1958;34:1081~1097
3.MarshallID Jr, Eveland WC and Smith CW. Superiority of fluorescein isothiocyanate(Riggs)for fluorescent antibody technique with a modi-ification of its application. Procsec Exper Biol C Med(NP), 1958;98:898~900
4.GoldsteinG, Slizys IS and Chase MW. Stuides on fluoresent staining.1. Nonspecificfluorescence with fluorescein - coupled sheep anti-rab-bit globulins. J ExperMed, 1961;114:89~110
5.NairnRC. Fluorecent protein tracing. E & S Living stone LTD. Edinburgh and .London, Third Edition, 1969:P136~142,PP152~264
6.王伯沄,免疫荧光组织化学和荧光组织化学技术,第四军医大学科技资料增刊,1974;2:5~30
7.Huang SN, et al. Application ofimmunofluorescent staining on paraffin section improved by trypsin digestion .Lab Invest,1976;35:383
8.GotakoYamad, et al .Hepatitis B core and surface antigens in liver tissue. LabInvest, 1977;36(6):649
9.黄 策.免疫荧光和荧光免疫.1983年全军三防医学会议报告论文
10.张忠兵,等.双标记免疫荧光法对胃粘膜抗体产生细胞的对比研究.上海免疫学杂志,1983;3(5):304
11.FairbanksTR. Current status of lymphocyte subpopulation testing in humans. Am J MedTechnol, 1980;46:471
12.李元敏等译,免疫细胞化学.原子能出版社,1985:25~44
13.WickG, Traill KN, Schouestein K. Immunofluorescence Technology, SelectedTheoretical and Clinical Aspects. Elseries Biomedical Press. Amsterdom,1982:P27~36, P181, P219~262, P317~323
14.AKiyoshi Kawamura Jr. Fluorescent antibody . Technique and Their Applications.Second Edition University of Tokyo Press, Tokyo,1977:P10,P79,P141~281
15. RayMB, et al. Immunofluorescent detection of alphaantitrypsin in paraffin embeddedliver. J Clin Pathol, 1975;28:717
16.王伯沄,胰酶消化法提高甲醛固定石蜡切片免疫组织化学法敏感性方法,第四军医大学学报,1982;2:127
17. AurelF. Labelled antibodies in biology and medicine.Printed in Romania,1978:PP52-190
18. 王伯沄,免疫荧光技术:见汪美先 主编.免疫学基础.西安:陕西省科学技术出版社,1981:279-295
19. 59175部队.荧光显微术.上海科学技术情报所,1976:224~288
20. PolakJM and Noorden SV. Immunocytochemistry, PP233~248Wright, PSG. 1983
21李成文.现代免疫化学技术.上海:上海科技出版社,1992:97~100
第四章 免疫酶细胞化学
免疫酶细胞化学是免疫细胞化学(Immunocytochemistry,ICC)中最常用的方法之一,它是在抗原抗体特异反应存在的前提条件下,借助于酶细胞化学的手段,检测某种物质(抗原/抗体)在组织细胞内存在部位的一门新技术:即预先将抗体与酶连结,再使其与组织内特异抗原反应,经细胞化学染色后,于光镜或电子显微镜下观察分析的形态学研究方法。
40多年前,Coons及其同事利用荧光色素(FITC)标记抗体而开创的免疫荧光抗体技术,具有一定的灵敏性、特异性、操作简单等优点,但亦存在抗体用量大,标本不能长期保存、需较昂贵的荧光显微镜等问题。几乎在同一时期,电子显微镜在医学生物学领域中得到了广泛的应用。为克服荧光抗体法的不足、并能在超微结构水平定位抗原物质的存在部位,Nakane(1966)等成功地引入了酶代替荧光色素标记抗体,进行组织细胞内抗原或半抗原的定位,开辟了酶标抗体技术免疫酶细胞化学之路。
Sternberger(1970)等人在此基础上又作了改良,建立了非标记抗体酶法以及PAP法。酶标抗体法确立至今已经27个春秋,不断发展、成熟。各种新技术的引入,使新抗体相继问世,应运而生的抗体制造、经销商遍布世界各地,使ICC技术得到了更广泛的推广和应用,成为当今形态学研究领域中不可缺少的手段;同时也有为临床病理诊断、肿瘤性质的判定、预后的估测等提供重要依据,是临床实验室常规检查法之一。近年,伴随分子生物学、分子遗传学的惊人进步,ICC技术在基因表达产物的观察,细胞功能动态分析中,亦发挥着重要作用。在此,结合,笔者经验,介绍ICC染色中的主要程序:组织标本的固定、切片、染色原理及步骤、结果判定及一些进展、特殊应用等供读者参考。
第一节 固定和切片
一、固定
若想得到理想的ICC染色结果、正确地判断抗原物质在组织细胞内的位置,除需有良好酶和抗体外,保持组织细胞内抗原物质的不动性(Immobility)和免疫活性也是至关重要的。换言之,如果抗原物质在组织细胞间弥散、丢失或失去免疫活性,无论如何努力染色都是徒劳的,所以说固定是ICC染色中非常重要的一环。ICC与其它组织学技术不同,除要求保存良好的结构外,还需保存组织抗原的免疫活性。一般认为,新鲜组织能够最大限度地保存组织抗原的免疫活性,但结构较差,易出现抗原弥散丢失现象。Cumming(1980)报告,不固定的组织切片ICC染色时,环鸟苷酸含量丢失80%以上。固定的目的是使构成组织细胞成分的蛋白等物质不溶于水和有机溶剂,并迅速使组织细胞中各种酶降解、失活,防止组织自溶和抗原弥散,保持组织细胞的完整性和所要检测物质的抗原性。因此迅速充分固定是ICC染色成功的关键一步。用于ICC的固定剂种类较多,选择时应根据所要检测物质的抗原性质和切片方法以及所用抗体特征等做最佳筛选。制片及固定方法见第一章 ,下面介绍两种近年报道的新方法。
1.AMEX(Acetone Meth Enzoate Xylene )法是改良的冰冻置换法(freeze substitution)的简称,主要用于石蜡包埋标本。Sato(1986)报告,该法具有同新鲜(未固定)组织冰冻切片同样的抗原保持性和石蜡切片的良好组织结构保存。其机制为:组织在丙酮中固定(脱水),组织细胞内水份逐渐被丙酮取代,继之,用苯甲酸酯取代组织内丙酮,经二甲苯置换后,石蜡包埋。组织在-20℃丙酮内过夜亦形成冰晶,所以原方法将组织先置4℃丙酮20~30min,再移入-20℃丙酮过夜。实际上组织在4℃丙酮内过夜亦可得到同样效果。如在该固定液内加入少量蛋白酶活性阻断剂,并采用低溶点石蜡包埋等,可获得更佳染色结果。
2.微波固定(Microwave fixation)为近几年所注目的问题之一。该方法能保持良好的组织结构和抗原性,适于各种切片的酶组化、ICC以及免疫电镜等材料固定。其固定机理可能与微波(频率1000~3000MHz)具有被水分吸收的性质(通常所用的微波是频率2450MHz,波长12cm);生物材料含有大量水份,照射后,温度升高,分子运动加快,促进固定液向组织内渗透,加速与组织成分的反应,短时间内达到固定的效果等有关。经微波照射固定的组织,需置相同固定液中,继续固定2~6h,室温。
近年研究的专门固定用的微波炉已商品化,例如:Bio-Rad H2500型、日新EM·MWE-2等,该类微波炉能够准确地调节 照射时间和测定被照材料的瞬时温度。利用家庭微波炉代替时,应选用能以秒为单位调控的微波炉。实验材料不同,所需固定液的量、照射时间等各异,所以应在预实验的基础上,找出合适的固定液量、照射时间和温度。多数实验室的条件为:固定液5~10ml,照射10~30s,照射后固定液的温度≤50。C。其方法为:将实验标本置于微波炉旋转台的中央,周边放一烧杯盛300~500ml纯水,吸收照射时炉内产生的热量,选择强挡照射10~30s 。接通电源(on)至微波产生利用超声波代替微波照射,或二者并用,照射后,组织标本和固定液的温度升高较少,亦能获得短时间内良好的固定效果(Yasuda 1992)。
二、切片
光镜ICC染色,常用的有冰冻切片和石蜡切片两种,二者各有其优缺点,应根据抗原的性质、实验室条件,合理选择之。对未知抗原显示时,最好同时应用。冰冻切片为ICC研究所首选。
Shi(1991)等报告:微波炉照射的切片,能够激活部分核内抗原活性。其机制不清,可能与高温、高热的作用,使核内DNA双链解开,DNA、RNA解离,抗原暴露有关。其步骤为:将切片脱蜡水洗后,置染色瓶中,加入去离子水或缓冲液至瓶颈处,反复多次照射,每次1min,照射5~10次,每次照射后,补充瓶中蒸发掉的液体,照射温度不超过90~95℃为宜。此处理后,细胞核染色以苏木精为佳(详见第一章 )。
第二节 染色方法
一、本科标抗体法
酶标抗体技术是通过共价键将酶连结在抗体上,制成酶标抗体,再借酶对底物的特异催化作用,生成有色的不溶性产物或具有一定电子密度的颗粒,于光镜或电镜下进行细胞表面及细胞内各种抗原成分的定位。
(一)酶的种类及特点
从理论上讲,用细胞化学方法能显示的酶,均可用于标记抗体,进行ICC染色,但实际上在ICC中所能用的酶并不多。现将常用的几种酶列于表4-1,供选用时参考。
表4-1 免疫细胞化学常用的酶
| 名 称 | 分 子 量 | 内 源 性 | 商 品 |
| Horseeradish peroxidase(E.C.1,11,1,7) | 40~45KD | + | 有 |
| Alkaline phosphatase (E.C.3,1,3,1) | 80~120Kd | ++ | 有 |
| Acid phosphatase (E.C.3,1,3,2) | 100Kd | +++ | 有 |
| Glucose oxidase | 160~190kD | - | 有 |
Sternberger(1986)指出,用于标记的酶应具备以下几点①酶催化的底物必须是特异的,且容易被显示,所形成的产物易于光镜或电镜下观察;②所形成的终产物沉淀必须稳定,即终产物不能从酶活性部位向周围组织弥散,影响组织学定位;③较易获得的酶分子,最好有商品出售;④中性pH时,酶应稳定,酶标记抗体后,保存1~2年活性不应改变,且酶的催化活性(Turnover)越高越好;⑤酶标过程中,酶与抗体连结,不能影响二者的活性;⑥被检测组织中,不应存在与标记酶相同的内源性酶或类似物质。
其中,①②两点甚为重要,因为并非容易显示的酶均能形成不可溶性的复合物。一般认为,辣根过氧化物酶(Horseradish peroxidase , HRP)较佳,是最常用的一种酶。HRP广泛分布于植物界,以植物辣根(西洋山嵛菜)的叶内含量最丰富而得名。它是由无色的酶蛋白和深棕色的铁卟啉结合组成的一种糖蛋白,糖占16%~18(8条糖链分布在HRP分子表面),分子量40kD,最适pH5~5.5,最适温度40~45℃; pH4~11,50℃以下均较稳定,易溶于水和58%以下的饱和硫酸铵溶液。酶的活性中心含铁卟啉,称辅基,最大吸收光谱为403nm,而其余非活性的酶蛋白部分吸收光谱为275nm,HRP的纯度是用二者的光密度比值(Od 403/275)衡量,Reinheit Zahl (RZ)表示。一般认为,标记酶的RZ值为3.0左右,不应小于2.8,RZ值越小,酶的纯度越差,例如RZ值为0.6的酶,含非活性的酶蛋白量高达75%。对于纯度低、质量差的酶,需纯化后使用。
除HRP外,碱性磷酸酶(Alkalinephasphotase, ALP)和葡萄糖氧化酶(Glucose oxidase, GOD)也较常用。ALP分子量约为HRP的2~3倍,最适pH9.0~9.5左右,比较稳定,内源性ALP也较易消除,大部分均可被左旋咪唑(Levamisole,分子量240.8kD)抑制,但肠粘膜表面的内源性ALP活性不受影响。目前所用的ALP大多系由牛的肠粘膜提取制得,所以肠粘膜等呈强阳性反应。
ALP最初是由Bulman等用于标记抗体的。选用不同的底物,可形成不同颜色的终产物,例如以萘酚(As-Mx)和快蓝(Fast Blue, FB)为底物,生成蓝色沉淀。用快红(Fast Red, FR)代替FB,形成红色不溶沉淀。与HRP/4-氯-1-萘酚(CN)或DAB形成的沉淀形成鲜明对比,但FB、FR等沉淀物溶于有机溶剂,不能进行脱水、透明等处理。据报告,利用新品红(New fuch-sine )显色,形成的红色沉淀产物不溶于有机溶剂,不褪色,轻度核复染后,可制成半永久性保存标本。
GOD所催化的底物为葡萄糖,电子供体为对硝基四唑蓝(P-Nitroblue Tetrazolium),终产物为不溶性的蓝色沉淀,比较稳定。从理论上讲GOD较ALP、HRP为佳,因为哺乳动物组织内不存在内源性GOD,但其分子量较大,具有较多的氨基,在标记时易形成广泛的聚合,影响酶的活性,故GOD主要用于ICC双重染色和两种酶的放大技术。
(二)本科标抗体的制备(Boosma,DM, 1983)
酶标抗体与荧光色素标记抗体不同,它需借助桥-偶联剂的作用,将酶连结在抗体分子上。偶联剂是一种双功能试剂,具备3个基本特征:①偶联剂与抗体和酶之间的连结,必须是不可逆的,即借共价键连结;②偶联剂不应影响酶和抗体的活性;③不能因偶联剂的加入,使酶与组织成分了生非特异结合。
在HRP标记抗体中,常用的偶联剂有戊二醛、过碘酸钠及Maleimide等,现简介如下。
1.戊二 醛标记法戊二醛为制备各种酶标抗体最常用的偶联剂。市售戊二醛往往含有戊二酸、丙烯释及戊二醛自身聚合本等杂质,故需纯化后使用。戊二醛的纯度用含杂质的二醛的单体戊二醛的OD比值表示,它们的最大吸收光波长分别为235nm 和280nm,二者的OD比值(235/280)小于3时,制备酶标抗体的效果较好,大于3时,需经蒸馏或Sephadex G-10柱层析或活性碳吸附等处理,除去杂质后应用。其制备方法分一步法和两步法;基本原理相同,是使戊二醛的两个醛基之一与酶蛋白的赖氨酸结合,另一醛基与免疫球蛋白上的氨基结合,将酶连结于抗体上。
(1)一步法:将酶、抗体、戊二醛按一定比例混合,经透析除去标记物中剩余的戊二醛,制得酶标抗体。优点是简单省时,缺点是反应程度不易被控制,因为酶蛋白分子和抗体蛋白分子同戊二醛间的反应速率不同,抗体蛋白的氨基数远较HRP为多,与戊二醛反应快,因此在戊二醛的作用下,抗体蛋白易通过分子内和分子间的彼此交联,形成较大的聚合体,而与酶蛋白分子间的交联相应减少,影响酶的标记。据Nakane等推算,加入的HRP仅20%与抗体连结,标记率较低(约1%~5%)很难获得理想的酶标抗体。
(2)二步法:首先用过量的戊二醛与HRP反应(HRP:戊二醛为1:105),以保证酶分子仅与戊二醛的一个醛基结合,另一个醛基游离;然后用层析法除去多余的戊二醛,制成活性HRP(HRP-戊二醛复合物),再加入过量的抗体,使活化HRP上剩余的醛基与抗体蛋白分子上的氨基结合,制成酶标抗体。过量的抗体可以保证酶与抗体间均匀连结,避免酶本身聚合。根据所用的HRP与抗体(IgG)比例不同,酶标记率各异,平均为5%~25%。标记步骤如下:
①10~15mgHRP(RZ=3.0),溶解于0.2ml 1.25%戊二醛中(0.1mol/L磷酸缓冲液配制),18h室温。
②透析或 SephadexG-25柱层析(0.15mol/l NaCl平衡),去除过量的戊二醛,收集活化HRP。
③浓缩活化HRP至10mg/ml左右,加入抗体5mg(1.0ml 0.15mol/L NaCl 溶解)。
④碳酸盐缓冲液(pH9.5)调整pH至9.0~9.5,使抗体与活化HRP结合,4℃24h。
⑤加入0.1ml赖氨酸缓冲液,阻断未反应的醛基,4℃,2h。
⑥用半饱和硫酸铵沉淀5次,对PBS透析24h,4℃,换3次PBS,除去硫酸铵(10000rpm/min,30min)。
⑦或用凝胶色谱法(SephadexG-200/Sephacryl S-200) 等分离标记抗体。
注意:该方法要求HRP的RZ值在3.0左右,游离氨基较少,与戊二醛反应后,制成的酶标抗体大部分为单体;而RZ值小于2.8的HRP,含有较多的游离氨基,与戊二醛反应后,易形成多聚体,使方法的敏感性下降。
2.过碘酸盐氧化法严格地讲,过碘酸钠(Sudium periodate)不是一种真正的偶联剂,其本身并非作为桥连结在抗体和酶之间,而是借助于过碘酸钠的氧化作用,将酶连结在抗体上。该方法仅适于含糖较丰富的酶(如HRP)的标记。我们知道,HRP分子的糖本身与酶活性无关,利用过碘酸钠氧化这部分糖分子内的-CH基,使之生成-CHO基,再与抗体蛋白的游离氨基反应,生成Shiff’s碱。此Shiff’碱在pH降低时呈可逆性解离,所以经氢硼化钠(NaBH4)还原,形成稳定的酶标抗体复合物(图4-1)。为防止生成的-CHO基与酶蛋白氨基自身交联,预先可用二硝基氟苯(Dintro-fluorobenzene)处理HRP,阻断分子内的ε-、α-氨基。

图4-1 过碘酸盐氧化原理
过碘酸盐氧化法,酶的RZ值≥3时较佳;RZ<3时,糖含量较少,游离氨基较多,氧化时酶易发生本身聚合,影响酶标抗体的产量,据报告,适当地控制过碘酸盐溶液及反应条件,几乎所加入的HRP和抗体均形成酶标抗体,其标记率为70%左右。具体步骤为:
(1)4mgHRP(RZ=3.0)溶于1.0ml双蒸水中。
(2)加0.2ml新鲜配制的0.1mol/LNaIO4,轻轻摇动混合20min,肉眼可见液体内棕黄变成深绿色。
(3)对0.1mol/L醋酸盐缓冲液(pH4.4)透析,20h,4℃。
(4)调整HRP液体的pH至9.5(一般加入20μl0.2mol/L碳酸盐缓冲液pH9.5),立即加入抗体(IgG)8.0mg/Fab 3.0mg (0.01mol/L碳酸盐缓冲液溶解),轻轻混匀后,置室温2h。PH≤8.5时,抗体的NH2基被氧化生成NH3+,后者不能与CHO基反应,所以,保持pH9.0~9.5非常重要。
(5)加入0.1ml新鲜配制的0.4%NaBH4 溶液,置1~4℃2h,以稳定酶标抗体复合物。
(6)经透析等去除未反应的NaBH4,避免还原过度。然后经盐析或柱层析等方法分离酶标抗体(方法同戊二醛法)。
如此制得的酶标抗体,加入终浓度1%牛血清白蛋白(Bovine Serum Albumin, BSA)分装后于-80℃可保存数年;亦可加入6%等量甘油,混匀置-20℃/4℃保存1年左右。上述两种标记法是ICC研究中最常用的酶标抗体制备方法。
3.Maleinmide法上述酶标抗体(IgG)的分子量较大,对抗体的穿透性有一定影响,而在制备过程中,需经两次纯化,即多聚体与单体及单体与非标记抗体的分离。已知单体(1个HRP分子标记1个IgG分子)的分子量为190~200kD,非标记抗体为146~150kD,用凝胶过滤法很难将二者分开。所以,Sternberger等进行了抗体片段Fab的标记。用植物性蛋白酶---木瓜酶(Papain)水解抗体蛋白,可获得一个无抗体活性稳定的Fc段结晶和两个相同的抗原结合片段(Fab),此Fab段为单价,分子量50kD,HRP标记后,单体分子量为90kD,较容易将单体和非标记的Fab段分离。在此基础上,Imagawa(1982)又进行了改良,引入了N-羟基丁二酰酯(Maleinmide),标记抗体的特定部位---Maleinmide法。该方法的主要原理是:(1)借助双功能试剂Maleinmide活化HRP,使其具有与—Hs 基反应的能力;(2)利用胃蛋白酶水解IgG,IgG重链在近羧基端被切断,这样在绞链区(Hinge region)至少可以保留一个S-S键,从而得到一个具有双价抗体活性的F(ab')2段。该S-S键与抗体活性无关。可以通过加入硫基乙醇(2(β)-Mercapto ethanol, HSCH2CH2OH)使其断裂,被还原成—HS基 。如此双价抗体活性的F(ab')2片段即变为带有—Hs 基的单价Fab’片段,后者再与活化的HRP结合,便制成了酶标抗体Fab'。由于空间遮蔽的关系,绞链区即使存在两个—HS基,也只能有一个能与酶结合,另一个—HS基不能与酶反应,即酶与抗体Fab’段结合比例为1:1,因此酶标抗体Fab’段绝大多数是单体,很少形成多聚体。在标记过程中,应用过量的活化HRP,还能避免非标记抗体Fab'段的存在。Fab'段的分子量与Fab段相似(50kD左右),所以酶标后Fab'亦较容易与未标记的Fab'分离。此标记方法多用于酶免疫分析研究,其步骤为:
①6mg HRP溶于1.0ml PBS(pH7.0)中。
②4mg Maleinmide 溶于0.5ml N, N二甲基酰胺(N,N-dimethylformamide)中。
③将上述两种液体充分混合,持续搅拌1h,30℃。
④离心取上清,经0.1mol/lPB(pH6.0)平衡的Sephadex G-25柱层析,收集含有蛋白部分的洗脱液,浓缩,制得活化HRP。
⑤每1.8mg活化HRP,加入已被还原的Fab'2mg,4℃20h持续搅拌。
⑥ Sephadex G-200/Sephacryl S-200分离酶标抗体Fab'片段,保存同前。
(三)酶标抗体的纯化
上述各种方法制备酶标抗体时,除产生酶标抗体外,还有未标记的抗体蛋白、游离酶、酶二聚体及偶联剂等。这些均可使酶标抗体的敏感性下降,故酶标抗体须经纯化后应用。现简介几种常用的纯化方法。
1.多聚体的分离实验中,不同的试剂形成的多聚体的数量各异,即使同样的实验药物和程序,在不同的时间制备的酶标抗体中,多聚体的数量亦不相同。多聚体较单体含酶量多,与组织的非特异吸附增强,使方法的敏感性下降,故用前必须除去多聚体。以凝胶过滤法分离多聚体的效果较好。
2.非标记抗体的分离 非标记抗体与标记抗体具有相同的免疫学特征,能竞争与组织特异抗原结合,而且亲和力较标记抗体强,优先与组织抗原结合。一般认为每个抗体连结1~2个酶分子,并不影响抗体的两个(Fab)抗原结合点,但因存在空间遮蔽现象,一个Fab段与组织特异性抗原结合。非标记抗体则不存在这种现象,两个Fab段均与抗原结合,因而亲合力较强。所以酶标抗体在应用前须用琼脂糖亲合层析等方法去除非标记抗体。
3.亲合层析 利用蛋白A(Protein A)/琼脂糖-刀豆素A/琼脂糖亲合层析柱能制得较纯的酶标抗体。因为蛋白A与抗体(标记和未标记)间有较强的亲合力,不与HRP结合。而刀豆素A与HRP(标记和游离)间的亲合力非常强,不与抗体结合。据此二者并用,能获得较纯的HRP酶标抗体。该方法省时,分离能力强(约为凝胶层析的600倍)。但有一定的局限性,因为蛋白A并非与所有种属的免疫球蛋白亲合力均较强,例:不能与羊的免疫球蛋白结合,所以难以用于纯化羊的酶标抗体。而刀豆素A与HRP的亲合力极强,甚至呈不可逆性结合,可使部分酶标抗体的活性丧失。
(四)染色原理及步骤
1.基本原理酶标抗体与荧光色素标记抗体的染色相同,亦分直接法和间接法。直接法是将酶直接标记在每一抗体上,间接法是将酶标记在第二抗体上,检测组织细胞内的特定抗原物质。间接法所用的第一抗体是对组织细胞内某种抗原的特异性抗体(80%~90%的抗血清系由家兔制得,而绝大数单克隆抗体系由小鼠制备);第二抗体则为第一抗体(家兔/小鼠的IgG)的抗体。所以,只要不同的第一抗体均来自同一种属,同一标记的第二抗体就能用来显示其不同特异性抗原的存在,这样可避免了直接法中标记每一种第一抗体的麻烦,并且提高了方法的敏感度。目前的ICC染色中,以间接法为常用,在此着重介绍间接法的染色程序。
2.染色程序
(1)切片准备:见第一章 。
①石蜡切片经二甲苯或Hemo-De脱蜡,下行酒精至水。②固定/无固定新鲜组织冰冻切片,室温干燥2h以上。
(2)未固定的新鲜组织切片,丙酮固定20~30min(fretrieval ),简而言之,即用蛋白酶处理,去除固定剂交联造成的空间遮蔽(室温),风干15~30min.;已固定的组织冰冻切片及石蜡切片,根据需要可进行组织抗原的激活。
(3)用蜡笔沿切片周围勾划一道屏障,以避免孵育液流失及孵育过程中切片干燥,同时也能节 省抗体用量,保持切片与抗体的充分接触,风干。石蜡切片(滴少量PBS,以防其干燥)直接进行步骤(6)。
(4)切片经PBS或其它缓冲液漂洗3次,每次2min,溶解除去冰冻切片上的OCT包埋剂。但应用ALP标记抗体时,禁用二甲胂酸钠缓冲液漂洗,因后者可使ALP失活。
(5)根据需要,用甲醇+0.3%H2O2处理切片15~30min(室温),封闭内源性过氧化酶的活性。应用ALP标记抗体时,此步可省略。
(6)PBS漂洗2min(共两次),移至0.05%Tween-20/PBS(或0.22~1%Triton X-100)中5min(室温)。Tween-20为一种表面活性剂,除具有清洁作用外,还可增加组织的通透性,有利于组织细胞内抗原的显示。
(7)4%BlockAce或0.1%~1%BSA湿盒内孵育15~25min(室温),然后;轻轻弃去孵育液(不冲洗);以阻断组织与抗体的非特异性结合,降低背景染色。
(8)根据需要,可用1/5~1/30正常来活兔/羊血清孵育15~20min(室温,以酶标抗体相同种属正常血清为宜,最好是同一动物免疫前的血清)。或者省略此步,而在稀释酶标抗体时,加入1%~2%的同一种属正常血清。
(9)轻轻弃去孵育液, 滴加含0.2%BSA/0.05 NaN3/PBS稀释的第一抗体(抗体用量:每张切片一般为50~80μl),湿盒内孵育1~2h(20~25℃);免疫电镜用标本,4℃过夜。
(10)PBS充分冲洗(3次×2min),以去除切片上非特异吸附的抗体。应用不同的第一抗体或同时进行对照标本染色时,需分别冲洗,以防相互污染。
(11)经0.05%Tween-20/PBs2min后,滴加含0.2%BSA/1%正常血清/PBS稀释的HRP酶标记的第二抗体,湿盒内孵育45~60min(20~25℃)。
(12)PBS漂洗(3次×2min),此处不需分别漂洗,因所有切片均系同一酶标抗体孵育。
(13)未固定或固定较弱的冰冻切片,此处可轻微固定。首先将切片从PBS移至TBS中3~5min,去除PBS,以防其中的磷酸与后面使用的固定液中的CaCl2形成磷酸钙而沉淀后,然后用Baker氏固定液固定5min(室温)此时轻微固定,既不影响抗原抗体结合,又较有利于保存第一抗体孵育前的组织抗原,尤其适用于单克隆抗体的ICC染色。
(14)呈色:HRP标记抗体的呈色液为0.01%~0.1%H2O2 0.01%~0.05% DAB 0.05~0.1mol/L Tris –HCl(pH7.4)。切片经PBS或Tris-HCl液漂洗后,置上述呈色液内10~15min(室温、暗处),亦可镜下控制显色速度。终产物为棕褐色沉淀。用于电镜观察的标本,呈色3~5min即可,防止DAB终产物向周围扩散,影响超微结构定位。另外,显色液应于用前新鲜配制,避免DAB本身氧化变质。新配制的DAB为无色透明液体。若DAB液已氧化变为紫红色,应换新药重新配制。
(15)将切片置流水中(仅光镜观察)或PBS(电镜标本)内,终止呈色反应。
(16)未固定的冰冻切片,可用1%戊二醛-PBS液加强固定5~10min(室温),流水冲洗。
(17)细胞核轻度染色,以甲基绿和苏木精为常用。前者细胞核呈绿色,与HRP/ALP等终产物对比度尤佳,但不适于微波照射的标本。苏木精是组织学、病理学研究中普遍应用的核染色方法,与HRP、ALP的终产物对比度比较好。
(18)DAB呈色的标本,可以系列酒精脱水、Hemo-De透明、DPX封固。其它物质呈色的标本,在有机溶剂中沉淀物易溶解,褪色,所以用水溶性封固剂如明胶甘油等封固,次日,于盖玻片周围涂少许女士用指甲油,可使切片保存时间更长。
(19)镜检、观察记录同一般形态学研究。
(20)免疫电镜用标本,经OSO4后固定,按电镜标本要求处理(参见本书第七章 )。亦可OSO4固定,喷碳(Carbon Coating),利用扫描电镜观察抗原的存在部位。
3.酶标抗体及发色剂的选择

HRP特异底物为H2O2,在分解H2O2过程中,与H2O2形成复合物,无电子供体存在时,反应不再进行,当电子供体存在时,迅速生成水,酶被还原,电子供体被氧化环化,形成苯乙胼聚合体(图4-2)。在酶反应部位,形成不溶性棕褐色沉淀,与组织对比清晰。

图4-2 DAB反应产物形成过程
HRP催化的酶促反应第一步是特异性的—酶催化底物H2O2,其余反应是非特异的,可用各种电子供体介导,所以选用不同的电子供体,可使终产物呈不同颜色,例如:CN(4—Chloro—1– N aphthol)为蓝黑色,TMB(Tetramethyl—Benzidine )为深蓝色,AEC(3—amino—9– ethyl--carbazole)为红色。市售试剂盒所配显色液以AEC居多,室温下较稳定,但不能进行脱水等处理,且时间长易褪色。DAB是广泛应用的电子供体之一,较敏感,切片可脱水透明、半永久保存,且终产物具有嗜饿性,经O2O4处理,电子密度增加,适于电镜下确定抗原的存在部位。但是DAB被认为可能具有致癌性,所以应尽量减少吸入和接触次数,最好将DAB制成10倍贮存液,分装于-20℃保存,应用时稀释、过滤。与DAB比较,CN敏感性略差,但因其终产物较局限,很少弥散,光镜观察较为适合。
(2)ALP,是以As-Mx为底物,FB/FR为发色团,生成蓝色/红色不溶性沉淀。ALP标记抗体主要用于内源性过氧化酶含量较高的血细胞、淋巴细胞等的ICC染色。显色液内加入终浓度为2~4mmol/l的levamisole, 大多数内源性ALP活性可被抑制。通常左旋咪唑(levamisole)以每毫升60~120mmol/L浓度的贮存液-20℃冰箱保存。应用时稀释30倍。为避免反复称取,试剂吸水,As-Mx、FR、FB试剂均应小量分装后-20℃冰箱保存,左旋咪唑能抑制内源性碱性磷酸酶活性。例如:以每次所用显色液30ml计算,分装As-Mx 5~7mg/支、Fr8mg./支、FB7mg/支,每次使用一支,用前稀释30倍,过滤显色。FR、FB等在光照射条件下易引起沉淀,故显色反应在暗处进行。
(3)GOD,是以葡萄糖为底物的酶,其显色方法为β-D-葡萄糖67mg、NBT6.7mg、PMS(Phenazine Methylsulfate)0.167mg,0.05mol/L PB(pH8.3)10.0ml,37℃孵育1h。生成蓝色不溶性沉淀。该终产物不溶于有机溶剂,切片可脱水透明,长期保存。但GOD的敏感度较HRP和ALP为低,电子供体少,应用较局限,主要用于两种酶的放大技术,能提高方法和敏感性和特异性。即用GOD和HRP分别标记第二、第三抗体(例第一抗体为小鼠单克隆抗体、第二抗体为GOD标记的兔抗鼠IgG,第三抗体则为HRP标记的羊抗兔IgG),ICC染色,以葡萄糖-DAB作显色剂。基本原理如(图4-3)。在这里HRP是作为第二酶系统,利用葡萄糖氧化时生成的H2O2作底物,催化酶促反应,不受内源性过氧化酶的影响。而且GOD和HRP所标记的抗体是结合在同一抗原位置,所以能良好地显示组织抗原的存在。其主要染色步骤为:
①切片经第一抗的孵育;②漂洗,GOD标记的第二抗体孵育40~60min(室温);③漂洗,HRP标记的第三抗体孵育30~45min(室温);④漂洗,显色、脱水透明观察同前。

图4-3 两步酶催化反应原理
二、非标记抗体酶法
由于酶标抗体存在一些缺点,例如①酶与抗体间的共价连结可损害部分抗体和酶的活性;②抗血清中的非特异性抗体被酶标记后,与组织成分结合,可致背景染色等。为此Sternberger等在酶标法的基础上,发展了非标记抗体酶法。包括酶桥法(Enzyme Bridge Method)和过氧化物酶抗过氧化物酶法(PeroxidaseAntiperoxidase Method, PAP法)。现分述如下。
(一)酶桥法
1.基本原理首先用酶免疫动物,制备效价高、特异性强的抗酶抗体,然后使用第二抗体作桥,将抗酶抗体连结在与组织抗原结合的第一抗体上,再将酶结合在抗酶抗体,经呈色显示抗原的分布。在此过程中,任何抗体均未被酶标记,酶是通过免疫学原理与抗酶抗体结合,避免了共价连结对抗体和酶活性的损害,提高方法的敏感性,且能节 省第一抗体的用量。
2.染色步骤 主要程序如图4-4

图4-4 酶桥法主要染色步骤
(1)切片准备及第一抗体孵育前处理同间接法,第一抗体(假设来自种属A)孵育24h(4℃)。第一抗体的稀释度可高些,使抗体的两个Fab段均与组织抗原结合,较牢固,漂洗时不易丢失。
(2)切片与第二抗体(也称桥抗体,抗种属a IgG抗体)孵育1~1.5h(室温)。应用过量的桥抗体能保证一个Fab段与第一抗体结合,另一个Fab段游离。
(3)切片与抗酶抗体(来自种属A)孵育1~1.5h(室温)。因抗酶抗体和第一抗体均系种属a IgG,具有相同的抗原性 ,所以 桥抗体游离的Fab能与抗酶抗体结合,起到桥的作用,将抗酶抗体连结在与组织抗原结合的第一抗体上。
(4)切片与酶(HRp70~100μg/ml,PBS溶解)孵育0.5h(室温),酶与抗酶抗体结合。
(5)显色等与酶标抗体法相同。
酶桥法克服了酶标抗体法的缺点,较好地保护了抗体和酶活性。但仍有其不足:①在酶抗体血清中,含有低亲合力和高亲合力两类抗体,它们作为抗原与桥抗体结合,主要依赖于桥抗体对它的亲合力,而与其本身对酶的亲合力无关,故二者均可被连结在桥抗体上。低亲合力的抗酶抗体与酶结合较弱,漂洗时易解离,使大部分酶(70%左右)丢失,降低了方法的敏感性。②第三步所用的抗酶抗体血清中,亦含有非特异性抗体,其抗原性与抗酶抗体相同,所以能与桥抗体结合,但不能与酶结合,影响组织抗原的显示。为此70年代初,Sternberger(1970)又建立了PAP法,并加以改良,现为ICC研究中常用的方法之一。
(二)PAP法
1.PAP的制备及特征 PAP复合物是离体制备的HRP抗HRP复合物,它的制备方法较多,现简介其中之一。
(1)制备抗HRP血清:健康雄性家兔(2.0kg以上),可先于足跖皮下注射灭活的卡介苗(共10mg),2周后重复1次,刺激机体免疫系统功能,1周后于背部脊柱两旁皮内多点注射1.0ml乳剂[(福氏完全佐剂,含HRP3.3mg(RZ=3.0)];间隔2周第2次注射,背部注入含HRP3.3mg的不完全福氏佐剂1.0mg;再间隔2周,第3次注射,2mgHRP(溶于2ml生理盐水中),分别于前后小腿皮下和背部肌肉内多点注射,1周后采静脉血,检查效价。再隔1周第4次加强注射(条件同第3次),一周后检查抗体效价,琼脂糖扩散法(HRP0.1mg/ml)为1:128以上时,颈动脉取血,制备血清低温保存备用。
(2)制备PAP复合物:离体条件下,使兔抗HRP抗体与HRP形成可溶性复合物。在制备抗HRP血清时,HRP的纯度要高(RZ≥3),而制备PAP复合物时,HRP的质量要求不高,甚至可用酶的粗制品。
【步骤】
①取10.50ml抗HRP血清,加7.60ml含7.6mgHRP(1.0mg/ml)的水溶液。
②混匀,室温1h后,离心16000g 4℃15min。
③0.9% NaCl(冷盐水)溶解沉淀,离心16000g 4℃15min,重复4次。
④加15.3ml HRP水溶液(含HRP30.64mg),室温,持续搅拌。
⑤用1N HCl及0.1N HCl调pH至2.3,沉淀物全部溶解变清,立即用1N 及0.1n NaOH调pH至7.2。
⑥慢慢加等体积的饱和硫酸铵,置0℃45min。
⑦离心35000g 0℃15min,沉淀用50%硫酸铵漂洗两次。
⑧用10.50ml水溶解沉淀,对透析液(48.6g NaCl, 1.5N NaOOCCH3 30ml, 3N(NH4)2SO430ml, 水5.94L)透析,4℃离心,收集上清,加透析液使体积至10.50ml,分装低温保存。
【质量鉴定】
制备的PAP复合物应检测酶和抗体的含量,以鉴定PAP复合物的质量。常用分光光度计检测PAP的复合物在280nm(IgG的最大吸收波长)和400nm(HRP的最大吸收波长)的光密度值(OD值),按下式计算IgG和HRP的含量:
一般HRP/抗HRP的克分子比达1.9时,可分装冷藏于-85℃冰箱,据报告如此冷藏的PAP复合物可保留14年之久,活性无改变。但稀释后的PAP复合物不稳定,4℃可保存2~3周。最好临用前配制。
【PAP复合物的特征】
PAP复合物的形成不同于其它抗原抗体反应,在抗原稍过量时,所有的抗HRP抗体均参与形成可溶性PAP复合物,仅残留少许游离的HRP,而大多数抗原抗体反应需要抗原绝对过量才能形成可溶性复合物。PAP复合物的形状相当稳定,不受抗原量的影响,无论最初加入的抗原抗体过量与否,最终形成的PAP复合物其HRP/抗HRP之比绝大部分为3:2。应用离心沉降、液相扩散等方法分析表明:PAP复合物沉降系数为11.5s,分子量为400~430kD,由此可推算出酶与抗体之比为3:2,即每个PAP生命物由3个HRP分子和2个抗HRP抗体组成,呈五角形结构,3个角为HRP,另两个角为抗HRP抗体。采用H2O2-DAB染色,电镜下已经观察到PAP复合物五角形环状结构,直径平均21nm 。这种结构异常稳定。据报告PAP复合物的抗HRP抗体与HRP结合常数为108,在此可溶性复合物中,即使存在少量游离HRP,亦不影响其稳定性。
2.PAP染色原理及步骤
(1)原理:与酶桥法相似,都是借助桥抗体将酶连结在与组织抗原结合的第一抗体上,所不同的是PAP法将酶桥法的步骤3、4合并为1,用PAP复合物代替,即第三步用PAP复合物孵育切片,故称PAP法。PAP复合物中的抗HRP抗体和第一抗体为相同种属动物的IgG,所以桥抗体能够作为“桥”将PAP复合物连结在第一抗体上。
(2)染色步骤:主要步骤与酶桥法相似,如图4-5。
①切片准备及第一抗体孵育前处理同间接法;切片与特异性第一抗体孵育同酶桥法。
②用过量的桥抗体孵育,作用同酶桥法。

图4-5 PAP法主要染色步骤
③用离体制得的PAP复合物(1:30~300稀释)孵育1~1.5h(室温),使其被桥抗体连结在第一抗体上。亦可用ALP抗ALP复合物代替。
④显色观察等同间接法。
3.PAP法的评价PAP法应用比较广泛,特别是近几年,PAP、ABC等试剂盒商品化,在科研和临床病理诊断等中有着广阔的前景。其主要特征和注意事项如下:
(1)抗体活性高:非标记抗体酶法最大限度地保存了抗体活性,因为在所有的反应过程中,任何抗体均未被酶连结,避免了标记过程(共价键连结)对抗体活性的损害。
(2)灵敏度高:灵敏度是指ICC方法所能发现最少数量抗原而言。从理论上讲,PAP法应该较间接法敏感2倍以上,因为酶标抗体法中,酶与抗体为1:1标记,而PAP复合物含有3个HRP分子。假设一个第一抗体同一个酶标抗体/PAP复合物结合,则被连结于抗原部位的酶分子数量不同,所以PAP法应较敏感。我们知道组织切片抗原的含量是未知的,所以不能直接在切片上检测方法的敏感度;但可以假设相邻切片抗原浓度相对恒定,采用相邻切片染色,以产生特异性染色所用的第一抗体最低浓度作为方法的敏感度,用信噪比(Signal/moise,S/N)表示。据此,Sternberger(1979)认为PAP法较间接法敏感20~25倍,可进一步稀释第一抗体,以节 省其用量。但实际上PAP法与间接法之间的差异并非如此明显。笔者在实验中注意到,PAP显示阳性的抗原,相同的稀释倍数的第一抗体在间接法中亦呈阳性反应,而时间阴性时,PAP法亦为阴性。其原因尚不清楚,可能与桥抗体和第一抗体结合时,“剩余”(游离)的Fab段少,PAP复合物被连结的相应减少有关。另外,PAP复合物分子量较大(400KD),冰冻切片时,对组织穿透性远不如酶标抗体(分子量90~180kDa),所以不适于免疫电镜的标本制作。
(3)背景染色低:在酶标抗体法中,被标记的非特异性抗体可与组织成分结合,造成背景染色(图4-6)。从理论上讲,在非标记抗体法,连结抗体中,即使存着非特异性抗体,因其不是抗第一抗体种属IgG的特异性抗体,故亦不能与抗HRP抗体结合,不能把PAP复合物连结在此非特异性抗体上(图4-7)。当然,PAP复合物内也可能存在些非抗HRP的抗体,假如这部分抗体能够与桥抗体及组织成分结合,但因其不是抗HRP的抗体,故不能与HRP结合,无酶活性。因此说桥抗体的引入,使ICC的特异性得到了双重放大,S/N增大。但也有人认为,过量的桥抗体及PAP复合物等均易与Fc受体结合,致使背景染色增强。实验表明:合适的切片准备、恰当地应用封闭性阻断剂、正常血清以阻断非特异性结合,加之适当地选择抗体稀释度和抑制内源性酶活性,PAP法和间接法二者的背景均相当低。

图4-6 间接酶标抗体法
背景染色增高原因

图4-7 PAP法降低背景的原理
(4)假阴性及其处理:应用PAP法显示抗原含理较多的组织或冰冻切片组织抗原保持良好的标本时,可导致阴性结果,这种现象称为假阴性。Vandesand发现:应用PAP法显示大鼠视上核和室旁核内加压素神经细胞分布时,第一抗体(1:200)染色,加压素含有细胞呈强性。如果取材前24~48h,脑室内注射秋水仙素,阻断轴突运输以增加视上核和视旁核加压素含量,同时组织标本经脱水、透明、再水化等处理以增加抗体的通透性,同样稀释度染色,结果却阴性。进一步实验发现:增加抗体的稀释度,开始出现阳性染色,稀释至1:1500时,染色最强,继续增加抗体稀释度,染色强度则下降。Bigbee(1977)认为假阴性是第一抗体用量过高与组织抗原结合过多,使相邻两个伉体的Fc段间的距离(d)恰好是连结抗体的两个Fab段与之结合的长度,于是连结抗体不存在游离Fab段,仅剩无活性的Fc段,所以不能将PAP复合物连结在与组织抗原结合的第一抗体上,结果阴性(图4-8)。因此,借助PAP法研究组织抗原分布,特别是新鲜组织冰冻切片组织抗原保存较好时,第一抗体尽量用高稀释度,避免假阴性。石蜡切片很少发生这种现象,所以PAP法在石蜡切片的ICC观察中更为常用。

图4-8 示假阴性:组织切片上结合过多的第一抗体,两抗体间的距离d 恰好适于桥抗体的两个Fab段与之结合,无PAP复合物结合的位置
(5)桥抗体:也称连结抗体,它的两个Fab段具有相同的结构、性质及与抗原结合的能力。因此,当第一抗体和PAP复合物中抗HRP抗体来自同一种属动物时,桥抗体能同时与上述两种抗体结合,起到桥的作用。为了确保桥抗体的两个Fab段之一与第一抗体结合、另一个与抗HRP抗体结合,桥抗体需用高浓度。另外,在非标记抗体酶法中可用葡萄球菌蛋白A(SPA)代替桥抗体,进行ICC染色。SPA不受种属限制,应用范围广。
(6)PAP复合物:在PAP法及酶桥法中,特别强调第一抗体和抗HRP抗体必须来自同一种属,桥抗体才能发挥桥的作用,将其连结在一起;但一些研究表明:第一抗体和抗HRP抗体来自不同种属,连结抗体仍可作为桥,将二者连在一起。例如Erlandsen发现豚鼠IgG作为第一抗体,可用羊抗兔IgG、兔PAP复合物显示之一。Grzanna(1982)根据这一报告,利用豚鼠抗DBH血清作第一抗体,羊抗兔IgG为桥抗体,12例兔血清制得的PAP复合物中,仅3例染色较佳。这种第一抗体和PAP复合物来自不同种属获得的阳性结果主要依赖于种属间的交叉反应。多数实验表明:抗体和种属交叉反应是有限的,也是不完全的。故利用桥抗体进行ICC染色时,仍以第一抗体和抗酶抗体来自同一种属为宜。
第三节 结果分析
ICC染色结果判断与其它组织化学相似,应在熟悉所应用方法、抗体的优点和局限性的基础上,避免主观意识,进行客观判断。一般认为在严格操作、控制染色的条件,选择特异性抗体等条件下,所得结果是阳性时才有积极意义。而阴性时,不一定意味着该物质或抗原不存在,即不能排除实验过程所致的抗原丢失或抗体选择不当等引起人工假象。另外根据ICC染色强弱做半定量分析时,必须是同时固定、相同的组织块、相邻/同一切片,在严格控制抗体用量和显色时间等条件下,进行图象测定,否则无法相互比较。镜检时,首先从对照标本开始,判断固定是否合适、非特异性着色强弱等再从低倍至高倍顺序观察实验标本,预期阳性部位是否被染色,不该含此类物质的部位是否阴性等。一般认为,切片边缘的较强染色,属于非特异性着色,所以应避免作为阳性结果的依据。同时应结合对照实验、鉴别假阳性,以便做出正确判断。
一、对照实验
1.常用的吸收实验分固相吸收和液相吸收两种(见本书第一章 ),对于不能形成沉淀,难以用离心沉降法分离的一些小分子多肽类抗原,以固相吸收为佳。一般市售抗体均经特异性检测,所以应用购买抗体时可省略此步。
2.交叉实验 我们知道,引起机体免疫应答反应的并非是免疫原整个分子,而是其中的一部份—抗原决定簇。每个抗原可能有不同的抗原决定簇,不同的抗原亦可能有类似的抗原决定簇,因此一种抗血清可能与几种抗原结合。所以同时最好亦用结构相近的抗原做吸收实验,以避免抗原间的交叉反应。
3.替代实验 用制备第一抗体相同种属的正常血清(1/10或相同IgG浓度)替代第一抗体或用第二抗体相同种属的正常血清替代酶标抗体/桥抗体或省略其中任何一种免疫试剂或酶等,以PBS代替之,分别孵育切片,结果均应为阴性。
4.置换实验 应用无关的特异性抗体代替第一抗体,孵育切片,结果应阴性。如果同时进行几种特异性抗体的ICC染色时,彼此之间即为此类对照。例如,无关的数种抗体,均在相同部位出现类似阳性结果时,非特异性着色的可能性较大,应慎重判断。
5.阳性对照 不具有ICC染色经验者,从事此项工作时,最好同时染色已知阳性标本,以排除操作过程失误所致的染色阴性。阳性标本切片最好冰冻保存备用。
另外,在观察新的组织抗原时,最好同时比较不同的固定的组织标本、冰冻切处及石蜡切片的ICC染色,选择最佳条件,以期得到良好的实验结果。
二、假阳性及其处理
组织成分与各种染色试剂及抗血清之间的非特异性结合称假阳性,其主要原因和处理方法如下:
1.组织细胞内色素 与DAB沉淀物颜色类似的色素,例如黑质内的神经黑色素,不易与反应产物区别开来。可用其它电子供体或免疫荧光技术鉴别之,亦可改用ALP代替HRP,进行染色。
2.假过氧化物酶活性RBC内的血红素辅基有类过氧化物酶活性,当组织内存在红细胞时,即使不加过氧化酶,亦可出现阳性染色。用甲醇-0.3%H2O2孵育标本15~20min(室温),能抑制这种假阳性。甲醇可以使血红素蛋白中的(亚铁)血红素游离,后者被H2O2破坏,从而抑制类过氧化物酶的活性。一般认为,RBC的染色容易同其它组织细胞区别,且动物实验还可通过灌注冲洗组织内的RBC,所以此步往往被省略。
3.内源性过氧化物酶活性粒细胞、巨噬细胞等存在内源性过氧化物酶,能够与DAB-H2O2反应,导致假阳性,所以含此类细胞较丰富的脾脏、肝脏、骨髓等组织,ICC染色时,最好做内源性酶阻断。适当的固定、经酸酒精孵育15~20min,或1%乙酸-甲醇硝基铁氰化物处理,冰冻切片可用苯肼孵育15~20min,均能不同程度地抑制内源性酶的活性。近年Li(1987)报告,应用0.1%NaN3 0.3%-- H2O2孵10~15min(室温)能较好地抑制内源性过氧化物酶的活性,冰冻切片效果尤佳。嗜酸性粒细胞内源性过氧化物酶活性较强,上述各种处理后,仍残留部分活性,此种情况,在DAB-H2O2显色液中加入终浓度为0.05NaN3,基本上可达到完全阻断的作用。但是,各种封闭内源性(假)过氧化物酶方法均不同程度地破坏组织的抗原性,所以在不影响反应结果判断或能够同内源性酶的反应所致的假阳性区别时,尽量避免此类处理或改用ALP代替HRP进行ICC染色,也可以在用第一抗体与抗原反应结合后,再进行消除内源酶的处理。
4.游离醛基醛类固定的组织切片上,可能存在些游离醛基,后者能与蛋白质(含IgG)间非特异性结合,导致假阳性,用白蛋白或封闭性阻断等预先孵育切片,可封闭之。
5.疏水键和离子键免疫球蛋白可通过疏水键或离子键与组织中的碱性蛋白或Fc受体(冰冻切片Fc受体保存尤佳)非特异性结合。用正常血清(制备第二抗体种属的血清为首选),于第一抗体前孵育切片,可消除之。“4”和“5”重叠应用,更有利于降低背景染色。
6.天然抗体及不纯抗体 天然抗体是指因动物自然感染等原因血清中存在的部分抗体:不纯抗体是指在制备血清时,所用的抗原不纯,获得的抗体含有杂质抗体。当天然抗体或不纯抗体与组织成分结合时,可引起非特异性染色。上述二者的含量均较低,增加第一抗体的稀释度,可以降低其非特异性染色。
7.载体蛋白抗体 制备小分子多肽(分子量小于4kD)的抗体时,需借助载体蛋白,使小分子多肽获得免疫原性,刺激动物产生特异性抗体。因载体本身具有抗原性,故动物同时也产生抗载体蛋白抗体,与组织蛋白结合后,引起背景染色。用固相吸收技术,能将载体蛋白抗体除去。一般市售抗体,均经特异性检测,所以“6”和“7”可不必考虑。
三、抗体有关事项
1.血清特异性检测为了发现新的物质或其它方法未能显示的物质、而又无相应抗体可购买时,往往需要自己制备抗血清。制备时应检测抗血清的特异性。常用的方法有:
(1)放射免疫分析(RIA)、免疫扩散或电泳及ICC法:在制备抗血清的过程中 ,用RIA和免疫电泳等方法检测抗血清的效价是不可少的。一般认为,RIA和免疫电泳的最佳稀释度较高。ICC染色时,应从其1%的稀释度试用之较合适。在制备ICC用抗血清时,最好在应用RIA和免疫电泳法的同时结合ICC染色,以鉴定抗血清的质量(制备单克隆抗体时,仅用ICC染色筛选特异克隆即可)。因为免疫过程中,各个时期抗血清效价不同的,例如给动物免疫催产素,7周时血清ICC染色较好,RIA不佳;在10~12周期间,RIA效价升高,但ICC染色较差。因此制备ICC用抗血清时,应在ICC染色效价最佳时,收集抗血清。
(2)系列稀释第一抗体法:在一定稀释度时,抗体的特异性结合最强;继续增加抗体的稀释度,特异性反应将随之减弱至消失。因此采用系列稀释第一抗体的方法,能够验证抗血清的特异性。
2.抗体的选择原则上应选择在较高稀释度时染色较佳而背景较低、结果稳定、重复再现良好的抗体。目前供ICC研究用的抗种类繁多,制造商如林,不同的厂家的相同抗体,其价格、包装及抗体的最佳工作浓度,差异较大。所以选购时,应多听取有经验者的建议,参考文献报告,并且自己应多查找不同厂家的抗体商品目录,恰当地选购自己所需的抗体。
3.抗体最佳稀释度的检测抗原抗体反应要求一定比例,过量或不足,均不能达到预期的结果,所以ICC染色时,应进行抗体最佳稀释度的检测。市售抗体所附说明书均标有工作液浓度,但实际上,厂商常常给较低的稀释倍数,因此应用时,可将所给工作液浓度稀释数倍至数百倍再进行系列染色,选择其中特异性染色最强、背景着色最低的释释度作日常ICC染色浓度。在抗体来源不明、又无任何可供参考依据时,则可从原液至数倍稀释试用。另外,酶标抗体/连结抗体和PAP复合物等也需要确定最佳工作液浓度。一般认为酶标抗体可用稍离浓度,例如HRP标记抗体为1:80~160、ALP标记抗体为1:50~100染色较理想。PAP法染色时,连结抗体稀释1:50、PAP复合物用1:50~200染色较合适。
4.抗体的保存为确保ICC染色结果稳定、再现性良好,应避免抗体反复冻融所致的效价降低。第一抗体分装、冷冻保存为佳,其最小包装可为每次用量或2周内用量。例如某抗体的工作液浓度1:1000~2000,每次染色需抗体量为1~4ml时,则所需原液为1~2μl。将原液分装成几微升难度较大,所以先将原液稀释为1:10~100,每支离心管内10~100μl保存,应用前稀释至工作液浓度。后者不宜冰冻,4℃可保存2~3周,原液和1:10~100的抗体在-80℃可保存数年而染色结果不变。单克隆抗体为培养液上清或腹水时,应4℃保存,应早应用。酶标抗体和PAP复合物原液4℃保存1年左右,免疫活性和酶活性不发生改变,大量制备的酶标抗体/PAP复合物最好分装后于-80℃或-20℃保存。所分装的抗体,应注明名称,稀释度、量及日期等,同时应在笔记本详细记录。ICC研究所用的任何抗体及酶,均应严格记录,妥善管理,才能保证实验成功。
四、单克隆抗体
在单克隆抗体问世前,ICC染色中通常所用的抗血清均为多克隆抗体,即抗血清含有多少B淋巴细胞株所分泌的抗体,这些抗体的性质不完全相同,不同的抗血清之间可能有交叉反应,使ICC染色受到一定限制。近年,单克隆抗体的引入,特别是市售单克隆抗体和种类和数量的迅猛发展,及各实验者比较容易制备自己所需的单克隆抗体,为ICC染色在特殊抗原定位、生物活性检测、肿瘤标记识别中,开辟了更广阔的前景。
1.单克隆抗体的制备(Oi,TV, 1980)(详见第一章 )。
2.单克隆抗体的特点
(1)酶标抗体:自己制备或市售商的单克隆抗体,绝大部分为小鼠IgG、Kappa型,所以酶标抗体选择抗小鼠IgG的多价抗体,进行ICC染色比较稳妥。
(2)特异性:专一性强:单克隆抗体是由同一细胞株分泌的,性质均一,且有相同的亲合力,识别同一抗原决定簇。这在研究某些类似物质的局部定位、分型、生物活性检测及肿瘤诊断等方面有重要意义。但同时也应注意,不同抗原的相同抗原决定簇有被识别的可能,所以应结合其它方法,判断其结果。
(3)不需纯化抗原:多克隆抗血清在制备时,要求抗原相当纯。而制备单克隆抗体时,不需纯化抗原。一些不能纯化的组织(游离)细胞可直接免疫,经克隆化,筛选所需细胞株,避免了纯化抗原的麻烦,这在研究人类各种疾病等有重要价值。
(4)工作液浓度:不同的单克隆抗体效价各异,所以ICC染色时需检测最佳稀释倍数,大量培养纯化的抗体可用更高的稀释倍数。
(5)切片选择:单克隆抗体仅识别抗原物质的某一抗原决定簇,所以以新鲜组织的冰冻切片为首选。因为在固定过程中,可能使抗原物质发生某些改变,致使其与单克隆抗体反应的抗原决定簇丢失,故拟用石蜡切片固定组织冰冻切片。ICC染色时,在制备单克隆抗体过程中,应该用同样标本和方法筛选所需细胞株,才能确保染色成功。
(6)特异性检测:单克隆 抗体的特异性强,性质均一,没有必要进行RIA分析和吸收实验等。自己制备的单克隆抗体,其特异性检测最佳方法为相同组织提取物质进行免疫电泳,确定抗原的分子量等。
(7)发现新物质:在制备肿瘤或其它组织细胞单克隆抗体时,往往有各种各样的抗原特异性杂交瘤细胞株产生,在筛选过程中,能够发现一些新的杂交瘤株,经培养制备相应的抗体,用于一些新领域的研究。
五、增加染色强度方法
通常染色、着色较弱时,应想办法改进标本的处理的抗原的保存,提高抗体的穿透力,再重新染色。但有时组织本身抗原含量较少或标本难得(如手术材料),可尝试下述方法以提高染色强度,确保染色成功。
1.重复显色一般认为,对ALP标记抗体,延长显色时间其反应可增强。但在同一染色液中延长显色时间,往往容易产生沉淀,出现终产物弥散现象。所以重新配制显色液继续呈色,第二孵育时间可缩短至4~5min,能提高部分染色强度。
HRP标记时,重复呈色无明显增强效应。通常在显色液中加入0.01mol/l Imidazole 或改用酸性缓冲液(pH5.5~6.0),可提高染色强度;亦可在DAB反应后,1%OSO4浸泡固定5~15min,继之0.4%亚铁氰化钾/0.1N HCl液处理5min,DAB终产物呈黑色,与背景的对比度较佳。另外,在间接法显色较弱时,亦可试用PAP法、ABC法等,探索较合适的染色方法。
2.重复第一抗体在漂洗过程中,结合力弱的抗体易离解丢失,重复应用第一抗体有利于抗体与组织抗原结合,增加抗体数量,提高染色强度(Noorden 1983)。切片经第一抗体孵育后,漂洗,再孵育第一抗体(此时第一抗体可稀释较原工作浓度1至数倍)2~4h,然后经酶标抗体孵育,呈色观察同前。所用抗体为多克隆血清时,提高第一抗体的稀释度,重复孵育2~3次,可得到一定效果。单克隆抗体,经第一抗体—酶标抗体—第一抗体—酶标抗体,也能增加染色强度。
3.双桥PAP法(Vacca 1982) 基本操作与单桥法相似,所不同的是切片经单桥PAP复合物孵育后,漂洗,再孵育桥抗体和PAP复合物(均可稀释1倍),即切片经两次桥抗体、两次PAP孵育—双桥法(Double bridged technique)。据报告,第一抗体用较高稀释度(例单桥法两倍),也能获得与双桥法相近的染色效果。
理论上讲,双桥法是ICC染色中较为敏感的方法,它较单桥法灵敏20~50倍,能够增加抗原的显示数量(25%)和反应终产物的大小。这在研究胚胎发育过程中一些抗原含量较低的组织时,具有一定的应用价值。双桥法可能是通过下列途径提高其敏感性的:①重复的桥抗体与PAP复合物中的抗HRP抗体的未饱和抗原位置结合,再连结另外的PAP复合物,在抗原部位抗体间彼此结合形成较大的抗原抗体复合物,具有多个酶分子(图4-9A),使反应增强。这可能是双桥法敏感性增高的主要机制;②重复的桥抗体与第一抗体未饱和的抗原位置结合,使第一抗体上结合较多的桥抗体及PAP复合物(图4-9B)。但PAP复合物较大,应设法提高其穿透性,达到增加染色强度的目的。

图4-9 双桥PAP法的两种放大原理
4.半抗原夹层法(Hapten Sandwich Method) 首先用半抗原(FITC等)标记的第一抗体与组织抗原结合,继之用HRP(或ALP)标记的抗FITC抗体与组织抗原结合的FITC的反应,呈色后观察抗原存在部位。FITC为一种荧光色素,荧光显微镜下呈亮绿色荧光,所以也可以同时观察免疫荧光染色结果。FITC特异荧光褪色后,其抗原性仍不丢失,从这种角度讲,荧光抗体法的切片亦能半永久保存。该法较一般间接法敏感性高,最大优点是不管第一抗体来自何种属,只要与FITC连结,均可被同一酶标记的抗FITC抗体识别。避免了准备不同种属的酶标抗体的麻烦,而且FITC标记抗体技术成熟、稳定,商品种类多,容易购买,实验者不妨一试。
第四节 ICC的几种特殊应用
近年 ICC技术在下述方面的应用,令人注目,有着广阔的前景。现介绍如下:
一、ICC在铺片中应用
铺片(Whole Mount Stretch Preparation) 是研究神经分布应用较早、较广的方法。19世纪末,Dogiel和Cajal等利用铺片技术,结合镀银及甲基蓝染色,观察肠道神经丛模式、神经元种类及其相关联的间质细胞。近年来,人们进一步认识到全层铺片技术的优点:例如①不必采用连续切片和三维重建技术,可以直接观察神经元间质细胞的三维结构;②能观察较大区域,在研究显微外科手术后神经分布模式和数量改变中有较好的应用价值;③操作简单,能在较短时间内制作大量标本等。所以,铺片技术在ICC染色中得到广泛的采用(Zhou等1992)
铺片ICC染色方法与切片基本相同,所不同的是铺片较厚,背景着色较强,有时甚至妨碍特异性染色的观察。实验证明,这种非特异性染色主要是酶标抗体/桥抗体与组织γ-球蛋白结合引起的,用封闭性阻断剂及正常血清等分别孵育切片,并在稀释抗体时,加入适量的BSA,可以降低此类非特异性结合。BSA、封闭性阻断剂与IgG(正常血清)的等电点不同,重叠应用,阻断效果尤佳。另外,铺片的细胞膜完整,不利于抗体的穿透,特别是PAP复合物等大分子物质,为此设法提高抗体的穿透性是非常重要的。采用反复冻融和表面活性剂前处理,有助于细胞内抗原的暴露。我们在实验中参考Costa(1980)的制片方法,将组织铺片经系列酒精(70%、90%、100%、100%,每次10~15min)脱水,Hemo—d 2次(10~15in/次),再水化(100%、90%、70%、50%降酒精)等处理,辅助Triton X-100应用,明显增加抗体的穿透性,获得较为满意的染色效果。 但是,并非所有的组织都能制成铺片,虹膜、肠系膜和小血管等适于制做全层铺片;食道、胃肠道、胆道、胆囊、大血管、输尿管等脏器则均需进行组织分层,再铺片,行ICC染色。
染色方法:以小肠分层铺片为例:
(1)4%多聚甲醛或Zamboni 液固定2~6h,4℃,或丙酮固定。
(2)PBS充分冲洗,置PBS中过夜。
(3)系列酒精脱水,Hemo—D透明,降酒精至PBS。
(4)分层铺片,直接漂浮染色或贴于载玻片风干,再染色。
(5)0.3%~0.5%Triton X-100/PBS 15~30min, 室温,PBS冲洗。
(6)封闭性阻断剂30in,室温,正常兔(羊)血清30min,室温。
(7)第一抗体,孵育,4℃冰箱过夜;PBS2次/2min;重复第一抗体孵育(可稀释1
倍),2~3h,室温,充分使抗体穿透至深层,使组织深层的抗原得以与抗体充分结合。
(8)PBS充分冲洗,2~3h,4℃。
(9)酶标抗体孵育,4℃冰箱过夜。
(10)PBS冲洗,呈色,观察与切片相同。
二、ICC的双重染色法
在某些物质活性检测、神经递质共存的研究、临床肿瘤的分型、定性,以及预后的估测等中,ICC显示了巨大的优势,它不仅能与Carbon、荧光色素、同位素追踪标记及其它组织化学方法(例如PAS染色法)结合,显示两种物质的共存,提示组织细胞的功能,而且本身亦可进行双重染色,研究一些抗原物质的共存,这里仅简单介绍ICC双重染色的几种方法。
(一)切片
1.连续切片(Serial sectioning technique) 连续切片是两种物质共存研究中应用最早的方法之一,是用相邻切片分别孵育两种不同特异性抗体进行ICC染色,主要适用于观察同一细胞内不同抗原的分布。该方法要求切片足够薄,保证每个细胞能同时出现在3~4张相邻切片上,第1和3张切片用相同抗体染色均阳性时,作为阳性结果,可信度较高,可避免结果判断困难。所以,常采用石蜡切片,厚约2μm左右,若用树脂包埋的半薄切片(0.5~1μm),比较容易识别同一细胞内两种抗原的共存。
2.镜影切片法(Mirror sectioning technique) 所谓镜影切片,简单地讲就是两张相邻的石蜡切片(厚2μm)或冰冻切片(厚3~4μm),第二张反转之,贴于载玻片上,同一细胞在两张相邻的切片上呈镜与影的关系(相当于冰冻蚀刻电镜的P面和E面)。分别孵育两种不同抗体,ICC染色,观察其在同一细胞内的分布。
(二)染色
1.ICC与荧光抗体法结合 首先染色显示A抗原,DAB/H2O2呈色,继之用间接(直接)荧光抗体法显示B抗原,于光镜和荧光显微镜下观察,比较两种抗原的分布。因DAB终产物能够沿其表面向周围迁移,尤其是DAB浓度略高、反应时间稍长时,形成的终产物较大,可以遮盖该抗原抗体的反应部位,故两种染色间很少出现交叉反应。该双重染色的方法主要适于显示两种抗原分布不同细胞内,尤其A抗原浓度高、反应较强、DAB终产物较牢固的情况。
2.同一切片的再度染色法(Restanining Method) 用ICC法显示神经递质、神经肽等在神经细胞/神经纤维内共存时,连续切片、镜影切片及重叠染色往往很难判断同一神经纤维的共染,为此建立了同一切片再度染色法。该方法利用4—氯—1—萘酚(CN)产物在酒精内的可溶性及酸处理能使抗原抗体解离的特点,首先第一种抗原用CN发色,染色阳性部位摄影;继之,用低 pH的甘氨酸/盐酸缓冲液(0.2mol/L甘氨酸—盐酸缓冲液,pH2.2~2.3,含0.5mol/l NaCl)或盐酸孵育切片,去除第一次染色的抗体,再经50%、70%、90%、100%酒精脱CN色,PBS洗净后染色第二种抗原,DAB呈色后,摄影比较同一部位是否两种抗原共存在于同一神经纤维。为验证盐酸等处理效果,可省略第二次染色的特异性抗体,仅重复酶标抗体的染色,观察第一抗原阳性部位是否出现重叠着色。
3.同一切片、不同呈色的双重染色ICC法显示A抗原时,用DAB/H2O2呈色,终产物为棕褐色;继之,B抗原染色,CN/H2O2呈色,反应产物深蓝色,光镜下可同时观察两种抗原的局部所在。为避免第二次染色的抗体与第一次染色抗体之间的交叉反应,在B抗原染色前,可用酸性缓冲液处理切片,去除第一次反应的抗体,方法同2。该方法DAB和CN的色彩对比不鲜明,而且HRP酶活性较强,酸性缓冲液中,亦能残存部位活性,所以可能有混合颜色出现,判定同一细胞内两种抗原共存常常有一定难度。
4.两种酶标抗体的双重染色 分别用HRP和ALP标记间接抗体,ICC染色,显示两种不同的抗原。首先显示A抗原,HRP酶标记间接抗体,CN/H2O2呈色;继之显示B抗原,ALP标记间接抗体,FR/As—Mx呈色,轻度甲基绿/苏木精复染细胞核,一般可获得理想的结果,组织结构清晰,色彩对比鲜明。笔者应用此方法,显示小鼠脾脏巨噬细胞标记物ED1、ED2和ED3分布时,得到了较佳的染色效果。尽管该双重染色法应用了不同的酶标抗体,但常用其二者来自同一种属的抗体,所以在第一次染色部位,往往有重叠染色的现象。我们的经验为先染色反应较弱、含量较少的抗原,第一抗体用较高稀释度,酶标抗体则用高浓度(低稀释度),尽量使所有的第一抗体均被饱和,防止其与第二种酶标抗体结合;第二种抗体染色前,应用PBS充分洗净;第二种酶标抗体可用较高的稀释度。这样可避免“非特异”性重叠着色,色彩对比亦较理想。
5.不同种属来源的抗体的双重染色上述几种双重染色法,均系来自同一种属的特异抗体和相同/不同的酶标抗体,所以两次染色间常常有交叉反应。较理想的方法是用不同种属动物制备特异性抗体和两种酶标抗体的双重染色,例如显示A抗原为小鼠单克隆抗体,HRP标记兔抗鼠IgG;显示B抗原为豚鼠单克隆抗体,ALP标记羊(驴)抗豚鼠IgG ,将两种抗体稀释最佳工作液浓度1/2,充分混合、孵育同一张切片,亦可分别染色。CN/H2O2呈色后,FR—As—Mx呈色,光镜下观察两种抗原的分布。该方法两种抗体间无交叉反应,特异性较高,即使细胞内抗原量较少也能发现。但当两种抗原存在同一部位,其中之一浓度较高、占绝对优势时,亦将妨碍另一种抗原的染色,此种情况应分别染色,首先染色含量较少的抗原,再显示含量丰富的抗原。该方法要分别制备4种不同的特异性抗体和酶标抗体,费时费力,实际应用受一定限制。
上述两种双重染色,两种酶标抗体的非特异性着色可能迭加,致使背景着色较单独使用时增强,S/N下降,所以各研究室应根据实验目的和条件,合理选择染色方法为宜。简述染色步骤如下:
(1)切片准备同一般间接法。
(2)切片孵育A抗原,特异抗体1~2h室温。
(3)PBS冲洗,孵育HRP标记抗体45min,室温。
(4)PBS冲洗,孵育B抗原的特异抗体1~2h,室温。充分漂洗,孵育ALP标记抗体,45~60min。
(5)PBS冲洗,Baker’液固定5min,室温,PBS洗净。
(6)呈色CN/H2O2/TBS 15min,室温。
(7)Tris—HCl(pH9.0)冲洗后,Fr AS—Mx呈色8min,37℃。
(8)轻度PBS冲洗,1%戊二 醛固定5min。
(9)水洗,轻度复染细胞核,水溶性封固剂封片。
(10)光镜下观察。双重标记细胞呈暗红至深紫色,与单独阳性细胞有明显区别。
三、ICC在细胞功能研究中的应用
形态学研究目的之一是揭示组织细胞结构特征及其功能意义。利用ICC显示给与细胞增殖标记物,是组织细胞学研究中形态和功能相结合的重要手段之一。目前常用的细胞增殖标记物有4种,Brdu (5—bromo—2--deoxyuridine), DNApolymerase α,PCNA (Proliferating cell nuclear antigen),Ki—67 等,相对应的4种单克隆抗体均有商品出售。因组织细胞内无内源性Brdu存在,所以Brdu应用较广。Brdu为胸腺嘧啶的衍生物,可代替胸腺嘧啶在DNA合成期(S期),活体注射或细胞培养加入,而后利用抗Brdu单克隆抗体,ICC染色,显示增殖细胞。同时结合其它细胞标记物,双重染色,可判断增殖细胞的种类,增殖速度,对研究细胞动力学有重要意义。
笔者在观察大鼠小肠上皮细胞增殖、代谢时,一次腹腔注射Brdu(Sigma)4mg/150~200g体重,分别在给药后1h和1、2、3、5、7天取小肠,应用抗Brdu抗体,ICC染色,可见肠上皮细胞从肠腺至绒毛顶端增生移行。在计数免疫活性细胞研究中,一次注射Brdu后,计数瞬间进入S期细胞数或连续多次注射Brdu,计数注射Brdu期间进入S期细胞的总和。另外在临床上,术前或术中给与Brdu,判断脑肿瘤细胞分化程度、恶性度等亦较常用。
掺入双链DNA内的Brdu,以氢链与腺嘌呤结合,不能直接与抗Brdu抗体反应,需经解链使Brdu暴露方能被染色。常用的解链方法为盐酸加热、蛋白酶处理等,使DNA双链部分单链化,抗Brdu小鼠单克隆抗体与增殖细胞核内的Brdu结合,再经酶标抗小鼠IgG抗体孵育、呈色,显示进入S期细胞的情况。
盐酸和蛋白酶处理等可引起其它抗原或组织形态发生变化。为此,Conchoroff(1985)等制备了一种单克隆抗体(Bu—1),其培养液上清能与双链DNA的Brdu反应,因为培养液上清中含有DNA酶,可分解双链DNA,显露Brdu,达到染色目的。笔者采用戊二醛固定后,胃蛋白酶—盐酸处理,亦得到了良好的染色结果。简述染色步骤如下(Matsuna,1989):
(1)冰冻切片/石蜡切片准备同前。
(2)TBS冲洗,Baker’s液固定10min,室温。
(3)TBS冲洗,1%戊二醛固定5~10min,室温。
(4)双蒸水冲洗,0.006%(冰冻切片)或0.02%(石蜡切片)胃蛋白酶/0.01mol/l HCl,37℃,10min。
(5)双蒸水冲洗,4N HCl 30min,室温。
(6)PBS充分冲洗,使切片pH回至中性。
(7)封闭性阻断剂20min,室温。
(8)抗Brdu抗体孵育1~2h室温或4℃过夜。
(9)PBS冲洗,HRP标记抗小鼠IgG抗体45min,室温。
(10)PBS冲洗,DAB/H2O2呈色。
(11)轻度苏木精复染,脱水透明,封片同前。分裂增殖细胞核呈棕褐色。
采用双重或多重染色、观察何种细胞分裂增殖时,首先应染色其它抗原物质,最后显示Brdu。通常在第一种抗体呈色后,再经1%戊二醛固定5~10min,重复上述程序,均可获得较满意的染色结果,分裂细胞核呈棕褐色;显示其它抗原用ALP标记抗体,则细胞浆为红色(FR)或蓝色(FB)。
四、 ICC在原位杂交技术中的应用
传统的ICC法主要用于检测组织细胞中含有何种物质,根据该物质的作用,推测其组织细胞生理、病理意义。但该物质来自何处,是否是阳性细胞合成往往较难判断,结合免疫电镜及双重染色等方法,在某种程度上,有助于推断该物质的来源。然而通常ICC法显示的是组织细胞已经合成的物质(过去时),本身不能说明阳性组织细胞目前的功能状态,亦无法预测细胞将合成何种物质,发挥什么功能,因此,单纯的ICC法存在着被动性。
近年来,ICC法与原位杂交技术结合,使细胞内活性DNA可视化,直接显示某染色体上,何种基因活性化或非活性化,描述组织细胞现在的状态,同时亦可预知未来组织细胞将合成何种物质,发挥哪些功能等,直接观察组织细胞的时空改变,这在病理生理研究中有着重要意义,为形态学研究开辟了令人瞩目的前景。
众所周知,机体内不同的蛋白质发挥其特定的功能,与其氨基酸序列密切相关,而它的氨基酸序列又是DNA通过mRNA转录控制的。因此检测该DAN/mRNA的分布,可判断组织细胞的功能状态。为在组织细胞水平检测DNA/mRNA等一定碱基序列的核酸存在与否,Gall(1969)等建立了原位杂交方法(详见第二十章 )。
在检测某种特定的蛋白质在哪一类细胞内合成时,常常应用连续切片或镜影切片,原位杂交法显示合成该蛋白质的mRNA,ICC法染色其蛋白质抗原,二者存在于同一细胞时,具有较强的说服力。同一切片进行上述双重染色时,原位杂交步骤中,大多数抗原物质的抗原性往往易被破坏,所以最好在ICC染色后再进行原位杂交染色。ICC染色中,抗体内含有RNase等可能破坏细胞内的mRNA,为此应选用精制IgG抗体,并加入500u/ml肝素抑制RNase。肝素系酸性多糖,其化学性质与核酸类似,能够与以核酸为底物的酶(RNase)结合,从而保护mRNA免受破坏。另外,ICC染色以DAB呈色时,核酸探针易吸附于DAB产物上,需注意。
近年随着细胞工程的进步,ICC、原位杂交技术将在细胞生物学、组织学、遗传学、病毒学、临床疾病诊断等各个领域,得到更广泛地应用。
参考文献
1.BigbeeJW,et al . Effects of primary antiserum dilution on staining of antlgen richtissue with the peroxidase antiperoxidase technique. j Histochem Cytochem. 1977;25:433~447
2.BorrsmaDM. Preparation of HRP Iabelled antibodies。In Cuello AC(ed) lmmunohistochemistry, JohnWiley&,Sons, New York :Bris-bane Toronto Singapore, 1983:87~100
3.ConchoroffNJ, et al . A monoclonal antibody reactive with 5—Boromo—2 deoxyuridine thatdoes not requireDNA denaturation。Cytometry,1985;6t506~512
4.CostaM, et al. Immunohistochemical localization of polypeptides in peripheralautononic nerves using whole mount preparation, Histo-chemistry, 1980;65:157~165
5.CummingR. Cyclic nucleotide losses during tissue processing for immunohistochemistry。j HistochemCotychem, 1980j28:54~55
6.GallJG, Paudue M. Formation and detection of RNA—DNa hybrid molecules incytological preparations. Proc Natu Acad Sci USA, 1969:63,378~383
7.GrzannaR, Light microscopic immunocytochemistry with fixed unembedded tissue, InBullock GR&Petrusz P·(eds.)Techniques in immunocytochemistry. London:Academic Press inc, 1982;1:183~204
8.KohlerG, Milstein C. Continuous cultures of fused cells secreting antibody ofpredefined speciflcity, Nature,1975;256:495~497
9.ImagawaM, et al. Characteristic and evaluation of antibody horseradish peroxidaseconjugates prepared by using maleimide compound,glutaraldehyde and periodate. JBiochem, 1982 j 4:41~57
10.Li CY,et al. Use of azide and hydroRen peroxide as an inhibitor for endogenousperoxidase in the immunoperoxidase method , J Histochem Cytochem, 1987;35: 1457~1640
11.Matsuno K, et al. Splenic outer periarterial lymphoid sheath (PALS):An immunoproliferative microen-vironment constituted by antigen laden marginal metallophils and ED3 positivemacrophages in the rat. Cell Tissue Res, 1989;257:459~470
12.NakanePK, Pierce GB. Enzyme labelled antibodies:Preparation and application for thelocalization of antigens。j Histochem Cytochem, 1966;14:929~931
13.NorrdenSV, Polak JM. Immunocytochemistry today techniques and practice, In PolakJM&Norrden SV(eds.) Immunocytdchemistry. London:Wright PSG Bristol, 1983:11~42
14. OiVT, Herzenberg LA. Imrnunoglobulin producing hybrid cell lines. In Mishell BBand Shiigi SM, (eds.) Selected methods in cellular immunology, San Francisco:Freeman WH and Company, 1980:351~375
15. SatoY, et al . The AMeX method. A simplified technique of tissue processing andparaffin embedding with improved preservation of antigens for immunostaining.Am J Pathol, 1986;125:431~435
16.Shi SR,et al . Antigen retrieval in forrnalin fixed,paraffin embedded tissue:An enhancement method forimmunohisotchemical staining based on microwave oven heating of tissue sections。j Histochem Cytochem, 1991;39:741~748
17.SternbergerLA, et al . The unlabelled antibody enzyme method of immunohistochemistry.Preparation and properties of soluble antigen –antigody complex (horseradishperoxidse antihorseradish peroxidase ) and its use in the identificationspirochetes, J Hsitochem Cytochem, 1970;18:315~333
18.Sternberger LA, Immunocytochemistry。New York:John Wiley&Sons, 1979
19.SternbergerLA, Conjugated antibody method. In :Sternberger LA(ed) Immunocytochemistry。3rd edi—tion, New Yor :John Wiley&Sons, 1986
20. VaccaLL. Double bridge technique of immunocytochemistry.In:Bullock GR&Petrusz P. (eds,)Tech. niques in Immunocytochemistry. London:Academic Press inc, 1982;1:155~182
21.Yasuda K, et al. Application of ultrasound for fixation:Combined use with microwave toenhance the effect of chemical fixation. Acta Histochem Cytochem, 1992;25: 237~244
22. ZhouDS, Komuro T. Interstitial cells associated with the deep muscular plexus ofthe guinea—pig small intestine, with special reference to the interstitialcells of Cajal. Cell Tissue Res, 1992;268: 205~216
第五章 免疫金银及铁标记技术
第一节 免疫金技术发展史
早在一个世纪以前,化学家就对胶体金进行了研究,当时只是研究它的结构和金属性质。在1939年Kausche和Ruska把烟草花叶病毒吸附到金颗粒上在电子显微镜下观察见金离子呈高电子密度。然而胶体金技术作为标记物应用于免疫组织化学研究是在1971年,Faulk 和Taylor首先将兔抗沙门氏菌抗血清与胶体金颗粒结合,用直接免疫细胞化学技术检测沙门氏菌的表面抗原。此后,他们还把胶体金与抗胶原血清,植物血凝素,卵白蛋白,人免疫球蛋白轻链、牛血清白蛋白结合应用。1974年Romano和他的同事们将胶体金属标记在马坑人的IgG上,实现了间接免疫金染色法。1974年Bauer等报道凝集素—金复合物的应用。1978年Geoghe-gan等应用免疫金技术检测B淋巴细胞表面抗原。1981年Danscher建立了用银显影液增强光镜下金颗粒可见性的免疫金银染色法(Immunogold—sliver staining, IGSS)。到了1986年Fritz等人在免疫金银法基础上成功地进行了彩色免疫金银染色,使得结果更加鲜艳夺目。胶体金技术逐渐得到完善和成熟,近10年来此项技术得到了迅速发展和广泛应用。应用胶体金为标记物的免疫金染色(IGS)与免疫金银染色(IGSS)方法在光镜和电镜下可以单标记和双标记或多种标记同时观察细胞和组织结构,可以定性,定位以至定量研究。目前它已被应用于医学和生物学研究的众多领域。
第二节 溶胶的基本概念
一、胶体金
即金的水溶液,它也具有一般溶胶的特性。分散体系的分类:体系就是一定空间范围内作为我们研究对象的物质,某一种或几种物质分散到另一种物质中所组成的体系叫做分散体系。被分散相质点的大小而改变,因此,按分散相质点的大小不同,可将分散体系分为三类。
(一)离子分散体系
指分数散相以小分子或离子状态分散着。这种溶液具有高度稳定性,无论放置多久,分散相颗粒都不会因重力而下沉,不会从溶液中分离出来。
(二)胶体分散体系
是指分散相颗粒在1~100nm之间的分散体系叫做胶体分散系。胶体溶液外观透明不浑浊,在普通显微镜下看不见它的分散相粒子,不易受重力影响与分散介质分离沉降,但其中的溶胶粒子有聚结变大的倾向,即具有聚结不稳定性。
(三)粗分散体系
分散相颗粒是由许多分子组成,因粒子较大,用肉眼或显微镜即可看见,不稳定,极易因重力而自动沉降,外观浑浊不透明。
二、胶体金的一般性状
(一)胶体金的颜色
溶胶的颜色决定于分散相物质的颜色、分散相物质的散度和入射光线和种类,是散射光还是透射光,粒子越小,分散度越高,则散射光的波长越短,对同一种物质的水溶胶来说,粒子大小不同,颜色亦不同,胶体金颗粒在5~20nm之间,吸收波长520nm,呈葡萄酒红色,20~40·nm之间吸收波长530nm,液体为深红色,60nm的金溶液主要吸收波长600nm,金溶液呈兰紫色,若离心去掉较大的金颗粒,溶胶呈红色。
(二)胶体金的稳定性
溶胶的稳定性介于小分子离子溶液和粗分散系之间,溶胶的颗粒作布朗运动,不易受重力影响下沉。然而溶胶又是不稳定体系,它的胶粒溶剂化作用很弱,总表面积较大,当胶粒相互碰撞时,有自动合并为较大、较重的颗粒倾向。胶体颗粒变大以致超出胶体范围而从介质中沉淀出来的现象叫聚沉。影响溶胶稳定性的主要原因有三点:①胶粒间的相互吸引力。当胶粒相距很近时,这种吸引力可能导致胶粒合并变大。②胶粒及其溶剂化层(溶剂是水就是水化层)的带电情况。一种溶胶的各个胶粒都带有相同的电荷。同性电荷相斥,双电层愈厚,胶粒带电量愈大,排斥力愈大,愈能阻止胶粒合并聚结,溶胶愈稳定。③胶体界面的溶剂膜,当二固体间夹有一厚层液体时,这层液体膜有一个反抗二固体接近的排斥力。两个胶粒要进一步接近,只有克服它们之间的溶剂化膜的斥力才有可能,因此溶剂膜的斥力是使溶胶稳定的原因之一。
(三)溶胶的聚沉现象
胶粒之间存在吸引力与排斥力这对矛盾,在溶胶颗粒带电及溶剂化的情况下,排斥力成为矛盾的主要方面,溶胶稳定而不聚沉。因为某种原因使溶胶颗粒带电量减到很小甚至中和;其所带电荷并能去溶剂化膜,胶粒之间可在更近的距离互相接近,引力成为主要矛盾,引力超过斥力时胶粒便聚结发生聚沉。引起溶胶聚沉的原因有:
1.少量电介质对溶胶的聚沉作用 少量电介质即可使溶胶聚沉,但各种电介质的聚沉能力可用聚沉值来表示,聚沉值愈小,聚沉能力愈大,聚沉值从实验中得出如下的离子价规则:①电介质负离子对带正电的溶胶起主要聚沉作用,正离子对带负电的溶胶起主要聚沉作用。②同价离子聚沉能力几乎相等,不同价离子的聚沉能力随离子价的增加而显著增加。电介质为什么能使溶胶聚沉呢?这是由于电介质与胶粒带相反电荷的离子的作用,中和了胶粒所带的一部分电荷,使胶粒电荷量减少,扩散层缩小,溶剂化层变薄,而当双电层厚度缩至很小的溶剂化层变得很薄时,两个胶粒间便可以更加接近即不产生斥力,两个胶粒间因引力加大而合并的趋势增强,甚至引力占绝对优势以致使胶粒聚结而发生聚沉。胶粒的双电层结构见图5-1。

图5-1胶粒的双电层结构示意图
2.温度对溶胶稳定性的影响 一般影响不大,当温度升高时,吸附能力减弱,溶剂化程度降低,溶剂化层变薄,胶粒聚结,不稳定性增加。
3.浓度对溶胶的稳定性的影响浓度增大时,粒子间距离缩小,引力增加,容易聚结而发生聚沉,所以制备比较稳定的溶胶,要有一定的合适浓度。
第三节 胶体金的制备方法
胶体金溶液的制备有许多种方法,其中最常用的是化学还原法,基本的原理是向一定浓度的金溶液内加入一定量的还原剂使金离子变成金原子。目前常用的还原剂有:白磷、乙醇、过氧化氢、硼氢化钠、抗坏血酸、枸橼酸钠、鞣酸等,下面分别介绍制备不同大小颗粒的胶体金溶液。
一、制备胶体金的准备
(一)玻璃器皿的清洁
制备胶体金的成功与失败除试剂因素以外玻璃器皿清洁是非常关键的一步。如果玻璃器皿内不干净或者有灰尘落入就会干扰胶体金颗粒的生成,形成的颗粒大小不一,颜色微红、无色或混浊不透明。我们的经验是制备胶体金的所有玻璃器皿先用自来水把玻璃器皿上的灰尘流水冲洗干净,加入清洁液(重铬酸钾1000g,加入浓硫酸2500ml,加蒸馏水至10000ml)浸泡24h,自来水洗净清洁液,然后每个玻璃器皿用洗洁剂洗3~4次,自来水冲洗掉洗洁剂,用蒸馏水洗3~4次,再用双蒸水把每个器皿洗3~4次,烤箱干燥后备用。通过此方法的处理玻璃器皿不需要硅化处理,而直接制备胶体金。也可用已经制备的胶体金溶液,用同等大不颗粒的金溶液去包被所用的玻璃器皿的表面,然后弃去,再用双蒸水洗净,即可使用,这样效果更好,因为减少了金颗粒的吸附作用。
(二)试剂的配制要求
(1)所有配制试剂的容器均按以上要求酸处理洗净,配制试剂用双蒸馏水或三蒸馏水。
(2)氯化金(HauCl4水溶液的配制:将lg的氯化金一次溶解于双蒸水中配成1%的水溶液。放在4”c冰箱内保存长达几个月至1年左右,仍保持稳定。
(3)白磷或黄磷乙醚溶液的配制:白磷在空气中易燃烧,要格外小心操作。把白磷在双蒸水中切成小块,放在滤纸上吸于水份后,迅速放入已准备好的乙醚中去,轻轻摇动,等完全溶解后即得饱和溶液。储藏于棕色密闭瓶内,放在阴凉处保存。
二、制备胶体金的方法和步骤
(一)白磷还原法
1.白磷还原法(zSigmondy 1905年)
(1)取1%的HAuCl4水溶液1ml,加双蒸水99ml配成0.01%的HAuCl4水溶液。
(2)用0.2mol/lK2CO3调pH至7.2。
(3)加热煮沸腾,迅速加入0.5ml20%白磷的饱和乙醚溶液,振荡数分钟至溶液呈现橙红色时即成。胶体金的颗粒直径为3nm左右,大小较均匀。
2.白磷还原法(zSigmondy 1905及z Sigmondy Thiessen 1925)
(1)取0.6%的HAuCl4水溶液2.5ml,加双蒸水120ml 。
(2)用0.2mol/lK2CO3,调pH至中性。
(3)加入1/5饱和度的白磷乙醚溶液1ml(1份白磷4份乙醚),在室温振荡约15min ,溶液呈红褐色,再加热至典型的葡萄酒红色,加热可使乙醚蒸发,胶体金液体内过量的白磷通入空气后被氧化,此方法获得胶体金颗粒的直径在5~12nm之间。
3.白磷还原法的改良法(Henegouwen1986)
(1)取20%饱和度白磷乙醚溶液0.5ml,加双蒸水60ml 。
(2)用1%的HAuCl4水溶液0.75ml,加0.1mol/l K2CO30.6ml, 振荡变成棕红色。
(3)加热煮沸,至溶液变成透明红色。
使用上述方法增加还原次数使金颗粒直径不断增大,二者之间的关系见表5-1。
表5-1 胶体金颗粒大小与还原次数之间的关系
| 还原次数 | 颗粒直径(nm) | 正负误差 |
| 1 | 5.6 | 0.9 |
| 2 | 6.7 | 0.9 |
| 3 | 7.9 | 0.9 |
| 4 | 9.8 | 1.3 |
| 5 | 12 | 1.0 |
此方法主要优点是简化了制备不同大小的颗粒胶体金的手续和其它试剂的配制,经济、操作简单。另外,在多次还原过程中氯化金不再形成新的金颗粒,只是在原先金粒子基础上使它的直径变大。第一次金颗粒起着“晶核”的作用。由于这一特点,制备的金颗粒相对均匀一致。
(二)抗体血酸还原法(Stathis and Fabrikanos 1958)
(1)将在4℃预冷的1%HAuCl4水溶液1ml,0.2mol/l K2CO31.5ml、双蒸水25ml混匀。
(2)在搅拌下加入1ml0.7%抗坏血酸水溶液,立即呈现紫红色。
(3)加双蒸水至100ml,加热至溶液变为透明红色为止。胶体金颗粒直径为8~13nm。
(三)柠檬酸三钠还原法(Frens 1973)
此方法是由Frens在1973年创立的,制备程序很简单,胶体金的颗粒大小较一致,广为采用。该法一般先将0.01%的HAuCl4溶液加热至沸腾,迅速加入一定量1%柠檬酸三钠水溶液,开始有些蓝色,然后浅蓝、蓝色,再加热出现红色,煮沸7~10min出现透明的橙红色。各种颗粒的胶体金制备详见表5-2。
表5-2 柠檬酸三钠用量与胶体金颗粒直径的关系
| 0.01%的HAuCl4(ml) | 1%柠檬酸三钠(ml) | 直径(ml) |
| 100 | 5.0 | 10.0 |
| 100 | 4.0 | 15.0 |
| 100 | 1.5 | 25.0 |
| 100 | 1.0 | 50.0 |
| 100 | 0.75 | 60.0 |
| 100 | 0.60 | 70.0 |
| 100 | 0.42 | 98.0 |
| 100 | 0.32 | 147.0 |
| 100 | 0.25 | 160 |
按照Frens法还可以制备出其它不同颗粒大小的胶体金出来。许多研究证明用该法制备胶体金时金颗粒的大小是柠檬酸三钠用量的函数,基本的规律是柠檬酸三钠用量多,胶体金颗粒直径小,柠檬酸三钠用量越少,腔体金颗粒直径越大。
(四)鞣酸—柠檬酸三钠还原法(Slot与Gueeze1985年)
该法是以1982年Muhlpfordt法为基础,1985年Slot与Geuze对该法进行了改良,特点是通过改变鞣酸的用量制备出多种颗粒直径的胶体金,而且颗粒的直径均匀一致,很适合于双标及多标研究。制备3nm、5nm、10nm、15nm的胶体金颗粒见表5-3。
表5-3 鞣酸—柠檬酸三钠还原法
| A 液 | B 液 | |||||
| 直径(nm) | 1%柠檬酸钠(ml) | 0.1mol/L K2CO3ml | 1%鞣酸(ml) | H2O(ml) | 1%HAuCl4(ml) | H2O(ml) |
| 3.3 | 4 | 0.2 | 4 | 11.8 | 1 | 79 |
| 5 | 4 | 0.2 | 0.7 | 15.1 | 1 | 79 |
| 10 | 4 | 0.025 | 0.1 | 15.875 | 1 | 79 |
| 15 | 4 | 0.0025 | 0.01 | 15.987 | 1 | 79 |
操作步骤:
(1)根据所需要的胶体金颗粒分别配制A液和B液。
(2)将配制好的A、B两液在水浴内加热到60℃,并通过控温装置使温度保持稳定。
(3)在电磁搅拌器上搅拌A液迅速加入B液,继续加热直至胶体金变成葡萄酒色,时间大约7~10min。在A、B两液混合后可见溶液立即变成蓝色,大约1~3min就变成红色。
用鞣酸—柠檬酸三钠还原法,柠檬酸三钠主要为还原剂,而鞣酸则有双重作用,一是还原作用,二是保护作用,控制“晶核”的形成过程,也就是说鞣酸的用量多少决定胶体金颗粒的大小形成,因此改变鞣酸的用量就可以改变胶体金的颗粒大小,达到制备不同直径颗粒的胶体金之目的。
(五)乙醇超声波还原法(Baigent and Muller 1980)
(1)1%HAuCl4水溶浓0.2ml加入100ml双蒸水。
(2)用0.2molK2CO3调pH至中性,再加入1ml乙醇。
(3)用20KC、125w超声波探头浸入溶液内进行超声振荡,由此法制得的胶体金颗粒为6~10nm。
(六)硼氢化钠还原法(Tschopp et al 1982)
(1)将预冷在4℃的40ml双蒸水中加入0.6ml 1%的HAuCl4。
(2)再加入0.2molK2CO3,0.2ml。
(3)在搅拌下,迅速加入新鲜配制的硼氢化钠水溶液(0.5mg/ml)0.4ml,一般重复加入3~5次,直至溶液的兰紫色变为橙红色为至。然后再搅拌5min,获得的金颗粒直径在2~5nm之间。
(七)放射性胶体金的制备方法(Kent and Allen 1981)
(1)取0.01%HAuCl4上水溶液100ml,加热至沸腾。
(2)加入40μl195Au。
(3)迅速加入4ml1%柠檬酸三钠水溶液,5~7min出现透明的橙红色。
(4)其含量为I×106脉冲数/min。
(八)微波制备液体金方法。
第四节 胶体金的质量鉴定
胶体金制备完毕后须经电镜下质量鉴定才能应用。
一、胶体金颗粒直径测定
用预先处理好的覆有Formvar膜的镍网浸入胶体金溶液内,取现放在空气中干燥或37℃烤箱烤干。然后在透射电镜下观察,主要观察金颗粒的大小,符合不符合所需要的颗粒直径,金颗粒是否均匀一致,有无椭圆形及多角形金颗粒存在。理想的金颗粒是大小基本相等,均匀一致,无椭圆形及多角形的金颗粒存在,还可以拍片放大后测量金颗粒直径的大小。
二、胶体金金颗粒均匀度测定
一般需测量100个以上的胶体金颗粒,然后用统计学处理,计算胶体金颗粒的平均直径及标准差,前者反映颗粒的大小,后者说明颗粒是否均匀一致。
三、影响胶体金颗粒大小的因素
如果有较多的大小不等的金颗粒及有椭圆形,三角形金颗粒存在应重新制备。一般造成这种情况的主要原因是在加还原剂的时候不是迅速一次加入,而是多次加入。再者搅拌不均匀,速度太慢没有搅拌起来,造成了颗粒大小不等。制备量的多少,容器的大小,加热的时间等也影响胶体金颗粒的大小。制备了合格的胶体金以后,放在室温或4℃保存。避免低温冻存,因为冻存可导致胶体金凝集,破坏了胶体状态。胶体金在室温避光无灰尘的环境中可放置3个月左右。冰箱内半年左右。根据胶体金的性质,有不稳定和聚沉的可能性,因此,制备完毕后最好在20天以内进行标记。
第五节 胶体金标记物的制备
胶体金标记蛋白质的原理,一般认为是由于pH值等于或稍偏碱于蛋白质等电点时,蛋白质呈电中性,此时蛋白质分子与胶体金颗粒相互间的静电作用较小,但蛋白质分子的表面张力却最大,处于一种微弱的水化状态,较易吸附于金颗粒的表面,由于蛋白质分子牢固地结合在金颗粒的表面,形成一个蛋白层,阻止了胶体金颗粒的相互接触,而使胶体金处于稳定状态,如果=低于蛋白质的等电点时,蛋白质带正电荷,胶体金带负电荷,二者极易静电结合形成大的聚合物。如果pH高于蛋白质等电点时,蛋白质带负电荷,与金颗粒的负电荷相互排斥而不能互相结合。为防止蛋白质与胶体金的聚合与沉淀,常用牛血清白蛋白,卵白蛋白,聚乙二醇或明胶作稳定剂。用Sephacryb S—400 (丙烯葡聚糖S—400)层析分离纯化胶体金蛋白标记物只适用于以BSA作稳定剂者。
一、待标记蛋白质的准备
(1)透析除盐:蛋白质溶液内应除去多余的电解质,不然过高的盐类物质会降低胶体金颗粒的Zeta电位,影响蛋白质的吸附,因此,标记之前必须彻底除盐。一般将蛋白质置入透析袋中然后直接放入双蒸水或极低浓度的盐水(0.005mol/l NaCl , pH7.0)透析。
(2)去除蛋白质中的沉淀:长期低温保存的蛋白质或4℃较长时间保存的抗体,特别是在浓度高于2mg/ml的情况下,很容易形成聚合物,聚合物对标记过程及免疫金探针的稳定性有一定影响,因此,标记之前须离心以除去这些聚合物。一般以100000r/min 4℃离心60min取上清液,调整蛋白质浓度至1mg./ml即可用于标记。
二、胶体金pH值的调整
胶体金与蛋白质的结合成功与否,取决于pH值,一般只有在蛋白质等电点(PI)略偏碱的条件下二者才能牢固地结合,因此,标记之前须将胶体金溶液的pH值调至待标记蛋白质的等电点略偏碱。需要提高胶体金的pH值时可用0.1molK2CO3,需要降低胶体金的pH值时可用0.1n HCl。测定金溶液的pH可能损害pH测定计的探头,因此,一般用精密的pH试纸测定其pH即可。
几种常用的蛋白质标记时胶体金所用的pH值见表5-4。
表5-4 常用几种蛋白质标记时胶体金所用的pH值如下
| 蛋白质 | pH |
| 抗体(γ球蛋白) | 9.0 |
| 亲合层析的IgG | 7.6 |
| 单克隆抗体 | 8.2 |
| F(ab')2 | 7.2 |
| SPA(葡萄球菌蛋白) | 6.0 |
| 蓖麻子植物凝血素Ⅰ | 8.0 |
| 蓖麻子植物凝血素Ⅱ | 8.0 |
| 花生凝集素 | 6.3 |
| Helix pomatia lectin | 7.4 |
| 大豆凝集素 | 6.1 |
| Lens Culinaris lectin | 6.9 |
| Lotus Tetragonolobus lectin | 6.3 |
| 荆豆凝集素 | 6.3 |
| Bandeirae simplicifolia lectin | 6.2 |
| 过氧化物酶 | 8.0 |
| 类卵粘蛋白 | 4.8 |
| 血浆铜兰蛋白 | 7.0 |
| α-胎球蛋白 | 6.5 |
| 小牛血清白蛋白 | 6.5 |
| 牛血清白蛋白 | 5.5 |
| 牛血球白蛋白结合肽 | 4.5 |
| 牛血清白蛋白结合胰岛素 | 5.3 |
| 霍乱毒素 | 6.9 |
| 破伤风毒素 | 6.9 |
| DNAase | 6.0 |
| RNAase | 9.0 |
| 低密度脂蛋白 | 5.5 |
| α2-巨球蛋白 | 6.0 |
| 抗生物素蛋白(亲合素) | 10.0 |
| 链霉抗生物素蛋白 | 6.6 |
| 麦胚凝集素 | 9.9 |
三、待标记蛋白质最适稳定量的测定
(1)光电比色法:制备一系列不同浓度的等体积蛋白质溶液(1ml),分别加入5ml胶体金中,迅速混匀,然后,各加入1ml 10% NaCl溶液,摇匀,静置5min后测各管。根据胶体金颗粒的大小,OD在520~580nm之间测定,以OD值为纵坐标,蛋白质用量为横坐标作一曲线,取曲线最先与横轴相接近的那一点处的蛋白质用量为最适稳定量。图5.2中10nm的胶体金溶液中蛋白质的最适稳定量为45μg/ml。

图5-2 蛋白最适稳定量示意图
(2)目测法:以目测法确定胶体金与待标记蛋白质用量比例,将标记的蛋白质逐级稀释后(由5μg~45μg另设对照管),各取等体积顺序加入一系列装有1ml胶体金的试管中,5min后,在上述各管内分别加入0.1ml 10%氯化钠,依表5-5顺序进行。
表5-5 具体的做法是按表内进行
| 管数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 胶体金(ml) | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 蛋白质(μg) | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | |
| 10%NaCl(ml) | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
①当分别加入0.1ml 10%氯化钠后、混匀静置2h以上观察结果。
②没有加入蛋白质的管为对照管。
③小于5nm颗粒的胶体金溶液,每个管内应加入5μl33%的双氧水,否则有不变蓝色及聚沉现象。未加蛋白及加入蛋白量不足以稳定胶体金的试管,即呈现由红变蓝的聚沉现象,而加入蛋白量达到或超过最低稳定量的试管则胶体金的红颜色不变。其中含蛋白量最低的试管即含稳定1ml胶体金的必须蛋白量。在此基础上再加上20%即为稳定所需蛋白质的实际用量。
四、蛋白质的胶体金标记
当蛋白质的最适稳定量及标记的最佳pH值被确定以后便可进行标记。具体步骤如下:
(1)根据用以标记的胶体金的总量计算出所需要的待标记蛋白质的总量。
(2)在电磁搅拌下,将蛋白质溶液加入胶体金溶液中(pH已调至PI超过0.5pH),加入蛋白质时应逐滴加入,1mg的蛋白质大约5min加完。
(3)在磁性搅拌下加入5%的牛血清白蛋白(BSA)使其终浓度为1%,或加入3%聚乙二醇(PEg MW20000)使其终浓度为0.05%, 我们对比了BSA和PEG稳定胶体金的效果,BSA稳定的标记胶体金,放在4℃达2年半仍然保持良好性能,而用PEG稳定的标记胶体金放在4℃1年左右就有分层现象,而且染色效果显著下降。因此,我们认为最好还是用BSA作稳定剂。
(4)将标记好的胶体金装入透析袋中,两头扎紧,放入蔗糖或硅胶中浓缩,浓缩到原体积的1/10量,浓缩完毕后纯化。离心法纯化时,不要浓缩。
五、胶体金标记蛋白质的纯化
标记好的免疫金探针必须经过纯化处理以后才能用于免疫细胞化学染色。纯化的目的是除去其中未标记的蛋白质,未充分标记的胶体金以及在标记过程中可能形成的各种聚合物。
(一)调整与超速离心法
(1)将标记的大于10nm的胶体金溶液选用15000r/min 4℃离心15min,吸出上清,弃去沉淀,以去除大的聚合物。
(2)一般在10nm以上所标记的胶体金均可在调整离心机上离心,小于10nm颗粒的胶体金用超速离心机离心,在4℃离心1h左右,弃上清,将沉淀以原体积的0.02mol./l TBSpH8.2(内含1%BSA,0.05%叠氮钠)溶解,重复离心2~3次,沉淀溶于原体积的1/10TBS中。4℃保存备用。为了得到颗粒均匀一致的免疫金试剂,上述粗提制剂可用10%~30%蔗糖或甘油溶液作密度梯度离心,分带收集不同大小颗粒的胶体金标记蛋白制剂。
几种免疫金探针离心所用转速(见表5-6),离心纯化时所用转速见表5-7,胶体金的OD值见表5-8。
表5-6 几种免疫金探针离心时所用转速参考表
| 胶体金颗粒直径(nm) | 蛋白质 | 时间(min) | 转速(r) |
| 3.0 | GAR IgG | 60 | 30000 |
| 5.0 | GAR IgG | 50 | 25000 |
| 10.0 | RAM IgG | 50 | 19000 |
| 15.0 | SPA | 40 | 17000 |
| 15.0 | ALcc IgG | 40 | 17000 |
| 20.0 | SPA | 40 | 13000 |
| 25.0 | SPA | 35 | 12000 |
说明:GAR IgG=羊抗兔IgG;RAm IgG=兔抗鼠IgG;ALcc IgG=抗肝细胞癌IgG; SPA=葡萄球菌A蛋白
表5-7 几种免疫金探针离心纯化时所用转速
| 胶体金颗粒(nm) | pH | 蛋白质 | 转速(xg) | 时间(min) |
| 5 | 9.0 | 羊抗人IgG | 45000 | 45 |
| 10 | 8.2 | 抗胃癌单克隆抗体 | 45000 | 30 |
| 15 | 6.5 | 链霉亲和素 | 12000 | 45 |
| 20 | 6.0 | SPA | 12000 | 30 |
将纯化好的胶体金用0.02mol/l TBS缓冲液作1:20稀释,用520nm测OD值。
表5-8 不同大小胶体金的OD值
| 胶体金颗粒大小(nm) | OD(520)nm |
| 5 | 2.5 |
| 10 | 2.5 |
| 15 | 3.5 |
| 20 | 5.0 |
(二)凝胶过滤法
为纯化免疫金探针的最好方法,其特点是简便,过滤的胶体金颗粒比较均匀,不容易凝集,而离心方法转速高,时间长,胶体金颗粒沉淀容易凝集,用凝胶过滤克服了这一弱点。选用本方法时胶体金溶液必须用牛血清白蛋白作稳定剂。具体操作过程如下:
(1)将浓缩好的胶体金以1500r/min离心去掉大的聚合物。吸出上清待过柱。
(2)柱高34cm,直径1cm,加样体积为柱床体积的1/10。
(3)丙烯葡聚糖S-400(Sephacryls—400, Pharmacia, Sweden)装柱后用0.02mol/lpH8.2TBS平衡层析柱(pH7.4者用于标记的SPA),平衡好后,吸取上清胶体金液体加入层析柱内,加样时请注意不要破坏S—400的界面。
(4)用0.02mol/lpH8.2 TBS洗脱,先行滤出的液体有少量微黄不透亮的液体,紧接着是浓度高红色而透亮的胶体金,注意颜色的变化,如红色变淡,变黄立刻停止收集。如Sephacryls—400没有,也可以用Sepharose –4B或6B代替(Pharmacia,Sweden)也能收到较好的效果。
六、免疫金探针的鉴定
(1)用有Formvar 膜的镍网沾取金标蛋白溶液,空气中干燥后醋酸铀复染,在TEM下观察,可见金颗粒周围有一明显的空晕,表示颗粒表面吸附有蛋白质分子。
(2)纯化后免疫金探针是否保持很好的生物学活性是判断其质量好坏的主要指标,因此,在使用之前必须对它的特异性,敏感性进行鉴定。鉴定举例,用阳性抗原片,脱蜡至水,胰蛋白酶消化,加第一抗体(多克隆或单克隆),一般过夜再加标记抗同一抗特异性抗体结合的胶体金溶液(多克隆或单克隆抗体标记的胶体金)详细方法步骤见后IgGS法,一般做1:2,1:4,1:8,1:16,稀释SPA-金,做1:10,1:20,1:40,1:80稀释,37℃45min,冲洗,显色,观察结果,染色效价以阳性结果明确,背景浅的稀释度为标准。免疫细胞化学染色试验可以较全面地反应免疫金探针的质量。
第六节 免疫胶体金银细胞化学染色的固定剂选择
免疫胶体金银染色和其它免疫细胞化学方法一样,要想得到好的染色效果,关键取决于标本处理是否合适,只有使抗原性及组织结构保存的好,才能使以后的染色成功成为可能,其次要用高特异性和高效价的一抗,选择合适的稀释度。由于免疫组化方法广泛应用于不同的生物学科,所要检出的抗原种类繁多,性质也各不相同。因此,不可能有一种适用于所有抗原的固定剂,而是根据不同的抗原性质区别对待。根据我们使用的固定剂介绍如下,供参考。
一、固定剂的选择及固定时间(详见表5-9)
(1)Karovsky's 液pH7.3。
(2)PAP液(Periodate—lysine – paraformaldehyde fixative)
配制见附录一。
表5-9 各种抗原固定剂的选择及固定时间
| 待检抗原 | 固定剂的种类 | 固定时间 |
| 蛋白质 | ||
| 酶 | 冰冻切片不固定,或用95%乙醇,B5固定液 | 10 min |
| 激素 | 冰冻切片,涂片,印片,不固定或丙酮,甲 | 10 min |
| 醇,乙醇,PEG固定,B5固定液固定 | 4℃30 min | |
| 免疫球蛋白 | 中性福尔马林,四氯化碳(1%甲醛) | 30 min |
| 白蛋白 | 95%乙醇含1~5%冰醋酸 | 30 min |
| 纤维蛋白元 | 同上 | 30 min |
| 病毒 | 丙酮,100%乙醇,甲醇,乙醚 | 30 min |
| 糖蛋白 | PLP,丙酮 | 30 min |
| 脂质Forssman | 中性福尔马林 | 20 min |
| 抗原 | 2.5%硫代硫酸钠,冰冻切片不固定 | 20 min |
| 免疫电镜 | PLP,戊二醛,戊二醛—多聚甲醛(Kacnovsky’s 液pH7.3)PEG、ECD-G等 | 30min |
二、切片的处理与粘附。
免疫组化染色过程较长,洗的次数很多,而且均在振荡洗涤,抗原片附贴不紧,往往在最后的时刻,还没有等显色就会脱落导致前功尽弃,这个环节 虽小却会影响大局,因此,为了保证切片染色成功必须把切片处理好,解除掉片的后顾之忧(方法见第一章 )。
第七节 光镜免疫金银细胞化学方法
一、免疫金染色
(一)免疫金法(IGS)
1987年,Geoghegan等首次应用免疫金探针检测B淋巴细胞表面抗原,建立了用于光镜水平的免疫金法(Immunogold staining, IGS)。IGS的特点是染色程序简便,不要显色,就能检测细胞表面的抗原,又能检测细胞内抗原。染色时免疫金法一般要求金颗粒的直径大于20nm,并且用的浓度较高。用IGS定位细胞抗原时一般都采用间接法,下面以人肝组织HBsAg的定位为例说明IGS的步骤:
(1)石蜡切片→脱蜡至水。
(2)0.1%胰蛋白酶消化10min或3mon/L尿素消化30min。
(3)用双蒸水振洗5'×2。
(4)用0.02mol/l TBS pH8.2振洗10'×2。
(5)1%卵蛋白(EA)封闭10min。
(6)稀释鼠抗HBsAg单克隆抗体(用0.02mol/l TBS pH8.2 作1:100稀释),4℃过夜。
(7)0.02mol/l TBS pH8.2振洗10'×2。
(8)1%EA封闭10min。
(9)0.02mol/l TBS pH8.2 稀释兔抗鼠金标抗体(1:8)37℃45min。
(10)0.02mol/l TBS pH8.2振洗10'×2。
(11)双蒸水振洗5'×2。
(12)1%戊二醛,10min。
(13)双蒸水5min 。
(14)用苏木素衬染核1min,甘油封片。
结果:在光镜下可见部分肝细胞浆内有金颗粒聚集呈红色,沿细胞膜分布,表明有HBsAg定位在细胞浆内。
(二)蛋白A-金(PAG)放大法
为了得到更明确的染色结果,在用IGS方法定位细胞抗原时可采用搭桥法,使IGS得到放大,这里介绍一种用抗A蛋白抗体作桥的PAG放大法。下面以5-羟色胺定位为例说明这一新方法。
(1)石蜡切片→脱蜡至水。
(2)1%胰蛋白酶消化10min或3mon/L尿素消化30min。
(3)0.05mol/l pH7.4 TBS振洗5'×2。
(4)1%EA封闭组织10min。
(5)用0.05mol/l pH7.4 TBS 稀释兔抗5-羟色胺抗体(1:1000)4℃过夜,或者37℃1h。
(6)0.05mol/l pH7.4 TBS振洗5'×2。
(7)1%EA封闭10min。
(8)用0.05mol/l pH7.4 TBS 稀释PAG(1:40),37℃1h。
(9)0.05mol/l pH7.4 TBS振洗10'×2。
(10)1%EA封闭10min。
(11)抗A蛋白抗体(1:100)37℃。45min。
(12)0.05mol/l pH7.4 TBS振洗10'×2。
(13)加0.05mol/l pH7.4 TBS稀释PAG(1:40),37℃45min。
(14)0.05mol/l pH7.4 TBS振洗10'×2。
(15)双蒸水振洗5min。
(16)1%戊二醛10min。
(17)双蒸水振洗5min。
(18)0.01%伊文思蓝2min,甘油封片。
光镜下观察,小肠粘膜内含有嗜银颗粒的细胞胞浆呈红色,阳性颗粒位于细胞核底部,比单纯用PAG染色深度得到加深,阳性结果得到放大。由于抗A蛋白抗体既能通过Fab段又能够通过Fc段与PAG上的A蛋白结合,因此,与其它桥抗体相比它能够在抗原位点处聚集更多的胶体金颗粒。基本原理如下图5-3。

图5-3 PAG放大法原理
PAG放大法的优点:①使用试剂单一;②可大大提高IGS的敏感性,从而使应用IGS方法定位抗原时使用高稀释度的抗体成为可能;③背景干净。可以预见这一新方法将很快受到人们的关注。
二、免疫金银法
1983年,Holgate等人将IGS与银显影方法相结合创立了免疫金银法(Immunogold—sliver staining, IGSS)IGSS的基本原理是通过免疫反应沉积在抗原位置的胶体金颗粒起着一种催化剂作用,用对苯二酚还原剂将银离子(Ag+)还原成银原子(Ago)。被还原的银原子于是围绕金颗粒形成一个“银壳”,“银壳”一旦形成本身亦具有催化作用,从而使更多银离子还原并促使“银壳”越长越大“,最终抗原位置得到清楚放大。请参见图5-4。

图5-4 用银增敏示意图
(一)石蜡切片的IGSS染色
以人肝细胞内HBsAg定位举例说明。
(1)切片常规脱蜡至水。
(2)Lugol's液,5min.
(3)5%硫代硫酸钠水溶液脱碘5min。
(4)用双蒸馏水冲洗干净。
(5)0.05mol/l pH7.4 TBS洗5min两次。
(6)用0.1%胰蛋白酶消化10min或用3mol/L尿素消化20min。
(7)0.05mol/l pH7.4 TBS洗5min一次。
(8)1%卵白蛋白封闭15min。
(9)马抗HBsAg抗体1:1000稀释,37℃1~2h 或4℃过夜。
(10)0.05mol/l pH7.4 TBS洗5min两次。
(11)1%卵白蛋白封闭10min。
(12)1:40,PAG,37℃45min。
(13)0.05mol/l pH7.4 TBS洗5min两次。
(14)双蒸水洗5min,两次。
(15)物理显影见后所述。
(16)双蒸水洗5min,两次。
(17)苏木素衬染。
(18)酒精常规脱水,透明,封固。
结果,光镜下见肝细胞胞浆内有膜或包涵体形分布的阳性黑色状颗粒,背景干净。
(二)冰冻切片的IGSS染色
作冰冻切片的组织,若在动物试验可以先经过固定液灌注或浸泡固定,也可不固定先做冰冻切片。人的组织也可通过浸泡固定或不固定,这主要根据保存抗原性的需要而定。固定过的组织可用20%蔗糖PBS(0.01mol/l pH7.2)浸泡2~4h或在切片时用OCT包埋,以减少冰冻切片过程中冰晶的形成。如果切片还准备用于电镜包埋,则可经过5%,10%,20%浓度逐级递增的蔗糖溶液。在冰冻切片前,可先入氟里昂–22 (Freon--22)骤冷,这样可使组织的结构保存更好,适用于电镜观察。
(1)冰冻切片。
(2)Lugol's液,5min.
以下步骤同人肝HBsAg的染色方法。
(三)半薄切片的IGSS染色
IGSS染色的半薄切片,可以在光镜下直接观察阳性结果,为电镱取阳性部位及观察打下良好的基础。环氧树脂会妨碍免疫组化染色。经过饿酸处理后固定的组织同样也会影响抗原抗体反应,因此,半薄切片作IGSS染色剂,应作以下处理。
(1)脱环氧树脂,切片以NaOH的无水乙醇饱和溶液浸泡30~60min,然后以无水乙醇洗5min,两次,再以95%,80%,70%酒精各洗5min,然后入水。
(2)经饿酸固定过的切片入1%过碘酸10min(0.5μm厚,时间可随切片厚薄增减)除去饿酸,然后蒸馏水洗5min,4次。
(3)切片用0.05mol/l TBS,pH7.4洗10min。
(4)按石蜡切片第二步往下进行。
三、彩色免疫金银法(CIGSS)
彩色免疫金银法(coloured IGSS简称CIGSS)是在IGSS基础上发展起来的一种新方法。其基本原理与彩色显影相似。IGSS方法染色在抗原位点处生成银颗粒经铁氰化钾与溴化钾的作用即被氧化成溴化银,后者与彩色显影剂相接触立即被还原成金属银,而彩色显影剂本身则被氧化,其氧化产物使彩色成色剂由无色变成有色的染料并沉积在银颗粒的部位,金属银变成了银离子。由于染料只能通过彩色显影剂沉积在有银的部位,所以不与组织发生非特异性吸附。
以彩色显影人肝组织内HBsAg的操作过程为例:
(1)脱蜡至水。
(2)0.1%胰蛋白酶37℃10min。
(3)Lugol's,碘液5min。
(4)5%硫代硫酸钠1min。
(5)用0.05mol/l pH7.4 TBS振洗5min,两次。
(6)1%卵白蛋白封闭10min。
(7)马抗HBsAg抗体1:1000稀释,37℃1~2h 或4℃过夜。
(8)0.05mol/l pH7.4 TBS振洗5min,两次。
(9)1%卵白蛋白封闭10min。
(10)PAg 1:40,37℃45min。
(11)0.05mol/l pH7.4 TBS振洗5min,两次。
(12)双蒸水洗5min,两次。
(13)物理显影(见P116页物理显影配方)。
(14)自来水冲洗。
(15)双蒸水洗5min,两次。
(16)2%铁氰化钾和1%溴化钾,1min。
(17)双蒸水冲洗。
(18)彩色显影(α-萘酚或菲尼酮)2min。
(19)双蒸水冲洗。
(20)2%铁氰化钾和1%溴化钾,1min。
(21)2%铁硫代酸钠和1%亚硫酸钠,5min。
(22)流水冲洗。
(23)如需要可用苏木素或核红复染。
(24)缓冲甘油封固,观察。
结果:CIGSS的优点:①阳性结果比黑色更鲜明;②可以使弱信号得到放大;③消除IGSS背景染色;④信号/背景比值高;⑤是开展免疫金银双标技术的新途径.光镜下见HBsAg阳性物质呈鲜艳的蓝色(α-萘酚为成色剂)或呈绿色(菲尼酮为成色剂)。背景干净,阳性结果清楚。
四、免疫金及免疫金银技术的优点
免疫金银技术(Immunogold—sliver Technique)是在免疫金基础上发展的新兴的先进的免疫细胞化学检测技术,它比免疫荧光,免疫酶标技术有许多独特的优点。
1.制备方法简单,易行。
2.标记简单抗体、凝集素、酶、SPA、激素等很容易通过物理吸附作用与胶体金颗粒相结合形成稳定的金标复合物。由于在标记过程中不需要经过任何化学方法交联,抗体的生物活性可保持不变,标记方法简单容易。
3.适用范围广胶体金银技术既能用于光镜也能用于透射及扫描电镜,同时还可用于X线能谱分析。在荧光显微镜上添置一块特制的滤板(IGs filter block)还可直接对胶体金颗粒进行观察,金颗粒在荧光显微镜下呈现明亮的点状物,定位准确,敏感性高,标本可长期保存。
4.特异性强免疫金探针的非特异性吸附作用小,较少受生物组织背景因素的影响,在抗原或抗体的检测中显示出高度的特异性。
5.敏感性高由于金颗粒的电子密度很大特别适合透射电镜及扫描电镜,因此,免疫金银法用于电镜,其检测抗原或抗体率远远超过酶反应物,从而大大改进了免疫细胞化学技术在电镜水平上的分辨率。光镜下金颗粒经过银显影后得到放大,用于检测组织细胞抗原时其敏感性比PAP法高200倍。我们检测肝炎表面抗原时比ABC法高6倍,是至今为止最为敏感的免疫细胞化学方法,特别适合于检测微量抗原及石蜡切片标本中的微弱抗原。
应用彩色IGSS和IGSS双标及多标记,可在同一张切片上检测两种以上的抗原成份。胶体金可以制备成不同大小的颗粒,将不同直径的胶体金分别标记不同的抗体或抗原,可以在同一张标本上同时区分出两种或两种以上的抗原或抗体,非常适用于电镜水平的双标和多标记,为研究细胞内抗原及多种抗原的表达及各种抗原分子相互之间的关系等提供了最佳手段。
免疫金银技术是新兴的科学技术,目前许多实验室越来越广泛地采用这一新技术,从而使它的发展有了扎实的基础。用免疫荧光、免疫酶技术、放射免疫技术可做的工作,均可使用免疫金银技术。另外,这一新的方法在其它技术的配合下不断地得到更新与进步,使它能经常增添新的内容,特别是免疫金和胶体金示踪作为一门独特的新技术将在生物医学及其它领域的研究中发挥着越来越大的作用。
五、在IGSS染色中常见技术问题和对策
(一)背景染色产生的原因和防止方法
(1)第一抗体或金标抗体稀释度不合适,一般容易犯抗体使用过浓的毛病,认为抗体越浓越好,结果适得其反。应该先作方阵滴定,优选最佳稀释倍数(见第一章 ),即可避免非特异性染色,又可节 省抗体。
(2)使用正常箅清封闭和在抗体稀释液中加入牛血清白蛋白,可以减少非特异吸附,降低背景染色。
(3)显色的器皿必须彻底清洗,化学试剂必需用三蒸馏水配制。
(4)乳酸银和硝酸银的显色在避光的环境中反应。醋酸银则可在有光的环境中显色。
(5)显色时切片应垂直放置在银显影液中,使过多的银颗粒下沉,如水平放置易沉淀于切片上。
(6)控制反应时间,显影液加入适量的阿拉伯胶或明胶可以延缓反应速度,避免形成过多的还原银,非特异地吸附在切片上。一般加入明胶1%~2%,效果比较满意,反应时间根据室温而定,室温25℃左右显色时间10~15min,室温在20℃以下,显色时间20~30min左右。
(7)洗涤:使用TBS时最好加入0.05%~0.1%的Triton X-100或Tween 80,可以洗脱掉组织表面发生非特异性吸附的污染蛋白,防止出现背景的非特异染色。
(二)背景染色已发生应如何消除
(1)2%硫代硫酸钠,1%铁氰化钾等量混合,加在切片上至背景无色为止。
(2)2%铁氰化钾和1%溴化钾等量混合作用1min水冲洗,然后加上2%硫代硫酸钠和1%亚硫酸钠脱色,至背景干净为止。
(3)0.1%重铬酸钾加0.25%浓硫酸,在显微镜下控制脱色时间,至阳性结果清楚,无背景为止。然后用5%硫代硫酸钠漂白。注意时间不要过长,以免阳性结果被脱掉。
(4)用0.3%~1%的H2O2处理切片也可消除背景的银颗粒。但必须在显微镜下控制脱水时间,防止把阳性结果脱色。
(三)彩色显影背景过染的处理方法
彩色免疫金银法,在胶体金技术中是一个很大的突破,它的优点是结果鲜明,对比度好,但是在彩色显影过程中时间过长,背景可有一些着色,彩色显影的时间控制很重要。一旦过染可用以下方法处理。
(1)纯酒精滴到切片上3~5s,立即冲掉,水洗,充分地把酒精洗掉,如果洗不彻底,造成阳性结果脱色。
(2)75%的酒精滴到切片上1min,立即冲掉,脱色不能时间过长,过长后阳性结果全部脱掉。
六、物理显影液及缓冲液的配制
(一)缓冲液的配制
(1)0.05mol/l pH7.4 TBS 配制
Tris(三羟甲基胺基甲烷)12.1g
NaCl 17.5g
加双蒸水1900ml
然后用浓HCL调至pH为7.4再加双蒸水至2000ml
Tris 4.84g
NaCl 17.5g
BSA 2.0g
NaN31.0g
双蒸水1900ml,充分搅拌至溶质完全溶解,用浓HCl调pH至8.2,再加双蒸水至2000ml。
(二)银显影液的配制
1.乳酸银显影液的配制:混合以下溶液
①10%阿拉伯胶水溶液60ml
②枸橼酸缓冲液pH 3.5 10ml
③对苯二酚1g,加双蒸水20ml溶解。
④乳酸银水溶液100 mg加水10ml。
注意在暗处显影。
2.硝酸银显影液的配制
①10%阿拉伯胶水溶液60ml。枸橼酸缓冲液ph 3.5 10ml
②对苯二酸1.7g水溶液30ml。
③硝酸银40mg水溶液2ml。
①②两溶液完全溶解,临用前加入硝酸银溶液。在暗处显影。
4.彩色显影液的配制
①0.2N氢氧化钠的异丙醇溶液5ml溶入100mgα-萘酚(或菲尼酮)。
②500mg碳酸钠,25mg溴化钾,50mg亚硫酸钠,加双蒸水25ml。
①②两液1:10混合,室温下彩色显影。
5.醋酸银显影液
①15%阿拉伯胶60ml,柠檬酸缓冲液10ml,pH3.5。
②对苯二酚1.7g溶于20ml蒸馏水中。
③醋酸银100mg溶于蒸馏水10ml中。
用前①②③依次混合,不需要避光,在室温下显影。
(三)柠檬酸缓冲液的配制
柠檬酸(C6H8O7.H2O)25.5g
柠檬酸三钠(Na3C6H5O7.2H2O)23.5g
加重蒸水100ml溶解即成,pH3.5
(四)氢氧化钠(NaOH)无水乙醇饱和溶液的配制
8g氢氧化钠,加入100ml无水乙醇振摇溶解即成。
第八节 免疫胶体铁细胞化学
胶体铁(Ferric Colloid)是一种阳离子胶体,可通过普鲁士蓝反应呈色,其颗粒有一定的大小及电子密度,最初被用于光镜及电镜下定位组织中的阴离子部位(Hale,1946Seno,etal, 1983,Murakami, et al 1986)。1989年日本学者Seno等在抗体分子上标记了胶体铁,将胶体铁引入免疫细胞化学技术(Seno,et al. 1989)。杨守京等在胶体的制备方法及其标记物的纯化等方面做了改进,成功地用于流行性出血热病毒抗原的检测(杨守京,等,1992)。该方法具有较高的特异性与敏感性,背景染色干净。
一、胶体铁的制备方法
早期制备的胶体铁作为阳离子胶体是用于检查组织中阴离子的定位,其制备主要是通过三氯化铁(FeCl3)的煮沸完成的,如有:(1)FeCI3直接煮沸(Hale ,1946):(2)FeCl3溶于甘氨酸和氨水的混和液中(Rinehart,1951):(3)FeCl3倒入煮沸的二甲坤酸钠溶液中(Seno.et al,1983)。或FeCl3与二甲砷酸溶液一起煮沸(Seno ,et al.1985)其后,制备方法不断改进,1986年Murakam 等用水合联胺二甲砷酸-FeCl3煮沸法制备出微细颗粒胶体铁(Fine-granular cationic iron colloid),胶体颗粒小(0.5~1nm),从而使其稳定性及穿透能力大大增加(Murakarmi,et al.1986)。用二甲砷酸代替二甲砷酸钠也可以获得同样胶体,具体步骤如下:在60ml 0.1mol/LFeCl33ml,将混合物加热煮沸至变成深棕红色为胶体砷酸铁。室温冷却后,再以二倍于原体积的0.1mol/LpH7.4的二甲砷酸钠缓冲液(Cacdylate sodium Buffer pH7.4,CB)稀释,即可进行抗体标记。该方法制备的铁胶体呈深红色,颗粒大小1nm左右,在pH4~8范围内稳定,4℃可存放一个月以上,室温存放半个月,阴离子定位分布同Murakami等的胶体铁,与IR-COO-有较强的亲和力,但不与IR-NH+结合。
二、抗体的标记和纯化
胶体铁的等电点为7.8至7.9,在pH7.4时通过离子键能与抗体IgG(pH5.8~7.3)结合而不影响抗体活性,在此条件下,Seno'对Hale'胶体铁进行了抗体标记,并成功用于免疫细胞化学染色(Seno,et al.1989),抗体标记时,用0.1mol/L碳酸钾将胶体的pH调至7.4按每毫升脱体铁0.2~1mg的蛋白量,将IgG在电磁搅拌下逐滴加入到胶体铁,搅拌5min后,通过CB平衡的Amber liaht CC-50层析柱,CB洗脱纯化.作者在胶体铁的制备方法进行了改进,吸收了Murakami等胶体的优点,所制备的胶体铁,颗粒小,稳定性高,其pH值近中性,标记效果好,CM-sephadex C-50(Pharmacia)可取代Amberlight CG-50用于纯化标记抗体(杨守京,等,1992)。
三、胶体铁标记抗体的鉴定
用免疫斑点法或免疫细胞化学染色等方法可鉴定抗体的标记效果
1.免疫斑点法 在处理好的硝酸纤维素膜上分别滴加100~10-7系列稀释的抗原,斑点直径0.25cm, 空气中干燥,80℃多聚甲醛蒸气固定1h,然后分别以胶体铁标记的抗体一步法或用桥抗联接胶体铁标记物的间接法染色,普鲁士蓝呈色观察。一步法所难检测到的抗原量为10-2~10-3μg,间接法 敏感性至少增加10倍(10-3~10-4μg)。
2.免疫细胞化学染色法 步骤同下,方法敏感性同免疫金银法(IGSS),优点是背景干净。
四、免疫胶体铁细胞化学染色
(1)组织切片脱蜡入水,0.01mol/l pH7.4 PBS洗;
(2)用4%正常羊血清封闭组织37℃ ,30min。
(3)分别以第一抗体孵育组织,4℃24h,PBS振洗10min×3;
(4)用胶体铁标记的第二抗体37℃孵育30min或用桥抗联接胶体铁标记物;
(5)蒸馏水洗;
(6)以1%的亚铁氰化钾与1%盐酸混合液显色20in;
(7)自来水洗 ;
(8)核固红染核,脱水,透明、封片。
以该方法染色,阳性为蓝色,胞核为红色。
五、方法的应用
胶体铁的呈色产物亚铁氰化铁是一络合物(解离常数1×10-35),一经形成,难以再与其它化学物质发生反应。蓝色的亚铁氰化铁与棕色的DAB产物及黑色的银颗粒颜色对比明显,因此强结合免疫酶及IGSS进行光镜下抗原的双标及多标记。胶体铁(颗粒1nm)标记抗体直径比常用胶体金(5~40nm)及铁蛋白标记抗体(12nm)小,因而对固定组织具有更好的穿透力,可用于抗原的超威结构定位,尤其是免疫电镜的包埋前染色。结合免疫酶及不同大小胶体金标记抗体,还可用于抗的双标记及多标记。
非特异性背景染色是免疫组化染色过程中经常遇到的问题。组织中的内源性过氧化酶活性及色素常会干扰免疫过氧化酶染色;而胶体金非特异性吸附组织是构成IGSS背景染色的主要原因。胶体铁与抗体结合呈电中性后,很少再与组织发生吸附,并且其染色不受内源酶活性的干扰。普鲁士蓝反应只显示标记的三价铁,不能显示组织中内源性二价铁(除外含铁血黄素,但可通过连续切片H·E染色对照排除),因而背景干净。另外免疫斑点试验和组织染色结果表明,免疫胶体铁间接法敏感性与IGSS基本相同但高于ABC染色,从上述两方面看,该方法要优于免疫酶及免疫金银染色。
参考文献
1.Fualk WP, Taylor, GM.Immunochemistry, 1971;8:1081~1083
2.Roth J.The Colloidal gold markem system for light and electron Microscopiccytochemistry Techniques in Immunocytochemistry, 1983;2:217~218
3. 蔡文琴,王泊沄主编.实用免疫细胞化学.成都:四川科技出版社,1983
4.HolgateCS, et al .Immunogold –sliver staining new method of immunostaning withenhanced sensitivity. J Histochem cytochem, 1983;31(7):938
5.RothJ,et al. Application of the protein A-gold technique for electron microscopicdemonstration of polypetide hormones. Endocrinology,1981;108:247
6.Bao –LeWang . Simplifide purification and testing of colloidal gold probes.Histochemistry, 1985;83:109
7.HackerGW, et al . Immunogold –silver staning –working protocol. J Histotechnol,1988;11(4):312
8.FritzP, et al. Colour development of immunogold-labelled antibodies for lightmicroscopy. Histochemistry, 1986;85:209~214
9.De,waele M, et al. An immunogold-silver staining method for detection of cellsurface antigens in ligh microscopy. J Histochem cytochem,1986;34:935
10.王福安.免疫金技术讲义.南京军区总院 电镜室,1987
11. 王保乐.胶 体金探针及免疫金、免疫金银染色方法讲义.陕西省中医药研究院,1986
12. 王泊沄,李玉松,对IGSS法常见问题和对策的探讨.临床与实验病理学杂志,1993;9(1):49
13.JiangGu, et al. Quantiative evalution of indirect immunogold-silver electronmicroscopy. J Histotechnology, 1993;16:19
14. HaleCW. Histochemical demonstration of acid polysaccharides in animal tissies.Nature(Lond),1946;157:802
15.MurakamiT, Taguchi T, Ohtsuka A , Sano K, Kaneshige T,Owen RL and Jones AL. A modifiedmethod of fine –granular cationic iron colloid preparation:It’s use in lightand electon microscopic detection of anionic sites in the rat kidney glomerulusand certain other tissues . Arch Histol Jap, 1986;49(1):12~23
16.Rinehart JF and Abutl- Hai SK. Animproved method for histologic demonstration of acid mucopolysocon cell surfaceand the histochemical stains of acid mucopolysaccharides. Histochem, 1983;79:27~31
17.SenoS, Tsujii T, Ono T and Ukitha S. Cationic Cacodylate iron colloid for thedetection of anionic sites on cell surface and the histochemical stains of acidmucopolysaccharides. Histochem, 1983;79:27~31
18.SenoS, Akita M, Ono T and Tsujii T.Fine-granular cationic iron colloid. Itspreparation, physicochemical characteristics and histochemical use for thedetection of ionized anionic groups. Histochemistry, 1985;82:307~312
19. SenoS ,Akita M and Hsueh CL. A new method of the immunocytochemical detection ofcellular antigens for light and electron micriscopy. Histochem, 1989;91:449~454
20. 杨守京,刘彦仿。改进的免疫胶 体铁细胞化学染色。中国组织化学与细胞化学杂志,1992;1(1):65~69
21.王泊沄.更敏感的免疫细胞化学方法---免疫金银染色。临床与实验病理学杂志,1985;1:41~43
第六章 亲合组织化学技术及免疫细胞化学技术的某些进展
70年代以来,由于免疫组织化学方法的广泛应用,在技术方法上不断得以改进,涌现了一批新的技术方法,其特点为一些具有双价或多价结合力的物质如如植物凝集素(Lectin)、生物素(Biotin)和葡萄球菌A蛋白(Staphylococcal Protein A, SPA)等被应用于免疫细胞化学技术,从而建立了SPA—HRP法、ABC法、BRAB法和LAB法等。这些方法的共同特点是以一种物质对某种组织成分具有高度亲合力为基础。它们一方面区别于古老的组织化学的分解、置换、氧化和还原,另一方面本质上又非抗原抗体反应。因此,Bayer(1976)首次称之为亲合组织化学(Affini-ty histochemistry)。事实上,抗原抗体反应从本质上也属于亲合组织化学这一范畴,只是近代免疫组织化学方法的更新更突出了“亲合”这一组织化学技术特点。目前,亲合组织化学包括抗原与抗体、植物凝集素和糖类、生物素与抗生物素、葡萄球菌A蛋白与IgG、阳离子与阴离子、激素、维生素、糖及类脂质作用部位和受体等。亲合细胞化学引入免疫细胞化学后使其敏感性得到进一步提高,因此更有利于微量抗原(或抗体)在细胞或亚细胞水平的定位。
第一节 抗生物素—生物素免疫细胞化学染色法
一、基本原理
很早以前,人们就注意到给动物饲以大量的鸡蛋白,会引起明显的“维生素H缺乏症”,也称为“蛋白质伤害”。经研究发现,在鸡蛋白中含有一种碱性蛋白,分子量为68000,属于糖蛋白,当时命名为卵白素(Avidin),卵白素具有4个同维生素H(Riotin,又名生物素)亲合力极高的结合点。给动物饲以大量鸡蛋白所致的维生素H缺乏,就是由于卵白素和大量的维生素H结合所致。维生素H(以下统称生物素)是一种小分子的维生素,分子量为244,系转氨甲酰基化过程中的辅酶,它与卵白素之间有很强的亲合力,较之抗体对抗原的亲合力要高出100万倍,能够彼此牢固结合而不影响彼此的生物学活性。同时,生物素与卵白素都具有与其它示踪物质如荧光素、铁蛋白和过氧化酶等相结合的能力。免疫细胞化学工作者利用上述特性,建立了卵白素—生物素免疫染色系统。由于维生素H习惯上称为生物素,为便于理解,现在译名上统称卵白素为抗生物素或亲合素。所以卵白素—生物素免疫染色系统又称为抗生物素—生物素免疫染色法。
二、几中抗生物素—生物素染色法
1.抗生物素—生物素—过氧化酶复合物技术(Avidin Biotin–Peroxidase Complex technique, 简称ABC技术)
(1)基本原理:ABC法是Hsu 等于1981年在HRAB法和LAB法的基础上改良的,其特点是利用抗生物素分别连接生物素标记的第二抗体和生物素标记的酶。与LAB法和BRAB法不同的是第一抗体不为标记物所标记,生物素标记的第二抗体与ABC复合物相连接。复合物是将过氧化酶结合在生物素上、再将生物素—过氧化酶连接物与过量的抗生物素蛋白反应而制备的(图6-1),最后进行显色反应定位。

图6-1 ABC法
(2)操作步骤
①冰冻切片或石蜡切片均可。
②冰冻切片可用丙酮固定10min左右,0.01mol/l PBS (pH 7.2~7.6) 洗5min,更换3次。石蜡切片需经脱蜡,系列酒精至水。
③第一抗体,室温孵育15min。
④PBS洗5min,更换3次。
⑤加生物素标记的第二抗体(1:200左右),孵育15min。
⑥PBS洗5min,更换3次。
⑦加ABC复合物室温作用15min 。
⑧PBS洗5min,更换3次。
⑨用DAB—H2O2液(配法见附录)显色。
⑩复染。
⑾封片、观察。
ABC复合物的配制:经试验,生物素与抗生物素之比为1:4时,能获得最佳满意效果。即抗生物素10μg/ml加2.5μg/ml生物素,应用0.05mol/l Tris—HCl液,pH7.6,在应用前30min配制。
(3)ABC法的评价及实验注意事项
ABC法具有:①敏感性强:Hsu等应用ABC法与PAP法相比发现敏感性较PAP法高20~40倍能显示PAP法所不能显示的抗原。这是因为生物素与抗生物素间有较强的结合力,一个抗生物素分子具有可与生物素结合的4个活性部位,其中一部分可与生物素标记的过氧化物酶相结合,另一部分可与生物素标记的免疫球蛋白结合。生物素通过氨基与抗体或过氧化物酶分子相结合,一个过氧化物酶或免疫球蛋白分子可以结合多个生物素分子,从而增加了免疫球蛋白或过氧化物酶结合抗生物素的能力。在ABC反应中,抗生物素作为桥连接于生物素标记的酶和生物素标记的抗体之间,而生物素标记的过氧化物酶分子又可作为桥连接于抗生物素分子之间,于是形成了一个含有3个以上过氧化物酶分子(大于PAP复合物)的网格状复合物,敏感性极大提高。②特异性强,背景染色淡:由于敏感性高,第一抗体和第二抗体都可被稀释至尽可能的高度,减少了非特异性染色。③方法简便,节 约时间:由于ABC法敏感,操作的抗原抗体反应的时间可由PAP法所需的数天缩短为2h左右,各层抗体作用仅需15min。④国内上海生物制品所等单位制备的生物素—抗生物素染色药盒经质量鉴定符合标准,已提供国内市场。⑤由于生物素与抗生物素具有和多种示踪物结合的能力,可用于双重或多重免疫染色。
实验注意事项:
①内源性生物素活性及其消除:生物素是一种辅酶,是在脱羧基酶、羧基转换酶等催化的代谢环节 中所产生的羧基的中间载体,它存在于某些组织和细胞内,在应用ABC染色时会与抗生物素结合而产生非特异性染色。因此,对抗生物素结合性较高的组织如肝、肾、白细胞、脂肪组织和乳腺,在应用ABC方法前应预先以0.01%的抗生物素和0.01%的生物素溶液分别作用20min左右,以消除内源性抗生物素结合活性,每次作用后用PBS洗5min,更换3次。Nar-itoku和Taylor(1982)报告神经组织中的乳糖可与抗生物素结合产生假阳性反应,以2—甲基-O-甘露糖预孵育切片可封闭神经组织内乳糖分子上的结合点,从而阻止与抗生物素蛋白的结合。必要时,也可用0.3%H2O2—100%甲醇孵育以消除内源性过氧化 物酶活性。
②生物素制剂之间相互亲合性差异大,因此在应用ABC试剂时,应注意厂家和批号,对购进试剂应进行事先测试,以保证实验结果的稳定性。
③ABC试剂保存温度以4℃为佳,据报告保存可达两年之久,仍能获得满意效果,而在—20℃生物活性在短期内即被破坏。
2.桥抗生物素—生物素技术(Bridged Avidin –Biotin technique, 简称BRAB技术)
该技术方法是用生物素分别标记抗体和酶,然后以抗生物素为桥,把两者连接起来(图6-2)。

图6-2B RAB技术
检查抗原时,先用生物素标记的抗体与细胞(或组织内)的抗原反应,洗去未结合的抗体,加入抗生物素孵育后,洗去未结合的抗生物素,再加入已标记酶的生物素孵育,洗片,以细胞化学方法呈色反应。
3.标记生物素—抗生物素技术(Labelled Avidin—Biotin technique, LAB技术)
以生物素标记抗体作第一抗体,酶标记抗生物素作为第二抗体(图6-3)。操作步骤如下:

图6-3 LAB技术
(1)切片在含有25~50μg/ml生物素标记抗体(PBS液稀释)中孵育1h,室温。
(2)PBS洗2次,每次5min。
(3)用20~50μg/ml过氧化物酶标记的抗生物素液孵育90min,水洗。
(4)酶呈色反应。
BRAB法和LAB示是Guesdon及其同事们(1979)建立的,由于这二种方法都需以生物素标记第一抗体,应用不如ABC法普遍。但用于免疫细胞中免疫球蛋白的显示具有特异性。二者比较,LAB法手续较简便,但灵敏度较低。
生物素—抗生物素染色法采用免疫细胞化学染色中各种常用固定剂(见附录),均可获得较满意的结果。但有实验报告推荐“PLP”固定液(即过碘酸—赖氨酸—多聚甲醛固定液),其配制法亦见附录。PLP固定后,依次经系列蔗糖磷酸缓冲液(10%,15%,20%各5min),进行冰冻切片,贴于载片上,置室温风干30min或37℃3~4h或过夜。染色前用PBS湿润水化切片,可获得满意染色效果。
第二节 葡萄球菌蛋白A(SPA)
葡萄球菌蛋白A(Staphylococal Protein A, SPA)是一种从金黄色葡萄球菌细胞壁分离的蛋白质。早在1940年,Vevwey发现在某些金黄色葡萄球菌中,含有一种物质,在双向扩散试验中能与正常人血清形成沉淀。Jensen(1959)也发现类似现象,并将其命名为A抗原。直到1963年Lofkvist等分离了该抗原,并证明它是一种蛋白质。为与A与糖相区别,Grov(1960)将其命名为葡萄球菌蛋白A,简称SPA或蛋白A(Protein A)。由于SPA的一些免疫特性,它已引起广大免疫学者的兴趣,并发展成为免疫学上一种极为有用的工具。
一、SPA的性质
(1)SPA存在于大多数(90%)金黄色葡萄球菌中,而不存在于表皮葡萄球菌中。并且主要存在于血浆凝固酶阳性菌株,而不存在于阴性菌株中。前者是致病的,后者是非致病的,但在体内研究中尚未发现SPA和菌株致病性之间有任何肯定的关系。不同菌株间的SPA含量有明显差异,以I株金黄色葡萄球菌含SPA量最高,SPA和细胞壁的肽聚糖呈共价结合。抗二甲氧基苯青霉素突变株(Methicillin—resistant strain)能产生分泌性SPA,它较之细胞壁所含的SPA在免疫学性质上相似,但易分离,损失少。
(2)SPA为蛋白质成分,仅含少量或不含碳水化合物,其分子量因提取方法不同而异,用脱氧核糖核酸酶消化细胞壁后超速离心或用加热油提法,所测分子量为12000~15000。用沉淀平衡分析和在6mol/L鸟嘌呤盐酸盐中凝胶过滤,测出分子量为42000。SPA为多肽单链,内含3个高度相似的Fc段结合区,每区由50个以上的氨基酸组成,不含色氨酸和半胱氨酸。其羧基末端是赖氨酸,氨基末端结构尚未肯定。SPA粘度高于球蛋白,等电点为pH5.1,其天然结构十分稳定,在应用6mol/L鸟嘌呤盐酸盐变性剂的条件下,尚能保存某些三级结构,如将此变性剂除去,则能自然矫正而恢复原有结构。
(3)SPA之所以引起免疫学家的重视,是因为它具有的免疫学特性。SPA具有和人与许多动物如豚鼠、猪、小鼠、猴等IgG结合的能力。SPA结合部位是Fc段而不是Fab段,这种结合不会影响抗体的活性。SPA具有的结合力是双价的,每个SPA分子可以同时结合两个IgG分子,也可一方面同IgG相结合,一方面与标记物如荧光素、过氧化物酶、胶体金和铁蛋白等相结合。还有一个饶有兴趣的事实是,和SPA结合后的IgG可用4mol/L鸟嘌呤盐酸盐等使之解离。SPA对IgG免疫球蛋白亚型的结合有选择性,如SPA与人IgG亚型:IgG1、IgG2、和IgG4有结合力,唯独不结合IgG3。只结合IgA2,而不结合IgA1。SPA和禽类血清IgG不结合。
(4)SPA具有多种生物学作用,如引起豚鼠解离体回肠和收缩,在吞噬反应中抑制IgG调理素吞噬和杀菌作用,SPA—Igg 复合物能固定人的补体和人、狗、猪的新鲜补体,对人类B细胞具有促有丝分裂因子的作用等。
二、SPA的应用
自70年代开始,国外应用SPA建立了许多敏感、特异性强、快速和简易的实验方法,并在许多方面的应用中积累了实际应用的材料,现已广泛应用到免疫学及其相关科学如细胞学、细菌学和病毒学等。其可能应用的范围可归纳为以下四个方面:
1.应用于免疫球蛋白的制备和分析 SPA是一种比较理想的提纯和分析免疫球蛋白的试剂。由于SPA与IgG及其某些亚型的Fc段有较强的结合力,可利用来提纯、分析免疫球蛋白制剂,结合后的PSA—IgG可再用解离剂如4mol/L尿素、4mol/L,硫氰酸盐或6mol/L的鸟嘌呤盐酸盐使之解离,多用SPA—Sepharose 层析柱分离IgG或其亚型及断片如Fc、Fab等。
2.应用于免疫细胞化学 由于SPA具有双价结合力,在免疫细胞化学技术中可作为桥抗体或标记抗体。由于SPA能与多种动物的IgG的Fc段结合,因此,作为第二抗体或标记抗体,SPA的最大优点是不受种属特异性的限制,故在目前各种免疫细胞化学技术中已得到广泛的应用。除不受种属限制这一特点外,SPA法还具有染色时间短、灵敏性高和背景染色淡等优点。据报告用国产酶联SPA代替酶标记抗体,应用间接染色,时间较PAP法省时一半。SPA分子量小(13000~42000),易于穿透组织,而免疫球蛋白酶标记抗体为200000,PAP复合物为430000,均较SPA分子量大。
3.应用于多种细菌、支原体和病毒等病原体的简易快速诊断可应用SPA菌体作为载体,结合特异性抗体成为一种吸附原,作协同凝集剂,用于某些细菌和病毒的定群和分型(详见第二章 第三节 )。
4.可作为一种研究免疫复合物、膜抗原、膜受体和膜Ig的固相吸附剂 Hallgsen用同位素标记SPA测定血IgG的凝集物,发现85%全身性红斑狼疮和42%类风湿病人血清中凝集物增高。SPA用于细胞膜抗原、表面IgG和Fc受体的研究最大特点是能研究活细菌。Ghetie(1976)用SPA致敏绵羊红血球,与经IgG处理的细胞形成玫瑰花环,来鉴定带Fc受体的细胞,反之,如用SPA抑制玫瑰花环形成,则可定量测定细胞表面的IgG。应用SPA与胶体金或铁蛋白相结合,可在电镜水平检查抗原抗体反应的定位。特别是蛋白A—胶体金技术(Protein A—Gold technique, PGA技术)自Pomano和Romano(1977)首次报告用于标记细胞表面抗原、包括淋巴细胞、血小板、大鼠肾脏细胞及感染的病毒细胞获得成功以后,已得到愈来愈广泛的应用(详见第七章 ),是一种较为理想的免疫电镜技术。
三、SPA在免疫细胞化学染色中的应用
SPA可为多种示踪物如荧光素、酶、胶体金、铁蛋白等所标记,应用较广的为酶标记SPA和金标记SPA技术,后者将在第七章 中叙述。标记SPA常用的酶为HRP。可应用于间接法。SPA在PAP法中可代替桥抗体。
1.SPA—HRP用于间接法的操作步骤
(1)切片经脱蜡后用0.5%H2O2—纯甲醇液处理5min以抑制内源性过氧化物酶活性。
(2)用Tris盐酸缓冲液(0.05mol/l pH7.6)洗2次,每次3min。
(3)以第一抗体血清覆盖处理切片,37℃,孵育30min,或4℃24~48h。
(4)用Tris-HCl缓冲液洗3次,每次5min。
(5)加SPA—HRP(1:100~1:400)处理30min。
(6)Tris-HCl缓冲液洗3次,每次5min。
(7)DAB—H2O2显色。
(8)复染、脱水、透明、封固。反应物为棕色。
2.SPA用于PAP法的操作步骤
(1)切片脱蜡至水洗。
(2)80%甲醇(含0.6%H2O2)封闭内源酶活性5min。
(3)10%卵白蛋白Tris缓冲液,20min。
(4)第一抗体作用37℃,30min或4℃ ,16~48h。
(5)0.05mol/l pH7.6 Tris-HCl缓冲盐液洗片5min。
(6)SPA(1μg/ml)5min。
(7)Tris-HCl盐液洗5min。
(8)PAP复合物(无种属限制),5min。
(9)Tris-HCl盐液洗切片5min。
(10)DAB(0.6mg/ml),加0.01%H2O2反应5min,然后水洗。
(11)复染:常用Mayer’s苏木精液数秒至1min(视需要而定),水洗。
(12)脱水、透明、封固、镜检。
3.SPA—HRP的制备应用Nakane和Kawaoi1974年建立的过碘酸法,酶:SPA=2:1,即HRP10mg,SPA5mg。
(1)10mg 溶于新鲜配制的pH8.1、0.3mol/L碳酸氢钠溶液1ml,加入0.1ml 1%二硝基氟苯无水乙醇溶液以封闭酶分子中的氨基,使不发生酶的自身聚合,室温轻轻搅拌1h。
(2)加入1ml0.04~0.08mol/L(依不同批号的酶而定)的NaIO4,室温搅拌30min。
(3)加入1ml0.16mol/L乙二醇,室温轻搅1h。
(4)对1000ml 0.01mol/L pH95 碳酸盐缓冲液充分透析(4℃,过夜),换缓冲液3次。
(5)加入5mg SPA的0.1mol/l pH7.4碳酸钠缓冲液1ml,室温轻搅2~3h。
(6)加5mg硼氢化钠(NaBH4)终止氧化,置4℃冰箱3h或过夜。
(7)对PBS透析24h,4℃离心去沉淀,半饱和硫酸铵洗沉淀结合物3次,溶于1ml 0.02mol/L pH7.4的PBS中。
(8)对PBS充分透析,经测定后分装,贮于-20℃冰箱中保存备用。
用过碘酸钠法可以得到很高标记率的HRP-SPA标记物,而且保存了抗体的全部活性,敏感度高,稳定性强,大大优于戊二醛标记抗体法,国内现在也有HRP-SPA的标记物供应,但要注意由于各家所用的SPA可能来源于不同菌株,在性质上可能存在一些差异。
【注意事项】
①在使用二硝基氟苯后,会产生氟化氢,应充分透析除净,否则抑制酶活性。
②标记时过碘酸浓度不宜过高,氧化时间不宜过长,否则会产生过度标记,即多个酶分子结合到一个蛋白A分子上。这些过度标记蛋白A的免疫反应性很差,容易产生非特异性染色。
③标记时加入酶与SPA的比例应适合,比值过大易产生过度标记,比值小则标记蛋白A产率低。
④过碘酸氧化结果能使酶具有多个醛基,从而能与多个蛋白分子的氨基相结合,成为一些大分子的聚合物。因此,有作者强调指出,对要求具有较强的细胞穿透力的免疫细胞化学实验时应予以考虑是否适用。但国内有实验室应用上海生物制品所产生的应用过碘酸氧化法制备的HRP—SPA于免疫电镜研究仍获得了较为满意的结果。
第三节 凝集素
凝集素(Lectin)是指一种从各种植物,无脊椎动物和高等动物中提纯的糖蛋白或结合糖的蛋白,因其能凝集红血球(含血型物质),故名凝集素。其常见种类见表6-1。常用的为植物
表6—1 常见的凝集素一览表
| 凝 集 素 | 缩 定 | 特异性结合 |
| 花生( Peanut agglutinin) | PNA | D—半乳糖、Gal(1→3)—GalNAC |
| 刀豆(Concanavalin ensifomis agglutinin) | ConA | D-葡萄糖、D-甘露糖 |
| 蓖麻(Ricinus communis agglutinin) | RCA | D—半乳糖、D-GalNAC>半乳糖 |
| 扁豆(Lens cuinaris agglutinin0 | LCA | D-甘露糖、D—葡萄糖 |
| 豌豆(Pisum satiwum agglutinin) | PSA | D-甘露糖 |
| 菜豆(Phaseolus vulgaris agglutinin) | PHA | D-GalNAC |
| 大豆(soybean agglutinin) | SBA | D-GalNAC>>D-半乳糖 |
| 荆豆(Ulex europeaus agglutinin) | UEA | L-岩藻糖 |
| 麦胚(Wheat germ agglutinin) | WGA | D-GalNAC、NANA |
| (Bandeiraea simplicifolia agglutinin) | BSA | D-半乳糖 |
| 双花扁豆(Dolichos bifows agglutinin) | DBA | D-GalNAC |
| 槐(Sophora japonica agglutinin) | SJA | D-半乳糖、D-GalNAC |
凝集素(Phytoagglutin, PNA),通常以其被提取的植物命名,如刀豆素A(Conconvalina,ConA)、麦胚素(Wheat germ agglutinin, WGA)、花生凝集素(Peanutagglutinin, PNA)和大豆凝集素(Soybean agglutinin, SBA)等,凝集素是它们的总称。凝集素不是来源或参与免疫反应的产物,它们之所以被收入本书,是由于凝集素具有的某些“亲合”特性,能被免疫细胞化学技术方法所应用。因此,Ponder(1983)提出应称“凝集素组织化学”而不能称为“凝集素免疫组织化学”。
一、凝集素的特性
凝集素具有多方面的特性,在此我们仅简要提及其与免疫细胞化学技术方法应用有关的某些特性。我们知道,生物膜中含有一定量的糖类,主要以糖蛋白和糖脂的形式存在。凝集素最大的特点在于它们能识别糖蛋白和糖肽中,特别是细胞膜中复杂的碳水化合物结构,即细胞膜表面的碳脂化合物决定簇。一种凝集素具有对某一种特异性糖基专一性结合的能力,如刀豆素与α—D—吡喃糖基甘露糖(α—D—Mannopyranosy)结合;麦芽素与N—乙酰糖胺(N—acetyl glucosamine)结合;菜豆凝集素与N—乙酰乳糖胺结合(见本章 表6—1)。 因此,凝集素可以作为一种探针来研究细胞膜上特定的糖基。另一方面,凝集素具有多价结合能力,能与荧光素、生物素、酶、胶体金和铁蛋白等示踪物结合,从而在光镜与/或电镜水平显示其结合部位。
二、凝集素的应用
一般认为细胞膜上特定的糖基可用以区别细胞的类型和反映细胞在分化、成熟和肿瘤细胞性变中的变化。仅在某些特殊的例子,其细胞结合凝集素的性能可以预先估计,如双花扁豆素之于血型A物质的特异性,荆豆凝集素之于血型O物质2—L—岩藻糖的特异性,然而在绝大多数情况下,关于由凝集素所识别的碳水化合物决定簇的种类,关于携带决定簇的分子的性质和机能,完全凭实验经验去发现。
1.作为细胞分化和成熟的标记应用凝集素作为细胞分化的标志,在这方面的应用报告最多,而且研究比较集中于血细胞,特别是淋巴细胞的分群。如Rose(1980)等发现在小鼠胸腺皮质内不成熟的T淋巴细胞呈PNA阳性反应,在小鼠小肠集合淋巴小结的生发中心也发现有20%左右的PNA阳性反应细胞,后者是否属于不成熟的T淋巴细胞,是值得进一步研究的问题。Newman等(1979)以荧光素标记凝集素PNA,发现在大鼠乳腺上皮的不同分化时期显示不同的荧光强度。在不成熟的大鼠乳腺上皮细胞,荧光弱或无,随着性成熟期到妊娠期乳腺上皮荧光程度逐渐加强,而泌乳期荧光强度达最高峰。在皮肤角质细胞自基底向表层分化、成熟的过程中,细胞表面的碳水化合物的分布和性质都在改变。Brabed等(1981)应用新生大鼠皮肤的实验表明,皮肤各层细胞分别与不同的凝集素相结合。麦芽素与角质化细胞相结合,蓖麻素与棘细胞和基底细胞相结合,而荆豆凝集素标记在棘细胞的表面。在成肌细胞(myeoblast)的分化与成熟过程中,Winaod 和Luzzati(1975)注意到类似的皮肤的改变。
2.作为细胞特殊类型的标记Kivela和Farkkanen(1987)发现在人视网膜,PNA标记视锥细胞而不标记视杆细胞。在乳腺、乳腺上皮细胞呈PNA阳性反应而肌上皮细胞和间质细胞呈PNA阴性反应。以多种凝集素对小鼠、大鼠和兔的肾组织切片进行染色结果表明,刀豆素A和蓖麻素存在于肾脏的各部,PNA和双花扁豆凝集素(DBA)主要分布于远曲小管和集合小管上皮细胞,荆豆凝集素(UEA)主要分布在血管内皮细胞,而麦芽素分布在肾小球。应用DBA对RIII和DDK品种的小鼠研究表明,DBA主要结合在各种组织内毛细血管内皮细胞上,电镜观察显示DBA结合在内皮细胞的表面,在趣的是在RIII品系小鼠某些组织的内皮细胞显示肯定的DBA阴性反应,说明同一种属动物的血管内皮细胞也存在有组织特异性的差别。Streit和Kreutzberg(1987)发现GriffoniaSimplicifolia凝集素特异性标记面神经节 内的小胶质细胞,其它类型的胶质细胞如星状胶质细胞(astrocyte)等都显示阴性反应。在切断面神经后,增殖的小胶质细胞对Griffonia Simplicifolia凝集素的反应加强,免疫电镜观察表明,凝集素主要沉积在细胞膜或小胶质细胞突起的轴膜表面,特异性结合糖基是α—D—半乳糖。上海医科大学附属肿瘤医院免疫病理室应用12种凝集素(表6-1)对人胚胎及各种正常组织进行了系统的凝集素受体的定位研究,结果表明,凝集素受体的分布并无即定规律可寻。如胃粘膜主细胞为PNA受体,而壁细胞为BSL受体,双花扁豆受体(DBA)主要出现在大肠部份。
3.在肿瘤中凝集素结合的改变肿瘤细胞伴有细胞膜的改变,细胞膜上的糖基也会产生相应的变化,可用凝集素检测出来。大量研究发现,凝集素可作为肿瘤组织源性的标记、肿瘤特异性诊断的标志、肿瘤恶性的标记和不同肿瘤的分化标记。如张华忠等(1987)报道115例胃癌标记PHA阳性率高达90.43%,而正常胃粘膜基本是阴性,故认为PHA是胃癌的诊断性标志。BSA对乳腺恶性肿瘤阳性率达79%,而对良性病变均呈阴性反应,提示BSA可能为乳腺恶性肿瘤的相关标志。凝集素还有助于判别肿瘤的组织类型,如神经系统星形细胞瘤ConA阳性,小胶质细胞瘤阴性,肾腺癌UEA1阴性,透明细胞癌阳性。
三、凝集素在免疫细胞化学中的应用
凝集素可为荧光素、酶和生物素等所标记,分别进行下列染色法:
1.直接法标记物直接标记在凝集素上,使之直接与切片中的相应糖蛋白或糖脂相结合。
(1)切片脱蜡至水。
(2)凝集素标记物(100μg/ml),室温,30min。
(3)TBS洗3次,每次2min。
(4)如为荧光素标记物,封片用荧光显微镜观察。如为酶标记物,则应依次进行呈色、脱水、透明和封固后在光学显微下观察。
直接法的优点是简便,目前商品用的凝集素药盒已能购得。但灵敏性不够高。
2.间接法将凝集素直接与切片中的相应糖基结合,而将标记物结合在抗凝集素抗体上。
(1)脱蜡至水。
(2)用含3%的H2O2的甲醇阻断内源性过氧化物酶10min。
(3)凝集素稀释液(100μg/ml)孵育30min。
(4)TBS洗3次,每次2min。
(5)用标记了的抗凝集素抗体(1:100)孵育30min。
(6)TBS洗3次,每次2min。
(7)呈色、脱水、透明、封片。
(8)观察。
间接法染色还可进一步改良为:①三步法:即在凝集素孵育后,接着用抗凝集素抗体孵育,再用标记了的抗-抗凝集素抗体孵育,层层放大,进一步提高其敏感性,PAP复合物也可作为标记物标记在抗-抗凝集素抗体上。②抗生物素—生物素凝集素法:用结合了生物素的凝集素孵育切片后,TBS洗后再以抗生物素—标记物与之结合。间接法较直接法和直接法敏感性高5~10倍或更多一些,但必须购买或自制抗凝集素抗体。
3.糖—凝集素—糖法本法是利用过量的凝集素与组织切片中特定的糖基相结合。经冲洗后,凝集素上还存在未被占用的结合部位,将这些部位与有过氧化物酶标记的特异性糖基相结合,形成一个三明治样的糖—凝集素—糖的结合物。
(1)脱蜡至水。
(2)用含3%的H2O2的甲醇阻断内源性过氧化物酶10min。
(3)用100μg/ml的凝集素孵育30min。
(4)TBS洗3次,每次3min。
(5)用100μg/mlHRP标记的糖液孵育30min。
(6)TBS洗3次,每次3min。
(7)DAB呈色、脱水、透明、封固。
本法特异性强,灵敏度高,因为这不象生物素—抗生物素法那样要改变凝集素,又不需要像抗体那样要制备抗体。HRP本身含有甘露糖,能与刀豆凝集素A、扁豆凝集素和豌豆凝集素结合。但对其它的凝集素,本法目前普及还有一定困难,因为要将过氧化物酶结合到其它凝集素上,就需要将一个适当的碳水化合物基团嵌入过氧化物酶,称为糖基化(glycosylation),方法虽不复杂(Lee 等1976),但需一定的试剂和设备。商品化能提供的糖基化过氧化物酶品种尚有限。
【注意事项】
①凝集素需要重金属离子维持其活跃的结合部位,如果金属离子耗尽了,就会影响凝集素的结合能力。因此,有作者主张用TBS作为缓冲液,内加微量的金属,配方是:Tris 60.57g,NaCl87g,H2O加至1000ml,其中含CaCl2、MgCl2各1.0mmol/L。或在进入凝集素孵育前,先用该液孵育,以增强凝集素结合力。
②和其它抗体血清应用一样, 应用每批新的凝集素实验时,都先要用缓冲液稀释成不同等级;如8,16,32,64,125,250,500,1000μg/ml,经染色选择最佳稀释度。
③有作者认为阻断组织内源性过氧化物酶所用的H2O2对碳水化合物有影响,可能改变凝集素的结合形式,因此,应尽量少用或不用,我们及一些作者在实验过程中发现影响不明显。
④有作者认为凡经固定的组织切片,不论是石蜡包埋切片或冰冻切片,都有可能使组织中抗原隐蔽,为了暴露隐蔽了的碳水化合物基团,主张在凝集素孵育前用酶处理切片,常用胰蛋白酶液(配制见附表)进行适当的孵育。
⑤已知哺乳动物的质膜含有占蛋白总量的1%~10%的碳水化合物,它们以低聚糖(oligosacchride)糖脂,并主要以糖蛋白的形式存在,糖蛋白线性的或分支的旁链可能含有两个到多个单糖残基,通常有两种或更多的单糖,在单糖单位末端常常是一个带负电荷的N-乙酰神经氨酸的残基,一个唾液酸(siallic acid)。有作者在凝集素实验中常用神经氨酸酶(neuramidinase)分解细胞表面的唾液酸或神经氨酸,以暴露出隐蔽的能与聚集素结合的次终末的碳水化合物。配制方法是将神经氨酸酶(Type V,Sigma Lot 63F—8172 63F--8172)用醋酸缓冲液(含2%牛血清白蛋白)BSA配成0.5μg/ml。
切片脱蜡后进行酶消化的过程中,将该组织切片置于上述配制液中,在湿盒内,37℃孵育30min。用缓冲液洗后,进行凝集素染色。
⑥对照试验,和其它组化染色一样,凝集素染色也需要设对照试验(最好在相邻切片进行)。由于凝集素具有单糖特异性,如果外加相应的糖,把凝集素的结合部位占有了,凝集素就不能再与组织中的糖基相结合了。一般采用的方法是将凝集素预先与相应的糖(0.2mol/L)在室温孵育30min,使之占有凝集素结合部位,再将此液代替凝集素进行孵育,结果应为阴性。在某些情况下即使提高糖液的浓度也不能达到完全的抑制。这时,只有用与凝集素有高亲合力的低聚糖(oligosachrides)代替或将切片预先用相应的糖苷酶孵育去除特异性糖基(Watanalte等,1981)。
四、HRP标记凝集素及凝集素抗体的制备
1.HRP标记凝集素法适用于小量的凝集素标记(Ponder 1983)。
(1)HRP的活化
①将10mg HRP(SigmaType VI)溶解在1ml 0.3mol/L 的重碳酸钠溶液中(1.25g/50ml)。
②加50μl含1%氟二硝基苯的无水乙醇溶液,室温轻度搅拌1h。
③加1ml含0.06mol/L的过碘酸钠的蒸馏水(0.62g/50ml),室温下轻度搅拌30min。
④在室温下加两滴0.16mol/L乙二醇,轻搅1h。
⑤用Sephadex G—25装成小柱,用0.3mol/L的重碳酸钠溶液,使含HRP的混合液过柱。
(2)结合
①正常条件下,可用凝集素及过氧化物酶各半量,但其比例可根据需要调整,以10mg凝集素溶解在25ml的重碳酸盐缓冲液里,加到“活化”的HRP中去 ,这样得出的凝集素浓度大约是0.3mg/ml,可加进0.1mol/L相应的特异的糖,以保护凝集素结合时的结合部位。糖在下步透析或层析时去掉。
②在室温下轻搅拌,结合3h。
③加入1mg硼氢化钠,室温下作用1h以稳定结合物活性。
④用1N HCl调整pH至6.4,留置室温下过夜。
(3)纯化
①用适当的凝胶层析柱如SephadexG—200、Saphacryl—300层析法将游离的凝集素、游离的过氧化物酶和高分子量的成分从结合物分离出去,包括抑制性的糖也在此时分离出去。
②提纯后的结合物在280nm和403nm波长处测量其吸光率。用1%BSA先通过0.22μm的微孔过滤器,以确定被结合的凝集素是否被吸附在滤器中,然后上述结合物经过该微孔滤过器过滤到一个无菌瓶中。
③加入叠氮钠,浓度1:1000,保存于4℃C备用。
2.抗凝集素抗体的制备抗凝集素抗体的制备法与一般免疫血清制备大致相同(见第二章 )。所不同的是:①凝集素具有较强的毒性,易使被免疫动物发病或甚至死亡。解决的方法是经处理使凝集素变性,从而减低其毒性,但同时要保证其抗原性不受或少受破坏。②要设法阻断凝集素的糖结合部位,以减少对这些部位的抗体的产生,解决的办法是预先以相应的糖阻断这些结合部位。Leathem 和Atkin(1982)设计了一个办法,他们首先应用琼脂糖(Sepharose)珠,珠上有一系列共价糖的附着,这些糖可阻断凝集素结合部位,这种糖珠有商品供应(Sigma LtD),每1ml糖珠能结合大约12mg凝集素。其次用加入福尔马林和加热的方法使凝集素变性,毒性减低而不影响抗原性。具体操作如下:
①1ml琼脂糖—半乳糖珠与1mg花生凝集素相结合,室温1h。
②加入10ml 10%福尔马林,在水浴中加热到60℃,1h。
③用盐水离心洗珠,将珠分成以10μl为单位的若干小份,保存在-20℃。
④皮下多处注射两只家兔背部,每次注射100μl,每隔三周注射一次。取血40~50ml,保存在-20℃备用。
第四节 免疫细胞化学技术的某些新进展
免疫细胞化学技术在继续改进和完善中,新的技术方法不断出现。除目前国内已开始应用的免疫金技术和免疫金银技术外,80年代,新的免疫细胞化学技术还有半抗原交联抗体法和令人瞩目的分子杂交免疫细胞化学技术。免疫金银技术和分子杂交免疫细胞化学技术将分别以专章 叙述,本节 仅就半抗原交联抗体法作一简要介绍。
【半抗原交联抗体法(Hapten –Coupled techniques)】
近年来,为提高敏感性和减低非特异性染色,有些学者(Cammisuli 1976; Jassani 1981;Falini 1983)在常规免疫细胞化学技术的基础上,发展了半抗原交联抗体法,可作免疫荧光或免疫酶染色。本法的基本原理是应用半抗原标记第一抗体。常用的半抗原有阿散酸,即对氨基苯砷酸(Arsanilic acid, ARS),对氨基苯酰甘氨酸(P—aminobenzoyl glycine),亚对氨苯酰甘氨酸(N—P—aminobonozyl glutamic acid)和二硝基苯氨基丙睛亚胺酸脂(dinitrophenyl aminopropionitrileimido ester, DNP)。通过酰胺化反应把半抗原结合到抗体分子上。在间接法(二步法)中,先以半抗原标记的特异性抗体(第一抗体)孵育切片,然后加入半抗原的标记抗体,(标记物可为荧光素或酶)(图6-4)。在PAP染色(三步法)中,先用半抗原标记的第一抗体孵育切片,再加未标记的抗半抗原特异性抗体作为桥抗体,第三步加半抗原交联的PAP与之反应,并作酶的呈色反应(图6-5)。第一和第三抗体分别为半抗原标记的特异性抗体和以半抗原标记的抗酶抗体制备的含半抗原的PAP复合物。本法具有许多优点,主要是:①敏感性高。由于本法是通过酰胺化反应标记半抗原,对抗体活性损失极小,抗体保留较高的活性,能结合较大量的半抗原,平均每个球蛋白分子可同时结合20个半抗原分子,每个半抗原又可用抗半抗原抗体相结合,特异免疫反应明显放大,其敏感性明显高于常规的免疫酶和免疫荧光染色技术,特别有助于发现滴度低的同种抗血清和含抗原量较少的组织。②可用于双重免疫染色。利用两种交叉反应的半抗原如阿散酸和对氨基苯酰甘氨酸分别标记来自同一种动物的两种特异性(第一抗体)血清,应用两步法或三步法,即可在同一张切片内同时显示两种不同的抗原。③由于特异性强、敏感性高,因此背景染色低。

图6-4 半抗原标记抗体酶技术—两步法

图6-5 半抗原标记抗体酶技术—PAP法
参考文献
1.Bayer EA, et al .Affinity Cytochemistry:The localization of lectin andantibody receptors on erythrocytes iva avidin—biotin complex.FEBS Letters, 1975;68:240
2.Brabec RK, et al .Differential lectin binding tocellular membranes in the epithelium of the new born rat.Proc Natl Acad Sci USA, 1987;77:477
3.Falini B. New development inimmunoperoxidase techniques and their application.Arch Pathl Lab Med, 1983;107:105
4.Jasani B. Et al. Use of monoclonal antihaptenantibodies of immno—Iocalization of tissue antigens.J Clin Pathol, 1981;34:100
5.Kivela T and Tarkanen A.A lectin cytochemical study ofglycoconjugates in the human retina.Cell Tissue Res, 1987;249:277
6.Newman RA, et al .Binding of peanut lectin to breastepithelium, human carcinoma and cultured rat mammary stem cells:Use of the lectin as a marker ofmammary differentiation.J Natl Cancer Inst, 1979;63:1339
7.Ponder BAJ, et al .Lectin histochemistry. (Immunocyto—chemistry Eds.JM Polak and SV Noorden )WrightPSG Bristol London Boston 1983;129
8.Rose ML, et al .Peanut lectin binding propertiesof germinal centres of mouse lymphoid tissue.Nature, 1980;284:364
9.Streit WJ and Kreutzberg GW.Lectin binding by resting andreactive microglia. Neurocytology, 1987;16:249
10.Virtanen AL, et al .Fluorochrome – coupled lectinsreveal distinct ceullar domains in human epidermis.J Histochem Cytochem, 1986;34(3):307
11.Watanalte M, et al.Discrete distribution of bindingsites for Dolichos biflrous agglutinin and for peanut agglutinin (PNA)in mouseorgan tissues.J Histochem Cytochem, 1981;29:779
12. 王益寿.葡萄球菌蛋白A的性质和应用.国外医学(生物制品分册),1980;4:145
13. 张华忠,等. 凝集素在人体正常组织的定位.中华医学杂志,1985;65:144~147
14. 沈铭昌,等.应用DBA标记胃粘膜上皮化生与胃癌的关系.肿瘤,1987;7:55~57
15.Ueda T, et al.Lectin histochemistry of maligantfibrohistocyte tumors.Am J Surg Pathol, 1987;11(4):257
16.Ree HJ.Lectin disfinction of benign frommalignant histocyts.Cancer, 1985;56(8):2046
第七章 电子显微镜免疫细胞化学技术
第一节 电子显微镜免疫细胞化学技术概述
免疫细胞化学技术为在细胞水平上研究免疫反应做出了贡献,但由于光学分辨率的限制,不可能从细胞超威结构水平观察和研究免疫反应。因此,Singer于1959年首先提出用电子密度较高的物质铁蛋白(ferritin)标记抗体的方法,为在细胞超威结构水平研究抗原抗体反应提供了可能。在此基础上,相继发展了杂交抗体技术、铁蛋白抗铁蛋白复合物技术、蛋白A-铁蛋白标记技术、免疫酶技术及胶体金技术等。电子显微镜免疫细胞化学技术(以下简称免疫电镜技术技术)区别于免疫细胞化学和常规电镜技术主要在以下几方面:
一、组织固定与取材
在这方面的要求是即要保存良好的细胞超威结构,又要注意保持组织的抗原性。因此,选用固定剂不宜过强。常用的免疫电镜固定剂有多聚甲醛—戊二醛混合液和过碘酸-赖氨酸—多聚甲醛液(Periodate—Lysine –Paraformaldehyde简称PLP液)。也有采用Bouin氏液、Zamboni氏液或4%多聚甲醛液(其配制法见附录)。国外不少文献推荐应用PLP液于免疫电镜技术,认为该固定液对含糖类丰富的组织固定效果特佳,因为组织抗原绝大多数由蛋白质和糖两部分组成,抗原决定簇位于蛋白部分,有选择性地使糖类固定,就可使抗原性稳定。PLP液中过碘酸能氧化糖类,使其产生醛基,再经赖氨酸作用,使新形成的醛基分子间和分子内相互连接,稳定组织抗原。但赖氨酸价格较贵,不如多聚甲醛戊二醛固定液经济、简便、效果佳。在取材方面,免疫电镜技术较光镜免疫化学技术要求更迅速、精细。
二、免疫染色
分为包埋前染色、包埋后染色和超薄切片免疫染色三种。
1.包埋前染色即先行免疫染色,在解剖显微镜下将免疫反应阳性部位取出,修整成小块,按常规电镜方法处理,经锇酸固定、脱水、包埋。如果特异性免疫反应的范围太小,为了准确定位,可作第二次包埋,即第一次包埋时将组织置于两层thermanox塑料片之间,中夹环氧树脂如夹心面包式,进行高温聚合,然后在解剖显微镜下取出需要部位作第二次包埋。包埋前染色的组织,以中层较为理想。表层因受机械修整,结构往往保存不好,深层因抗体不能透入,免疫反应弱或无。在作超薄切片前应先切半薄切片,寻出免疫反应阳性部位。根据作者经验,半薄切片可在相差显微镜下不染色进行观察(指PAP染色法),免疫反应部位呈黑点状。在HE或甲苯胺蓝染色的半薄切片上,免疫反应部位呈棕黄色。据此定位作超薄切片,可大大提高阳性反应检出率。为避免电镜铅、铀染色反应与免疫反应之间的混淆,可取相连续的起薄切片,分别以两个铜网捞取,其中之一进行染色观察,另一以铀单染色或不染色进行对照观察。
包埋前染色法的优点是:①切片染色前不经过锇酸后固定、脱水及树脂包埋等过程,抗原未被破坏,易于获得良好的免疫反应。②可在免疫反应阳性部位定位作超薄切片,提高电镜下的检出率。特别适用于含抗原量较少的组织,但由于经过一系列的免疫染色步骤,常出现一定的超微结构损伤。
2.包埋后染色组织标本经过固定、脱水及树脂包埋、制成超薄切片后,再进行免疫组化染色。由于是以贴在网上的超薄切片进行免疫染色,故又名之载网染色(on grid staining)。必须指出的是:①后固定中是否应用四氧化锇存在不同意见,作者经验一般以不用四氧化锇为佳,或尽量缩短在四氧化锇中停留的时间。有作者认为,从理论上讲,四氧化锇具有保存抗原的作用,但实践证明应用四氧化锇可使抗原活性明显减低。②在载网染色过程中,铜网易与化学物质产生反应,故需选用镍网或金网。③在免疫组化处理的全过程中,应注意保持网面的湿润,网面干燥会影响抗体活性。本法的优点是超微结构保存较好,方法简便,阳性结构有高度的可重复性,还能在同一张切片上进行多重免疫染色。但抗原活性在电镜生物样品处理过程中可能减弱甚至丧失;环氧树脂中的环氧基,在聚合过程中可能与组织成份发生反应而改变抗原性质;包埋在环氧树脂中的环氧基,在聚合过程中可能与组织成份发生反应而改变抗原性质;包埋在环氧树脂中的组织不易进行免疫反应等。因此,免疫组化工作者曾试图以不同的方法如饱和苯溶液,无水酒精中NaOH饱和溶液或乙氧化钠溶液等以减少或去除包埋剂,取得不同程度的效果。现普遍采用的是在进行免疫染色前,以H2O2液蚀刻数分钟,以去锇和增强树脂的穿透性。
3.超薄冰冻切片按照Tokuyasu建立的方法,将组织置于2.3mol/L蔗糖液中,以液氮速冻,在冰冻超薄切片机上切片,切片厚度可略厚于常规树脂切片。冰冻超薄切片由于不需经固定、脱水、包埋等步骤,直接进行免疫染色,所以抗原性保存较好,兼有包埋前和包埋后染色的优点。
三、包埋
(一)树脂包埋
国内现普遍采用的是环氧树脂包埋法,可直接脱水后包埋,也可将小片组织或半薄切片贴在载片上,将充满环氧树脂的明胶囊倒置于切片上聚合、硬化,进行原位包埋。
(二)低温包埋
常规树脂包埋由于需高温聚合等处理程序,组织抗原性可能全部或部分丢失。因此,在免疫电镜技术方面,国外不少实验室已开始采用低温技术如低温包埋和冰冻超薄切片等,后者需配备冰冻超薄切片机,且技术难度较大,不如低温包埋法易推广。低温包埋剂的研究开始于60年代,80年代免疫细胞化学技术在电镜水平上的广泛的应用,为低温包埋剂的实验研究开辟了广阔的领域。国内已有较多的应用报道,国内一些实验室已开始摸索。作为低温包埋剂的多为乙烯系化合物如乙二醇甲基丙烯酸酯(Glycolmethacrylate,GMA),Lowicryls, LR White和Lr Gold等,目前国外生产厂家有Polysciences INC , Reichert—Jung 和LKB等系列产品。现将常用的几种低温包埋剂及其应用简单介绍如下:
1.Lowicryls 是丙烯酸盐(acrylate) 和甲基丙烯酸盐(methacrylate)化学物质,包括K4M、HM20、K11M、KM23等系列产品(Polysciences INC),其特点是能在低温下保持低粘度(K4M:--35℃;HM20:-70℃;K11M、HM23:-60℃~-80℃)和具有在光照射(紫外光,波长360nm)下聚合的能力,它的光聚合作用与温度无度。其中K4M和K11M具有亲水性,特别适合于免疫细胞化学的应用,因它能较好地保持组织结构和抗原性,减少背景染色。HM20和HM23具疏水性,能产生高反差图像,适用于扫描、透射电镜和暗视野观察切片的制作。所有这些种类的低温包埋剂都适用于冰冻置换技术。K4M的应用和报道较多,现侧重介绍如下:
(1)包埋剂的配制:商品提供的Lowicrys包埋剂由三个部分组成:单体(Monomer),交联剂(Crosslinker)和引发剂(Initator)。调整单体和交联剂的比例,增加交联剂的量,组织块的硬度增加。中等硬度的组织块,其配制比例如下:
K4M:单体 17.30g
交联剂2.70g
引发剂0.10g
K11M:单体19.00g
交联剂1.00g
引发剂0.10g
作者的经验,可用微量注射器加针头抽取后,注入棕色的玻璃容器避光,用玻棒轻搅3~5min或用一小管通入液氮气泡以搅拌之。勿过分搅拌,以防氧的气泡进入包埋剂中。
(2)生物样品处理程序(Lemanski 等1985)
①动物麻醉取材,以多聚甲醛—赖氨酸—过碘酸钠在9℃固定2h。
②磷酸缓冲液含7%蔗糖,pH7.2,冲洗过夜,0℃
③0.1mol/L 磷酸缓冲液,pH7.2,冲洗,0℃
④脱水:65%乙醇,1h ,0℃
80%乙醇,2h,-35℃
LowicrylK4M:80%乙醇=1:11h -35℃
LowicrylK4M:80%乙醇=2:11h -35℃
100%Lowicryl K4M 1h -35℃
100%Lowicryl K4M 过夜-35℃
⑤包埋:新鲜K4M置于胶囊内,将组织移入,在-30℃~-40℃以紫外线灯波长360nm 2× 15W(Ladd Research Industries Burlington VT)相距30~40cm照射24h使之聚合。如为100W灯泡,照射距离应大于85cm。聚合后的胶囊移至室温在紫外线下继续照射2~3天,可增加其硬度,便于切片。
(3)免疫染色
①切片(厚50~70nm)贴在金网或覆有碳膜的镍网上。所有下列步骤在室温、湿盒内进行。所有溶液需经微孔滤纸(0.25~0.45μm)滤过。
②正常羊血清30min。
③第一抗血清(PBS稀释),37℃2h。
④可用烧杯法(或塑料壶喷洗法),以镊夹镍网在第一烧杯中洗荡30min,然后在第二烧杯中洗荡1h 。
⑤正常羊血清30min。
⑥第二抗血清(胶金标记抗体)以正常羊血清稀释为1:1,以镍网置于血清滴上孵育1h。
⑦冲洗如④。
⑧覆于2%OSO4水溶液上,30min。
⑨冲洗如④。
⑩干燥后在电镜下观察。
(4)Lowicryl K4M快速包埋染色法(Altman等1984)
①包埋剂的配制:单 体13g
交联剂2g
引发剂75mg
②生物样品处理:除了聚合这一步骤外,下列所有步骤都在20℃进行。
1)组织用3%戊二醛—3%多聚甲醛磷酸缓冲液,pH7.4,在20℃固定1~2h。用磷酸缓冲液清洗后进行脱水。
2)脱水:在50%、75%和90%的双甲基甲酰胺(Dimethylformamde,DMF)内系列脱水,每步10min。
3)浸透:Lowicryl K4M:DMF=1:2 10min
LowicrylK4M:DMF=1:1 15min
100%Lowicryl K4M 20min
100%Lowicryl K4M 25min
4)包埋与聚合:组织移入装满K4M的胶囊中,以紫外线灯照射聚合(紫外线灯条件同上),灯和组织距离10cm,4℃照射45min,组织块在室温进行超薄切片(切片时水槽内水面应略低以防浸湿组织块的切面)。
5)以覆有碳膜的镍网捞取切片。
6)免疫染色。
整个包埋时间仅需4~5h。
Lowicryls应保存在暗处,-4℃,该物质有刺激性,在配制时应戴手套,以免触及皮肤。在通风橱内操作,以免蒸气刺激眼睛。如触及皮肤和眼睛,应立即以水冲洗局部,氧化重金属如KmnO4能与包埋剂作用而影响染色效果,以不用为佳。
2.LR White 和Lr gold 是一种混合的丙烯酸单体的透明树脂,具有极低的粘度(8cps)和较强的嗜水性,因此有较强的穿透性,有利于抗体(或抗原)和免疫化学物质穿过LR树脂,达到组织结合部位。在免疫细胞化学的光镜(半薄切片)和电镜水平应用都具有良好效果。标本脱水至70%乙醇即可,能较好地保持抗原性。Lr white和Lr gold在国外提供厂家有 Poly-sciences INC等,Lr gold是一种光引发低发低温聚合的包埋剂,对于免疫细胞化学特别适用,能最大限度地保持组织的抗原与抗体活性,其最佳光聚合温度在-25℃,在聚合后呈现金黄色,因而得名。Lr white可在热和冷两种情况下聚合,热聚合在60℃,24h,冷聚合在-25℃,需加加速剂(accelerator)调整配制比例。生物样品处理与免疫染色等同常规树脂切片。
3.GMA 是乙二醇甲基丙烯酸酯(Glycol Methacrylate 即2—hydroxyethyl methacrylate, HEMA)的缩写。远在60年代,电镜工作者就试图将其作为生物包埋剂应用于光镜和电镜。GMA作为电镜包埋剂的优点是电子密度大,影像反差好。但存在三个主要缺点:一是包埋聚合后的组织块很脆,不易修整和切片。二是聚合过程中易造成组织损伤如人为的细胞器肿胀。三是缺乏稳定性,不能承受电子束的轰击,包埋剂遇热升华,造成组织塌陷变形。故后来为环氧树脂所取代。聚合后的环氧树脂有良好的塑料稳定性,能承受电子束的轰击不变形,而且影像反差好,分辨率高,但其半薄切片染色不够满意始终是个有待解决的问题。而GMA包埋切片的染色效果明显优于环氧树脂。于是电镜工作者如Leduc和Bernhard(1986)尝试以增加一定比例的增塑剂如甲基丙烯酸酯和少量水外,并加入适量的增塑剂如聚乙二醇400(PEG400)以改变其硬度,加入适量的闻联剂乙烯二甲基丙烯酸酯(ethylene dimethacrylate)以增强其抗电子束轰击的稳定性。为避免聚合时过快,产生高温,损伤组织结构,选用低温型引发剂—过氧化苯甲酰(Benzoyl Peroxide),温度范围-10℃~-30℃。经过不断的配制改进,现GMA已广泛应用于半薄切片(1~3μm)的光镜观察,特别是组织化学方面的研究和电镜水平的免疫细胞化学技术。现将GMA包埋剂的配制、生物样品处理和电镜水平的免疫细胞化学染色方法简介如下:
(1)GMA单体溶液在出厂时都加有氢醌类稳定剂,用前须以每25ml单体溶液加一匙活性碳,在振荡器上振荡5min,过滤以除去氢酯,以免影响聚合。
(2)包埋剂的配制:
a. 100%GMA66.5ml
N—甲基丙烯酸丁酯 28.5ml
5%乙烯二甲丙烯酸酯 5.0ml
1.5 %过氧体苯甲酰 1.0g
1.0%PEG4001.0ml
b.A液:
GMA单体液 90ml
PEG 400 5~9.4ml
过氧化苯甲酰0.2~0.69g
搅拌溶解后置棕色瓶内; 4℃保存。
B液:
PEG 400 20ml
二甲基苯胺1ml
应用时A:B按10:1比例充分混合(张承志等1986)。
(3)生物样品处理:组织固定可用PLP液或1%戊二醛溶液(磷酸缓冲液配制,pH7.4)。经系列酒精脱水至新鲜的GMA单体溶液中浸24h。以上步骤可在室温或4℃进行。
(4)包埋聚合:组织移入盛潢包埋液的胶囊内,先放在真空泵内以去除包埋液中的气泡,然后在4℃,以紫外线灯(波长360nm)在距胶囊底部10~20cm处进行照射12~16h,以手指捏胶囊试其硬度可知聚合是否完成。在聚合完成后,将胶囊丢入热水中以去除胶囊外壳。
(5)切片贴在镍网上,按PAg技术进行包埋染色,其区别于EPON包埋剂者,在于GMA包埋切片染色所需时间较短,在第一抗血清中,GMA室温只需孵育1h,而EPON包埋切片需16~20h;在第二抗血清,即Pag 复合物中室温30min,而EPON包埋切片需1h。铀、铅双染后,电镜观察。
低温包埋剂常用于铁蛋白或胶体金免疫电镜技术的包埋后染色。能检出应用环氧树脂包埋难以检出的多种抗原。
四、对照试验
为确定方法的特异性,免疫电镜技术也需进行对照试验(同第一章 )。
总之,不论哪一种免疫电镜技术都面临微细结构的保存和组织中抗原活性的保存这一对矛盾,如戊二醛、锇酸等固定液有利于微细结构的保存,但对抗原活性有影响,而H2O2能增加树脂穿透性,但对微细结构有损伤,能使反应部位产生孔洞。在生物样品处理过程中,应同时注意到这两个方面。其次,每次免疫染色中的清洗工作应注意彻底,否则非特异性产物和其他污染物会影响特异性反应产物的显示和观察。根据作者经验,以塑料水壶加锥形喷水头喷洗,与镍网面成平行方向,即顺网面喷洗,较之目前通用的杯水洗涤法易于达到清洁目的。冲洗的残留水滴以滤纸吸干时,应注意不要触及载网本身。可将滤纸剪成三角形,以尖端接触水滴,即可达到吸干水份的目的,整个过程中,必须应用双蒸水,容器应专用。
第二节 免疫铁蛋白技术
一、基本原理
铁蛋白是一种含铁约占23%的蛋白质,分子量460kD,直径10~12μm。抗体与铁蛋白通过低分子量的双功能试剂结合为一种双分子复合物。此复合物既保留抗体的免疫活性,同时因为铁蛋白含有致密的铁离子核心,铁胶粒直径核心为55~60nm含2000~3000个铁原子,分布于四个区域,形成四个圆形致密区,具有很高的电子密度,便于电镜观察。铁蛋白来自许多动物,以肝、脾含量较高,其中马脾脏含量最高。因而,商品铁蛋白主要是从马脾脏中提取的。
二、铁蛋白的提取和纯化
取健康的马脾(新鲜或冰冻均可),去除脾外的淋巴结和脂肪组织,按湿重1:1.5或1:2加入蒸馏水,用组织匀浆器将组织匀浆,置水浴中加热至75~85℃,使铁蛋白以外的蛋白质变性,冷却后用2~4层纱布过滤,滤液离心取上清液,每100ml上清液中加入35g硫酸铵,充分搅拌使铁蛋白沉淀析出,4℃过夜,3000~10000r/min离心20min,弃去上清液,刮取沉淀物置透析袋内,剩余沉淀物以蒸馏水洗后,一并加入透析袋内对水透析,除去硫酸铵。100ml中加入4~5g硫酸镉使炎结晶,在室温或4℃冰箱内使之出现铁蛋白结晶。此铁蛋白结晶以2%硫酸铵(pH5.58)溶解后,如上述再用硫酸镉使之结晶。反复溶解,结晶六次,达到纯化。纯化后铁蛋白在半饱和的硫酸溶液内可保存1~2年。用时以蒸馏水透析除盐后即可应用,应用前可以用负染色法在电镜下观察,了解铁蛋白的完整性和纯度。
商品制备的铁蛋白是用2%硫酸铵溶液稀释的1%~2%溶液(pH5.85)。为了在应用中得到满意的结果,应用前必须将商品制备的铁蛋白进一步纯化。纯化的方法是用0.1n NaOH或0.1n HCl调整pH值至5.85,然后加入20%硫酸镉溶液使其在铁蛋白液中最终浓度为5%硫酸镉,此溶液置于4℃冰箱内2h(或过夜)至结晶完成,离心1h(2000r/min)充上清液。铁蛋白结晶再溶解,离心除去不溶性颗粒,倾出上清液,加入5%硫酸镉再结晶,至在显微镜下呈棕红色铁蛋白结晶为止。将结晶溶于2%硫酸铵溶液中,用50%5硫酸铵溶液沉淀三次,第三次沉淀形成的沉淀物溶于少量蒸馏水中,先对自来水透析,再对0.05mol/L,pH7.5磷酸缓冲透析12~24h。纯化的铁蛋白溶液用100000r/min 超速离心2h ,除去3/4无色上清液,沉淀物(内含铁蛋白)在4℃过夜,待完全融解后,用微孔滤过器(Millipore filter, 孔径 0.25~0.45μm)过滤,保存1~2年内仍可使用。
三、铁蛋白与免疫球蛋白的结合
一般用低分子量的双功能试剂把两者联结起来,常用的双功能试剂有间苯二甲基二异氰酸盐(简写XC)。甲苯2,4二异氰酸盐(简写TC)。邻茴香胺(简写BDD);对,二氟一间,间,二硝基二苯矾(简写FNPS)和戊二醛。近年来,普遍认为戊二醛作为联结剂效果较好,对抗体活性影响小,标记抗体产量高。分为一步法和二步法,现简介如下:
1.一步法以15mg 铁蛋白和3mg球蛋白溶于0.9ml 0.1mol/L磷酸缓冲液中,pH7.0,加入0.1ml新鲜配制的戊二醛溶液,使其最终浓度为 0.005%~0.05%, 加入0.02%叠氮钠(NaN3)防腐,此混合液置37℃24h,无需搅拌,结合完毕后加0.01mol/L赖氨酸中止反应。
2.二步法
(1)在含50~80mg铁蛋白的0.1mol/L磷酸缓冲液(pH7.0)中,加入稀释的戊二醛,使其最终浓度为0.05%~0.15%,总体积为1ml。
(2)置37℃作用2h后,经葡聚糖G—25 滤柱,除去未结合的戊二醛。为避免不必要的稀释,只收集脱峰的中间部分。然后加入球蛋白(铁蛋白与球蛋白之比为5:1)即铁蛋白最终浓度为15mg/ml,球蛋白3mg/ml。
(3)混合液置37℃,作用12h(无需搅拌),加入0.01mol/L 的赖氨酸以中止进一步交联。两步反应都需在0.02% NaN2防腐条件下进行。
四、电镜标本的制备方法
1.固定同常规电镜一样,应用醛类和四氧化锇双固定,以维持细胞和组织的超威结构。有文献报告以4%的甲醛溶液在pH7.2的磷酸缓冲内,在0℃进行固定,并用四氧化锇作后固定,不会影响抗原的反应能力。高锰酸钾能使大部分抗原失去活性,一般不宜采用。另外,铁蛋白标记抗体的特点之一是分子量大。因此,如用于细胞表面抗原的定位研究,可将样品直接放入固定液,否则需采取适当的措施,打破细胞膜,增强细胞对标记抗体的通透性,常采取以下方法:
(1)冻融法:将小块组织或细胞经固定后,冻融一次,使细胞膜破裂,标记抗体能进入细胞内。
(2)冰冻切片法:固定后组织快速冷冻,切成10~15μm左右薄片,溶化的切片直接浸泡于铁蛋白标记抗体液中。
(3)有报道经戊干杯固定后,浸入4×10-3mol/L洋地黄皂甙液中1~2min,能有助于增强细胞膜的穿透性,使标记抗体液进入细胞内。
2.免疫反应处理常用包埋前染色,分直接法和间接法两种。在染色前,将组织切成约10~20μm厚的薄片。
(1)直接法:将薄片直接浸泡于标记抗体液中,室温或37℃作用1~2h或更长;缓冲液(有人提倡用冷缓冲液)浸漂,除去未结合的标记抗体溶液,然后转入常规双固定和电镜包埋。
(2)间接法:
①将组织切片浸于第一抗体液中,室温30~60min。
②以大量冷缓冲液充分搅拌洗涤,至少3次,每次30min。
③浸入铁蛋白标记抗体液中,室温30min。
④如②,用缓冲液充分洗涤后,可以自然沉淀或用离心方法捞取组织片。
⑤将离心沉淀小块,用四氧化锇固定30min。
⑥常规电镜脱水、包埋、切片、染色和观察。
第三节 免疫酶细胞化学技术
一、基本原理
免疫酶细胞化学技术是以酶作为抗原抗体反应的标记物,在既不改变抗原抗体的免疫反应特异性也不影响酶活性的条件下,与相应的酶底物作用,形成一种不溶性的反应产物。在光学显微镜下观察时,要求反应的终末产物是不溶性的有色物质,具有可观察性。在电镜下观察时,则要求底物的终末产物具有较高的电子密度。由于辣根过氧化物酶(Horse Radish Peroxidase, HRP)具有稳定性强和反应特异性高等优点,是目前应用最多的酶标记物。实验方法包括酶标记抗体法、非标记抗体酶法和非标记的过氧化物酶—抗过氧化物酶技术(即PAP法,见第四章 )。
二、电镜标本制备方法
免疫酶细胞化学技术可用于包埋前和包埋后染色,但以前者应用较多。
1.单层细胞培养物免疫酶染色法
(1)用4%多聚甲醛(在0.05mol/l 磷酸缓冲液中,pH7.2)在原位固定(4℃)1h。
(2)用0.05mol/l PBS充分洗涤后,用HRP标记的抗体血清作用18h,再用PBS充分洗涤。
(3)2%戊二醛固定1h,再水洗。
(4)呈色反应,用DAB—H2O2呈色反应,水洗。
(5)1%锇酸后固定30min~1h,原位用环氧树脂包埋,光镜作半薄切片定位,作超薄切片。
2.组织切片酶标记抗体染色法
(1)1mm厚组织块,在4℃下用固定液固定后,置于含4.5%的蔗糖PBS(0.05mol/l pH7.2),4℃中漂洗,换数次固定液,过夜。
(2)随后,作10~40μm的冰冻切片,放入第一抗体血清作用12~18h,4℃,用含蔗糖的PBS洗数次。
(3)置于HRP标记抗体液(第二抗体)4℃过夜。然后用4℃含蔗糖PBS反复冲洗数次。4℃浸漂过夜。
(4)2.5%戊二醛(pH7.4磷酸缓冲液)再固定1h,4℃用含蔗糖PBS反复冲洗去戊醛,每次5min,共洗3次。
(5)DAB-H2O2显色15~30min。
(6)0.05mol/l PBS冲洗3次,每次30min,再置于室温中用1%~2%锇酸固定1h,脱水、包埋、切片复染和观察。
3.PAP包埋前染色法(Pickel 等,1975)
经固定组织、应用振动切片机(Vibratome)切35~50μm厚片,或用组织铺片,以漂浮法在反应板上进行下列步骤:
(1)正常羊血清(1:30PBS稀释),室温孵育30min。
(2)第一抗体(A种动物抗血清),4℃湿盒中48~72h。
(3)羊抗A种动物血清(1:100)室温30min。
(4)A种动物血清PAP复合物(1:100)室温30min。
(5)DAB·4HCl/H2O2(0.05%/0.01%),室温1.5min。上述每一步骤后应用PBS洗涤(5min×3次)。
(6)在解剖显微镜下检出免疫反应阳性部位,修整组织,用0.1mol/L磷酸缓冲液稀释的1%锇酸(pH7.4)后固定30min~1h。
(7)按常规电镜样品制备,脱水、包埋、超薄切片、染色观察。
4.PAP包埋后染色法(Ordronneau, 1982)
(1)将载有切片的镍网(或金网)在5%的H2O2液中蚀刻(etch)2~3min。生理盐水冲洗,滤纸吸干。
(2)正常羊血清用0.05mol/L Tris盐液(TBS)稀释成1:30,pH7.0,室温5min 。
(3)兔抗血清(第一抗体),内含1%正常羊血清,用0.05%mol/l Tris缓冲液稀释,pH7.6,4℃,48h后以Tris缓冲液洗涤。
(4)正常羊血清1:30,室温5min。
(5)羊抗兔1:10(第二抗体,0.05mol/l Tris缓冲液稀释,pH7.0),室温5min,Tris缓冲液洗涤。
(6)正常羊血清1:30,室温5min。
(7)兔PAP复合物,内含1%正常羊血清,室温3min,Tris 缓冲液洗涤。
(8)DAB—H2O2液显色(含H2O20.01%~0.03%),室温3min。
(9)4%的磷酸盐缓冲的锇酸溶液10~15min,蒸馏水洗涤(此步用于改善微细结构的反差),电镜观察。
5.PAP免疫电镜双重标记
在连续的超薄切片上进行,用包埋后染色法在相邻的两张切片上分别以不同的抗体进行免疫染色。可在超威结构水平判定细胞内抗原共存的情况。
第四节 免疫电镜胶体金标记法
金标法是Faulk和Taylor(1971)提出的,并首先用于免疫电镜。它是利用胶体金在碱性环境中带有负电的性质,使其与抗体相吸附,从而将抗体标记。当用金标记的抗体与抗原反应时,在光镜水平胶金液呈现鲜艳的樱红色,不需加外进行染色。在电镜水平,金颗粒具有很高的电子密度,清晰可辨。因此,免疫电镜胶体金标记法近年来被成功地应用于生物学的各个方面,并取得了要喜的进展,解决了一些过去未能解决的问题,80年代以来似有取代免疫电镜PAP技术的趋势。胶体金标记抗体技术在电镜水平应用有许多优点:首先,手续不如PAP法烦琐,不需用H2O2等损伤微细结构的处理步骤,对微细结构的影响较少。其次,金颗粒具有很高的电子密度,在电镜下金颗粒清晰可辨,易于与其他免疫产物相区别。因此,金标法还可以和PAP法相结合进行双重或多重染色的超微结构定位。另外,利用不同直径的金颗粒标记不同的抗体,是研究突触小泡内神经递质共存的有力工具。由于抗原抗体反应部位结合金颗粒数量的多少可进行粗略的免疫细胞化学定量研究。金标抗体还可加入培养液中,对培养细胞内抗原进行标记定位。曾有报告用金标记法于细胞内骨架的研究获满意的效果。由于金具有强烈的继发电子的能力,因此,不仅可以用于透射电镜的超薄切片观察,也可以用于扫描电镜对细胞表面的抗原、受体进行标记定位观察。金标液无毒性,对人体无损伤。胶体金及胶体金标记物的制备见第五章 第3节 。在原位分子杂交技术在电镜水平的应用中,胶体金的标记术被科技工作者认为是当前最理想的标记物(详见第二十章 )。
一、电镜水平的免疫金染色法
应用于电镜水平的免疫法,可分为包埋前染色和包埋后染色,由于包埋前染色对细胞膜的穿透性差,一般只用于细胞表面的抗原标记,如需穿透细胞膜,则需辅以冻融法或加入Triton X—100、皂素等活性剂,后者会加重细胞超威结构的破坏,因此,现较普遍采用包埋后染色,现分别介绍如下:
1.包埋后染色
(1)超薄切片厚50~70nm左右,载于200~300网孔的镍网上。
(2)置1%H2O2内10min至1h(视树脂的硬度和切片的厚度而定),以去锇酸和增进树脂穿透性,有利抗体进入。如切片很薄或于低温包埋时,此步可省略。操作时,滴入1%H2O2液1滴于蜡板上,将网的载片面轻浮于液滴上。对中枢神经系统切片,有主张以1%过碘酸钾(KIO4)代替H2O2的。
(3)双蒸水洗3次,每次10min,第1,2次洗法如(2),浮于液滴上,第3次以盛双蒸水的注射器沿镍网面冲洗,水流应有适当压力,但不宜过高强,用滤纸在网缘将水吸干。
(4)浮于正常羊血清(1:50~1:100)滴上,室温30~60min,以饱和固定剂中的游离醛基占据非特异性结合部位。
(5)PBS漂洗3min,洗1次(有人主张不洗)。
(6)滤纸吸干,孵育于第一抗体血清滴上,先室温预孵1h,再置于4℃24~36h。
(7)PBS漂洗3min,3次。
(8)PBS(内含1%的牛血清白蛋白)pH8.2中,5min,此步为胶体金结合作准备。
(9)胶体金标记抗体液1:30~1:100,淡红色为适宜稀释液,室温孵育10min至1h。
(10)双蒸水洗3min,3次。
如作双重染色,则应将镍网翻过来,用另一类抗体血清,重复上述步骤(2)~(10)。
(11)5%醋酸铀(双蒸水配制)染5min,然后用双蒸水洗。
(12)枸橼酸铀(或醋酸铅)染色5min,双蒸水洗净。
(13)电镜观察。
2.包埋前染色
(1)组织经过适当固定,为增强细胞穿透性,可在固定液中加入皂角素(Saponin),使其浓度为0.01%,经含皂角认固定剂处理5~8min后,应用0.01mol/l PBS Ph7.4冲洗12h左右,中间换洗3~4次。
(2)组织切片贴于明胶涂抹的坡片上,细胞可制成混悬液,用离心法操作或制成涂片。
(3)0.05mol/l PBS pH7.4洗3min。
(4)以1:5正常羊血清处理切片30min室温,以阻断非特异性吸附。
(5)第一抗体4℃孵育20h后室温2h或过夜。
(6)0.05mol/l TBS pH7.4洗3min×3。
(7)0.02mol/l TBS pH8.2洗3min×3,为与胶体金结合作准备。
(8)再次阻断非特异性吸附,同(4)。
(9)以金标记的第二抗体(工作浓度1:40左右)在室温下孵育1h。
(10)0.05mol/l TBS pH8.2洗3min。
(11)0.05mol/l TBS pH7.4洗3min×3
(12)1%锇酸(0.1mol/l PBS溶液)1h。
(13)双蒸水洗15min。
(14)系列酒精或丙酮脱水,包埋、超薄切片。(15)枸椽酸铅对照染色。
为增加抗非特异性染色,有的实验室倾向在TBS中加入1%小牛血清白蛋白(Bovine Serum Albumin, BSA, Sigma)。理想的免疫金染色切片,背景应清洁,无残留的金或其他无机盐颗粒,金粒集中在抗原、抗体反应部位。要获得理想的免疫金染色切片,需注意的因素很多,其中主要的如:①抗体血清的高度特异性和亲和力;②被检组织应有较高浓度的抗原;③冲洗液的清洁度,冲洗的彻底程度以及整个过程中应用的各种器皿的清洁度等;④所有溶液最好用微孔滤过器(milipore filter滤过),滤膜孔径0.2~0.45μm,所有器皿应清洁和专用。整个操作过程应在湿盒内进行,以使载网保持湿润。
二、胶体金标记蛋白A技术(Protein A-goldtechnique, PAg法)
在电镜水平应用较为广泛,因该法具有特异性中、灵敏度高、方法简便和背景染色淡等优点。蛋白A的免疫特异性在第五章 已作了介绍,PAg复合物制备方法简便,作为第二抗体,无种属特异性,可以免去不同种属动物要制备不同的特异性免疫球蛋白。PAg 复合物与包埋剂和细胞成分都极少发生非特异性的交互作用,蛋白A和金粒间非共价的结合特性既不影响蛋白A的活性,又能保持高度的稳定性,PAg复合物分子最小易于穿透组织。
1.蛋白A—金(PAg)复合物的制备(Slot 和Geuze,1981)
(1)胶体金液的制备,应用枸椽酸三钠还原法(见第五章 )。
(2)待标记蛋白质和金溶液的准备,同前。注意点是用0.2mol/l K2CO3将金溶液pH调至5.9~6.2之间。
(3)确定胶体金与蛋白A的结合用量比例。取一系列盛有0.1ml胶体金液的小玻璃管,分别加入不同量的蛋白A,5min后,再各加0.25ml 10%的NaCl。如加入的蛋白A浓度不够,不能稳住金粒,在电解质NaCl的影响下,金粒聚合沉淀,溶液由红变蓝。选择能防止溶液由红变蓝的最低浓度的蛋白A的量作为两者的结合比例。以枸椽酸钠法制成的胶体金每毫升约需要5μg蛋白A来结合,方能保证其稳定性。
(4)胶体金与蛋白A的结合和纯化,依上法测得所需的比例超过10%,即每30ml胶体中加入2mg蛋白A,5min后,加入0.3ml PEG作为稳定剂,然后以15000r/min离心45min(不同方法制备的金离心速度不同),略带红色的松散的复合物沉淀即为PAg复合物。小心弃去上清液,加入PBS冲洗,如上,松散的PAg复合物置于PBS溶液中,按0.2mg/ml的比例加入聚乙二醇作为稳定剂,保存于硅化的玻璃器皿中备用,也有主张将上述PAg复合物放入3~6ml 5%甘油—0.05%聚乙二醇—0.02%叠氮钠混合液中,再离心,弃去无色上清液后,收取管底部浓缩纯化的PAg复合物置4℃保存。
据文献报告,此PAg复合物的原液在4℃可保存达一年之久。
2.
在电镜技术的应用原则是二步标记法,可用于包埋前和包埋后染色。其主要区别于一般胶体金免疫染色在:①须1%卵白蛋白—PBs (pH7.4)或1%卵白蛋白—0.05mol/l Tris缓冲液(pH7.4)来封闭非特异性的结合部位,而不是采用羊或其它的动物的正常抗血清,因为PAg复合物能够与正常血清组中的Ig结合,从而给出假阳性结果;②在应用第一抗血清孵育和PBS冲洗后作第二抗血清即PAg复合物孵育前的准备时,应用的PBS或TBS的pH应变更为pH7.4。在变更这两步后,其它可参照本节 中包埋前、后染色法进行。也可采用下列步骤进行包埋后染色。
(1)载有超薄片的镍网或金网浮于1%卵白蛋白—PBS液滴上,室温约5min。
(2)载网不冲洗,直接移至第一抗血清液滴上,在室温孵育2h或4℃18~24h。
(3)PBS冲洗3min×2次。
(4)将PAg原液稀释10~20倍,载网浮于该液滴上,室温孵育1h。
(5)PBS冲洗5min×2次。
(6)5%醋酸铀水溶液染色,水洗。
(7)枸椽柄铅染色。
(8)电镜观察。
三、胶体金双标记技术(常用为蛋白A—胶体金)
1.单面法以不同直径的金粒分别标记两种不同的抗体,以间接法先染第一种抗体,洗净后再染第二抗体。
2.双面法以不同直径的金粒标记的抗体于镍网的两面分另进行免疫染色。本法的优点是可防止两种金标记的抗体的相互干扰,又可防止第一次应用的一抗与其相应的抗原相结合,占据了空间,第二次应用的抗体没有适合的空间使之与相应的抗原相结合。
3.异种动物抗原—抗体染色法如一抗分别用人与兔抗血清,人抗组织抗原A,兔抗组织抗原B。第二抗体分别以不同直径金粒标记的抗人和兔免疫球蛋白。由于种属不同,两种抗血清不会互相干扰,在应用一抗和二抗时都可将两种血清一次混合使用,将四步减少为两步。
4.金标记抗原检查法(Gold—labelled antigen detection method, GLAD 法)此法是Larson(1977)年首先提出的,应用放射性同位素如125I或酶标记抗原进行染色。先用特异性抗体与组织抗原反应,标记的纯抗原又与特异性抗体反应。Larson(1980,1981)又在此基础上提出应用胶体金在电镜水平进行双抗原甚至多抗原定位。GLAD原理是:双价的Ig抗体分子过量地加到有抗原的组织切片上,使分子的两个抗原结合点中有一个结合到组织抗原上,而另一端可与标记金的抗原起反应。双标记时,预先将两种不同的抗原标以不同直径的金粒,可分别与相应的第一抗体相结合,从而显示出两种抗原在组织切片的定位。此法的优点是标记物所显示出的组织抗原的部位经过两次选择,标记了抗原只能与相应的特异性抗体相结合而不能与切片中非特异性Ig相结合,因此具有较高的特异性。但由于使用此法时需备有与欲检抗原相同的纯抗原,并要对不同抗原分别进行标记,非一般实验室所能做到,所以至今尚未被广泛应用。
双面金标记法操作程序(Cai et al 1993, 改良自Bendayan et al 1982).
(1)镍网面A(树脂包埋)
①蒸馏水冲10min。
②10% H2O2蚀刻10min室温
③10%正常血清(以0.5mol/l Tris缓冲液pH7.4、含1%BSA和2%Tween20 稀释,简称TBT缓冲液)室温30min。
④以滤纸吸去多余液体,覆于特异性第一抗体1:500(Tris 缓冲液,pH7.4,含1%BSA和0.1%叠氮钠)4℃,孵育过夜
⑤彻底清洗,应用0.5mol/L Tris缓冲液pH7.2,不含BSA
⑥继之用0.5mol/L Tris缓冲液pH7.6,含1%BSA冲洗
⑦0.5mol/L Tris缓冲液pH8.2,含1%BSA,室温孵15min
⑧羊抗兔IgG标记以15nm金粒,应用0.5mol/l Tris缓冲液pH8.2、含1%BSA稀释1:40,孵育2h,室温
⑨0.5mol/L Tris缓冲液pH7.4 冲洗
⑩蒸馏水冲洗
(2)镍网面B,重复①~⑩,只在第④时更改另一特异性一抗,在⑧时羊抗兔IgG标记以5nm金粒。
(3)铀铅双重染色,电镜观察,可见二种不同直径金粒标记。
注意事项:①所有溶液均须经加有微孔滤纸(0.45μm孔,国内外现均有商品提供)的注射器过滤,过滤后直接以注射器冲洗。②滤纸最好用无纤维吸水滤纸。③冲洗在胶金标记技术上是个决定性关键,仅次于抗体血清的纯度。笔者的体会是一般应漂洗3×5min,以注射器喷水漂洗效果优于杯漂洗法,但漂洗水流需与网面平行,勿使水压破坏切片。
四、免疫电镜金—银法染色技术
关于免疫金银细胞化学的原理、试剂配制和光镜显示技术在本书第五章 已作了较详尽的叙述。免疫金银细胞化学技术说可应用于电镜水平。一般用于包埋前染色。其主要操作步骤如下:
(1)组织固定振动切片机切片10~30μm。
(2)人3%正常羊血清,含0.1%Triton X—100 的PBS孵育30min,以封闭非特异性结合部位
(3)1%硼氢化钠的PBS孵育30min。
(4)一抗37℃,2h。
(5)PBS含0.1%BSA pH7.4 冲洗3min×3次。
(6)PBS含0.1%BSA pH8.2 冲洗3min×3次。
(7)人10~15nm金标羊抗兔抗血清,工作浓度约1:10,37℃孵育45min。
(8)硝酸银液物理显影(详见第五章 第六节 )。
(9)在解剖显微镜下取免疫反应阳性部位,人1%锇酸后固定20min,常规脱水,树脂包埋。
(10)超薄切片机切0.1μm左右半薄切片,定位阳性反应部位,制超薄切片。如有暗视野微镜则更有助于定位。在暗视野前景下,金银粒呈金黄色闪光颗粒,即使微量金银也可定位,微镜则更有助于定位。在暗视野前景下,金银粒呈金黄色闪光颗粒,即使微量金银也可定位。
(11)铀—铅电镜染色,电镜观察。
免疫金银法敏感度高,金银颗粒电子密度高,反差强;应用包埋前染色可先定位阳性反应部位再作电镜超薄切片,获得阳性反应机率高,特别适用于含微量抗原的部位,如突触等。其不足是须经暗室显影,手续较烦杂,包埋前免疫染色易增加非特异性染色。另外,由于单个金粒周围结合的银粒不是固定的,受多种因素影响。因此,电镜免疫金粒染色法的金粒银粒计算不适于做半定量观察,误差较大。
第五节 其它免疫电镜技术
一、凝集素电镜标记技术
凝集素的特性及标记原理详见第五章 ,近年来,凝集素电镜标记技术应用日益广泛,且获得较为满意的效果。凝集素电镜标记技术方法较多,常用的有凝集素—酶(常用为HRP)、凝集素—生物素—酶电镜标记技术。现将凝集素—酶电镜标记技术(包埋前染色)简介如下(Sterit 和Kreatzberg,1987)。
(1)固定:常用为PLP或多聚甲醛—戊二醛固定液。如为取脑组织,可将已藻注动物在4℃过夜,次日取脑组织置0.1mol/L磷酸或二甲胂酸钠缓冲液(含7.5%蔗糖)中漂洗。
(2)振动切片机(Vibratome)切60μm的厚片。
(3)切片孵育在PBS(内含0.1mol/l CaCl2、Mgcl2和MnCl2)10min(有作者主张此步可省略)。
(4)为增强细胞通透性,切片可孵育于含0.1%胰蛋白酶和0.1CaCl2水溶液中,pH7.8,37℃孵育30min。
(5)PBS洗3次,每次2min。
(6)凝集素—HRp 1:10 在PBS中(含0.1%Triton X--100)4℃过夜,最好不断轻轻振荡。
(7)PBS洗3次,每次2min。
(8)DAB-H2O2显色。
(9)1%OSO4水溶液固定。
(10)系列酒精脱水,EPON包埋,切片。
(11)电镜沿—铀双染观察。
凝集素呈高电子密度常沉积在细胞膜上,易与电子染色相区别。
二、扫描免疫电镜技术
扫描免疫电镜技术可为研究细胞或组织表面的三维结构与抗原组成的关系提供可能性。
(一)标记物
应用于扫描电镜的标记物应能在扫描电镜可分辨的范围内,并能对细胞或组织抗原有较好的定位能力。在选择标记物时应根据研究目的而定,如标记细胞等由于体积较大,可用体积大的标记物;如鉴别阳性(标记细胞)与阴性(未标记细胞),而要定位受体等则需选用较小的,易于辨认的标记物。
常用的标记物为颗粒性标记物。依其特性可分为:
1.蛋白类 如血蓝蛋白、铁蛋白等。
2.病原体类 如烟草花叶病毒、南方菜豆花叶病毒、噬菌体T4、大肠杆菌f2、噬菌体等。
3.金属颗粒胶体金、免疫金银标记技术和同位素放射性自显影的银颗粒等。其中以金属类颗粒标记物应用最为广泛。最常用的是胶体金,胶体金商品提供的直径从3~150nm不等,扫描免疫电镜常用的金颗粒直径在30~60nm左右为宜。由于金本身系重金属,有较强的发射2次电子的作用,故不需喷镀金属膜,这是胶体金应用于免疫扫描电镜的标记优于其它标记物之处。免疫金银染色能加强细胞或组织表面金属颗粒聚集的密度。金、银粒在电镜显示为电子密度高,外形清晰的颗粒易于识别和定位。病原体标记物主要利用其特异殊的外形和结构以达到标记定位的目的,如噬菌体T4形似星形的球拍,头部大约100nm直径,呈六角形星状,尾长约100nm,由颈部与头部相接;烟草花叶病毒为15×30nm的杆状病毒,而南方菜豆花叶病毒是直径25nm的园形颗粒,这些病原体的典型外形很易于辨认。铁蛋白由于含有致密的铁离子核心具有较高的电子密度,从而达到标记定位的目的。血蛋白是由海螺类软体动物中提取的多分子聚合物,其外形为35×50nm的柱状体,多应用于病毒研究,但也有利用血蓝蛋白与过氧化物等的糖蛋白部份可与凝集素相结合的特性,进行细胞膜受体的定位。
(二)免疫标记方法
金属类标记物的免疫标记法同切片免疫染色,即将标记物与抗体相结合,通过直接或间接法显示抗原部位。胶体金可与蛋白A相结合后与IgG分子中的Fc 段相结合。哪与卵白素(a-vidin)相结合可与结合抗体的生物素(biotin)反应。免疫金银染色法在胶体金标记后,再进行银液显影。病毒(包括噬菌体)标记物多采用不标记抗体法,即搭桥法。此法的原理是采用同种动物制备抗原的特异性抗体与标记物抗体(例如兔抗A抗原与兔抗HRP)。再用另一种动物制备第一种动物血清抗体的抗体(例如羊抗兔IgG抗体)。利用后者为桥,把抗原的特异性抗体与抗标记物抗体结合起来,后者再与标记物结合,以达到定位抗原的目的,其基本原理与PAP法类同。病原体免疫标记可不用标记物显示,而利用其形态学特征定位或采用抗原抗体凝集法,其基本原理是利用病毒或病毒抗原的特异性抗体在与相应的抗原反应后,使后者之间发生交联而凝集,经浓缩后用阴性染色法(负染)便可在电镜下显示定位部位。
(三)扫描免疫电镜的具体操作步骤
1.标本处理
(1)细胞悬液:用10ml PBS 内含1mg/ml牛血清白蛋白(PBS—BSa )悬浮细胞,离心250g,5min×2。加入PBS—BSA 至105~106细胞/ml,振摇成单细胞悬液。BSA能减低生物标本的非特异性吸附,但注意浓度应适宜,过高会减弱特异性反应。
(2)细胞附着于固体支持物:由于固定与免疫标记的孵育过程会引起细胞凝集,妨碍细胞表面的暴露,而且反复的离心与悬浮会导致细胞表面形态的改变。因此,通常将悬液中的细胞粘附于过滤膜或涂有带正电荷聚合物的盖玻片上,在粘附之前可依(1)法清洗标本,以除去细胞表面的附着物。固体支持物可用涂有多聚—L—赖氨酸薄膜的载片或直径13nm、孔径0.22或0.45μm的过滤膜,载片制备方法:多聚—L—赖氨酸(Sigma)100μg/ml重蒸溶解涂抹于载片上,4℃30min后倾倒掉表面液体,令其自然干燥。注意载玻片事先需要清洁液浸泡,水漂洗过夜,然后浸泡于乙醇或丙醇中,用前取出自然干燥或用绸巾拭干。将细胞悬液(如细胞数少可事先离心,取沉淀细胞),滴于滤膜或载片上,由于多聚赖氨酸的粘附性,在固定及免疫标记过程中细胞不至于脱落。但注意勿使细胞干燥。
(3)组织切片与固体组织:组织切片如为石蜡包埋应预先脱蜡,由二甲苯经梯度酒精至水。组织切片与固体组织(勿过大)均应以PBS—BSA冲洗,并保持湿润避免干燥。
2.固定
(1)固定前用PBS—BSA冲洗5min×3。
(2)选择加入适合的固定剂;可为4%多聚甲醛+0.1%~0.5%戊二醛在pH7.4的磷酸缓冲液中。室温固定10~60min,或4℃30~120min。
(3)PBS—BSA冲洗5min×3。
(4)除去残留的自由醛基,选以下任一方法:
①0.5mg硼氢化钠/1ml PBS 10min(新鲜配制)
②0.05~0.2mol/l 甘氨醊或赖氨酸—HCl/PBs 30~60min。
③0.1~0.5mol/L氯化钠/PBs 30~60min。
④PBS—BSA冲洗5min×3。
3.免疫标记与透射免疫电镜的原则及步骤基本相同。
免疫金银染色法举例(张留保等,1997)
(1)血细胞以PBS—BSA冲洗5min×3。
(2)2%多聚甲醛—戊二醛混合液固定,4℃,1h
(3)PBS或TBS反复冲洗5min×3。
(4)胶体金免疫标记程序(略)
(5)暗室显影液显影
(6)扫描电镜样品制样
(7)观察
作者在血细胞膜外显示了密集的金银粒标记(特异性标记膜的谷胱甘肽过氧化物酶及激素肽)。
4.常规扫描电镜标本处理
(1)PBS—BSA冲洗5min×3。
(2)后固定:2.5%戊二醛0.1mol/L磷酸缓冲液,时间视样本大小而定,一般室温30min左右。
(3)PBS—BSA洗5min×3。
(4)1%四氧化锇后固定1~2h
(5)系列梯度乙醇或丙酮脱水
(6)临界点干燥或冰冻干燥
(7)喷镀碳与金
(8)扫描电镜观察
三、冷冻蚀刻免疫电镜技术
冷冻蚀刻法(Freeze Ftching),也称冷冻复型法(Freeze Replica)或冷冻切断(Freeze Fracture),是研究生物膜结构的重要方法之一。其主要步骤首先是将样品在液氮中冷冻,然后放到真空喷镀仪中切断,切断后的切面上有细胞器,其间还有冻成洋的水分。再加热使冰升华,将水份蒸发,把细胞器的膜结构暴露出来,这一步骤就称为冷冻蚀刻。如不进行蚀刻就称为冷冻切断。向暴露的膜结构上喷镀铂—碳投影,再喷碳来加固。这样就在切断的样品表面形成一层复型膜。在此复型膜上印下了细胞切面的立体结构。从真空中取出样品,把复型膜下面的组织腐蚀掉,再把复型膜捞在铜网上,在透射电镜下观察复型膜。
关于生物膜的分子结构,目前被大家公认的并为冷冻复型电镜观察所证实的是流动镶嵌型(图7-1),即脂质—球状蛋白质镶嵌模型。依照这上模型学说表明,生物膜是一种流动

图7-1 生物膜分子的流动镶嵌模型及冷冻断裂面图解
的、可塑的、镶嵌蛋白质分子的脂质双分子层的膜;脂质双分子层中每一分子分别具有两极,一端为亲水极,朝向膜的内、外表面,而另一端的疏水极朝向膜的中线部位,两排分子彼此相对,构成生物膜膜性结构的基础。蛋白质分子彼此相对有嵌入性和表在性两种,前者大约占蛋白质总量的3/4左右,外形近似球状,镶嵌在脂质分子层的不同深度内,而后者则大多附着于细胞膜的胞质面。在冷冻劈裂后,生物膜的水平断面大多发生在单位膜的疏水极。因此,膜的亲水部,分别命名为PS(与细胞质,核质或线粒体内基质相邻的面)和ES(与细胞外间隙或细胞内间隙或细胞内间隙相邻的面,如内质网腔、核质间隙、线粒体内、外膜之间的腔和其它各种泡的腔等)。膜的疏水部、亦即劈裂面分别叫做EF(面向细胞质、核质、或线粒体基质的面)和PF(向细胞外间隙或内间隙的面)。从70年代初期开始,冷冻蚀刻免疫电镜技术已开始在应用,但由于免疫标记必须在冷冻蚀刻步骤以前进行,所以仅能标记细胞外表面(ES)。80年代开始建立了断裂—标记细胞化学方法,将细胞膜劈开后,中央的两侧断面(EF与PF)以及各种细胞器的膜的各个表面及细胞质与核质都能被标记,为此技术的广泛应用创造了条件。应用此法还可对抗原与受体分子进行定量统计。
1.冷冻蚀刻表面标记免疫电镜技术
(1)新鲜或固定的细胞进行直接法或间接法免疫标记。
(2)PBS(pH7.5)冲洗3min×2,加入1mmol/l MgCl2蒸馏水洗洗3min×3,离心沉集细胞。
(3)将细胞团置于小纸板上,入液氮冷却的Freon中,取出入冷冻蚀刻仪中进行断裂操作,再于-100℃蚀刻1min 。
(4)制做断裂面复型。
(5)再次氯酸钠清洗复型,蒸馏水洗后进行观察。
本法可显示断裂暴露的PF位于中央,周围则是蚀刻后露出来的ES,标记物只出现在ES上。
2.断裂—标记免疫电镜技术
此法是先进行冷冻断裂,再做免疫标记,从而可以对断裂开的各种膜结构及胞浆断面进行标记。
(1)临界点干燥法
①固定:1.0%~2.5%戊二醛PBS液4℃1~2h,PBS冲洗3min×3。
如为细胞悬液,可加入30%BSA后加入1%戊二醛,使BSA凝胶化,将凝胶切成2mm左右的小块,用30%的甘油—PBS浸透后置于用液氮冷却的Freon中冷却。
②冷冻断裂,将冰冻的凝胶小块放在盛有液氮的培养皿中,培养皿放置于二氧化碳—液氮槽中,用预冷的解剖刀切割凝胶小块进行冷冻断裂。
③解冻,置碎块于30%甘油—1%戊二醛磷酸缓冲液中解冻。
④置换甘油,放入1mmol/l 氨基乙酰甘氨酸磷酸液去甘油,PBS冲洗,3min×2。
⑤免疫标记。
⑥1%锇酸,室温固定30min。
⑦系列梯度乙醇脱水,临界点干燥,喷镀铂—碳膜,次氯酸钠清洗复型,蒸馏水洗,捞于有Formvar 膜铜网上透射电镜观察。
(2)超薄切片法
步骤:①至⑤同临界点干燥法。
⑥1%锇酸,室温固定2h,系列酒精或丙酮脱水,常规电镜包埋。
⑦切半薄片,光镜定位合适的断裂部位,再切超薄切片,铀铅染色,透射电镜观察。
断裂标记法目前文献报告应用较多的是植物凝集素—胶体金免疫标记技术,常用的如刀豆球蛋白(Con A)-- 胶体金免疫标记技术,如第六章 所述,Con A 能与细胞膜中的甘露糖结合,能标记内质网膜、核被膜以及细胞膜的EF面,有助于糖蛋白在超微结构水平的定位。
为保证实验结果的准确性,每组实验在免疫标记阶段应设立对照组。对照组的设计同第一章 总论中的免疫对照染色。
参考文献
1.Altaman IG,et al.Rapid embedding of tissue LowicrylK4m for immunoelectron microscopy.J Histochem Cytochem, 1984,32:1217
2.Bendayan M.Double immunocytochemical applyingthe protein A-Gold techniqnes.J Histochem Cytochem, 1982,30:81~85
3.Cai WQ(蔡文琴),et al.Colocalization of vasoactivesubstances in endothelial cells of human umbilical vessel.Cell Tissue Res, 1993,274:533~538
4.De Mey J.Clloidal gold probes inimmunocytochemistry.In :Immunocytochemistry(Eds:Polak JH and Noordren SV)1983;82,wright PSG Bristol LondonBoston
5.Faulk WP and Taylor GM, Am immunocolloid method for theelectron microscope.Immunocytochemistry, 1971,8:1081
6.Mclean I and Nakane PK.Periodase-Lysine-paraformaldehyxefixative for immunoelectron microscopy.J Histochem Cytochem, 1974,22:1077
7.Ordronneaa P.Technique inimmunocytochemistry(Eds:Bullock GR and Petrwoz P, 1982, 269~280
8.Roth J, et al.Application of the protein A-goldtechnique for electron microscopic demonstration of hormone.Endocrinology, 1981,108:247
9.Spour RC and Morlarty GC.Improvements of glycolMethacrylats.I.Its as an embodding medium for electron microscopic studies.J His-tochem Cytochem, 1977,25:163
10.Sterit WJ and Kreatzberg GW.Lectin binding by resting andreactive microglia.Neurocytol, 1986,16:249
11.Solt JW and Geuze HJ.A new method of preparing goldprobes for multiple-labelling.Cytochemistry.Eur J Cell Biol, 1985,38(1):87
12 .Tokuyasu KT.Immunocytochemistry on ultrathinfrozen sections.Histochem J, 1980,12:381
13.Vacca LL, et al.A modified peroxidase procedurefor improved localization of tissue ontogens,localization of substance Pin ratspinal cord.J Histochem Cytochem, 1980,28:297~307
14.Wang Bao –Le, et al.Simplified purification andtesting of colloidal gold probes.Histochemistry, 1985,83:109~115
15.Cai WQ(蔡文琴),et al.Localization of neuropeptide Y andatrial natriuretic petide in the endothelial cells of human umbilical blood ves-sels.Cell Tissue Res, 1993,272:175~181
16.蔡文琴.胶体金标记法在免疫细胞化学电镜的应用.解剖学杂志,1985,8(2):19
17.张承志.软型包埋剂GMA制作薄切片的原理及其应用.解剖学杂志,1986,9(1):73
18.李文镇主编.组织细胞冷冻复型图谱.人民卫生出版社,1981
19.孙榆,蔡文琴,李巍,等.改良低温包埋胶体金免疫电镜技术.第三军医大学学报,1991,13(8):417~472
第八章 蛋白质与多肽激素的放射免疫分析
第一节 概述
1960年,美国学者Yalow 和Berson 创立了放射免疫分析(Radioimmunoassay,RIA),并首先用于糖尿病人血浆中胰岛素含量的测定。这是医学和生物学领域中方法学的一项重大突破,开辟了医学检测史上的一个新纪元。它使得那些原先认为是无法测定的极微量而又具有重要生物学意义的物质得以精确定量,从而为进一步揭开生命奥秘打开了一条新的道路,使人们有可能在分子水平上重新认识某些生命现象的生化生理基础。其后30年中,内分泌科学的飞速进展,充分证明了这一超威量分析技术的巨大推动力。1977年,这项技术的发明者荣获诺贝尔生物医学奖。随后这一崭新的技术迅速渗透到医学科学的其它领域,如病毒学、药理学、血液学、免疫学、法医学、肿瘤学等,以及与医学生物学相关的学科,如农业科学、生态学及环境科学等。放射免疫分析的物质,由激素扩大到几乎一切生物活性物质。我们放射免疫分析研究起步于1962年,并迅速发展与普及,对我国生物医学的进展起着很大的促进作用。
一、放射免疫分析的优缺点
(一)RIA的优点
放射免疫分析具有许多其它分析方法无可比拟的优点。它既具有免疫反应的高特异性,又具有放射性测量的高灵敏度,因此能精确测定各种具有免疫活性的极微量的物质。
1.灵敏度高一般化学分析法的检出极限为10-3~10-6g,而RIA通常为10-9(毫微克,ng)、10-12g(微微克,pg),甚至10-15g(毫微微克,fg)、10-18g(微微微克,ag)。
2.特异性强由于抗原—抗体免疫反应专一性强,所被测物一定是相应的抗原。良好的特异性抗体,能识别化学结构上非常相似的物质,甚至能识别立体异构体。
3.应用范围广据不完全统计,目前至少已有300多种生物活性物质已建立了RIA。它几乎能应用于所有激素的分析(包括多肽类和固醇类激素),还能用于各种蛋白质、肿瘤抗原、病毒抗原、细菌抗原、寄生虫抗原以及一些小分子物质(如环型核苷酸等)和药物(如地高辛、毛地黄甙等)的分析,应用范围还在不断扩展。近年来由于小分子半抗原制备抗体的技术有很大的发展,有人预测几乎所有的生物活性物质,只要其含量不低于RIA的探测极限,都可建立适当的RIA法。
4.操作简便RIA所需试剂品种不多,可制成配套试剂盒;加样程序简单一次能分析大量标本,标本用量也少;反应时间不长;测量和数据处理易于实现自动化;RIA属体外分析技术,对患者无任何辐射危害。
(二)RIA的缺点
1.只能以免疫反应测得具有免疫活性的物质,对具有生物活性百失去免疫活性的物质是测不出的。因此RIA结果与生物测定结果可能不一致。
2.由于使用了生物试剂,其稳定性受多种因素影响,需要有一整套质量控制措施来确保结果的可靠性。
3.灵敏度受方法本身工作原理的限制,对体内某些含量特别低的物质尚不能测定。
4.由于放射免疫分析是竞争性的反应,被测物和标准物都不能全部参与反应,测得的值是相对量而非绝对量。
5.存在放射线辐射和污染等问题。
尽管RIA存在以上缺点,但它毕竟是定量分析方法的先进技术。随着科学技术的进步,放射免疫分析技术将会得到更加广泛、更加深入的发展。
二、基本原理
放射免疫分析技术,是把放射性同位素测定与抗原、抗体间的免疫化学反应两种方法巧妙地结合起来所形成的一种超威量物质的测定方法。
RIA的基本原理,是利用标记抗原(*Ag)和非标记抗原(Ag)对特异性抗体(Ab)发生竞争性结合。竞争结合反应可用下式表示:

在上述反应系统中,当只有*Ag和Ab时,只产生*Ag—Ab复合物,并保持可逆的动态平衡。如反应系统中同时加入Ag,因Ag 与*Ag 免疫活性完全相同,故与Ab具有相同的亲合力。当*Ag为一定量、Ab为有限量、Ag 与* Ag 的量之和超过Ab上的有效结合位点时,*Ag –Ab复合物的生成量与Ag 的量之间呈一定的函数关系。即当Ag 量少时,Ag –Ab生成量多,而*Ag –Ab生成量增多,游离的*Ag 减少。可见*Ag –Ab复合物生成量是受Ag含量制约的。因此,在放射免疫分析中,用已知不同浓度的标准物和一定量的*Ag及限量的Ab反应,采取一定方法将B与F分开,即可算出该标准物在各浓度下*Ag –Ab复合物的结合百分率(B/T)。
这一反应过程,可用以下简图(图8-1)说明。图中黑圈表示标记抗原,白圈表示非标记抗原,长条代表抗体,每个抗体有两个结合位点,标记抗原与非标记抗原对抗体有同等的结合能力。

图8-1 放射免疫分析原理示意图
从图中可见,当标记抗原与抗体量一定时,结合率(B/B+F)随抗原量增加而降低。在实际工作中,以B/T的值为纵座标,标准物的浓度为横座标,绘成曲线,即竞争性抑制曲线,或称准确曲线。将未知浓度的样品按同样条件操作,所得结合率(%)与标准曲线相比,即可查出样品中待测抗原的浓度。
放射免疫分析典型的操作程序如下:首先配制一系列已知浓度的标准溶液,并各取一定体积;于其中加入一定量的标记抗原和特异性抗体;在一定条件下使之反应平衡后,采取适当方法将B与F分离;分别测量其放射性;绘制标准曲线(图8-2)。对样品中抗原的测定,则可在同样条件下操作,在标准曲线上查得含量。

图8-2 标准曲线
左:横座标为等份刻度; 右:横座标为对数刻度
由此可见,要成功地进行放射免疫分析,必须解决好以下3个关键性技术问题:
(1)标记抗原:要求其纯度高、免疫化学活性好、比放射性强、用量适当。
(2)制备抗体:要求其特异性高、选用的稀释度适当。
(3)分离B与F:理想的分离方法应当是分离完全、稳定可靠、操作简单、适用范围广。
第二节 放射性碘标记
在RIA中,标记抗原质量的优劣,直接影响测定结果,必须制备比放射性强、纯度高的标记抗原,并保持免疫活性不受丧失。
一、同位素的选择
同位素有稳定性和放射性两种。放射性同位素可利用其衰变时放出的放射线进行测量,这种测量较灵敏而方便,故多用放射性同位素。标记抗原,常用的放射性同位素有3H、14C、131I和125I等。在使用上各有其优缺点,可根据所进行的放射免疫分析的类型特点,标记物制备和供应情况以及实验室设备条件等作适当的选择(表8-1)。大多数抗原分子中都含有C、H等原子,所以用14C或3H标记不改变抗原的结构及其免疫学活性,且14C、3H半衰期长,所标记的抗原长时间放置后仍可使用,这都是其优点。14C或3H标记的不足之处是操作较繁琐,并难以获得高比放射性的标记物;3H及14C放出的都是弱β射线,需用较昂贵的液体闪烁计数器方能获得较高效率的测量,且测定操作也较麻烦。但某些抗原用放射性碘标记容易丧失免疫化学或生物学活性者,则仍以采用3H或14C标记物为佳。
表8-1 标记抗原常用的放射性同位素及其性质
| 放射性元素 | 半衰期 | 射线种类及能量(百万电子伏特) | |
| β | γ | ||
| 14C | 5720年 | 0.155 | - |
| 3H | 12.5年 | 0.0189 | - |
| 125I | 60天 | - | 0.035 |
| 131I | 8.05天 | 0.608,0.335,0.250 | 0.364,0.637,0.722 |
大多数抗原分子中是不含碘的,引入碘原子就改变了抗原的分子结构,往往容易损伤抗原的免疫化学活性;且放射性碘的半衰期较短,标记物放置后因衰变使放射性降低,因而需要经常制备标记物或要求能定期提供放射性碘标记都能适用,放射性碘放出γ—射线,用一般晶体闪烁计数器就能获得较高效率而精确的测量,测量操作也很简单。由于这些突出的优点,目前在放射免疫分析中,使用放射性碘标记物最多。
从应用角度来看,131I和125I又各有其优缺点,可根据实验的要求、仪器的条件和放射性碘制剂的规格等条件合理选用。但相对而言,125I有较多的优点,一是半衰期适中,允许标记化合物的商品化及贮存应用一段时间;二是它只发射28keV能量的X射线和35keV能量的γ射线,而无β粒子,因而辐射自分解少,标记化合物有足够的稳定性。放射性碘适用于放射免疫分析许多对象(包括蛋白质、肽类、固醇类、核酸类以及环型核苷酸衍生物等)的标记,且操作简单,一般实验室都不难做到。
二、蛋白质与多肽激素的放射性碘标记
要制备高比度、高纯度与免疫化学活性好的标记物,首先要有高纯度、良好免疫活性的抗原。用作放射标记加网免疫分析的特异性,所以若用纯度不高的抗原作标记,则标记后必须采取适当的步骤除去杂质,以获得高纯度的标记物。标记对象的纯化应尽量采用温和的方法,否则在纯化操作中已受潜在性损伤的蛋白质(这时表面上活性可能还是良好的),再经标记反应时所受的损伤,活性就会显着降低,影响以后的放射分析结果。有了好的纯抗原,还要采用适当方法加以标记,尽量获取高比放射性、而又能保持良好的特异免疫化学活性的标记物。这些都是放射免疫分析能取得高特异性和高灵敏度的关键问题。
多肽激素与蛋白质多用碘标记,最常用的是125I。碘化反应的基本过程如下:通过氧化剂的作用,使碘化物(125I-)氧化成的碘分子(125I2),再与多肽激素、蛋白质分子中的酪氨酸残基发生碘化作用。所以不管采用哪一种放射性碘标记法,标记的化合物内部必须有碘原子可结合的基团,即结构上要含有酪胺基或组织胺残基。凡蛋白质、肽类等抗原,在结构上含有上述基团的可直接用放射性碘进行标记。如不含上述基团的,放射性碘无法标记,必须在这些化合物的结构上连接上述基团后才能进行碘标记。
因此影响蛋白质、多肽碘化效率的因素,主要决定于蛋白质、多肽分子中酪氨酸残基的数量及它们在分子结构中暴露的程度;此外,碘化物的用量、反应条件(pH、温度、反应时间等)及所用氧化剂的性质等也有影响。
常用的标记方法有:
(一)氯胺T法
氯胺T法标记效率高、重复性好、试剂便宜易得,是目前使用最多的碘标记方法。
1.原理 氯氨—T(Chloramine--T)是一种温和的氧化剂,在水溶液中产生次氯酸,可使碘阴离子氧化成碘分子。这活性碘可取代肽链上酪氨酸苯环上羟基位的一个或两个氢,使之成为含有放射性碘化酪氨酸的多肽链。

2.方法 以125I—AVP的制备为例。
(1)碘化反应:AVP5μg+0.5mol/lPB50μl(pH7.5)+1251800μCi,混合后,加入新配置的Ch—t 30μg/15μl(0.05mol/l PB, pH7.5)。迅速振荡混匀,室温下反应40s。
(2)终止碘化反应:加入还原剂偏重亚硫酸钠40μg/20μl(0.05mol/l PB, pH7.5),以终止碘化反应。
(3)Bio—Gel P2层析纯化:将碘化反应混合液注入Bio—Gel P2柱,用0.1n HAC溶液洗脱,分部收集,每2min收集一管,共收集60管。
(4)放射性测量:测定各收集管的放射性,出现两个峰,第一峰为125I—AVP,第二峰为游离碘盐峰。第一个峰中计算最高的几管,留下备用。
为了解标记抗原的质量,每次碘标记后应计算出碘的利用率,标记上多少放射性碘,以及每微克抗原结合上多少放射性碘。
(5)标记抗原的贮存:经纯化与检查后的标记物、加入1/8体积的异丙醇,分成若干小份,置于铅罐中,在-20℃以下的冰箱中贮存备用,应避免反复冻融。标记抗原在贮存中是不稳定的,这是因为:一是脱碘,标记的碘从原来位置上脱落,变成游离碘;二是蛋白损伤、变性,成为聚合大分子或断键成小分子碎片。由于上述原因,使B/F明显降低,标准曲线斜率变小,以致不能使用,故需分离纯化,其方法是用SephadexG100长柱(40~80cm )过柱,洗脱后出现3个峰。第1个峰分子量大,是蛋白变性的聚合的大分子,尚保留部分抗原决定簇,免疫活性弱;第2个峰是纯抗原的蛋白峰,免疫活性好;第3个峰是游离125I或小分子碎片,不具备免疫活性。收集到的第2个纯抗原蛋白峰,免疫活性好;第3个峰是游离125I或小分子碎片,不具备免疫活性。收集到的第2个纯抗原蛋白峰,其性能类似于新鲜标记的抗原。分离纯化的方法解决了标记抗原的贮存、长期使用问题,特别对来之不易的抗原更显得重要。
2.注意事项
(1)放射性碘源的选用:无载体的131I或125I均可用于碘化标记,但应尽量选用新鲜的、比放射强度高的、含还原剂量少的放射性碘源。碘源的比放射强度最好≥50~100mCi/ml,至少也要>30mCi/ml,否则加入碘源的容量要增加,随着带入碘源中含有的还原剂(为放射性碘源运输保存所需加入)量也增加,这将会显著降低碘利用率及标记蛋白比放射强度。放置较久和放射性碘源,一方面因衰变致比放射强度降低,另一方面因水的辐射化学产物增多(主要是131I源),都会降低标记时的碘利用率。放射性碘源含还原剂(如Na2S2O5等)量多时,会抵消氯胺T的作用,降低碘利用率,甚至导致标记完全失败。放射性碘源要用无载体的,标记所用全部用具和试剂必须不含碘;只要有极少量的碘的污染,非放射性碘就会稀释放射性碘,使放射性碘利用率显著降低。为了便于放射性防护和除污染,以及减少射线对蛋白质分子的损伤,标记投入的放射碘量不宜过大,一般以<5mCi为宜。
(2)放射性碘与多肽、蛋白质用量的比例:这比例对标记结果的影响很大。如上述原因,一般标记时放射性投入量不宜过多,示踪实验室中常规每次只用1~2mCi,因而放射性碘与多肽、蛋白质用量的比值主要靠标记时投入的多肽、蛋白质用量来控制。当投入的放射碘量一定时,多肽、蛋白质用量多(即I/多肽、蛋白质比值低),能获得高碘利用率,但所得标记蛋白比放射强度低;相反多肽、蛋白质用量少(即I/多肽、蛋白质比值高),则碘利用率降低,但所得标记多肽、蛋白比放射性随此比值变化都有较大的变动;而当此比值<1后,则碘利用率再下降的幅率较小,标记多肽、蛋白比放射性也不会再增加多少。
(3)氯胺T与偏重亚硫酸钠的用量及碘化反应时间:氧化碘化标记法中,会导致失活的最主要原因是氧化还原。氯胺T是氧化剂,早期用氯胺T法作碘化标记时氯胺T用量都比较大,或碘化反应时间较长,结果导致蛋白质结构和活性的严重损伤。氯胺T用量大,或长时间进行碘化反应,结果并不能使碘利用率和标记多肽、蛋白质比放射强度提高多少,反而使标记多肽、蛋白活性下降。当用不含还原剂或还原剂很少的放射性碘源时,试以各种蛋白质(包括白蛋白、球蛋白、ACTH、胰岛素等)作微量标记,当氯胺T用量为20μg/0.1ml反应液、0~20。C反应20s,碘利用率都已接近或达到最大峰,再加大氯胺T用量和延长反应时间是没有必要的。随放射性碘源中还原剂增多,氯胺T用量也应增加,以达到预期的碘利用率,但决不应盲目加大氯胺T用量和延长碘化反应时间(通常反应时间不要超过1min),否则会导致标记多肽、蛋白质严重失活,不能用于实验。当然,减少氯胺T用量要在了解放射性碘源还原剂含量的基础上,否则碘源中还原剂量较多,双盲目减少氯胺T用量,就会使标记失败。一般用125I标记时,氯胺T用量要适当加大。加入氯胺T后必须迅速混匀,以防标记不均匀。氯胺T与偏重亚硫酸钠溶液要新配制的。
氯胺T用量减少了,Na2S2O5用量也就可以随之减少。为保证按时终止碘化反应,实验时加入Na2S2O5一般都是过量的。氯胺T用量大时,加入Na2S2O5的剩余量也就会随之增加,这就可能加重某些对还原剂敏感的蛋白质或多肽生物活性的损伤。为此,Na2S2O5用量也不应过多。只要药品没有变质、试剂是新配的,以重量计算Na2S2O5加入量与氯胺T相同就足以保证终止碘化反应(按反应克分子浓度计算,Na2S2O5/氯胺T重量比约0.4),不要盲目加大用量,并应迅速将标记多肽、蛋白质从反应液中分离出来,以尽量减少多肽、蛋白质活性的损伤。
某些蛋白质或多肽对氯胺T较敏感,还可进一步减少氯胺T用量、缩短碘化反应时间、降低反应温度,以保护蛋白质的活性。这对一些较容易丧失活性蛋白质或多肽的碘标记十分重要。
(4)碘化反应体积:系指加入Na2S2O5终止反应前液体的总量。碘化反应体积愈小,局部反应物浓度愈高,所得碘利用率和标记多肽、蛋白比放射强度就愈高。所以,标记应采用比放射标记效果。当反应液量少(<0.2~0.3ml)时,反应体积对碘利用率和标记多肽、蛋白质比放射强度的高低影响较大;当反应液量大(>0.5~1.0ml)时则影响较小。微量氯胺T法放射碘标记时,一般多控制碘化反应体积<100μl。
(5)碘化反应温度:温度升高,碘化反应速度加快,碘利用率有所增加。但总的来看,反应温度的影响不很大,一般从0℃到20℃碘利用率相差不过百分之几,故一般在室温下进行标记操作就可能获得重复性好的结果。有些蛋白质或肽类极易丧失活性,则可在0℃进行碘化反应。
(6)碘化反应的pH值:受氧化剂氧化生成的活性碘,对多肽链的酪氨酸基苯环羟基邻位的碘化作用,最适pH是7.3~7.8之间。当pH变化时,碘化位置也会发生变化,例如pH值较高时,组氧酸的咪唑环也可被碘化;当pH4~5时,活性碘能迅速氧化色氨酸基生成羟基吲哚,导致肽链断裂。这些都会影响蛋白质或多肽的放射性碘化反应,或引起降解或失活。因此作放射性碘化标记时,除放射性碘源外,所有的试剂都应用适当的缓冲液配制,保证碘化反应在最佳pH条件下进行。
(7)微量蛋白质或多肽的吸附损失:界面的吸附损失,在使用大量蛋白质或多肽类时是可以忽略的,但作微量法标记时投入的蛋白质或多肽类只在微克甚至毫克甚至毫微克水平,界面吸附导致的损失就不能忽略。例如制备131I—ACTH时,所用ACTH浓度低到50Pg/ml时,因表面吸附可损失10%~30%,甚至高达75%。改变pH、加入非特异性载体蛋白、或使用聚苯乙烯、聚乙烯容器时,能减少吸附,但不能完全消除。一般残留在反应管和滴管上的放射性为投入总放射性的2%~8%、残留在层析柱上折占5%~10%。残留量随标记蛋白比放射性强度而直线增减,残留者几乎全部都是标记蛋白。由此可见,微量蛋白质或多肽受吸附而损失的量是不容忽略的。由于微量蛋白质、多肽会被显著吸附而丢失,所以标记时投入蛋白质、多肽量过微(如<2μg)也是不适宜的,否则标记蛋白质、多肽的收回率会太低,并在计算上会造成较大的误差。
(8)不同蛋白质、多肽碘化标记的差别:由于不同的蛋白质和多肽分子中含有的酪氨酸数目不同,而且其空间结构也不相同,分子中的酪按酸残基有的容易发生碘化反应,有的就不容易碘化,因此同样条件下进行碘化标记,不同蛋白质或多肽对碘的利用率是不相同的。不同蛋白质经碘化标记后生物活性受损的情况也各不相同。例如ACTH、促性腺激素释放激素(GRH)、促黄体激素释放激素(LRH)等多肽,碘化标记后容易丧失激素活性或与受体结合的活性;而AFP及人绒毛膜促性腺激素(HCG)等的碘化标记,则较容易保存良好的免疫化学活性。
尽管不同多肽、蛋白度的碘化标记结果有所差别,但上述讨论的因素对不同多肽、蛋白质碘化标记的影响有共同的规律。掌握了这些因素,就容易成功地获得合格的标记物。
不同多肽、蛋白质的分子量大小、理化性质各不相同,放射碘化标记反应后,可根据具体情况采取不同的方法将标记蛋白质(或多肽)与未反应的游离放射性碘及受损伤的标记物分开,常用的方法有凝胶过滤、离子交换层析、吸附层析、各种电泳法等。
(二)乳过氧化物酶法(LPO)
本法反应温和,对抗原、抗体免疫活性影响小,已被广泛应用。缺点是标记率较低,一般为20~40%。
1.原理此法是利用乳过氧化物酶(Lactoperoxidase)有促进微量过氧化氢对125I-的氧化作用,生成125I+,并标记在多肽、蛋白质酪氨酸分子上。
2.方法以标记蛋白质抗原为例。
(1)反应液组成:蛋白质2~5μg溶于磷酸缓冲液10~25μl中,加入Na125i 1m Ci(10μl)、乳过氧化物酶溶液25ng(10μl)、H2O2200ng(10μl);
(2)在室温保温7min;
(3)加入H2O2200ng(10μl);
(4)过7min再加入H2O2(3μl);
(5)保温7min后,加入0.5ml、10mmol/L巯基乙醇以停止反应;
(6)10min后加入NaI载体溶液1ml ;
(7)按常规方法分离纯化。
3.注意事项
(1)LPO质量好坏,可直接影响标记率,LPO应在使用前新鲜配制,以防酶活性降低。
(2)LPO用量应小于总蛋白质用量的1%,以减少酶自身碘化而带入的放化杂质。
(3)碘化反应速率分析表明,酶的催化速度很快。
(4)碘化反应在pH4.0~8.5较宽范围内均可进行,最适pH值应依据蛋白质本身性质而定。
(5)H2O2应保持低浓度,如高于0.1mmol/L,对酶的活性将有抑制作用。
(三)Iodogen碘化法
此法具有标记率高、反应体积小(3ml水平)、可用低浓度的125I原料、对多肽激素和蛋白质的免疫活性损失小、稳定等优点,系常规的碘化方法之一。
1.原理 用Iodogen为氧化剂,对蛋白质和多肽抗原进行碘化标记,把125I直接引进分子中的酪氨酸残基上。标记过程中被标记样品不与Iodogen混合,标记后取出样品即停止反应,不使用任何还原剂。
2.方法
(1)标记之前,先把Iodogen溶于有机溶剂,涂于管底,并使之干燥。
(2)标记时,将蛋白质溶液10~20μg/10μl(0.5mol/L,pH7.5PB)置于反应管中,反应管置于冰浴中。碘化时,125I与蛋白质克分子之比例为1~1.2。反应时间在温和的连续的搅拌下可达10min,从反应管中转移出反应混合液,使其反应停止。反应液转移到含有200μl0.01mol/L、pH7.2PB和0.15mol/L NaCl溶液中,层析分离前再放置5min,使其未标记的碘离子还原成分子碘,以避免在带有缓冲液的柱中使白蛋白碘化。
3.注意事项
(1)涂有Iodogen的反应管,有氮气中密封,并贮存在-20℃条件下,至少可用3个月。打开管,使用时间很短。
(2)碘化反应时间,7min时标记率达最高,10min时略有减少。PH6.0~8.5时,标记率最高。
(3)Iodogen与蛋白质的比率是标记率的函数。最大的标记率是1克分子的Iodogen与8克分子或再多量之比。
(四)酰化试剂(Bolton和Hunter试剂)法
1.原理这个方法用酰化剂3--(4-羟苯基)丙酸—N琥珀酰胺酯(Bolton—Hunter试剂)做连接试剂,将125I标记在羟苯基的2,5位置上,再将琥珀酰胺酯水解,通过一个酰氨键将3--(4—羟基—5—125I—苯基)接在蛋白或多肽的末端氨基上。
2.方法125I—Bolton—Hunter试剂可用氯胺T法自行制备,出已有该试剂的苯溶液作为商品出售。使用时取一定量的标记酯(μmol 蛋白用3~5μmol标记酯),用氮气吹除苯,投入欲标记蛋白5~10μg及缓冲液10~50μl,pH8.0~8.5为宜,在冰浴中反应15~30min后,加入多量氨基酸(如甘氨酸),使过量标记酯消耗掉以终止反应。
此法避免了蛋白质与氧化剂的接触,又避免了与放射性碘原子的直接接触,可防止碘源中有害物质对蛋白质的损伤,适用于标记缺乏酪氨酸的蛋白质或酪氨酸在活性中心,引入碘原子后会引起蛋白质的失活。其缺点是标记技术比较复杂,需要接触较多的放射性,经二步反应,碘标记率比较低。一般认为此法不宜标记短肽,而适于分子量大于1万的蛋白质。
三、放射性标记化合物的纯化与鉴定
(一)纯化标记化合物的常用方法
不论使用何种制备方法,要获得合格的标记化合物,都必须将反应物经过仔细的分离、纯化。另外,一些标记化合物,经过一定时间的存放后,往往会出现不纯物,而需再纯化。如碘标记生长激素(125--HGH),在刚标记的第2天,从Sephadex G-100过滤谱上可见,几乎所有的碘化HGH都集中在峰II;保存1个月后,峰II组份减少,峰I和峰III成分明显增加,峰I是集聚的标记生长激素,而峰III是不具有免疫活性的放射性化学杂质(图8--3)。

图8-3125I—HGH的SephadexG-100过滤谱
实线:新鲜制备的125I—HGH 虚线:保存1个月的125I—HGH
标记化合物的纯化方法,除制备比活度低而化学量又较多的标记物可用重结晶、蒸馏、萃取等常规方法外,一般需用微量分离技术,较方便的是层析法、离子交换法、凝胶过滤及高效液相层析法等。现以碘标记蛋白为例,说明以上各种方法的适用情况。
1.凝胶过滤法常用的是SephadexG系列,也有Biogel—P系列。分离标记蛋白与无机碘时,通常用Sephadex G—25或G—50,然后用G—100进一步纯化。
2.离子交换法一般是制成离子交换层析柱,用于分离纯化短肽标记物。
3.透析法 能将标记蛋白与小分子化合物很好地分离。
4.电泳法可用来分离单碘化、多碘化及已受损伤的蛋白质。
5.亲和层析法利用蛋白质与其特异抗体或受体的结合来分离、纯化标记蛋白质。此法特异性强,保持生物活性好,但操作较复杂。
6.高效液相层析法此法最大优点是分离效果好、快速,但需特殊设备。
7.伴刀豆球蛋白A(ConA)吸附法ConA是一种植物凝集素,对糖蛋白有良好吸附能力,因此适于分离标记糖蛋白。吸附的标记糖蛋白可用含0.2mol/L甲基α-吡喃葡萄糖苷的PBS洗脱。
(二)标记化合物的主要质量指标
作为示踪剂及分析试剂的标记化合物,应具有比一般非标记化合物更高的质量要求。标记化合物的质量指标包括:放射性核纯度、放射化学纯度、放射性比活度、生物活性和免疫活性以及标记位置和定量分布情况等。
1.放射性核纯度及其检查方法
(1)放射性核纯芳可用下式表示:
放射性核纯度(%)=所需放射性核素的活度/样品的总放射性活度×100
(2)放射性核纯度的检查方法:每一种核素都有它的特征,即物理半衰期及射线能量,故可通过半衰期及射线能量的测定来鉴别所需放射性核的纯度。
①测定半衰期法:如短半衰期放射性核素,一般可采用时间跟踪法,每隔一定时间测量放射性一次,共测3~5个半衰期,以每次测得的放射性计数为纵座标,时间为横座标,在半对数纸上作图,并通过分析,可求出该放射性核素的纯度。
②测定射线能量法:利用每一放射性核素的特征射线谱来检查放射性核纯度。γ发射体可用γ能谱仪,如检测57Co和58Co的核纯度:纯β-发射体可用液闪仪,调节 道宽及淬火校正后,对如3H、14C、32P的核纯度进行测量;而β、γ混杂垓素,则用吸收法测量,如99mrTc中母体杂质99mMo的含量测量,是通过适当厚度的铅屏蔽,将99mTc 发射的能量为141ke V的γ射线减弱后,测定99Mo发射的能量为739Kev的γ射线。
2.放射化学纯度及放化纯度鉴定
(1)放射化学纯度:放射性核素标记化合物都是以一定的化学形态存在的,所以:
放射化学纯度(%)特定化学形态的放射性活度/样品总放射性活度×100
放射化学纯度受制备方法及原料的化学纯度、产物存放条件等影响,一般放化纯度控制在95%以上。
(2)放射化学纯度的测定方法:原则是高效的化学分离与灵敏的放射性测量相结合。常用下列方法:
①放射层析法,又称放射色谱法:本法是利用色谱技术使混合物中各组份分离,然后测定各组份的放射性活度。它具有选择性高、分离效果好、操作简便等优点,在放化纯度鉴定中是一种重要的分析方法。最常用的是放射性纸层析法和放射性薄层层析法。
②放射性高效液相层析法:它对分离纯化标记化合物及鉴定标记化合物的放化纯度都有很大潜力,具有分析速度快、分离效率高、适用范围广等特点(几乎80%的有机化合物均可应用)。关键是要选择合适的固定相和流动相,使产品与杂质分离。在流动相中,被分析物各组份的浓度变化可用紫外或荧光检测器检测,而其放射性活度,可同时由放射性探测仪测定。放射性活度测定最简单的一种办法,是将洗脱液分部收集,然后在γ仪或液闪仪上进行测量;另一种较理想的是连续测量,在洗脱液流通池外包围一个固体闪烁探头,进行γ计数或在流通池前加一个三通混合室,用另一个泵混入闪烁液,测定软β射线。可以与紫外控测器的扫描图,同步描绘出放射性的分布图。
③放射性核素反稀释法:取一定量(W1)已测定比活度(SO)的标记化合物(约0.1~10mg),用>1000倍化学量(W2)的纯载体稀释,充分混匀后反复纯化到比活度恒定不变(Sp),此标记化合物的放化纯度值应为:
![]()
有时该值>100%时,往往是由于所用载体化学纯度不够。因本法操作要求严格,一般不作常规放化纯度鉴定用。
3.化学纯度及化学量的测定标记化合物中的非放射性化学杂质虽一般不会对示踪结果带来直接干扰,然而这种杂质的含量越多对标记化合物在使用、存放过程中分解、变性的影响就越大。此外,也已发现某些标记化合物的化学杂质会给使用带来直接影响。如用氚标记类固醇作放射免疫分析试剂,其中的化学杂质会影响标记抗原与抗体的结合率,使分析灵敏度降低。因此,对标记化合物的化学杂质含量,同样必须加以控制。
要制得化学纯度的标记化合物,最好是对可能产生的杂质加以防止。这要在冷试验中解决。因为冷试验所得产品是非放射性的,其化学纯度可用常规方法,如溶点、沸点测定,NMR、红外、紫外谱分析等手段加以鉴定,得到合格产品后,再按同样方法及条件进行标记制备。
对于标记化合物的化学含量,则必需在标记反应及一定纯化步骤后进行,由于需要高比活度的标记化合物,往往样品的放射性很强,而化学量极微(如某氘标记化合物,分子量为300,每分子上标记2个氘原子,氘的同位素活度为99.8%,则理论上每25mCi(925MBq)的化学量还不足(130μg),所以需用微量分析法才能测定其含量。一般而言,各种常规微量分析技术均可应用。目前大多用紫外分光、荧光光度等进行含量测定。
4.放射性比活度及其测定
(1)放射性比活度简称比活度,过去也称比放射性。
比活度=放射性活度/单位化学量
(2)比活度的理论值计算:每种放射性核素有一个比活度理论值,取决于该核素的半衰期和衰变常数。若N是1毫克原子(1mA)的总原子数,衰变常数λ(单位时间衰变的%),则
![]()
任何元素每1mA的原子数都相同,等于阿伏加德罗常数,即6.023×1020个,故
![]()
若T1/2min为单位,则上式的活度单位为dpm/mA,进行单位换算后为:
![]()
根据上式,可计算出每种放射性核素比活度的理论值(常用放射性核素的比活度理论值见表8-2)。如果标记化合物每分子接上一个放射性核素原子,则以上原论值亦为该标记化合物的比活度(每毫摩尔的活度)理论值。
表8-2 一些常用放射性核素的比活度理论值
(亦即每分子一接一个该放射性核素原子的标记化合物的经活度理论值)
| 放射性核素 | 半衰期 | 比活度理论值(每mA或mmol的活度) |
| 14C | 5730年 | 0.0624 Ci (2.3 GBq) |
| 3H | 12.33年 | 29.0 Ci(1073 GBq) |
| 45Ca | 165天 | 793 Ci (29.3 TBq) |
| 75Se | 118.5天 | 1100 Ci(40.7 TBq) |
| 35S | 87.4天 | 1494 Ci (55.2 TBq) |
| 125I | 60.2天 | 2196 Ci(80.3 TBq) |
| 131I | 8.04天 | 16240 Ci (600 TBq) |
(3)放射性比活度测定方法
①直接测定计算法:将标记产品经分离纯化后,配成合适的溶液,测定每毫升的放射性活度(如mCi/ml)及含量(μg/ml)从而计算其比活度。对于高经活度的标记物,化学含量甚低,一般需用光谱法,如紫外分光光度法测定其含量。
②层析扫描面积计算法:一般应用纸层析或薄层层析,将反应结果尚未分离的反应液点样、展层,然后在扫描仪上描绘放射性分布图,根据描绘的面积来进行计算,如图8-4。

图8-4 放射层析扫描面积计算比活度示意图
1为标记物峰面积:
S2S3为杂质峰及放射性原料峰面积
先计算标记率:![]()
放射性比活度的计算:若投入的待标记物重量为W,且100%转化为标记物,则比活度=A·Y/W,其中A为投入的总放射性。
如果层析扫描仪有紫外监测器和放射性活度计数率仪可同步测定扫描,则直接可给出比活度。
③自身取代计算法:这是间接测定标记物比活度的方法。所测定的标记物,需是分离纯化后可用于RIA或RRA标记试剂。
方法的原理是:作一条常规的RIA(或RRA)标准曲线,另作一条不加非标记标准品,只加抗体和不同量标记试剂的自身取代曲线。两者用同一种抗体,且抗体用量完全相同。若反应平衡后测定结合部分的放射性,掏算成所加总放射性(注意:对标准曲线总说总放射性各管相同,对自身取代曲线来说各管不同,需分别换算)的百分数,即结合率B。由于两条曲线所用抗体的质和量严格相同,标记物与非标记标准品与抗体亲和力也相同,故B的大小就完全取决于各管中标记物和非标记标准品的总量。亦即若从两标准曲线上取一点相同的B,则
(标记物+标准品)标准曲线=(标记物)自身取代曲线
故由此便可直接计算标记试剂的化学含量并进一步求得比活度。为求准确度高,可取我点B求出平均比活度。
用自身取代法测定标记化合物的比活度,只适用于RIA的标记抗原及受体的标记配基。使用时应注意:①标记物与未标记物对抗体(受体)的亲和力应相同;②非特异性结合应较小,且计算时应扣除;③制备标准曲线与自身取代曲线时,操作步骤应相同,特别是B与F分离的条件要一致。
5.生物活性、免疫活性测定
(10)生物活性、免疫活性测定的重要性:放射性标记化合物作为示踪剂用于生物体内的示踪研究,或作为分析试剂用于生物活性物质分析,都要求标记化合物不改变其原有的生物活性和免疫活性。当给化物引入放射性原子,即使“同位素标记”大多需经过原子交换或化学反应及分离纯化等物理化学处理,有可能造成光学构型及立体构型的改变而使标记物改变性质。“非同位素标记”,如蛋白质分子中引入碘原子,则更易引起蛋白质失活、变性。故测定放射性标记化合物的生物活性和免疫活性,对保证使用效果十分必要。
(2)生物活性和免疫活性测定的要求:需根据使用要求而定,因为同一标记物其生物活性的变化与免疫活性的变化不一定相关;同一标记激素,其与受体结合能力的改变与抗体结合能力的改变也不一定平行。
(3)测定方法:测定标记蛋白质或多肽的生物活性和免疫活性常用的方法有下述几种:
①物理化学方法:可用电泳法、吸附法及凝胶过滤法等物理化学方法来测定标记蛋白质的结构改变情况,如标记后受损全伤的蛋白质在电泳时泳动性减少,碘化受损的多肽激素在血红蛋白涂碳上的吸附性质也有改变,而蛋白质变性聚合时大分子聚合体将在凝胶过滤时不停留在凝胶柱上。这些测定虽较快速方便,但对标记物的生物活性和免疫活性的严格判定来说,还是很不够的。
②特异结合试验:根据放射性标记化合物用于放射免疫分析等不同要求,分别与其相应抗体或受体进行特异性结合试验。以放射免疫分析试剂为例,测定其免疫活性的方法是:先观察标记物与抗体的结合率,如果结合率高,说明抗原的免疫活性较好。进一步观察标记抗原与非标记对抗体亲合力是否一致,做法之一是用不同稀释度的抗体,分别与标记抗原及与标记抗原加非标记抗原的混合物进行特异结合,其中混合物抗原总浓度要和单独使用放射性抗原的浓度相同。如单独使用标记抗原1.0ng,而混合抗原的总浓度亦为1.0ng,其中标记抗原为0.1ng,非标记抗原为0.9ng,比较两者的结合率,如果基本相同,说明标记抗原保持其原来的亲和力,在标记等操作过程中未受到明显损伤。如图8-5中,A线与B线基本平行;如果标记抗原免疫活性已有降低,则如C线所示。

图8-5 标记蛋白的免疫活性测定
A;为标记抗原与血清的滴度曲线B:为非标记抗原(加入少量标记抗原)的滴度曲线;C:与A相同,但标记抗原免疫活性已有降低
③生物特性测定:如125I—纤维蛋白原,可用凝血酶测定其可凝能力,与非标记物相比,视是否有改变。使用何种生物特性测定,根据标记物的生物性质而定。另外,上述特异性结合试验,如果受体作异结合剂,也是检验用作RRA或RBA分析试剂的标记物生物活性情况的有效方
第三节 结合和游离部分的分离
放射免疫分析时加入的抗原和抗体的量极微,反应所形成的复合物并不能成为肉眼所能辨认的不溶性沉淀物,但是放射免疫分析必须分别测量与抗体结合的(B)和游离的(F)抗原,所以,B、F的分离是放射免疫分析中的一个重要环节 。根据抗原—抗体复合物与游离抗原理化性质或免疫学性质的不同,可采取各种分离技术。
一、对分离方法的要求
分离方法的选择直接影响分析的质量,通常需满足以下要求:
①使B和F分离完全;②不受外界因素的干扰而影响分离效果;③与游离抗原的非特异性作用尽可能小;④操作简便,分离迅速,重复性好,适用于大量样品分析;⑤来源广,价格低廉,便于使用,适合RIA技术自动化。
二、常用的分离方法
目前用于放射免疫测定中的分离方法很多,各有其优缺点,下面介绍几种常见的分离方法:
(1)吸附分离(固相颗粒)
活性碳吸附剂(目前常用)
硅镁吸附剂(滑石粉等)
交换树脂吸附剂
(2)蛋白沉淀剂
硫酸铵、硫酸钠
聚乙二醇(PEG)(目前常用)
无水乙醇、丙醇等
(3)免疫分离剂(第二抗体)
(4)磁性分离剂
磁化活性碳吸附剂
磁化固相抗体
(5)固相包被分离法(固相分离剂包被在测试管内)
(一)吸附分离法
这种吸附分离剂是固相颗粒,它可以从反应液中吸附游离抗原。
活性炭是常用的吸附剂。活性炭多用于小分子游离抗原和抗原—抗体复合物的分离。具体应用时在活怀炭颗粒的表面涂上一层右旋糖酐或蛋白类化合物。这样活性炭末的表面构成一定大小的孔洞,在反应液中加入这种特殊颗粒的混悬液时,小分子的游离抗原被活性炭吸附,达到分离B与F的目的。
活性炭吸附方法的优点是操作简便、价廉,缺点是离心沉淀部分是F而不是B,不适用目前自动化放免测定,分离时易受温度和时间的影响。
(二)沉淀分离法
沉淀分离法的原理,是盐类或有机溶剂能够破坏蛋白质分子表面的水化层而发生沉淀(这种分离要求蛋白质分子处在等电点环境中)。常用的沉淀剂是聚乙二醇(PEG)。PEG是一种直链大分子聚合物,使用PEG溶液时分离沉淀是在有载体血清蛋白或丙种蛋白存在,而且要求γ球蛋白的最终浓度达250mg/ml以上的情况下才能实现。PEG沉淀的结果易受过量的脂类或离心温度的变化影响,PEG离心温度在20℃以下进行。PEG沉淀的优点是PEG价格低廉,操作简便,一次可处理大量样品。其缺点是PEG单独使用时非特异结合高,所以常与其它方法联合使用;其分离效果易受pH、温度等影响。
(三)双抗体分离法
双抗体分离法也称免疫分离法,是特异性分离,应用十分普遍。本法是以抗IgG抗体和可溶性的抗原-抗体复合物结合,形成很大的复合物而沉淀。很多抗原的特异抗体来自家兔或豚鼠,称为第一抗体,形成的复合物不能通过离心将其沉淀。或将第一抗体的同种正常动物的血清IgG免疫另一种动物所制得的抗体为第二抗体,该抗体与第一抗体形成不可溶的复合物,经离心可将其沉淀,从而达到分离的目的(图8-6)。

图8-6 双抗体法分离原理模式图
第二抗体分离的优点是重复性好,B和F分离较为完全,非特异结合低,可同时处理大量样品,使用方便。缺点是分离时间长,非特异性结合可有较大的波动,第二抗体用量较大。
(四)磁性分离法
1975年,Hersh报道了用磁化分离技术分离血清狄高辛放免测定的B、F后,受到了广泛的重视。近年来国内外许多学者对磁化颗粒的制备进行了系统地研究,应用于B与F的分离,并取得了引人注目的进展,使放免的B、F分离不再使用离心,缩短了放免操作时间,便于放免自动化测量。磁性分离的具体原理为血清样品与标准品中的抗原与磁颗粒上的一定量的抗体反应,产生的抗原抗体磁性颗粒复合物,在磁场作用下沉降,使结合部分与游离部分分离。在磁性分离器上弃上清,进行测量。优点是简化了操作程序,B、F分离也较完全,稳定性好。
目前常用的磁性分离技术除磁性固相抗体外,还有磁化活性炭吸附分离剂。
(五)固相包被分离法
近年来由于固相技术的研究使其固相所被(埋)技术发展迅速,再有固相包被具有简便、快速、稳定、不需离心等优点,有逐渐取代液相法的趋势。
1990年,Causse报告了活化塑料管新技术及生物素结合抗体、亲和素标记物的应用,使放免技术对多数微量物质的检测可达到10-15g级水平,大大提高了放免测定的精确度、灵敏度。
抗体包被:物理吸附法—方法简便,但包被量低。
价键结合法—需要纤维素、琼脂等固相载体,操作复杂。
Causse活化塑料管新技术,提高了包被量,主要特点是将顺丁烯二酸酐和苯乙烯的共聚体涂布试管,在试管壁形成一层活性薄膜(这种方法操作简便)。
(六)双抗体+PEG的分离法
这种分离方法利用双抗体特异性强、PEG沉淀简便快速的优点,从而克服了双抗体时间长、PEG方法非特异结合高的缺点。这一方面是当前分离技术中较理想的一种方法。
这种联合方法分离方法减少了第二抗体的用量,PEG的最终浓度也只需2~4%,成本较低。这种方法既适用于蛋白质、酶、大分子物质,又适用于小分子肽等半抗原物质。
1991年,北京中国同位素公司北方免疫试剂所采用80年代法国广泛应用的双抗体+PEG、再加一定剂量的γ球蛋白(免疫第二抗体时应用的γ球蛋白)的分离剂,溶解于磷酸缓冲液中,pH在7.4左右。这种分离剂推广应用产生了很好的效果。沉淀完全,牢固,而非特异性结合低,时间短(加入分离剂15min后即可离心),受温度影响小,受到用户的广泛好评。
以上方法,要依据反应液中反应物分子量大小,酸碱度等特点,选择合适的分离方法及分离剂。
第四节 样品的前处理
样品的正确收集与处理,是蛋白质及多肽激素放射免疫分析取得成功的前提。不同的样品与测定项目,其前处理有不同的要求。下面以神经肽测定为例,介绍样品的前处理方法。
一、脑、脊髓与垂体中神经肽的提取(以大鼠为例)
1.大鼠称重后,在尽量安静的情况下,迅速断头、取躯干血。
2.尽快取下全脑、脊髓(某段)与垂体,在沸生理盐水中煮5min,以灭活酶,保持神经肽的稳定。
3.
4.脑区等称重。
5.把脑区、垂体或脊髓,分别置于玻璃匀浆管内,加入1mol/l HAC(或HCl)1ml,充分匀浆后倒入塑料指形管中,在室温下放置100min,使生物活性物质充分溶解在酸中。
6.加入1mol/l NaOH 1 ml,中和酸。
7.离心,取上清。
8.低温(-20℃以下)保存待测。
二、大鼠脑神经核团微穿孔取样方法(以下丘脑为例)
1.大鼠迅速断头,取出全脑,置沸生理盐水中煮5min。
2.将全脑置于取材角度器上,分别于视交叉前和乳头体后用双面刀片垂直切断,取下丘脑块。
3.将双面刀片装在切片机上。
4.将下丘脑置于切片机机载物台上,腹侧向下,并用502胶水固定。在脑块后方适当放置琼脂块以利固定。
5.开动振动切片机,缓慢移动推进器,切片厚400~500μm。用毛笔沾生理盐水,小心收集切片置于平皿内的生理盐水中。
6.将脑切片平置于橡皮板上,并在体视显微镜下,参照鼠脑立体定位图谱,确定神经核团位置。
7.选择相应直径的穿孔器,分别于两侧核团上垂直插下,然后推出针蕊将所取核团组织放入匀浆器中。
8.加入1mol/l HAC 0.5ml, 充分匀浆后倒入放免测定管中,放置100min。
9.加入1mol/l NaOH 0.5ml中和酸,离心(3000rpm/min)20min,取上清液,低温保存待测。
三、内脏、肿瘤组织中神经肽的提取(以胃粘膜为例)
(1)取下胃粘膜后,迅速称重置于试管,中沸蒸馏水1ml,在水浴中煮100min。标本在室温下放置,其中的生物活性物质会被酶降解,所以要立即加热处理。
(2)冷却后倒入特殊的匀浆器中,充分匀浆(使用电动搅拌器)。匀浆液倒入塑料指形管中,再用蒸馏水1ml,冲洗匀浆器,并倒入上述管中。
(3)离心,取上清,低温保存待测。
四、血浆
1.直接测定
(1)加酶抑制剂:准确采全血若干毫升,注入预冷的加有①抗凝剂0.3mol/l EDTA·2Na(乙二胺四乙酸二钠)溶液(每毫升全血20μl)、或1%肝素(每毫升全血10μl);②抑肽酶(每毫升全血500单位)的塑料指形管中,迅速低温离心,取血浆低温保存待测。
抑肽酶有液体的(标签写的有每毫升含多少单位)与固体的(每毫升含12TIU,1TIU=900KIU,即每毫克含10800单位)。固体的抑肽酶可用生理盐水溶解,使之每20μl含500单位。
(2)酸化处理:每毫升血浆加1mol/l HCl 0.2ml,低温保存待测。测定前加1mol/l NaOH 0.2ml。
以上两种方法,任选一种即可。
2.间接测定血标本经提取后,可去除蛋白质等干扰因素,并使微量的生物活性肽浓缩,但较费时,成本也高。常用的提取方法有:
(1)柱层析提取法:有多种层析柱可供提取不同的神经肽,其中较为方便的是用Sep-pak C18层析柱提取。主要步骤步:
①柱的预处理:该柱有两头,长头连接注射器,可注入溶液与样品,短头为排出口。预处理时注入乙腈10ml。蒸馏水20ml,使柱中的生物胶活化。
②注入样品(如血浆、脑脊液、腹水、尿等):样品中的水份流出,生物活性肽、蛋白及杂质等吸附在生物胶上。血浆上柱前,如先去除蛋白,可增加柱子的使用时间。]
③淋洗:用4%HAC溶液100ml注入柱中,以洗去一些杂质。
④洗脱:用7ml酸性乙腈(按容积算,每100ml中含有乙腈75ml、HAC4ml、蒸馏水21ml)作为洗脱剂,注入柱中,把生物活性肽洗脱下来,收集在塑料指形管中。
⑤清洗:用乙腈、蒸馏水清洗柱子,以备后用。
⑥将洗脱液吹干,低温保存待测。测定时可加入一定量的缓冲液溶解。
Sep-Pak C18柱层析,也可用于制备标记抗原时的层析纯化。
(2)加膜藻土提取法:
①抽血:用一次性塑料注射器抽取受试者静脉血4ml,置于加有肝素(125单位/ml 全血)指形管中。
②分离血浆:在4℃下离心,取出血浆。
③血浆酸化:取2ml血浆,加入1mol/l HCl 0.5ml, 摇匀。
④吸附:加入0.5%藻土悬液2ml,在水平震荡器上震30min。离心,去上清,留沉淀。
0.5%藻土县液(Fuller’s earth)的配制:
0.5gFuller’s earth
0.1gDextran T70
100ml去离子水
⑤洗脱:在沉淀管中加入80%酸性丙酮1ml,在漩涡振荡器上振2min,离心,取上清置于经硅化的玻管中。
80%酸性丙酮的配制:
80ml丙酮
20ml1mol/L HCl
⑥去脂:加入石油醚1ml,摇匀,脂肪溶解在石油醚中,分层后吸去上层。
⑦干燥:下层液体,置于37℃水浴中,用氮气(或空气)吹干。
⑧低温保存待测。测定时用一定量缓冲液溶解。
(3)有机溶剂提取法:常用的有甲醇、乙醇、乙腈、丙酮等。将溶剂按一定比例,加入标本内,混匀、振荡、离心,取上清吹干,冷藏待测。通常在有机溶剂中加入适量的酸。
在这些方法中,以柱层析法最稳定、准确,但成本高,推广不易。加膜藻土法,提取率较高,但操作复杂、费时。有机溶剂提取法操作方便,成本也低,虽稳定性较差。
五、脑脊液
1.煮沸收集脑脊液时,管子浸在冰水中。收集完毕,立即在沸的水浴中煮5min。离心、取上清;低温保存,待测。
2.酸化在1ml脑脊液中加入1mol/l HCl 0.2ml;测定时,再加入1mol/l NaOH 0.2ml中和。
3.加酶抑制剂
4.柱层析提取
以上方法,任选一种。
六、尿
尿液收集于事先加有适量醋酸或盐酸的容器中,使pH达4左右,煮沸1~2min,冷却后离心,取上清,加适量NaOH液,使尿液pH达7.0左右。此尿即可用于直接测定或经提取后再测定。
尿认提取法相同。采用Sep—Pak C18柱层析提取较为方便,因尿中不含蛋白,柱子可多次使用。
七、胃液
抽取胃液,注入加有抑肽酶的管中,离心,取上清,低温保存待测。
第五节 放射免疫分析法的建立
一、放射免疫分析的基本试剂
(一)标准品
标准品是放射免疫分析法定量的依据,由于以标准品的量用来表示被涮物质的量,故标准品与被测物质应当化学结构一致并具有相同免疫活性。标准品作为定量的基准。应要求高度纯化。标准品除含量应具有准确性外,还应具备稳定性,即在合理的贮存条件下保持原来的特性。
按实验要求,将标准品用缓冲液配成含不同剂量的标准溶液,用于制作标准曲线。
(二)标记物
标记抗原应具备:①比放射性高,以保证方法的灵敏度;②免疫活性好;③所用的核素的半衰期尽可能长,标记一次可较长时间使用,这对来之不易的抗原尤其重要;④标记简便、易防护。
要准确测量B与F的放射性,必须有足够的放射性强度。所选用的标记抗原的量,在使用125I时达5000~15000cpm。
(三)抗体
应选择特异性高、亲和力强及滴度好的抗体,用于放射免疫测定。
根据稀释曲线,选择适当的稀释度,一般以结合率为50%作为抗血清的稀释度。
(四)B与F分离剂
以2%加膜活性炭溶液为例,2%加膜活性炭溶液的配制:
活性炭2g(杭州木材厂生产,森工牌732型)
右旋糖酐T200.2g
加0.1mol/L PB 至100ml
电磁搅拌1h,然后置于变通冰箱冰箱待用。
(五)缓冲液
放射免疫分析技术所用的缓冲液有多种,要通过实验选用抗体和抗原结合最高的缓冲液。
目前最常用的缓冲液有下列几种:①磷酸盐缓冲液;②醋酸盐缓冲液;③巴比妥缓冲液;④Tris–HCl缓冲液;⑤硼酸缓冲淮。其中以磷酸盐缓冲液应用最多。
在缓冲液中,除必须有弱酸及弱酸的盐成分外,还应根据不同检测项目加入下列物质:①保护蛋白:常用的有牛血清白蛋白或白明胶,浓度为0.1%~0.2%,用以降低试管对抗原的非特异性吸附。②防腐剂:多采用0.1%叠氮钠、0.01%柳硫汞、溶菌酶或抗菌素。③酶抑制剂:如测定心钠素等肽类激素时,要加入适量的抑肽酶,用以抑制血浆内源性水解酶对待测物的降解;又如测定cAMP、cGMP时,需加入EDTA·2Na,抑制磷酸二酯酶的活性。④阻断剂:在测定甲状腺激素或测定某些甾体激素时,必须加阻断剂,使和蛋白质相结合的激素,变为游离型。常用的阻断剂有8—苯胺—1—萘磺酸、柳硫汞、水杨酸钠、三氯醋酸钠等。⑤载体蛋白:采用二抗作B与F分离剂时,要向反应液中加入适量与第一抗体同种动物的正常血清。在测定不含有血浆蛋白的样品时,用PEG沉淀剂分离B、F,必须加适量γ球蛋白或正常人混合血清。
在神经肽的RIA时,常用PELH缓冲液,(按1000ml,pH7.6):
0.1mol/l PB980.0ml
0.3mol/L EDTA·2Na 10.0ml
0.2%洗必泰溶液 10.0ml
溶菌酶 1.0g
二、加样程序
由于抗原、标记抗原和抗体三者加样次序不同,而出现两种加样程序,分述如下:
(一)平衡饱和加样程序
1.基本原理所谓平衡饱和,是指抗原和抗体反应达到再不结合,也不解离的平衡状态,称为饱和状态,即平衡饱和。所以,有人称此为饱和分析法。这意味着抗原或被测抗原、标记抗原、抗体三者一起温育。
2.加样程序一般先加标准物或被测样品,再加抗血清,最后加标记物。这样的顺序是让标准物或被测物与抗体有短暂的结合,提高抗原的竞争抑制能力。
在小分子半抗原的放射免疫分析中,标记抗原和未标记抗原与抗体结合的亲合力常常是不相同的,前者比后者的亲合力高。因此,上述加样程序就更有必要,所以一般都采用先加标准物或样品和抗血清,后加标记物。这样测定也比较稳定。
在大分子蛋白质抗原的放射免疫分析中,如果是双抗体分离法,抗原和标记抗原与抗体三者加样,可不分先后,有的是标准物、标记物、抗血清的加样顺序,但一般习惯还是标准物或血样、抗血清、标记物、然后混匀温育24~48h,再加双抗体,继续温育24h,使免疫反应达到平衡。对一些多肽激素的放射免疫分析,应用双抗体分离法,其流程比较长,这样的顺序同样可不分先后。
以大鼠垂体、下丘脑β-内啡肽RIA测定程序为例:
(1)加样(单位μl;总反应体积500μl)
| 标准曲线 | 样品 | ||||||||||
| T | NSB | Bo | 5Pg | 10Pg | 50Pg | 100Pg | 500Pg | 1ng | 垂体 | 下丘脑 | |
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| β-EP标准液 | / | / | / | 100 | 100 | 100 | 100 | 100 | 100 | / | / |
| 样品 | / | / | / | / | / | / | / | / | / | 1 | 100 |
| β-EP抗血清 | / | / | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 125-β-EP溶液 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 缓冲液 | / | 400 | 300 | 200 | 200 | 200 | 200 | 200 | 200 | 299 | 200 |
(2)孵育:4℃,24h
(3)分离B与F:每管加入2%加膜活性炭溶液300μl,摇匀,立即离心,去上清,测沉淀(F)的CPM数。
(二)顺序饱和加样程序
1.基本原理先将标准物或血样品与抗血清混匀,免疫反应6~24h,使抗原与抗体充分结合,甚至达到平衡,然后再加入标记抗原,与抗体反应12~24h,最后分离B与F,这称为顺序饱和分析法。
应用顺序饱和加样,可以提高测定方法的灵敏度。Utiger在做人促甲状腺激素(TSH)放射免疫分析时,将标记物延至第2天加入,发现其灵敏度增加两倍。如果缩短最后的温育时间,仍可取得满意的结果。所以一般认为,在顺序饱和加样中,第1次温育时间可以长,而第2次温育时间要短,这样可以提高灵敏度。但也有相反的意见,认为顺序饱和加样,是使用过量抗体,会使灵敏度受到一定影响。如果使用抗体不过量,温育时间缩短,在抗原和抗体结合未达到平衡饱和时就加入标记物,这样既不影响加灵敏度,反而比较稳定,甚至可提高灵敏度。
2.加样程序 以人血浆精氨酸加压素RIA测定程序为例(直接测定)。
(1)加样(单位μl;总反应体积600μl)
| 标准曲线 | 血浆 | |||||||||
| T | NSB | Bo | 1Pg | 5Pg | 10Pg | 50Pg | 100Pg | 500Pg | ||
| 管号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| AVP标准液 | / | / | / | 100 | 100 | 100 | 100 | 100 | 100 | / |
| 样品 | / | / | / | / | / | / | / | / | / | 300 |
| 无肽血浆 | / | 300 | 300 | 300 | 300 | 300 | 300 | 300 | 300 | / |
| AVP抗血清 | / | / | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 缓冲液 | / | 200 | 100 | / | / | / | / | / | / | 100 |
| 在4。C下孵育12~24h | ||||||||||
| 125I-AVP | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
(2)孵育:4℃,24h。
(3)分离B与F。
无肽血浆,用于血浆的直接测定。其制备方法为:在电磁搅拌下,抽取2%加膜活性炭溶液5ml,共两管,离心、去上清。血浆5ml,倒入上述活性炭管中,加盖,充分振荡10min,离心,上清倒入上述另一活性炭管中,振荡10min,再离心,取上清,即无肽血浆。血浆中的生物活性物质被活性炭吸附而去除。
(三)计数、绘制标准曲线与测定样品含量
以活性炭分离B与F,沉淀计数是F的cpm。T—F—NSB,得B的cpm数。
计算标准管与样品管结合(B)的cpm数及与零标准管结合(B)的比(B/B×100%)。
用半对数纸,以标准管的B/B为纵座标,以各标准管含量为横座标,绘制标准曲线。
根据样品的结合率(B/B×100%),从标准曲线中找出被测样品抗原的含量,再换算成每毫升血浆含某抗原的量,或每毫克(组织湿重)含某抗原的量。
三、放射免疫分析的质量控制
(一)质量控制的目的和内容
放射免疫分析的质量控制实际上就是控制测定误差,监督测定结果。它包括两方面的内容:一方面对测定结果做精确分析;另一方面鉴定常规测定方法,对那些测定结果不好的方法加以改进,并建立新的测定方法。质量控制分四个方面:
1.在一个测定方法内产生的误差。
2.在同一实验室内不同方法之间产生的误差。
这两种情况属于内部质量控制。
3.用同一测定方法,在各实验室之间产生的误差。
4.采用不同方法,在各实验室之间产生的误差。
后两种情况属于外部质量控制。
(二)放射免疫分析中造成测量误差的因素
误差包括系统误差和随机误差。系统误差发生在测量过程中由于仪器不准、试剂不纯、标准品不稳定等原因,使测定结果呈倾向性偏大或偏小,这种误差应力求避免。随机误差是测量过程中各种偶然因素造成的,没有固定的倾向性,这类误差是不可避免的,必要时做统计学处理。
造成误差的可能来源有以下几个方面:
1.各种仪器:设备的准确性、稳定性、效率以及被污染等情况带来的误差。如:①由于放射性测量仪器的稳定性、效率、样品试管的材料和均匀性及被测物的放射性强度等原因。②由于样品的自吸收,本底校正,测定时间,可能的污染等原因。③在试验室中所有的移液管、微量取样器以及天平的刻度、校准和使用方法等原因。④由于反应试管、移液管以及测定用试管等表面清洁度和所引起的不同吸附等原因都可以对测定结果带来误差。
2.试剂的纯度、质量和稳定性的影响也是造成误差的重要因素。如标记抗原的比度、纯度,辐射自分解,抗体的稳定性,分离剂、阻断剂及缓冲液等试剂的纯度等。
3.在放射免疫分析中一些基本操作,如取样、提取、沉淀、分离以及保温条件不适当等造成的误差。由于工作人员熟练程度不同也常常带来误差,如操作移液管垂直程度、下流速度、吹气与不吹气等。工作人员草率、不按规程操作等也都可以造成误差。
4.样品误差。样品的收集方法、贮存温度、放置条件,微量样品取样的准确度,样品可能造成的污染以及样品的变性(如免疫反应活性的降低、蛋白质的变性等)也都能造成测量的误差。
5.提取及层析分离过程中的丢失。
(三)放射免疫分析中测量误差的控制
1.选择准确性高的方法:对各种方法进行比较,淘汰粗糙及难以重复的方法。
2.建立方法对比。用相同的测量方法和不同的测量方法在同一实验室和不同实验室,在同一地区和不同地区,在同一时间和不同时间,对同一样品进行对比,检查产生误差的原因。
3.建立各种类型的标准。对标准品应规定纯度及制备方法,使用年限及贮存条件。
4.建立操作规程,按章 操作。对使用的试剂、仪器设备要经常检查其有效性,更换试剂时应进行必要的鉴定,必要时对测定方法要做重复性试验和回收试验。
5.建立可靠的检查制度。经常对测定结果进行核查,利用控制血清、标准血清检查每批结果的准确性。
参考文献
1.汪美先.免疫学基础.西安:陕西科学技术出版社,1983;9
2.夏宗勤.实验核医学与核医学.上海:同济大学出版社,1989;1
3.放射免疫测定基础.天津:天津科学技术出版社,1985;8
4.李振甲,韩春生,王连勋.实用放射免疫学.北京:科学技术文献出版社,1989;5
5.李振甲,王仁芝.激素的放射免疫分析.北京:科学技术文献出版社,1985
6.赵惠扬,张承刚.实用核医学.太原:山西人民出版社,1984;3
7.放射免疫分析在医学中的应用.北京:原子能出版社,1991,6
8.刘真,等.抗精氨酸加压素血清的制备及其初步应用.动物学报,1987;33:309~315
9.祝元祥,等.β-内啡肽的抗血清制备及其放射免疫测定.第二军医大学学报,1986;7:332~336
10.宁朝佑,等.催产素的放射免疫分析.中华核医学杂志,1987;7:224~497
11.王成海,等.强啡肽A1-13的放射免疫测定.中国药理学报,1987;8:494~497
12.Abrahom, GE. Handbook ofRadioimmunoassay. New York:and Basel, 1977
13. Yalow , RS. Methods isRadioimmunoassay of Peptide hormones. Amsterdam:North –HollandPub. Co, 1976
14. Pasternak, CA. Radioimmunoassayin Chinical biochemistry.London Heyden, 1975
第九章 免疫细胞化学与图像分析
在细胞生物学中,一个常见的问题是如何获取与细胞功能相关的各种定量测量信息。在免疫细胞化学中也存在同样的问题。制作免疫细胞化学标本环节 较多,只要有一个环节 失误就会影响实验结果,除了需要精制的药品外,还需要熟练的技术。那么,做成了理想的标本后,如何进行观察,才能获得尽量多的的各种定量信息,而且使这些信息能较客观的反映出来,这就是本章 的编写目的。
一、定量分析的重要性
目前有许多研究免疫细胞化学的文章 ,是做定性和定位研究的。如有文献中提到,P物质在脑组织中存在于30处以上,这只是解决了定性定位问题,这些部位含P物质的量是否相同?可否用快速简便的方法对细胞内免疫反应产物的量进行分析?从而可进行比较。所谓反应产物的“量”包括颜色深浅,其所占的长度或面积等,就要借助于图像分析仪(image analyzer)了。
以往我们对免疫细胞化学或一般组织化学光镜标本的观察,对反应产物的量常用“+”号表示,一般可分为0~+++,共五个等级,这种方法对差别较大的标本当然还是可以用的,但存在以下三方面的问题:①同一张标本,不同的观察者可以得到出不同的结论,因为这种分级没有明确的客观标准;②即使同一张标本同一个观察者,间隔若干天后进行再次观察时,可能结论也不一样的;③最后一点也是最重要的一点,人的视觉是有一定限制的,用一般观察法实际上已经丢失掉了许多可贵的信息,因为你察觉不到实际上存在的较小的差异。因此我们力求有一个客观的比较精密的标准。除了常用的仪器如显微分光光度计(microspectrophotometer)和显微密度计(microdensitometer)等以外,还可用图像分析仪进行测量。前二者已有许多有关著作中介绍过,就其精确与灵敏来说都是够的,但却不能同时测出标本中某些成分的面积、体积或长度等其他极有用的参数。图像分析仪的分析广度则要大得多,并能明显地提高工作效率,所得到的各种数据可通过分析仪上的计算机进行统计学处理,只要将各种统计学公式输入计算机,选择其中你所采用的公式,即可快速得出分析结果,告诉你有无显著性差异。
二、图像分析仪简介
图像分析仪又称图像分析系统(image analysis system),主要用来解决如何客观地较精确地用数字来表达存在于标本中的各种信息,可称为数学形态学。它已经成为一种公认的科学研究工具,并且逐渐展现出巨大的潜能。图像中包含着极其丰富的内容,是人们从客观世界中获得信息的重要手段,因此,正确地测量和处理图像已成为测量技术中的重要课题,并广泛应用于航空遥感测量、金属图像测量、微电子技术中微图形检测、精密机件尺寸检测,光波干涉图、医学生物学的研究及应用等有关领域中。图像测量将会随着信息科学和人工智能的发展而日益显示其重要作用。现代图像测量是光学、电子学、计算机技术等相互渗透的跨学科的结果,涉及广泛的学科领域,医学只是其中一个分支。
我们在光学显微镜下看到的是光学图像,而在图像分析仪屏幕上看到的是电子图像,因此在显微图像分析中,整个系统最重要最关键的工作就是要保证得到的电子图像能最精确地反映出光学图像,这个过程由摄像机(图像扫描器)、显像管和图像处理机(计算机)来完成(图9-1)。图像可通过光学显微镜、透射电镜或扫描电镜传到摄像机而产生电信号,照片或胶卷上的图像也可以通过摄像机反映到电视屏幕上进行分析。图像在电视屏幕上是由许多像素(pixel)构成的,单位面积屏幕上像素愈多则图像愈清晰,即分辨率愈高。各厂家生产各种不同规格的产品,如有640×480像素的、896×704像素的、512×480像素的屏幕等。当图像显示时,每个像素含有两方面的信息,即此像素的灰度及其在标本中的位置,两种信息决定了图像的形状和颜色深浅。

图9-1 图像分析系统简图
有关图像分析的学术活动,1963年召开了第一届国际讨论会,此后每四年有一次国际学术交流活动。1983年在美国召开了第六届国际学术会议,与会代表约150人。1987年9月在法国召开了第七届学术会议,在200多正式代表中有2/3是生物医学方面的专家,而我国生物医学界没有人被邀参加,可见我国过去对如何将图像分析应用于医学生物学方面的研究重视得不够,对国际上这方面的信息掌握得不及时。国内自70年代末期相继从国外引进大型自动图像分析仪后,80年代才开始将医学生物学研究与图像分析方法结合起来。从1981~1983年召开了三次全国体视学与图像图像分析学术会议,1987年召开了第四次学术会议,虽然在宣读的论文中医学研究已占了很大的比例,但具体应用到免疫细胞化学则实例极少,仅是一个开端。1988年中国体视学会正式成立,是在民政部登记的属于新学科的第一个学会。并于1991年11月在重庆第三军大学召开了“全国计量学在形态学研究中应用研讨会”,与会代表来自22个省市,形态计量学的方法已应用到组织学、解剖学、病理学、细胞学等领域。更为可喜的是过去此类研讨会都是请外商到会介绍他们的产品,为他们提供中国市场,而此次会议上本国的三家研制生产图像分析仪的单位在大会上介绍各自的产品,以较好的性能价格比与国外产品竞争,扩大国内市场,我国在此领域的研究进展也是很快的。
三、常用的测量方法
(一)灰度
灰度(grey level)指图像各种分颜色的深浅程度。比较高级的图像分析仪可将灰度分成为256级,也有的只能将灰度分成64级,总之都是2n,24是26256是28。免疫细胞化学标本上反应产物的染色深浅即可用灰度来表示。能将一张标本上不同染色深度区分为几十或更多的等级,这是人眼所不及的。因此,某些实验的结果,如果用光学显微镜作一般的观察,似乎实验组与对照组无明显差异,而用图像灰度法经统计学分析,则可反映出显著性差异,说明仅仅用显微镜观察是不够的,在某些情况下可能会辜负了制片过程中所花费的大量精力,而得不到应有的结果。
由于免疫反应产物在细胞内不一定是均匀分布的,在同一个细胞中就可产生各种灰度,这种情况如何进行比较?有两类方法可供选用:一种是测每个细胞的平均灰度,近年较新型的图像分析系统有此性能,而比较早期的或比较简单的图像分析系统就没有这种性能,例如某一细胞在电视屏幕上占有120个像素,按灰度级进行测量后,也许120个像素中有十多种不同的灰度,分析仪可立即显示其平均灰度。另一种方法是在反应产物不均匀的细胞中可用每一种灰度所占的百分率来表示,例如你要观察1000个细胞,在这些细胞中各种灰度所占的百分率可测出,并作出曲线,或用其他统计学方法处理,来进行比较。
如果用彩色图像分析仪,除了上述的灰度测量以外,还可以将不同的灰度编成不同的颜色,使图像更鲜明美丽,而且便于测量。彩色有两种情况:在屏幕上出现与标本一样的颜色称为真色(real color),如果将不同的灰度转换成不同的颜色则称为假色(pseudo color),应用假色的目的是增强对比度,来改善对细胞结构的视觉识别,同时可增强轮廓用来强调结构的细节 。例如,免疫细胞化学中常用的非标记抗体过氧化物酶—抗过氧化物酶法,最终反应产物呈棕色,假设在脑内某核团的许多细胞中,呈现出不同深度的棕色,深浅差别较大者显示在屏幕上人眼还能区别,若差别小的则不易区别了,操作者可将灰度11~15用红色显示,灰度16~20用蓝色显示、灰度21~25用黄色显示、灰度26~30用绿色显示等。一般可呈现数十种颜色。也可以将灰度11~20用深红色显示、灰度21~30用淡红色显示、灰度31~40用蓝色显示等,由操作者随心所欲加以编辑。这种图像如拍摄下来,旁边显示出一条彩色带,表明什么颜色代表什么范围的灰度,如此可将一种颜色的免疫细胞化学标本转换成多种彩色的,对比鲜明的照片。
有些图像分析仪中带有光密度计组件,光密度计能将扫描器视频信号变换成对数等值,然后数值化,就能用绝对光密度单位来校正。因此,光密度计把被测物的积分光密度作为主要输出,所谓积分光密度即各个单独探测的像素密度分布的总和。因为容易得到被测物的面积,也就很容易求出平均密度。光密度在细胞化学反应的定量领域内极为有用。灰度是一种相对值,因为你可将标本上的灰度随你编辑分为64级、也可将其分为128级或者256组,而光密度是绝对值。在文献中光密度常用OD表示(optical density)。有的单位购置了图像分析仪后才发现不能作光密度测量,但已无法再去掉换,所以在购买前必须详细了解其性能,包括屏幕像素数、有无光密度计组件等。
(二)长度
形状不规则的线形组织结构,一般方法很难计算出其长度,如组织中的毛细血管,神经纤维、细胞超微结构中的各种膜性结构等,以往常用排列稀疏或密度集等词描述,图像分析仪则可测出各种图像周界线的长度。例如:在活检组织的子宫颈上皮细胞的电子显微镜照片上,测出在一定范围的细胞膜长度为8128像素,桥粒长度为1229像素,计算出桥粒长度占细胞膜总长度的15%,wiernik等用此方法观察到癌细胞的桥粒值远小于正常细胞,提出这可能与癌细胞易于失去相互间的的细胞连接,从而形成转移有关。用免疫细胞化学法显示的神经纤维,在局部组织中可能出现纵横交错的复杂图像,用图像分析仪可获得单位面积内神经纤维的总长度。又如去甲肾上腺素神经纤维呈串珠样,如果测出一定范围内神经纤维总长度及局部膨大数目,即可计算出串珠平均间隔距离,比较精确。
(三)面积
无论是在光镜或电镜免疫细胞化学标本的观察中,都要涉及有关标本中某些结构的面积问题。即使是极不规整的结构,用图像分析法容易算出其面积。在一定的放大倍数下,每μm2中含多少像素可以测出,画出待测结构的轮廓,在所勾画的范围内含多少像素是立即可显示出来的,这样,很快可算出面积的数值。例如免疫电镜技术中的铁蛋白法、胶体金法等,可用上述方法进行单位面积中反应产物颗粒的计数,可进行各种实验条件的比较。
曾有人在肝脏切片上进行图像分析,在一定范围内所有细胞核的总面积显示为51554像素,其中肝细胞核总面积为27431像素,可知肝细胞核占全部细胞核总面积的53%。
四、图像分析仪工作程序
使用者对硬件不需操纵,它们可完成复杂的运行过程,完整的计算机软件可按实际需要使其执行功能。对操作者来说,图像分析仪的实际操作很少,几乎完全是通过一个称为光电鼠标(mouse)的附件来操纵的。计算机屏幕上显示出多项指令,可由光电鼠标来指明你所需要的程序,光电鼠标可控制计算机屏幕上的一个光标,移动光电鼠标也随着移动,将光标移到计算机屏幕上显示的某项功能的区域内,就表示选择了该项功能,可以开始工作,极简便。图9-1为图像分析仪的简化图。
图像分析仪主要包括输入(input)、中央信息处理机(central processor)和输出(output)三大部分。实际上,工作程序并不是一成不变的,后面的步骤的信息常会反馈到前面,于是又重复前面的程序,具体步骤如下:
1.标本成像 移动标本使需要观察的部位在电视摄像机上得到适当放大的图像,标本包括组织切片或电镜照片或照相底片等。
2.图像获取 用电视摄像机或其他方法将图像转变为电信号,在此过程中,摄像机的性能极重要,不能使用那些便宜的适用于监视的电视摄像机,一定要用使图像具有很好的清晰度的摄像机。
3.加强图像 加强电子图像(electronic image)使其更适合于分析。
4.检测检测(detection )是图像分析过程中设法从图像中确定并且分离出需要分析灰度相的步骤,“相(phase)”是图像中我们想要测量的部分的总称。检测是通过选择一定的阈值来完成的,如果所需相比背景暗,那么所有暗于下限的东西都被选,例如相的灰度是20~50,20是下限,50是上限,背景的灰度小于20,检定时暗于灰度20的东西都被选。如果所需相比背景亮,如免疫荧光细胞化学技术的标本,那么亮于上限的东西都被选。如果所需相比背景亮,如免疫荧光化学技术的标本,那么亮于上限的东西都被选,例如相的灰度是5~20,5是下限,20是上限,背景灰度大于20,所谓上限既指比灰度20浅的亦即灰度20以下的相被选,而背景是暗于上限的,不被选作测量。如果相暗于图像某些部分而又亮于图像的另一些部分,那就要在二限之间的部分选择灰度了。
在检测过程中要使用图像框(image frame)和测量框(measurement frame)。检测只在图像框内进行,框的大小按需要而定,测量框在图像之内,是进行测量的部位。两个框之间的部分称为保险区(图9-2)。
图像中每个被测物都有其特有的特征计算点(feature count point, FCP),FCP在被测物的最底点,如图9-2中上面10个被测物的FCP均在测量框内,可计数或作其他测量,而最下面2个被测物的FCP不在测量框内,则不计在内,在测其他区域时再计算,有的被测可能被测量框截断,那么测量框外的那部分被测物应该位于保险区,即保险区要大于被测物,才能观察FCP是否在测量框内而决定取舍。这样当换到相邻的区域进行测量时,不会使某图形重复测量,可避免测量误差,图9-3显示放置标本的显微镜载物台的移动方式,可由计算机控制,用编制好的程序,使载物台按一定方式移动,也可以人工操作。图中可以看出每个部位都将通过测量框,不会遗漏。

图9-2 示测量框位置,图中有10个被测物的FCP在测量框内
5.阴影校正校正图像细节 直到正确无误并达到能被测量的要求。所谓阴影(shading)是指人眼看来是均匀的视场内存在着不均匀的电子反应,这使得灰度相同的图像成分由于在视场中所处位置不同而显示出不同的灰度,这种影响必须校正才能使图像得到准确测量。阴影有三个主要的来源:
(1)图像源的不均匀的光照。
(2)穿过透镜时光路发生变化引起的透镜阴影。
(3)显像管本身的图像灵敏度差异引起的扫描阴影。]
任何图像分析在具体运用中都有这些阴影存在,前二者可通过精密安装图像分析仪来控制,后者可通过对显像管的质量严格筛选来减少影响。阴影可贮存起来,并且在每上次扫描时同步地从图像信号中去掉。

图9-3 显微镜载物台移动方式
1.载物台移动方向;2.晕微镜观察视场;3.图像框;4.测量框
6.测量经以上各步骤后,可以用图像分析仪的计算机对图像进行测量来取得所需的参数,如灰度、面积、长度、个数等。原始的参数可由计算机转化成容易理解的数值,例如面积可由某图形所占像素数转化为平方微米,使观察者容易理解。
7.资料分析 将资料进行分类,并加以说明,以便做出结论。也可将资料贮存,随意可提取出来,供研究者使用。
8.其他事项
(1)标本要清洁:如果标本上有污点,研究者可分辨哪些是正常的免疫反应产物,哪些是污染引起的,但仪器不会区别,只要是电视屏幕上测量框内有的东西都会被测量,如测灰度时切片上有污点,会影响结果。
(2)电压要稳定:这一点是结合我国目前情况而言,虽然仪器使用时是通过稳压器的,也要经常注意稳压器上的电压指针是否稳定,否则也影响结果。
(3)价格问题:图像分析仪广泛应用于工业、农业、医学等领域,因此并不是价格愈贵就愈好,而要看我们的应用目的及其性能,以免购置一些用不着的昂贵的附件而造成浪费。一般可以从以下三方面来考察仪器性能:在本专业范围内应用的广度、运算的速度和操作的方便程度。
(4)合作使用:分析仪价格昂贵,根据国内目前实际情况,有些工厂购置了图像仪而仅仅用作工业金相分析,闲置的时间很多,我们从事医学研究的人可以去充分利用它的性能,联合进行科研工作,发四川省目前最高级的图像分析仪就是在工厂中而不是在高等学校中。
五、没有图像分析仪可否进行图像分析?
当没有图像分析仪时,研究者早已想到用网格来进行图像分析,也获得了客观的评定结果。网格可分为两大类:一类是置于目镜内的网格,可测量切片标本上的各种数据;另一类是大的网格,可放在照片上,光镜电镜照片均可用,对照片上的各种结构可进行测量。以上二者至今仍被采用。英国标线片公司提供许多型号的市售标线片(即网格)。有的国家制造的显微镜,将目镜与带有六种不同型号标线片的旋转盘装在一起,以便于观察者作各种测量。国内某些单位有自制标线片,并有少量出售。
Aalto等1982年曾在“免疫组织化学的形态测量法一卵巢肿瘤内的胚性癌抗原”一文中推荐用视野评分法,他用三种方法对PAP法免疫组化标本进行分析:①对全切片的染色进行分级。②在10×10放大倍数下,每一切片用目镜网格任选25个方形视场进行观察,并对每一视场进行分级。③在25个视场内取25个点的着色强度进行分级。染色强度分为0级、1级(轻度)2级、(中度)、3级(重度)。方法①的结果不同于②③,而方法②和③差别不大,说明主观估算的鉴别能力低,一般镜下观察不能确切反映染色强度。
用网格进行图像分析的方法很多,如用免疫荧光等方法显示神经纤维,要表示各处的纤维密度不同,除了文字描述如致密、稀疏等以外,用网格法就要客观一些,在目镜或照片上放上网格,观察阳性神经纤维与网格上的线条的交叉次数,排列密集的区域交叉次数必然多些,这就比较客观,重复性也较好。
用荧光显微镜观察免疫荧光标本,Ploem曾在1977年指出荧光强度之差至少要二倍才能在直观估计时显示出差别,说明人视觉对荧光强度变化不够敏感。作者在工作中体会到,可利用照相的自动曝光系统来作相对定量,因为荧光愈强则自动曝光时间愈短,荧光弱则自动曝光时间长,相当敏感,用眼睛观察二个荧光强度几乎无差别的细胞,也能在自动曝光时间上显示出差别来。作者曾经将许多荧光标本用相同的曝光时间拍在同一个胶卷中,冲洗后,荧光强的区域胶卷上显色深,荧光弱的区域胶卷上显色浅,因为荧光容易淬灭,用此法可将胶卷较长期保存,而且胶卷上的信息还可通过图像分析仪测灰度等数据。这些都是在实践中的一点经验,供读者参考。
用网格测量的具体操作举例:图9-4为一关联方测格,由于测点、测线、测面之间有互相关联的关系,故称为关联方测格。方格直线交叉称为测点,总数为100个,方格中所有直线称为测线,小方格边长为d如图中所示,测线总长度为200d,整个大方格为测面,测面总面积为100d2,测格周围的虚线不是测线。关联测格的优点是:只在计数位于欲测图像中的测点数P,就可计算位于该图像中的测线长度L及测面的面积A。计算方法为:L=2d·P,A=d2·P。
可将图9-4摄制于小的透明胶片上,剪成你所用的目镜筒的内径大小,将其置于目镜内,使测格清晰地叠映组织标本的图像上,则可进行测量。d的长度可用台微尺来确定。也可将9-4复印在较大的透明胶片上,可用来测量电镜照片或光镜照片,将透明胶片叠加在照片上即可进行测量。图9-5为一测量的例子:

图9-4 关联方测格

图9-5 示测点计数
此关联方测格共有测点100个(如果只计数粗测点则有25个),图像为一个肾小体的轮廓,包括血管球和肾小囊腔,测点计数的结果,在肾小囊腔内的测点数为12,在血管球内的测点为49个,整个肾小体内的测点为12+49=61个,用台微尺测出d的长度,则可得到此图像中肾小囊腔的面积,血管球的面积,肾小体的面积。明小囊腔与肾小体的面积比12:61=19.7%等多个参数。
值得提出的是,在显微镜下网格的线条有一定宽度,如图9-6所示。计数测点时如①箭头所示,即横线上缘与竖线右缘交点处为真正的测点,若此点落在图像外面则不能计数。如②箭头所示,此测线的上缘才能作为真正的测线。

图9-6 示真正的测点与测线
表面积密度的测定:免疫细胞化学电镜照片中的膜性结构如内质网、线粒体、细胞膜等都可测定表面积密度,光镜标本中的各种结构也可同样测定。表面积密度是指单位体积参照空间内特征物的表面积,通过数学运算可简便地用以下方法测定:测量单位面积参照面内特征物断面周界线的长度。如果某一个细胞的电镜照片作为参照面,线粒体作为特征物,欲测单位面积电镜照片内线粒体断面周界线的长度,可用以下公式:
SV=2IL
SV表面积密度2IL交点密度
IL=测线与特征物断面周界线之间的交叉点数除以参照面内测线总长度。
图9-7为一咱摆线测格,可用来方便地测表面积密度。图中的平行直线不是测线,仅是为了便于计数交叉点和测点而画上的。图中的曲线即摆线,也就是测线,共45条,每条摆线长度d=1/10测格宽度(1cycloid arc =1/10×frame width) ,测格的宽度容易测量,如用目镜测格,可用台微尺测量,如用大的透明胶片,可实际用尺测量,因此每条摆线长度很易算出。测格中共有45条摆线,其总长为45d。图中直角短线(L)示测点,共90个,测线长度L与测点数P的关联关系为L=d/2·P。具体来说,用图9-7摆线测格,置于一个细胞的超微结构照片上,如果整个测格均位于照片内,则参照面内测线总长度为45d,如果90个测点只有60个落至细胞内(即测格中有30个测点落在此照片外)则参照面内的测线总长度为d/2·P=d/2×60=30d。摆线与特征物(如内质网膜、线粒体的膜等)的交叉点容易数,用上述IL和SV公式即可得出所需参数。此公式为经过数学上的研究而得出,我们可应用公式来作表面积密度的研究。
读者需注意的是:若特征物是各向同性分布,可采用任意方向的随机切片。若特征物呈各向异性分布,可采用垂直切片或其他一些方法制作的切片。Mattfeldt等曾提出在一个组织块中作三个互相垂直的切片(three mutually perpendiculersections )用作研究。目前通用的垂直切片的概念是1986年Baddeley等人提出,指垂直于某任意确定的水平面的随机切片,或平行于某一任意确定的垂直轴的随机切片。如图9-8所示,HP为水平面(horizontal plane),VP为垂直面(vertical planes),二个垂直面互相不是平行关系,成一定角度。在生物组织中,如皮肤的表皮、各种上皮的外表面均可作为水平面,只要与水平面垂直的各个方向所切的切片均为垂直切片。骨骼肌纤维的长轴、长骨的长轴均可作为垂直轴,与其平行的切片也作为垂直切片。管状的器官如消化管、呼吸管道等,可纵向剖开,展平,当作水平面,在其中作垂直切片如图9-9所示:以水平面为基准,垂直切片必需在随机的位置和随机的方向,在标本计划中,第一步是需要随机,常用一组系统随机位置的垂直切片(systematic randomly positionedvertical sections),第一个切面是随机的,其余切面则是与第一个切面或一定的角度而选择的,如图中(3)和(4)即表示三个不同的方向,但都垂直于同平面,即垂直切片互相间有一定的旋转角度。图9-7摆线测格中大箭头所示vertical 表示箭头方向与标本垂直轴一致,即图9-8中的verfical 所示方向。
如果有的标本没有可辨认的垂直轴,可任意确定一个水平面,来作垂直切片。

图9-7 示摆线测格

9-8 示垂直切片
VERTICAL:指垂直轴;
P:水平面;二个VP为垂直面,互相不呈平行关系

图9-9 示管状器官的垂直切片
六、实例介绍
因为将免疫细胞化学方法与图像分析结合起来进行研究的论文在国内国外都还不多。在第六届国际学术会议上发表的90多篇论文中只有1篇,因此在实例介绍中,包括一部分不是免疫细胞化学方法,而是用其他组织学方法与图像分析结合起来研究,但这种方法对研究免疫细胞化学标本也可借鉴,从中可得到一些启发的,也在此选择性地作一些介绍。
Mcmillan等1983年在第六届国际体视学会议上曾报告了“用图像信息处理机客观评定免疫组织化学染色的组织”,阐明了当组织与第一抗体作用时,不断搅动血清,明显提高了免疫反应。Bordier 等1982年用图像分析法对大鼠的神经垂体进行研究,阐明了轴突占神经垂体体积的一半,分泌颗粒占轴突体积的20%,加压素的含量与分泌颗粒的体积密度无关,而与分泌颗粒内激素浓度有关。这些结果如不用图像分析法是很难得出的。Steward等1983年用测量家鸡脑单位面积内的突触数目等,来研究与记忆形成有关的细胞学改变。
英国现在有300万75岁以上的人,其中有五十万人患有老年性痴呆(Alzheimer病),这种病过去认为是由于年龄增长的不可避免的现象。英国神经科学所用图像分析仪与谷氨酸盐受体的放射自显影法结合起来对此病进行了重要的研究。由于放射自显影会产生一些非特异性的结合,用图像分析仪可以从全结合图像减去非特异性结合图像,而得到特异性结合图像,可以测出特异性结合的百分率。目前已知道,老年性痴呆患者脑中,与记忆、理性行为及感情行为有关的区域内,神经元的进行性退变,神经递质发生改变,影响了从一个神经元到另一个神经元的信息传递。
我国1991年11月出版的“计量学在形态学研究中应用学术研讨会论文集“共收集论文123篇,其中有关免疫细胞化学与计量学结合的论文共8篇:①大鼠烫伤后下丘脑室旁核和视上核内AVP含量变化的形态学计量(第二军医大学张忠义等)用图像分析仪测定AVP阳性反应物的面积。②人脊神经节 内SP、SK、CGRP免疫反应细胞的比率(中国医科大学方秀斌等),用人工计数方法。③交感神经元和胆碱能神经元中ACh和ChAT显示比较(军事医学科学院汪家政等),用图像分析法测定各种参数。④大鼠脾树状突细胞的组织分布棗S—100蛋白标记和立体计量分析(南京铁道医学院张锦堃等)用目镜标线片的测格进行定量研究。⑤垂体GH腺瘤细胞分泌颗粒的免疫胶体金定位检测及定量分析(中国人民解放军总医院罗毅等),用图像分析法测定各种参数。⑥胃肠粘膜重度异型增生与腺癌细胞核DNA含量的测定及免疫组化的比较研究(上海第二医科大学吴平平等),用显微分光光度系统进行DNA测量。⑦免疫组化在胃癌病理棗生物学分型中的价值(滨州医学院张树毕等),将免疫组化反应分为阳性阴性而进行比较。⑧人胎十二指肠EC细胞的体视学研究(江西医学院朱清仙等)用目镜标线片测格进行定量研究。由此可大致体现我国在此领域的研究现状。
七、图像分析与体视学
图像分析还可用于三维重建,用连续切片可重建立体的原形,在神经组织的研究中很适用。我们在显微镜下观察到的是平面图像,而这些平面图像是从立体结构中切下来的,单凭平面图像不能反映组织的真实结构,例如圆形可以从球形、圆柱形、椭圆形物体中切下。如何从二维结构推导出三维结构,这就是所谓体视学(stereology)所研究的范畴。stereology 这个词是1961年开始正式应用的,由于体视学与图像分析的密切关系,无论是国际上的或国内的学术会议都将这二者放在一起讨论。
将体视学知识与免疫细胞化学标本观察联系起来,将是一种可以获取更多信息的研究手段,目前国外已很重视体视学的研究方法,发表了一些论文,国内也开始做这方面的工作,因此有必要将体视学的一些基本术语介绍给读者,供参阅文献时或自己进行研究时应用。体视学语言目前已是一种通用的术语,现将常用的介绍如下:
结构(structure):在一个确定的组织模式中,由许多相互依赖的部分所组成的某物体称为结构。一个结构至少有二个组分构成,体视学的目的即弄清楚各组分之间相互关联程度、相对大小等。
组分(component):在结构中能被截然分开而且能被辨认的部分。
相(phase):所有在本质上相同的组分的集合称为相。例如一个细胞的所有线粒体构成了此细胞的线粒体相。
粒子(partiele):假如组分是由许多离散的并且能够作为单元独立存在的要素所组成,则将这些要素称为粒子,粒子可以表现为各种形状。
凸面体(convex solid):连接此实体内任何两点的线段,必需全部落于此实体内,换句话说,即此实体上切下的一个切片只能形成一个截面。
包容空间(containing space):指包含被研究的组分的空间。当然,被研究的组分常与其他不被研究的组分并存。
密度(density):单位体积、单位面积或单位长度内的量。
体积密度(volume density):在单位包容空间内,某相的体积。
表面积密度(surface density):单位包容空间内所含有某相的表面积。
长度密度(length density):单位包容空间内某相的长度。
数密度(numerical density):单位包容空间内某相的数目。
截面(profile):任何结构的切片上的图像。
体视学的测量值往往是相对测量值,以两个彼此相关联的测量值的比率来表达,其中一个测量值与组分有关,另一个测量值与包容空间在关,后者也称为“参考系统”。体视学原理可确定在切片上测得的这些比率与空间结构内相应的比率之间的精确关系。上述性质反映在体视学符号中,而这些符号目前已普遍被使用,在有些文献中已不再作解释了。常用的符号如下:
P测试点数
P1单位测试线长上的交点数
Pa单位测试面积上的点数
Pv单位测试体积上的点数
L测试线长
L1单位测试线长上的截距
La单位测试面积上线的单元长
Lv单位测试体积上线的单元长
A测试面积
S表面积
Aa单位测试面积上被测物的面积
Sv单位测试体积内被测物的表面积
V体积
Vv单位测试体积内被测物的体积
N被测物数目
N1 单位测试线长上与被测物相交的数
NA单位测试线长上与被测物的数
Nv单位测试体积内被测物的数
用测试网格的体视学方法,杨光等,1987年曾对腹腔神经节 小强荧光细胞进行超微结构的定量分析,测量了线粒体、溶酶体、粗面内质网、颗粒小泡的Vv、Sv、Na、Nv等参数,得出了标准小强荧光细胞的计量值。此处的Vv即单位体积细胞质内某种细胞器的体积,据体视学原理,Vv等于切片上被测的某种细胞器所占的面积的均数a与细胞质的面积的均数A之比,如用图像分析仪即可得出此二者的面积,而用测试格a等于落在此细胞器上的测试格的交点总数∑Pi,A等于落在细胞质上的测试格交点总数∑Pc。
Vv=ā/A=∑Pi/∑Pc
测试格的交点数有各种规格,如果有20条横测试线与20条纵测试线组成的测试网格,则有400个交点,利用交点所落部位进行推算。
免疫组织化学形态计量研究中参照空间的“陷井”问题。在某种组织结构(参照空间)内测量特征物的密度值(如体积分数、表面积密度、长度密度、数目密度等),如果不知道参照空间的体积,得不到绝对值,就有可能作出错误的结论,就是参照空间的“陷井”。举一例子说明:实验的结果苯巴比妥对大鼠肝细胞中的内质网的体积分数和表面积密度无显著差异,如果依此就认为苯巴妥对肝细胞(参照空间)内质网无显著影响,就错了,就进入了参照空间的“陷井”中去了。实际上,在些实验条件下,肝细胞质总体积显著增加,因而虽然内质网的体积分数和表面积密度无显著差异,但其绝对值已显著增加了。因此,要测量或估计参照空间的体积、乘以密度值,获得绝对值,才能获正确的结论。
八、国内外生产图像分析仪的情况简介
(一)国内情况
80年代初,以IBM—PC为代表的个人计算机得到了突飞猛进的大发展和在普及;紧接着各种功能强大面向图像处理与分析的专用超大规模(VLSI)蕊片或单板达到商品化水平,两者的结合,为微机图像处理系统的问世奠定了硬件基础。打破了以往只能在大中型计算机加专用图像处理系统的构成价格昂贵的图像处理系统的局面。为推广图像处理与分析技术创造了物质基础。从80年代中期开始,国内先后有武汉大学、清华大学、中科院自动化所、计算所、重庆大学、四川大学、华北计算所等单位,纷纷进行微机图像处理与分析系统的研制和推广应用工作。其中以四川大学计算机系图像图形研究所研制开发并定型生产的MIAS系列图像分析仪在国内具有较大的优势,获得了1992年国家级新产品证书。
现介绍如下:MIAS系列图像分析仪包括伪彩色型MIAS—300,真彩色型MIAS—400,超高分辨率型MIAS—1000等面向生物医学、金相分析、石油地质以及其它专用目的的各种图像仪均由硬件系统和软件系统两大部分构成。硬件系统主要包括MIAS图像处理计算机、图像输入设备,图像输出设备和交互式处理设备等。其主要性能指标:图像分辨率512×512,640×480,1280×1024。图像采集速度:电视方式0.04s/帧,慢速高精方式2~10秒/帧。图像存储体:MIAS—3000.5MB~1.5MB(兆字节 ),MIAS—4001.5MB~4.5MB,MIAS—1000 2MB~10MB 。灰度等级:256或4096。专用图像处理器特性:IPU40MHZ主频,>10MIPS。IFU(图像浮点处理器)40MHZ主频,>4MFOPS(每秒兆浮点处理指令)。在各种图像输入设备中,以视频摄像机为图像的基本输入设备,也可以配接视频录像机、数字扫描仪和连接扫描电镜的专用接口。高分辩彩色监示器为图像的基本输出设备。该系统还具备有自动移位的载物台和自动聚集控制系统可供用户选择。MIAS系列图像分析仪的软件系统是在DOS(磁盘操作系统)3.2以上环境开发的,全部采用C语言和汇编语言(80286宏汇编,TMS340系列专用汇编)进行编程,共98个功能模块。主要功能包括初始化及环境设置、图像输入和输出、图像编辑、图像增强、图像分割、图像测量、实用程序等。测量参数包括一维和二维目标的各种形态参数,灰度参数和纹理参数等数十种。该系统在长期为华西医科大学、第一和第四军医大学、北京军事医学科学院、上海医科大学、湖南医学院、哈尔滨医科大学等数十个医学单位的服务中,积累了许多有效的实用算法和功能、用户界面和处理速度方面已达到和超过某些进口中高档图像仪的水平。
(二)国外情况
英国的主要生产厂家有剑桥仪器公司(Cambridge Instruments Company),在图像的测量、计算、比较、分类等功能上都比过去的产品更完善,使用了大功率的新型计算机,使用QUIPS程序可获得各种图像分析测量的数据,重现性好。操作者不必精通程序设计语言,只需接受几小时使用QUIPS语言的教学训练即可。
英国Ealing—Beck公司生产Histotrak图像分析系统,如用透射光,该仪器能自动改变放大倍数。具有阴影校正系统。最使研究工作者感兴趣的是该仪器中设有坐标发生器,能使被检图像的坐标数据通过台式计算机在输出打印机上打印出来。
英国Micro Measurements 公司生产电视扫描图像分析仪,成本较低,用途较多。
英国Joycez—Loebl公司生产Magiscam图像分析系统,操作较简单,可解决一般图像分析问题,并可进行彩色图像分析,在医学和放射学等方面适用。
美国的主要厂家有美国美敦设备公司(Milton Roy Company),生产OMNICON图像分析仪,据上海多国仪器仪表展览会资料介绍,Ommicon图像分析系统有Omnicon Alpha500用于常规检验和研究。Ommicon FAS—III 用于医学和生物学领域较合适。Omnicon 3500为一种多用途的系统,配有64K通用NOVA4×计算机。Omnicon 5000是该公司发展的使用起来最方便的定量图像分析仪。Omnicon 7500是为了对图像作实时分析而设计的产品。
德国Leitz公司制造Leitz T.A.S图像分析仪,图像输入装置是一台Leitz Orthplan显微镜,该仪器还包括一台TU—58双盒式磁带机,可用于存贮程序、数据、图像。该公司产品的新型号是Leitz T.A.S PLUS,增加了自动调焦、自动图像旋转等功能。
德国Carl Zeiss公司的产品是Micro—Videomat,主要优点是有适用于计算机和大型计算机的程序。型号有Micro Videomat 2型、3型等。
德国的OPTON公司生产IBAS2000图像分析系统,可应用于显微图像分析的所有领域,如放射自显影、染色体分析、真色图像信息、细胞学分析、用连续切片来重建原形、颗粒大小分析、纤维分析、可测定交叉的或重叠的纤维长度及纤维的长/宽比例等。
德国VEB Zeiss Jena公司生产EPIQUANT图像分析仪,可进行自动或半自动分析。
日本浜板电视公司生产一系列特殊用途的、测量特殊参数的自动分析系统,如其中有一种称为Multianalyser的,与显微镜相结合,可用来测面积、长度等。
对国内外资料收集比较局限,总之购置仪器时要充分了解性能、对价格作比较、才能获得满意的结果。
参考文献
1.Jenkinson G. An introduction tothe operation and capabilities of image analysis systems.International Labmate,1987:12(3~4)
2.WeibelER. Stereological methods –practical methods for biological morphometry. London:Academic Press,1979
3.McMillanPJ. Objective evaluation of immunohistochemically stainned tissues using animage array processor. 6h International congress for Stereology, 1983
4.AaltoML, et al . Morphometric approach to immunohistochemisiry:carcinoembryonic antigen(CEA)inovarian tumours. Acta Stereologica, 1982;1(2):347~356
5.BoudierJA. et al. Stereological analysis of the rat neurohypophysis. ActaStereologica, 1982;1(2):323~328
6.StewardMG, et al. Stereologlcal analysis of synapses in the brain of the domesticchick following avoidance learning. 6th International Congress for Stereology,1983
7.CambridgeInstruments Issue 2, 1987
8.WiernikG, et al. A quantitative comparison between normol and carcinomatous squamousepithelia of the uterine cervix, British Journal of Cancer, 1973;28:488
9.杨光,等.豚鼠腹腔神经节 小强荧光细胞超微结构的定量分析.中国第四届体视学与图像分析学术会议论文汇编(第一集),1987]
10. 孙培懋,等译.图像分析入门.北京:计量出版社,1983
11. 管汀鹭译.显微术中的分析与定量方法.北京:科学出版社,1983
12. 杨正伟.生物组织的形态计量研究中应特别注意的两个问题:参照空间的“陷井”和样本含量问题.川北医学院学报,1992;7(3):73~76
13. Crus- Orive LM, et al:Recent stereological methods for cell biology:abrief survey. Am J Physiol, 1990;258(Lung Cell/Mol . Physiol. 2 ):L148~L156
14.Baddeley AJ, et al.:Estimation of surface area from vertical sections. J of Microscopy,1986;142:259~276
15.Mattfeldt T, et al. Orthogonal triplet probes:an efficient method for unbiased estimationof length and surface of objects with unknown ori-entation in space. J of Microscopy, 1985;139(3):279~289
第十章 流式细胞术(FCM)在免疫细胞化学中的应用
近些年来,流式细胞分析技术已经成为细胞生物学、肿瘤学、免疫学等基础和临床医学领域中的一项新的有效工具。本章 主要介绍流式细胞分离及分析的基石原理、流式细胞计的基本结构和操作、流式细胞术在免疫细胞化学中应用的技术思路、途径和方法,以及它们在临床医学中的应用。对FCM在外周血白细胞的免疫组织化学分析方面的应用作重点介绍。
第一节 流式细胞术简介
一、流式细胞术发展简史
流式细胞术(Flow Cytometry, FCM)是一种可以对细胞或亚细胞结构进行快速测量的新型分析技术和分选技术。其特点是:①测量速度快,最快可在1秒种内计测数万个细胞;②可进行多参数测量,可以对同一个细胞做有关物理、化学特性的多参数测量,并具有明显的统计学意义;③是一门综合性的高科技方法,它综合了激光技术、计算机技术、流体力学、细胞化学、图像技术等从多领域的知识和成果;④既是细胞分析技术,又是精确的分选技术。
概要说来,流式细胞术主要包括了样品的液流技术、细胞的分选和计数技术,以及数据的采集和分析技术等。FCM目前发展的水平凝聚了半个世纪以来人们在这方面的心血和成果。
1934年,Moldavan1首次提出了使悬浮的单个血红细胞等流过玻璃毛细管,在亮视野下用显微镜进行计数,并用光电记录装置计测的设想,在此之前,人们还习惯于测量静止的细胞,因为要使单个细胞顺次流过狭窄管道容易造成较大的细胞和细胞团块的淤阻。1953年Crosland –Taylor根据雷诺对牛顿流体在圆形管中流动规律的研究认识到:管中轴线流过的鞘液流速越快,载物通过的能力越强,并具有较强的流体动力聚集作用。于是设计了一个流动室,使待分析的细胞悬浮液都集聚在圆管轴线附近流过,外层包围着鞘液;细胞悬浮液和鞘液都在作层液。这就奠定了现代流式细胞术中的液流技术基础。
1956年,Coulter在多年研究的基础上利用Coulter效应生产了Coulter 计数器。其基本原理是:使细胞通过一个小孔,只在细胞与悬浮的介质之间存在着导电性上的差异,便会影响小孔道的电阻特性,从而形成电脉冲信号,测量电脉冲的强度和个数则可获得有关细胞大小和数目方面的信息。1967年Holm等设计了通过汞弧光灯激发荧光染色的细胞,再由光电检测设备计数的装置。1973年Steinkamp设计了一种利用激光激发双色荧光色素标记的细胞,既能分析计数,又能进行细胞分选的装置。这样就基本完成了现代FCM计数技术的主要历程。
现代的FCM数据采集和分析技术是从组织化学发源的,其开拓者是Kamentsky。1965年,Kamentsky在组织化学的基础上提出了两个新设想:(1)细胞的组分是可以用光光度学来定量测定的,即分光光度术可以定量地获得有关细胞组织化学的重要信息。(2)细胞的不同组分可以同时进行多参数测量,从而可以对细胞进行分类。换句话说,对同一细胞可以同时获得有关不同组分的多方面信息,用作鉴别细胞的依据。Kamentsky不仅思路敏捷,而且能身体力行。他是第一个把计算机接口接到仪器上并记录分析了多参数数据的人,也是第一个采用了二维直方图来显示和分析多参数的人。
流式细胞术在细胞化学中的应用的先驱者是Van Dilla和美国的Los Alamos小组。他们在1967年研制出流液束、照明光轴、检测系统光轴三者相互正交的流式细胞计的基础上,首次用荧光Feulgen反应对DNA染色显示出DNA的活性与荧光之间存在着线性关系,并在DNA的直方图上清楚地显示出细胞周期的各个时相。Gohde 和Dittrich接着把这项技术推向实用,他们用流式细胞术测定细胞周期借以研究细胞药代动力学问题。FCM用于免疫组织化学中的关键是对细胞进行免疫荧光染色,其它和在细胞化学的应用并没有多大差异。
近20年来,国内外在FCM上都做了不少的研究和应用工作,也取得了不少成果。特别是随着仪器和方法和日臻完善,人们越来越致力于样品制备、细胞标记、软件开发等方面的工作以扩大FCM的应用领域和使用效果。FCM在免疫组织化学中的应用也大致差不多,并注重了在临床应用的推广。
二、流式细胞计的基本结构和工作原理
流式细胞计是对细胞进行自动分析和分选的装置。它可以快速测量、存贮、显示悬浮在液体中的分散细胞的一系列重要的生物物理、生物化学方面的特征参量,并可以根据预选的参量范围把指定的细胞亚群从中分选出来。多数流式细胞计是一种零分辨率的仪器,它只能测量一个细胞的诸如总核酸量,总蛋白量等指标,而不能鉴别和测出某一特定部位的核酸或蛋白的多少。也就是说,它的细节 分辨率为零。国外又把流式细胞计称作荧光激活细胞分选器(Flu-orescence Activated Cell Sorter, FACS)。美国Becton—Dickinson 公司生产的流式细胞计系列均冠以FACS字头。目前我国国内使用的仪器多为美国、西欧及日本等国的产品,国内有些单位也已研制成功,但尚无定型产品面市。
1.流式细胞计的基本结构流式细胞计主要由四部分组成。它们是:流动室和液流系统;激光源和光学系统;光电管和检测系统;计算机和分析系统。图10-1为其结构示意图。

图10-1 流式细胞计结构示意图
(1)流动室和液流系统:流动室由样品管、鞘液管和喷嘴等组成,常用光学玻璃、石英等透明、稳定的材料制作。设计和制作均很精细,是液流系统的心脏。样品管贮放样品,单个细胞悬液在液流压力作用下从样品管射出;鞘液由鞘液管从四周流向喷孔,包围在样品外周后从喷嘴射出。为了保证液流是稳液,一般限制液流速度υ<10m/s。由于鞘液的作用,被检测细胞被限制在液流的轴线上。流动室上装有压电晶体,受到振荡信号可发生振动。
(2)激光源和光学系统:经特异荧光染色的细胞需要合适的光源照射激发才能发出荧光供收集检测。常用的光源有弧光灯和激光;激光器又以氩离子激光器为普遍,也有配和氪离子激光器或染料激光器。光源的选择主要根据被激发物质的激发光谱而定。汞灯是最常用的弧光灯,其发射光谱大部分集中于300~400nm,很适合需要用紫外光激发的场合。氩离子激光器的发射光谱中,绿光514nm和蓝光488nm的谱线最强,约占总光强的80%;氪离子激光器光谱多集中在可见光部分,以647nm较强。免疫学上使用的一些荧光染料激发光波长在550nm以上,可使用染料激光器。将有机染料做为激光器泵浦的一种成份,可使原激光器的光谱发生改变以适应需要即构成染料激光器。例如用氩离子激光器的绿光泵浦含有Rhodamine6G水溶液的染料激光器,则可得到550~650nm连续可调的激光,尤在590nm处转换效率最高,约可占到一半。为使细胞得到均匀照射,并提高分辨率,照射到细胞上的激光光斑直径应和细胞直径相近。因此需将激光光束经透镜会聚。光斑直径d可由下式确定:d=4λf/πD。λ为激光波长;f为透镜焦距;D为激光束直径。色散棱镜用来选择激光的波长,调整反射镜的角度使调谐到所需要的波长λ。为了进一步使检测的发射荧光更强,并提高荧光讯号的信噪比,在光路中还使用了多种滤片。带阻或带通滤片是有选择性地使某一滤长区段的光线滤除或通过。例如使用525nm带通滤片只允许FITC(Fluoresceinisothiocyanate,异硫氰荧光素)发射的525nm绿光通过。长波通过二向色性反射镜只允许某一波长以上的光线通过而将此波长以下的另一特定波长的光线反射。在免疫分析中常要同时探测两种以上的波长的荧光信号,就采用二向色性反射镜,或二向色性分光器,来有效地将各种荧光分开。
(3)光电管和检测系统:经荧光染色的细胞受合适的光激发后所产生的荧光是通过光电转换器转变成电信号而进行测量的。光电倍增管(PMT)最为常用。PMT的响应时间短,仅为ns数量级;光谱响应特性好,在200~900nm的光谱区,光量子产额都比较高。光电倍增管的增益从103到108可连续调节 ,因此对弱光测量十分有利。光电管运行时特别要注意稳定性问题,工作电压要十分稳定,工作电流及功率不能太大。一般功耗低于0.5W;最大阳极电流在几个毫安。此外要注意对光电管进行暗适应处理,并注意良好的磁屏蔽。在使用中还要注意安装位置不同的PMT,因为光谱响应特性不同,不宜互换。也有用硅光电二极管的,它在强光下稳定性比PMT好。
从PMT输出的电信号仍然较弱,需要经过放大后才能输入分析仪器。流式细胞计中一般备有两类放大器。一类是输出信号辐度与输入信号成线性关系,称为线性放大器。线性放大器适用于在较小范围内变化的信号以及代表生物学线性过程的信号,例DNA测量等。另一类是对数放大器,输出信号和输入信号之间成常用对数关系。在免疫学测量中常使用对数放大器。因为在免疫分析时常要同时显示阴性、阳性和强阳性三个亚群,它们的荧光强度相差1~2个数量级;而且在多色免疫荧光测量中,用对数放大器采集数据易于解释。此外还有调节 便利、细胞群体分布形状不易受外界工作条件影响等优点。
(4)计算机和分析系统:经放大后的电信号被送往计算机分析器。多道的道数是和电信号的脉冲高度相对应的,也是和光信号的强弱相关的。对应道数年纵坐标通常代表发出该信号的细胞相对数目。多道分析器出来的信号再经模-数转换器输往微机处理器编成数据文件,或存贮于计算机的硬盘和软盘上,或存于仪器内以备调用。计算机的存贮容量较大,可存贮同一细胞的6~8个参数。存贮于计算机内的数据可以在实测后脱机重现,进行数据处理和分析,最后给出结果。除上述四个主要部分外,还备有电源及压缩气体等附加装置。
2.流式细胞计的工作原理下面分别简要介绍流式细胞计有关的参数测量、样品分选及数据处理等工作原理。
(1)参数测量原理:流式细胞计可同时进行多参数测量,信息主要来自特异性荧光信号及非荧光散射信号。测量是在测量区进行的,所谓测量区就是照射激光束和喷出喷孔的液流束垂直相交点。液流中央的单个细胞通过测量区时,受到激光照射会向立体角为2π的整个空间散射光线,散射光的波长和入射光的波长相同。散射光的强度及其空间分布与细胞的大小、形态、质膜和细胞内部结构密切相关,因为这些生物学参数又和细胞对光线的反射、折射等光学特性有关。未遭受任何损坏的细胞对光线都具有特征性的散射,因此可利用不同的散射光信号对不经染色活细胞进行分析和分选。经过固定的和染色处理的细胞由于光学性质的改变,其散射光信号当然不同于活细胞。散射光不仅与作为散射中心的细胞的参数相关,还跟散射角、及收集散射光线的立体角等非生物因素有关。
在流式细胞术测量中,常用的是两种散射方向的散射光测量:①前向角(即0。角)散射(FSC);②侧向散射(SSC),又称90。角散射。这时所说的角度指的是激光束照射方向与收集散射光信号的光电倍增管轴向方向之间大致所成的角度。一般说来,前向角散射光的强度与细胞的大小有关,对同种细胞群体随着细胞截面积的增大而增大;对球形活细胞经实验表明在小立体角范围内基本上和截面积大小成线性关系;对于形状复杂具有取向性的细胞则可能差异很大,尤其需要注意。侧向散射光的测量主要用来获取有关细胞内部精细结构的颗粒性质的有关信息。侧向散射光虽然也与细胞的形状和大小有关,但它对细胞膜、胞质、核膜的折射率更为敏感,也能对细胞质内较大颗粒给出灵敏反映。
在实际使用中,仪器首先要对光散射信号进行测量。当光散射分析与荧光探针联合使用时,可鉴别出样品中被染色和未被染色细胞。光散射测量最有效的用途是从非均一的群体中鉴别出某些亚群。
荧光信号主要包括两部分:①自发荧光,即不经荧光染色细胞内部的荧光分子经光照射后所发出的荧光;②特征荧光,即由细胞经染色结合上的荧光染料受光照而发出的荧光,其荧光强度较弱,波长也与照射激光不同。自发荧光信号为噪声信号,在多数情况下会干扰对特异荧光信号的分辨和测量。在免疫细胞化学等测量中,对于结合水平不高的荧光抗体来说,如何提高信噪比是个关键。一般说来,细胞成分中能够产生的自发荧光的分子(例核黄素、细胞色素等)的含量越高,自发荧光越强;培养细胞中死细胞/活细胞比例越高,自发荧光越强;细胞样品中所含亮细胞的比例越高,自发荧光越强。
减少自发荧光干扰、提高信噪比的主要措施是:①尽量选用较亮的荧光染料;②选用适宜的激光和滤片光学系统;③采用电子补偿电路,将自发荧光的本底贡献予以补偿。
(2)样品分选原理:流式细胞计的分选功能是由细胞分选器来完成的。总的过程是:由喷嘴射出的液柱被分割成一连串的小水滴,根据选定的某个参数由逻辑电路判明是否将被分选,而后由充电电路对选定细胞液滴充电,带电液滴携带细胞通过静电场而发生偏转,落入收集器中;其它液体被当作废液抽吸掉,某些类型的仪器也有采用捕获管来进行分选的。
稳定的小液滴是由流动室上的压电晶体在几十KHz的电信号作用下发生振动而迫使液流均匀断裂而形成的。一般液滴间距约距约数百μm。实验经验公式f=v/4.5d给出形成稳定水滴的振荡信号频率。其中v是液流速度,d为喷孔直径。由此可知使用不同孔径的喷孔及改变液流速度,可能会改变分选效果。使分选的含细胞液滴在静电场中的偏转是由充电电路和偏转板共同完成的。充电电压一般选+150V,或-150V;偏转板间的电位差为数千伏。充电电路中的充电脉冲发生器是由逻辑电路控制的,因此从参数测定经逻辑选择再到脉冲充电需要一段延迟时间,一般为数十ms。精确测定延迟时间是决定分选质量的关键,仪器多采用移位寄存器数字电路来产生延迟。可根据具体要求予以适当调整。
(50)数据处理原理:FCM的数据处理主要包括数据的显示和分析,至于对仪器给出的结果如何解释则随所要解决的具体问题而定。
①数据显示:FCM的数据显示方式包括单参数直方图(histogram)、二维点图(dotplot)、二维等高图(contour)、假三维图(pseudo3D)和列表模式(listmode)等。
直方图是一维数据用昨最多的图形显示形式,既可用于定性分析,又可用于定量分析,形同一般X—Y平面描图仪给出的曲线。根据选择放大器类型不同,横座标可以是线性标度或对数标度,用“道数”(ChannelNo .)来表示,实质上是所测的荧光或散射光的强度。纵座标一般表示的是细胞的相对数。图10-2给出的是直方图形式。只能显示一个参数与细胞之间的关系是它的局限性。
二维点图能够显示两个独立参数与细胞相对数之间的关系。横座标和纵座标分别为与细胞有关的两个独立参数,平面上每一个点表示同时具有相应座标植的细胞存在(图10-3)。可以由二维点图得到两个一维直方图,但是由于兼并现象存在,二维点图的信息量要大于二个一维直方图的信息量。所谓兼并就是说多个细胞具有相同的二维座标在图上只表现为一个点,这样对细胞点密集的地方就难于显示它的精细结构。

图10-2 直方图

图10-3 二维点图
二维等高图类似于地图上的等高线表示法。它是为了克服二维点图的不足而设置的显示方法。等高图上每一条连续曲线上具有相同的细胞相对或绝对数,即“等高”。曲线层次越高所代表的细胞数愈多。一般层次所表示的细胞数间隔是相等的,因此等高线越密集则表示变化率越大,等高线越疏则表示变化平衡。图10-4给出了二维等高图的样式。
假三维图是利用计算机技术对二维等高图的一种视觉直观的表现方法。它把原二维图中的隐座标—细胞数同时显现,但参数维图可以通过旋转、倾斜等操作,以便多方位的观察“山峰”和“谷地”的结构和细节 ,这无疑是有助于对数据进行分析的。图10-5为假三维图的示意图。

图10-4 二维等高图

图10-5 假三维图
列表模式其实只是多参数数据文件的一种计算机存贮方式,三个以上的参数数据显示是用多个直方图、二维图和假三维图来完成的。可用ListMode中的特殊技术,开窗或用游标调出相关部分再改变维数进行显示。例如,“一调二”就是在一维图上调出二维图来;“二调一”就是从二维图中调出一维图来。图10-6给出了从二维图等高图中调出相应窗口的直方图的示意图。

图10-6 从二维图设窗调出直方图示意
上面简要地介绍了几种数据显示形式,在实际应用中,可根据需要选择匹配,以便了解和获得尽可能多的有用信息。
②数据分析:数据分析的方法总的可分为参数方法和非参数方法两大类。当被检测的生物学系统能够用某种数学模型技术时则多使用参数方法。数学模型可以是一个方程或方程组,方程的参数产生所需要的信息来自所测的数据。例如在测定老鼠精子的DNA含量时,可以获取细胞频数的尖锐波形分布。如果采用正态分布函数来描述这些数据,则参数即为面积、平均值和标准偏差。方程的数据拟合则通常使用最小二乘法。而非参数分析法对测量得到的分布形状不需要做任何假设,即采用无设定参数分析法。分析程序可以很简单,只需要直观观测频数分布;也可能很复杂,要对两个或多个直方图逐道地进行比较。
逐点描图(或用手工,或用描图仪、计算机系统)是大家常用的数据分析的重要手段。我们常可以用来了解数据的特性、寻找那些不曾预料的特异征兆、选择统计分析的模型、显示最终结果等。事实上,不经过先对数据进行直观观察分析就决不应该对这批数据进行数值分析。从这一点来看,非参数分析是参数分析的基础。
逐道比较工作量较大,但用直观法很容易发现明显的差异,特别是对照组和测试组。考虑到FCM的可靠性,要注意到对每组测量,都要有对照组,对照组可以是空白对照组、阴性对照组、或零时刻对照组等,具体设置应根据整体实验要求而定。对照组和测试组的逐道比较往往可以减少许多不必要的误差和错误解释。顺便指出,进行比较时对曲线的总细胞数进行归一化处理,甚至对两条曲线逐道相减而得到“差结果曲线”往往是适宜的。
因为数据分析往往和结果解释关系十分密切,也就是说和生物学背景相关,因此具体的分析法和原理将在后面结合实例再介绍。
3.流式细胞计的技术参数为了表征仪器性能,往往根据使用目的和要求而提出几个技术参数或指标来定量说明。对于流式细胞计常用的技术指标有荧光分辨率、荧光灵敏度、适用样品浓度、分选纯度、可分析测量参数等。
(1)荧光分辨率:强度一定的荧光在测量时是在一定道址上的一个正态分布的峰,荧光分辨率是指两相邻的峰可分辨的最小间隔。通常用变异系数(C.V值)来表示。C.V的定义式为:
C.V=σ/μ
式中,σ为标准偏差,μ是平均值。
在实际应用中,我们使用挖关系式σ=0.423FWHM;其中FWHM为峰在峰高一半处的峰宽值。目前仪器的荧光分辨率均优于2.0%。
(2)荧光灵敏度:反映仪器所能探测的最小荧光光强的大小。一般用荧光微球上所标可测出的FITC(fluoresceinisothiocyanate 异硫氰基荧光素)的最少分子数来表示。目前仪器均可达到1000左右。
(3)分析速度/分选速度:仪器每秒种可分析/分选的数目。一般分析速度为5000~10000;分选速度掌握在1000以下。
(4)样品浓度:主要给出仪器工作时样品浓度的适用范围。一般在105~107细胞/ml的数量级。
其它技术参数尚多,不再一一介绍。
4.流式细胞计的调试和使用古语说:“工欲善其事,必先利其器”。要想很好地应用流式细胞分析和分选技术,必需先对仪器进行调试,使其处于良好的工作状态,并能正确使用仪器。下面简要介绍细胞计的调试项目及要点、使用的程序等等。
(1)调试和校准:流式细胞计在使用前,甚至在使用过程中都要精心进行调试,以保证工作的可靠性和最佳性。调试的项目主要是激光强度、液流速度和测量区的光路等。
激光强度:除调整反射镜的角度以调整到所需波长的激光出光外,还要结合显示屏上的光谱曲线使激光的强度输出为最大。
液流速度:可通过操作台数字显示监督,调节 气体压力大小以获得稳定的液流速度。
测量区光路调节 :这是调试工作的关键。需要保证在测量区的液流、激光束、90。散射测量光电系统垂直正交,而且交点较小。一般可在用标准荧光微球等校准中完成。
流式细胞术中所测得的量是相对值,因此需要在使用前或使用中对系统进行校准或标定,这样才能通过相对测量获得绝对的意义。因而FCM中的校准具有双重功能:仪器的准直调整和定量标度。标准样品应该稳定,有形成份形状应是大小比较一致球形,样品分散性能良好,且经济、容易获得。常用标准荧光微球作为非生物学标准样品,鸡血红细胞做为生物学标准样品。微球用树脂材料制作,或标有荧光素,或不标记荧光素。FlowCytometry Stands公司可提供荧光强度药盒,在免疫实验中可用来作为定量荧光标准来测定每个细胞所标记的抗原位点数目。所用的鸡血红细胞标准样品制作过程昭下:取3.8%枸橼酸或肝素抗凝的鸡血(抗凝剂:鸡血=1:4),经PBS清洗3次,再用5~10ml的1.0%戊二醛与清洗后的鸡红细胞混合,室温下振荡醛化24h,最后经PBS再清洗,贮4℃冰箱中备用。需要指出的是因为未经荧光染色,所测光信号为鸡血红蛋白的自发荧光。
(2)仪器的操作和使用:
①打开电源,对系统进行预热;
②打开气体阈,调节 压力,获得适宜的液流速度;开启光源冷却系统;
③在样品管中加入去离子水,冲洗液流的喷嘴系统;
④利用校准标准样品,调整仪器,使在激光功率、光电倍增管电压、放大器电路增益调定的基础上,0。和90。散射的荧光强度最强,并要求变异系数为最小;
⑤选定流速、测量细胞数、测量参数等,在同样的工作条件下测量样品和对照样品;同时选择计算机屏上数据的显示方式,从而能直观掌握测量进程;
⑥样品测量完毕后,再用去离子水冲洗液流系统;
⑦因为实验数据已存入计算机硬盘(有的机器还备有光盘系统,存贮量更大),因此可关闭气体、测量装置,而单独使用计算机进行数据处理;
⑧将所需结果打印出来。
在操作和使用中一定要注意如下事项:
1)光电倍增管要求稳定的工作条件,暴露的较强的光线下以后,需要较长时间的“暗适应”以消除或降低部分暗电流本底才能工作;另外还要注意磁屏蔽;
2)光源不得在短时间内(一般要1h左右)关上又打开;使用光源必须预热并注意冷却系统工作是否正常;
3)液流系统必需随时保持液流畅通,避免气泡栓塞,所使用的鞘流液使用前要经过过滤、消毒;
4)注意根据测量对象的变换选用合适的滤片系统、放大器的类型等;
5)特别强度每次测量都需要对照组。
本节 着重介绍了流式细胞计的基本结构和工作原理、技术指标及使用操作中的基本问题。由于实际使用的仪器厂家、型号差别很大,不能一一介绍,可参照仪器使用说明书使用。至于流式细胞术在生物医学工程和免疫组织化学应用中的一些具体技术途径则在下节 详细介绍
第二节 FCM在生物医学工程学方面的应用
流式细胞术在细胞生物学、分子遗传学、微生物学、免疫学、分子生物学以及临床肿瘤学、临床血液学等诸多领域都有广泛应用。本节 概要介绍它们的技术途径及主要原理,大家可以从中看出它们是和细胞化学密切相关的。
一、FCM应用的技术途径
FCM是通过测量细胞的多种参量来获取信息的。细胞参数分为结构参量和功能参量两大类。结构参量主要用于描述细胞的化学组分和形态特征;功能参量主要是描述细胞整体的理化和生物特性。这些参量有的需要经荧光标记方可测定,有的并不需要荧光标记。DNA以及RNA的含量,蛋白总含量、胞内pH值和细胞大小等为结构参数;细胞周期动力学、特殊配体的鉴定、特殊细胞的生物活性等则为功能参数。
1.DNA和RNA的测量和分析DNA和RNA的含量可以用多种荧光探针标记后测出。对细胞内DNA含量的测定可用于细胞生物学方面的研究和临床肿瘤学的诊断;测量RNA的含量可用于血液中的网织红细胞的检测和计数;DNA和RNA含量的测定可以用于区别细胞周期中的G和G1期。常用的荧光探针有吖啶橙(AO,Acridine·orange)、派洛宁Y(PY,Pyronine Y)、HO(Hoechst)系列和色霉素A3(CA3)等。利用HO/CA3双染色还可分析DNA的碱基组成。还可以结合Brdu (Bromodeoxyuridine, 溴脱氧尿嘧啶核苷)单克隆抗体免疫荧光来测定细胞内DNA合成。
2.蛋白质总量测定用FCM可以测定细胞中蛋白的总含量,以检测一个细胞群体生长和代谢的状态,或区别具有不同蛋白含量的细胞亚群,如血液中的白细胞的分类。检测总蛋白的常用荧光探针为异硫氰基荧光素(FITC,Fluorescein isothiocyanate),FITC以共价键方式与蛋白上带正电的残基结合。
3.特殊配体的测定配体是与不同的细胞结构特异结合很强的各种大分子和小分子,通过对特异性的荧光标记的配体的测定可以获得不少有关结构参量和功能参量的信息。例如用标记的外源凝集素可检测细胞表面糖;用标记抗体可测表面抗原;用标记多聚阳离子可检测细胞表面电荷;用标记的激素、生长因子、神经递质和病毒等可检测细胞受体;用标记的大分子、微生物等可检测细胞的内吞性;用荧光素标记的亲和素以及带有DUTP的生物素衍生物的DNA探针跟靶细胞的DNA杂交能够检测原位的特殊基因等。这方面的应用范围广、有前途,已经成为研究细胞和组织中的抗原、基因和各种生化过程的强有力的新技术。用于这方面工作的荧光探针主要有FITC、若丹明系列(如四甲基异硫氰基若丹明TRITC、异硫氰基若丹明X-RITc 和美国德州红等)、藻胆蛋白系列等。由于各种荧光探针具有不同的光谱特性,在使用中要注意正确地使用激光光源和滤片。
4.生物活性的测定就生物流行性来说,主要包括两方面工作:①细胞本身的死活;②活细胞生物功能发挥的强弱。前项工作单一,后项工作要复杂得多。FCM用来判断细胞死活的常用荧光探针有二大类:一类是能透过活的细胞膜进入细胞内而发出荧光的物质;例如下醋酸酯荧光素(FDA,flourescein Diacetate)它可被活细胞持留而发出黄绿色荧光;若细胞有损伤则会从细胞中流失,观察不到荧光。另一类是不能透过活细胞膜,但能对固定的细胞及膜有破损的细胞的核进行染色,例如碘化丙啶(PI,Propidium iodide)和溴化乙锭(EB,Ethidiumbromide )就是常用的第二类荧光探针。
用FCM来测定活细胞生物功能发挥方面和性能的指标很多。例如可用来测细胞膜电位、细胞内pH值和细胞内钙等,这些都和细胞的激活密切相关。FCM也可用来测膜结构的流动性或微粘度等。有报告可以用FCM代替51Cr的放射免疫分析来测定天然杀伤细胞(NK, Natu-ral killer cells)对靶细胞毒理学活性的大小。
二、FCM的典型应用简介
下面简单介绍FCM在各个领域中应用的典型实例,以求对FCM应用的全面了解,并能深入了解FCM在免疫细胞化学中应用的背景。
1.在细胞生物学方面的应用细胞生物学是FCM应用最广泛也是最基本的领域,细胞周期分析是其基本分析内容之一,而实施的技术途径是通过测定细胞周期各时相的DNA含量来达到的。
众所周知,细胞周期由G1期、S期、G2期和M期所构成的。各期细胞的DNA含量如下:G1期为2C,G2期和M期为4C,S期则在2C到4C之间。所以在FCM的DNA直方图上形成的谱线则为峰分布,而且G1峰的道数恰好是G2和M峰道数的一半(图10-7)。研究表明:对于正常细胞群,各周期时相的细胞数的比例是同一的;对于恶性病变的细胞群则是非均一的(图10-8)。

图10-7 细胞周期的DNA直方图

图10-8 细胞周期中的细胞数目与肿瘤的关系
临床肿瘤病学已经注意到细胞动力学的重要性。研究工作表明:肿瘤细胞对化疗和放疗的敏感程度与细胞的增生率高低密切相关;采取细胞同步化(Cell Synchronization)措施可以提高疗效。例如可以使用雌激素这种外源性药物让雌激素受体阳性的乳腺癌细胞同步化。
临床微生物学可以用FCM对大量细菌的DNA和RNA含量进行测量,进行微生物鉴定、医学常规中的细菌抗生素敏感试验和传染活性的测定。
FCM优良的分析和分选功能在分子遗传学领域也能充分发挥。例如流式细胞核型分析技术就是用FCM对染色体进行分类、纯化,检测或定量测量细胞表面或内部由特异基本所编码的成份。这方面的成果已用在畜类性别的预选择,以及对人类计划生育等方面的工作。
2.在免疫学方面的应用FCM以它的快速、灵活及定量的特点被广泛地应用于免疫学的基础研究和临床应用的各个方面,尤其是结合单克隆抗体技术,在免疫分型、分选、肿瘤细胞的免疫监测、机体免疫状态的监测、免疫细胞的系统发生及特性研究等方面更能起到重要作用,成为现代免疫技术的重要组成部分。基于免疫技术是免疫细胞化学分析技术的基础,我们着重介绍FCM在免疫应用中的技术问题。
(1)免疫应用的激发光源和滤片系统:适用于免疫技术的FCM的激发光是氪离子气体激光器,光谱中波长为531nm和856nm的谱线最强。为了扩大仪器对双标记或三标记染色的荧光信号的分辨范围可使用双激光光源。
为了减少细胞由于激光束造成的散射光对光电倍增管的影响,要使用贴有干涉膜的滤片系统。为了同时测定两种波长以上的荧光信号,光路中还要使用二向性分光元件。
为了测定伴随细胞转化过程所产生的早期免疫及生化性质的改变,例如膜的流行性,DNA构象变化等,可以使用偏振片。
总之,应用于免疫学时要充分考虑有关光源及光学滤片系统的正确使用。
(2)免疫应用的荧光染料及染色:免疫应用中的荧光染料主要有FITC(488nm)、TRITC(515nm)、PE(藻红蛋白,575nm)及其组合。在进行多种标记时特别要注意结合抗体的每种色素都不干扰抗体反应的特异性,也不相互干扰。
免疫荧光染色有直接法和间接法二类:
①直接染色法
1)取约106的细胞置于尖底离心管内,管内液体要少些。加荧光标记抗体,在4℃温度下静置15~30min。若作双标记染色也可直接加入。
2)用冷的10%的小牛血清、0.1%的叠氮钠溶液,1/15mol/L的PBS(pH4.4)离心清洗细胞2次。1000rpm离心5min或4000rpm离心1min。
3)加入适量缓冲液待测。
②间接染色法:
1)取106细胞加特异的第一抗体,4℃温度下静置15~30min。
2)加缓冲液离心清洗2次后,吸尽残留液体,弹散沉淀,加入荧光标记的第二抗体,4℃静置30 min。
3)缓冲液离心清洗2次后加入适量缓冲液待测。为减少无关因素干扰,操作尽量在水浴中进行。
染色中应注意的事项:①细胞标本在整个过程中要尽量保持新鲜,采用有效措施防止表面抗原消失和细胞死亡;②荧光标记物用前应用滤膜或高速离心去除颗粒或沉渣以减少非特异性干扰;③细胞标本染色前应除死细胞;④为提高灵敏度可用三步间接染色法。
(3)免疫荧光标本的特殊处理:
①死细胞及碎片去除:样品中不可避免地存在着死细胞及碎片,影响分析结果。对于血细胞可用FCM通过0。散射的差异不经染色而将死细胞分出弃除;对于培养细胞,由于其大小分布不均,可在样品内加少量PI染色后将死细胞去掉。一般情况下即可用仪器直接去除碎片,也可用血清沉降法去除大碎片,用离法去除小碎片。
②标本的保存和固定:实验中大多数样品在染色或分析前需要保存一定的时间,有时甚至需要进行固定。
未染色的新鲜标本贮存方法如下:10%二甲基亚砜,90%小牛血清,5×106~1×107细胞在-70℃过夜,然后置液氮中可长期保存。
免疫染色未经固定的标本在4℃可保存48h。若需存放时间较长、或标本具有传染性,应该用固定剂固定。常用的固定剂配方是:1%~4%的多聚甲醛和PBS或0.8%的生理盐水配成p H7.2的固定液;或用0.37%~1.5%甲醛和PBS配成p H7.4的固定液。固定方法是:将经免疫荧光染色的细胞离心沉淀,再加入固定液混匀,放在4℃温度保存。一般来说,经固定处理的标本保存1周至2个月,多数样品的阳性细胞群体比例及荧光强度增色能保持在正常范围之内。
(4)主要检测的免疫指标:
①细胞毒试验:细胞毒是机体的一种免疫监督机制,细胞毒实验是一项重要的免疫指标。例如天然杀伤细胞NK(Natural killer)是一种引起免疫媒介的效应物,在抗肿瘤及感染因子的免疫监督系统中起着重要作用。研究表明,对NK细胞的测量可以做为免疫治疗监测的重要参数和有效的预后征状的指标。所使用的荧光探针为CFDA(Caboxy-fluorescein diacetate)。
②吞噬功能实验:单核吞噬细胞系统是机体的主要防御系统之一。FCM可以快速、定量地检查吞噬细胞的吞噬能力和速度。
③I型变变态反应的IgE受体细胞、IgE结合因子的检查。
④胞浆Ig及血清Ig分析,血小板表面的IgG测定,等等。
3.在临床方面的应用FCM在临床诊断、疗效评价和预后预测等方面都发挥了一定的作用。工作做得较多的主要在肿瘤学、血液病学等。这些都和FCM在荧光细胞化学中的直接应用有关。
(1)癌前病变的检测和预后评价:有效地发现癌前病变而给予阻断治疗,无疑是肿瘤防治的重要环节 。FCM的探测对象主要是癌前细胞,即那些处于正常细胞向癌细胞转化的量变阶段、尚未达到质变的细胞。研究表明,除心肌、肝组织及精子细胞外,人类正常的体细胞都具有恒定的DNA二倍体含量,而那些癌前细胞和癌细胞则在其发生发展过程中伴有DNA含量变化异常。另在资料表明:癌前病变向癌变的转化发生率与细胞的不典型增生程度有关,而细胞的不典型增生程度又与DNA含量的异常改变呈平行关系。利用FCM可以定量地测出癌前细胞的DNA含量并根据DNA分布直方图直观地反映出细胞的周期分布状态,从而了解到癌前细胞增殖能力变化的动态过程,这样便可以获得一些从组织形态学中难以得到的信息。
表10-1 是以胃粘膜为例比较正常细胞和胃癌细胞在DNA含量及细胞周期分布方面的差异。
表10-1 正常与胃癌的胃粘膜细胞DNA含量方面的差异
| 二倍体 | DNA含量(%) | 细胞周期分布(x±s) | |||
| 非整倍体 | G/G1 | S期 | G2/M期 | ||
| 正常细胞 | 100 | 88.9±1.2 | 5.0±0.6 | 3.4±0.7 | |
| 胃癌患者细胞 | 100 | 77.3±1.8 | 10.9±1.1 | 7.4±0.7 | |
从表中看出差异是显著的。我国一些学者也提出有关FCM诊断癌肿细胞的细胞标准,并已付之临床应用。
目前,对于癌症病人预后评估的主要依据是病理组织学分级和临床分期等指标,不少人已认识到用FCM来检测DNA是对肿瘤预后评价的一个较为客观有效的指标。总的倾向是:异倍体的出现是恶性肿瘤的一个标志;异倍体肿瘤的恶性程度高、复发率高、转移率高及死亡率高;二倍体及近二倍体肿瘤预后较好。
在临床血液学方面的应用目前也以血液系统的肿瘤诊断、分型和预后关系等方面的应用为主;其主要技术途径也是基于对DNA倍体分析和细胞增殖周期的分析。限于篇幅不再多叙。有关的技术细节 将在下节 以FCM在外周血白细胞的免疫组织化学分析方面的应用为例详加介绍。
(2)DNA指数:由于DNA的非整倍体细胞是肿瘤的特异性标志已经得到肿瘤学界的公认,在些学者提出建议采用流式细胞术DNA分级指数(Flow cytometry DNA Crading Index, 简称DNA指数或DI)表示DNA含量的异常程度。根据1984年国际分析细胞学会名词审定委员会的规定:
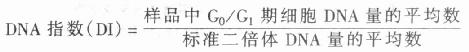
一般样品应采用同种或同个体的正常细胞为标准二倍体细胞。在血液学研究中通常以正常人外周血淋巴细胞作为标准二倍体细胞。需要指出的是,在报告DNA的测定结果时必需包括G/G1峰的变异和系数,即C.V值,若有多个DNA干系则要给出各个G/G1峰的C.V值。用于肿瘤临床诊断的总体依据是:a.正常二倍体的DI=1.0,判断为阴性;b.出现二个或多个可以分辨的G/G1峰则可判断为阳性;c.虽无明显的G/G1峰的分化现象,但峰的C.V值较大,则可根据DI数个及其它有鉴别意义的征状给出参考性的诊断。
以上我们主要从FCM在生物医学工程学领域应用的基本原理和技术途径介绍了和组织化学有关的内容,至于一些技术细节 则在下节 做较为详细的说明。
第三节 FCM对外周白细胞的免疫荧光分析
外周血是临床检验中的重要标本。FCM分析外周白细胞的主要目的是了解各种白细胞的数目与分群情况。这些数字的变化与临床的某些疾病有一定的关系。近年来,由于多种识别白细胞膜表面抗原的单克隆抗体的发现,以及对这些单克隆抗体的直接或间接荧光标记物的出现,使得利用FCM的荧光组织化学分析获得被测细胞的多指标的更多、更准确的信息,这无疑对警觉临床和科研有很大帮助。本节 主要讨论有关外周血的白细胞的免疫荧光标记技术、数据分析及临床应用等方面的问题。
一、白细胞的免疫荧光标记技术
1.白细胞抗原下面给出世界卫生组织对白细胞抗原的统一命名,以及它们的分子量、对应的单克隆抗体及反应阳性的细胞(见表10-2)。
表10-2 WHO对白细胞分化抗原的命名
| 抗原 | 分子量 | 单克隆抗体 | 反应阳性细胞 |
| CD1 | P45/12 | Leu6,T6,OKT6 | 胸腺细胞、朗格罕细胞 |
| CD2 | P50 | Leu5B,T11,OKT11 | E玫瑰花受体、T和NK细胞 |
| CD3 | P19-29 | Leu4,T3,OKT8 | T细胞 |
| CD4 | P55 | Leu3,T4,OKT4 | 协助—诱导T细胞,单核细胞 |
| CD5 | P67 | Leu1,T1, T101 | T细胞、B细胞亚群,慢粒(淋巴性) |
| CD6 | P120 | T12 | T细胞 |
| CD7 | P41 | Leu9.3A | T,T—ALLa和NK细胞 |
| CD8 | P32-33 | Leu2,T6,OKT8 | 抑制-细胞毒T细胞、NK细胞 |
| CD9 | P24 | BA-2 | 淋巴细胞白血病相关抗原 |
| CD10 | P100 | CALLA, J5 | 粒细胞、前B白血病细胞 |
| CD11 | P170/95 | CR3/Leu15,OKM1 | 单核细胞、粒细胞、NK细胞 |
| MO1 | T细胞亚群(C3bi受体) | ||
| CD15 | LNFP-I | LeuM1 | 单核细胞、粒细胞、激活的T细胞 |
| CD16 | P50~70 | Leu11 | NK细胞、粒细胞(IgGFc受体) |
| CD19 | P95 | Leu12,B4 | B、CLLb前B-ALL细胞 |
| CD20 | P35 | Leu16,B1 | B细胞 |
| CD21 | P140 | CR2,B7 | B细胞、C3a受体细胞 |
| CD22 | P135 | Leu41 | B、CLL、和毛细胞白血病细胞 |
| CD23 | P45 | Blast2 | |
| CD24 | P45,P55 | BA-1 | B、CLL和前B-ALL细胞 |
| CD25 | P65 | IL-2受体 | 数分裂因子激活的T细胞HTLV-I、II、感染细胞 |
a:急性淋巴细胞性白血病;b:慢性淋巴细胞性白血病。
2.样品的制备供FCM分析的样品是单细胞悬液,而且大部分样品都需经荧光染色。样品的制备方法大致有三种:①用荧光单克隆抗体染全血,随后溶解红细胞;②红细胞溶解后染色;③通过梯度离心法分离出单个淋巴细胞和单核细胞,再将之制成细胞悬液染色。
(1)全血染色后溶解红细胞:由于不少血液标本具有生物危害性,用此方法可以将染色、溶解、固定、分析几个步骤都在一个试管内进行,这样减少转换过程中的污染。而且此法比用梯度离心分离出单个核细胞更节 省时间。由于此法未将粒细胞去除,故在用FCM分析时,要注意排除粒细胞的干扰。
具体操作步骤如下:
①全血100~150μl,放入5ml试管,并用50~100μl PBS稀释,总体积为200μl。]
②荧光标记的单克隆抗体染色30min,4℃(或放于冰上)。单克隆抗体的浓度因不同来源差异很大,但为了使用方便,可按其说明书配成每次实验使用10μl。注意蔽光。
③用3~4μl冷BPS清洗。离心250×g(约每分钟1500转),5min,洗3次。注意每次用吸管将上清吸出,决不能倾倒去液!
④用2ml氯化铵液(配法见下)在室温下溶解红血球,约10min。若红细胞完全被溶解,溶液由混浊变到透明。注意溶解程度的掌握十分重要:若溶解过分,则导致白细胞上抗原被破坏,或者某些敏感的细胞死亡而导致比例的改变。若溶解不彻底,大量红细胞会影响对淋巴细胞的分析。这是因为淋巴细胞在分析图像上与红细胞群接近,在框出淋巴细胞群时,会把部分红细胞框定于淋巴细胞内。而红细胞溶解不足或过度在很大程度上影响着分析结果。
【氯化铵液的配制】
Tris—氯化铵1×氯化铵
0.16mol/L NH4Cl 0.38g/100ml 90ml0.16mol/LNH4Cl
0.17mol/L Tris 2.06g/100ml 10ml0.17mol/l Tris
pH值7.56 pH值7.2
⑤红细胞被彻底溶解,加入1mlPBS稀释的0.5%甲醛,立即离心,洗3次,条件同步骤③。加入甲醛的目的是尽早固定细胞和细胞上的抗原,避免有生物危害的标本到处污染。
⑥将染色完成的细胞悬浮于0.5~1ml的0.1%甲醛溶液内。置4℃,蔽光,等待分析。经固定后的细胞在冰箱内可保存一周,这样对工作的安排会带来方便。
(2)红细胞被溶解后再对白细胞染色:此方法的优点是可以了解被染白细胞的数量以及存活率。但由于有时有些标本比较敏感,溶解红细胞后,还要经过多个染色步骤,这样容易造成抗原的丧失。此法具体步骤如下:
①室温下放入14ml氯化铵在15ml的试管里。
②加入0.5~1ml全血,混合3~5min。
③立即离心100~150×g,并用PBS洗2次。
④白细胞计数,注意存活率应在90%以上。做成每毫升含5×106白细胞悬浮液。将细胞分配到5ml的试管,每试管0.2ml,即1×106个细胞。
⑤荧光标记的单克隆抗体染色30min,4℃,避光。抗体浓度配制如前所述。
⑥PBS洗3次后,用0.5%甲醛固定。方法如前。
(3)用Ficoll—Hypaque梯度离心法分离出单个核细胞:用此法可以分离骨髓细胞、淋巴结、扁桃体捣碎后的单细胞悬液等。血液标本应有抗凝剂。取血到分离不能超过6h。
①抗凝全血4~20ml,用等量PBS或Hanks液稀释。
②稀释血8或40ml置于15或50ml离心管内,4或10ml Ficoll—Hypaque(或者等量的其它分离液,比重为1.007)从离心管底部轻轻加入到血的下面。这种方法对血的扰动较小,比将全血加到Ficoll上面为好。加完后,可以清楚看到Ficoll与全血之间有一明显的分界线。注意在Ficoll快加完时应特别小心,否则有可能加入气泡搅混血样,使血与分离液混合,达不到分离的目的。
③离心350~400g,30min。红细胞、粒细胞以及死细胞将位于离心管底部,中间层的单个核细胞为淋巴细胞、单核细胞和一些血小板。
④取出中间层中所有细胞,若在Ficoll中还有细胞也要取出,这也是单个核细胞(PBMC)。
⑤用PBS洗3次,第1次清洗时,可用较快速400×g离心10min。因为有可能中间层中混有一些ficoll,比重增加而细胞不易沉降。
⑥PBMC计数,注意存活率应高于90%。配成5×106个/ml的细胞悬浮液。
⑦取出0.2ml的悬浮液加入到5ml试管(内含1×106细胞),用荧光标记的单克隆抗体染色,方法如前。洗3次后固定。注意必须先染色后固定,固定后的细胞膜通透性改变,会导致荧光标记的抗体进入细胞中去,而在显微镜下观察的染色效果则和死细胞一样。当用FCM分析时,则均为阳性而达不到检验目的。这也是用FCM分析的细胞存活率应高于90%的原因。
(4)荧光标记抗体的细胞染色:如前所述,FCM分析被荧光标记的抗体染色的细胞,在选择荧光染料时必须注意这些荧光染料所需要的激发光波长是否与所使用的FCM的激发光谱相匹配。一般各个公司所采用的绿色荧光染料为FITC,而选用的红色荧光染料却不尽相同,有的用TRITC,有的用藻红蛋白(PE),所需要的激发光谱就不一样,因而若因匹配不当则会招致荧光抗体所染的细胞分析不出来,这是应该注意的。
这里的标本染色方法和免疫荧光法相同。下面仅说明一些具体的注意事项:
①在用间接法染色时,染色步骤依次为第一抗体→清洗→第二抗体→清洗→红细胞溶解。为了实验的方便,将第二抗体也配成每次实验用10μl。
②双色法:双色法多用于直接染色法。将分别用FITC和PE标记的抗体各10μl置入同一个含有约1×106/0.2ml的试管内,30min,4℃避光。然后清洗、固定。
目前不少制备单克隆抗体的公司已将比值有意义的两种抗体,分别用红、绿荧光染料标记后,制成一种试剂。如CD2—FITC/CD20—PE;CD4-FITC/CD8-PE等。可按说明使用,具体用量为每次实验10μl。
③对照组:众所周知,免疫组化的染色过程中,阴性和阳性对照是必不可少的。在准备用FCM分析的细胞时,对照标本的制备显得格外重要。因为一次用FCM分析的样品可能会很多,甚至多达上百个试管。对同一病人也可能会用到20~30个不同的单克隆抗体。每一个病人都要有相应的阴性对照。阴性对照主要用于仪器分析细胞之前,设立阴性和阳性的分界线。阳性对照主要用于检查染色方法。阳性对照细胞选自那些已知的细胞和已知的单克隆抗体中的阳性反应最明显者。阴性对照细胞有以下几种:
1)非染色细胞:直接染色法时,用10μlPBS代替与荧光结合的单克隆抗体,其它步骤相同。间接染色法时,分别用10μl的PBS代替第一抗体和荧光第二抗体,其它步骤相同。
2)使用非特异性的抗小鼠膜表面免疫球蛋白(MsIg),代替特异性的单克隆抗体。这是由于所使用的单克隆抗体来自小鼠,可能造成非特异性的假性反应,因此使用MsIg作为对照。同时还需要注意选择与实验用单克隆抗体亚类一致的MsIg。如大部分单克隆抗体为IgG1,也有部分抗体为IgM,所以用MsIg作对照组时,往往使用MsIgG和MsIgM两种。直接染色法时,用10μl与荧光结合的MsIg,代替荧光单克隆抗体。间接染色时,用10μl无荧光的MsIg代替第一抗体。其它步骤与实验组相同。
3)双染色对照:将各10μl 的分别与红荧光染料和绿荧光染料结合的MsIgg 或MsIgM,加入到同一个试管,代替荧光的特异性单克隆抗体,其它步骤相同。
4)间接法对照:用10μl的PBS代替第一抗体。荧光第二抗体的浓度和使用量均与其它实验相同,其它实验步骤也和实验组相同。
二、白细胞免疫荧光分析的数据分析
在仪器调试和校准及标本制备完毕之后,就要做测试和数据分析工作。这里先讨论一下有关数据测量和分析的技术问题,而一些医学应用的具体参数的测量和分析后面做介绍。
1.0。散射和90。散射的双指标的二维图像分析可以把0。和90。散射分别选作二维图像的X轴和Y轴指标。通过图中数据点分布把全血分为淋巴细胞、单核细胞和粒细胞几个亚群(图10-9)。

图10-9 人的外周血白细胞分群的二维点图
图中,A、B图的淋巴细胞数大约有6000~9000个;C、D图约有2000~4000个。分群编号依次表示:①红细胞、死细胞和渣滓;②淋巴细胞群;③大颗粒淋巴细胞;④单核细胞;⑤粒细胞。数据是对1000个细胞分析得到的。
若用单指标直方图,对PBMC而言,可以把淋巴细胞和单核细胞分开。见图10-10中的A、B图。但对红细胞溶解后的全血,单指标图分辨率则不够了(图10-10的C、D图),图A、B给出的是经ficoll后的PBMC;图C、D给出的是人外周血白细胞。图中数字编号所代表的组分和图10-9相同。
由上可见,在分析红细胞溶解后的全血时,必须先采用双指标二维点图。从图上也可清楚地看出,粒细胞、未被溶解的红细胞和一些渣滓,由于不同的体积和致密度,明显地区别于淋巴细胞和单核细胞从而能把它们分开。看到清楚的细胞分群以后,可以在计算机的显示屏上将所要分析的细胞画线框出,并通过指令送入存贮器,以后就可只对框出部分做各种数据分析和深入考查。图10-11就是对双指标点图上的淋巴细胞群框定的示意图。数字所表示的意思和图10-9相同。

图10-10 外周血白细胞及PBMC的单指标直方图

图10-11 双指标点图上细胞的框定
2.单维直方图上阴性分界游标设置前面已经强调,在用FCM分析时,阴性对照是必不可少的。首先用非染色细胞,根据前面介绍的双指标二维点图的办法,将某一细胞群框定;然后分别选用绿色荧光(GFL)和红色荧光(RFL)单指标直方图。在直方图上所出现的细胞均为阳性。可用改变GFL和RFL增益的办法,将细胞恰好调节 到左侧并设立游标(图10-12)。
然后再测试MsIg染色的阴性对照。某些细胞,由于膜上的Fc受体可以与对照抗体鼠Ig非特异性结合,因而有一定的背景染色,不过这种阳性百分率不应超过5%。所以MsIg与非染色细胞的分界游标确立后,以后所测试的标本以此为标准,游标位置基本不变。
图10-12 阴阳性细胞分界游标的设置
MsIg的红、绿荧光阴阳性分界游标确立以后,可以测试实验标本。首先检查细胞分群情况,然后检查淋巴细胞群是否落在已输入计算机的淋巴细胞框定的范围里。若染色及FCM的工作性能都正常,则框定的位置不会改变。然后转换成荧光直方图。若为FITC标记的细胞,则GFL为X轴;若为PE标记的细胞,则用RFL为X轴。由于阴阳性分界游标记已确立,细胞阳性率及图像均显示于计算机荧光屏上;同时也可选用其它指标和图像、打印所需的资料等。
3.双染色分析游标设立和荧光校正
(1)游标的设立:游标设立的原理和单染并无不同,但具体要用二维点图和二维等高图来完成。分别选用GFL和RFL为X和Y轴。先用不染色细胞测试,将阴性细胞集中在左下角(图10-13)。分别为X、Y轴设立游标,再用MsIg的阴性对照测试。可将X、Y轴游标略为移动,使位于窗“3”内的细胞(阴性)在95%以上。
(2)红、绿荧光的校正:由于红色荧光探测器在最佳测试状态时,会让部分绿色荧光进入红色荧光探测器。这是因为一部分细胞发出的绿色荧光波长较长。若用阻断或滤色的办法消除进入红荧光探测器的这部分GRL,就会大大地降低RFL探测器的灵敏度。因而只好在操作时,通过电子计算机预先进入荧光校正,在RFL中适当扣除GRL的影响。
通常红色荧光进入绿色荧光探测器的情况比较光见,图10-14给出CD11-PE(T细胞、RFL)及CD8-FITC(T抑制细胞,GFL)双染细胞在二维等高图上进行荧光校正的示意图。X轴为GFL,Y轴为RFL,由X轴Y轴游标划分的四个窗的阴阳性和图10-13相同。各窗给出的百分数为该细胞群所占百分比。图A表示未经校正时的情形。窗“2”内31.46%表示双阳性细胞,即在T细胞中31.46%为抑制细胞毒细胞。经过适当校正,可见有两群阳性双标记细胞出现(B图)。高强度部分为真正的CD8、CD11双标记阳性细胞;低强度部分属于CD8绿色阳性细胞(NK细胞)。此时“2”窗中细胞份额减为7.59%。需要指出的是校正过度则会使各区的阳性细胞都减少(图C)。

图10-13 双染色二维点图上游标的设置
1区:红色荧光阳性;2区 :红、绿荧光均为阳性;3区:阴性细胞:4区:绿色荧光阳性细胞

图10-14双染色在二维等高图上荧光校正
双染色的荧光校正是用电子补偿电路来完成的。补偿时先测定一种染料的荧光,此时除了应该接收该荧光的光电倍增管PMT1有信号输出外,另一光电倍增管PMT2也常会有微弱输出。调节 补偿器使PMT2的输出为0;然后再测另一种波长的荧光染料,调PMT1的补偿器使之输出也为0;然后再测另一种波长的荧光的染料,调PMT1的补偿器使之输出也为0:如此反复调节 ,使两种荧光的探测器都获得补偿。实际调节 时用的是一种标准荧光微球,微球上标有已知数量的荧光分子。利用不同的微球可调整、补偿不同荧光的测量通道。需要指出的是:当PMT高压有所改变、激光和滤片系统有所变动时,都要对荧光校正做重新补偿调节 。
三、淋巴细胞亚群的测定及其在临床医学中的实用意义
淋巴细胞由于表面特异性抗原的差异可分为四大类(表10-3),这些不同抗原表现型的亚群执行不同的机能。而且某些疾病会选择性地损伤某些亚群而造成亚群之间的比例失调。根据FCM双荧光分析的结果,现将不同的抗原和不同的机能的淋巴细胞亚群列于表10-4。
表10-13 主要淋巴细胞亚群的表面抗原
| 细胞表面抗原的类型 | 抗原表现的细胞 | |||
| T协助、诱导细胞 | T抑制、T细胞毒细胞 | NK细胞 | B细胞 | |
| 独特的 | ||||
| CD3(Leu4) | + | + | - | - |
| CD4(Leu3) | + | - | - | - |
| CD8(Leu2) | - | + | -/+ | - |
| CD16(Leu11) | - | - | + | - |
| CD19(Leu12) | - | - | - | + |
| 限制性的 | ||||
| Leu7 | -/+ | -/+ | +/- | - |
| Leu8 | +/- | +/- | -/+ | +/- |
| CD7(Leu9) | +/- | + | +/- | - |
| CD11(Leu15CR3) | -/+ | -/+ | + | - |
+:表现的抗原;-:未表现的抗原;+/-:主要亚群有表现的抗原;-/+:抗原仅表现于少数亚群。
表10-14 淋巴细胞机能性亚群
| 细胞群 | 细胞机能 | 测试的单克隆抗体 |
| T细胞 | 协助细胞 | Leu3+8- |
| 抑制细胞—诱导细胞 | Leu3+8+ | |
| 细胞毒细胞 | Leu2+15- | |
| 抑制细胞 | Leu2+15- | |
| 抑制作用 | ||
| 抑制—诱导细胞 | Leu3+8+ | |
| 抑制--增强细胞 | Leu2+8- | |
| 抑制—增强细胞(激活) | Leu2+8-DR+ | |
| 抑制—效应细胞 | Leu2+8+15+ | |
| 组织相容限制的细胞毒性细胞 | ||
| 第一类限制性 | Leu2+15-DR-(7+?) | |
| 第二类限制性 | Leu3+ | |
| 第二类反应性 | Leu2+ | |
| 非组织相容性限制的细胞毒细胞 | ||
| NK亚群 | Leu7+11+15+ | |
| Leu7-11+15+ | ||
| Leu7-11+DR+ | ||
| B细胞 | Leu12+14+16+DR+ | |
| CR2+k+或λ+ | ||
| 亚群 | Leu12+1+ | |
| Leu12+1- |
外周血白细胞的机能,特别是淋巴细胞的机能状态在一定程度上反应了机体的免疫机能。近几年来,用FCM来测定某些疾病的淋巴细胞及其亚群已成为重要的诊断和预后判断的指标,如对骨髓、器官移植,白血病、淋巴瘤的诊断和对免疫缺陷病的估价等。测定淋巴细胞亚群的主要依据是在于淋巴细胞表面不同的抗原表现型,而这些表现型又依赖于相应的单克隆抗体而被识别。所以,特异性很高的单克隆抗体结合先进的FCM,已为临床提供了不少非常有用而重要的资料,但被FCM所分析的淋巴细胞的整个临床意义尚未完全认识清楚。随着更多确定淋巴细胞表现型的试剂的应用,FCM对诊断和治疗计划的拟定以及预后的估计将会表现出更重要的实用意义。
1.T淋巴细胞亚群的测定如前所述,在使用FCM分析时,先用0。散射和90。光散射双指标将白细胞分为三群:淋巴细胞、单核细胞和粒细胞。在二维点图上划出淋巴细胞群范围后,设立GFL的RFL单指标的直方图。命电子计算机仅计数所输入的淋巴细胞,即划线框出的那部分细胞。一般计数输入的细胞可设1000~5000个。直方图的分析可显示阳性细胞的百分率。应用输入细胞数、阳性细胞百分数以及白细胞分类计数,就能得到阳性细胞的绝对值,即每立方毫米血液中的绝对值。有时T淋巴细胞某亚群的绝对值比百分率更为重要,因为它可以表明T细胞某亚群的增高和减少。当然,淋巴细胞占白细胞的百分数也是一个重要数据,应当准确测出。
CD4/CD8细胞的比值,有时也用于反映病人淋巴系统的机能状态。不少临床免疫实验室已把CD4/CD8的值作为常规血检查的项目。在国际上,淋巴细胞亚群以及CD4/CD8并未建立统一数值,各实验室均需建立自己的标准。平均值一般为1.73~2.00。
一般而言,影响淋巴细胞亚群的因素较多,如年龄、性别、种族、以及外周围环境如季节 、药品等的影响。T细胞的绝对值在儿童略高于成人。婴儿CD4细胞的百分率较成年人高;老年人的CD8略低。正常人在一昼夜内也有周期性的波动:上午CD4略低,下午4时之后开始增加,直至次晨,平均波动为15%~20%。尽管正常情况下淋巴细胞亚群有所变动,但仍属正常范围。某些疾病,如器官移植、免疫疾病、免疫抑制和一些淋巴细胞肿瘤,其淋巴细胞亚群及其比值测量结果均可能偏离正常范围。
有工作报道,传统的T辅助诱导细胞(CD4+)具有抑制机能,而在T抑制细胞毒细胞(CD4+)中,有些又具有协助的功能。因此,对原来设想的CD4、CD8的机能分群有所混淆。预计会有新的单克隆抗体再从CD4和CD8的细胞中分出。不过就目前看来,不少临床免疫实验室已用CD4/CD8比值结合淋巴细胞绝对值对多种疾病的诊断、治疗和预后的估计提供了不少有价值的资料。
2.艾滋病以及HLTV—III感染艾滋病是一种由人类T淋巴细胞病毒(HLTV--III)感染而造成的疾病。这种病毒主要侵袭CD4+T细胞,而导致CD4淋巴细胞减少,CD4/CD8淋巴细胞比值下降,甚至可低到0.5以下。艾滋病多发生在同性恋性行为活跃的男性,这可能与多次重复感染HLTV-III有关。对异性性行为活跃的人来讲,对HLTV—IIi 感染的机会也不容忽视。另一种感染的途径是HLTV血清阳性的献血者对受血者的感染。有部分人血液中T淋巴细胞减少,CD4/CD8比值下降,但HTLV血清反应不一定就是阳性。有些人CD4减少不明显,但CD8有所增加,也会导致CD4/CD8的的比值下降。
对可疑为艾滋病及血清检验为阳性的人,T细胞亚群是分析了解免疫系统被病毒破坏程度的标志。初诊时,CD4细胞越少,CD4/CD8值越低者,预后越差。所以经治疗后恢复的指标则是CD4细胞数增加,CD4/CD8比值升高。用荧光标记双染色的FCM分析的结果表明,艾滋病人除CD4和CD8的改变外,同时还可以表现出OKT10阳性细胞增多(图10-15)。病人表现为CD8和OKT10同时增加时,预后比OKT10阳性细胞低的病情严重。

图10-15 健康人艾滋病人淋巴细胞表面抗原的比较
艾滋病人Leu3+、Leu8-和Leu3+、Leu8+细胞均减少,而Leu2+、Leu8-细胞相应增加,
Leu2+、Leu7+与Leu23+、Leu10+细胞明显增加
3.白血病和淋巴瘤的表现型近年来,为了弄清这些肿瘤的病理组织形态、影响治疗效果的原因与免疫状态的相互关系,对于不同类型的白血病和淋巴瘤作为广泛的细胞表面表现型的研究。
在诊断方面,FCM与单克隆抗体结合,可以弄清这些肿瘤的免疫起源,特别是分清B细胞性、T细胞性或骨髓性肿瘤。同时,还可以证实一些与细胞起源相关的抗原,如普通急性淋巴细胞性白血病抗原(CALLA、CD10)。另外,可以用适当的试剂从反应免疫过程中来证实单克隆的肿瘤细胞的增殖。
大部分淋巴系统肿瘤均起源于B细胞。而B细胞肿瘤常用抗免疫球蛋白的抗体来证实。由于前B细胞与浆细胞表面均无免疫蛋白,所以用检测免疫球蛋白的办法就只能证实B细胞发育中间时期的肿瘤。目前,已有一系列的B细胞表面抗原被发现,而可以证实B细胞个体发育的各个时期的肿瘤。
对B细胞肿瘤最有价值的抗原是CALLA。这种抗原仅存在于B细胞正常以育期的前B细胞、早期B细胞以及80%~90%的急性淋巴细胞性白血病。因此,抗CALLA抗体可以区别淋巴细胞性和髓性白血病。用抗CALLA结合其它一些成熟B细胞的单克隆抗体,如CD19,CD20,CD24(B4,B1,BA-1)将能证实大部分B细胞来源的肿瘤。图10-16给出了B细胞分化的各个时期细胞膜的表现型。来源于B细胞的肿瘤和正常B细胞的表现型相似,也就是说,B细胞前身、成熟B细胞及最后分化为分泌B细胞—浆细胞。

图10-16 B细胞分化各时期的细胞膜表现型
由于T淋巴细胞来源的肿瘤浸润性较强,预后较差,并需要多种治疗。T细胞肿瘤的表现型千变万化,但大部分均表现T细胞抗原CD7(Leu9,3A)或其它T细胞抗原CD2、CD5(OKT11,OKT1)。这些抗原与肿瘤的细胞成熟时间有关,因而有助于拟定治疗方案。从FCM分析的结果表明,非成熟的T细胞肿瘤常表现非成熟的T细胞抗原,如CD1和t10。而成熟的T 细胞肿瘤则仅表现成熟T细胞抗原:CD2、CD3、CD5和CD7。有时也可表现CD2、CD8,但不会出现在同一个细胞上面。
由于肿瘤细胞的多种来源,很难避免在肿瘤标本中混杂正常细胞,这给FCM的分析带来技术上的困难。如残留的红细胞在FCM分析时,落入淋巴细胞框定的范围内而造成淋巴细胞各种亚群百分率下降。所以在制备标本时,应尽量想法去除红细胞。另一种污染是正常细胞存在于肿瘤细胞之间,这是一个很头痛的问题。例如骨髓常被外周血污染,反应性的正常淋巴细胞渗入到肿瘤组织中等,因此估计污染程度对解释FCM分析的资料有一定的意义。因为在FCM分析时,正常细胞与肿瘤细胞可能由于不同的体积和密度而被分开,根据对污染的估计,仔细分析图像就能得到比较正确的结果。
4.FCM对正常B细胞和B细胞肿瘤分析FCM对正常B细胞和B细胞肿瘤的分析在免疫学研究和临床诊断上有着重要的实用价值,B细胞的某些特征必须使用FCM来分析,但是这在FCM技术方法中仍存在着一些需要解决的问题。
(1)B细胞的标记:B细胞膜表现免疫球蛋白(SIg)存在于所有成熟B细胞。最早的B细胞前身,细胞质内含有免疫球蛋白M(IgM),但不存在于细胞膜表面。细胞质内IgM的证实以及同时测定细胞表面的SIg,对FCM是很困难的,当然今后可能会用双染法来解决这样的难题。大部分成熟B细胞具有SIgM和SIgD,少量具有SIgG和SIgA,当然这也可能是因为不同的亚群的缘故。但仅以Ig的重链来分类B细胞是不可靠的,因为B细胞可以从膜表面的IgM逐渐转变成IgG,因而从重链着手无法把B细胞分类。大部分B细胞肿瘤也表现出带有SIgM和SigD。随着B细胞逐渐转变成浆细胞,膜表面Ig 逐渐丧失,在细胞质内又出现大量的免疫球蛋白。
与重链相反,B细胞的整个发生期只有一种k或者λ轻链,B细胞肿瘤克隆仅表现一种轻链,因此通过在FCM上显示的不平衡的轻链表现可以确定B细胞肿瘤。测定方法见(3)。
用SIg的最大缺点是它的“嗜细胞性”,因为正常B细胞、自然杀伤细胞(NK)、激活T细胞以及所有巨噬细胞均有Fc段受体,因而可以不同程度地与抗SIg单克隆抗体的Fc段结合而产生非特异性的结果,因此选择抗体时,应使用已被胃蛋白酶消化过的、Fc段也被去除的、仅留下来的F(ab’)2。
(2)FCM测定B细胞的临床指证:
①免疫缺陷;免疫缺陷可以是先天性或获得性的。低丙种球蛋白白血症和无丙种球蛋白白血症常伴有免疫球蛋白分泌的紊乱,因此有必要分析B细胞。
②淋巴瘤:非何杰金氏病的淋巴病,80%来源于B细胞。因而一旦怀疑为淋巴瘤,就应仔细用FCM对B细胞的表现型进行分析,可以分析血、骨髓、以及活检淋巴结等。首先确定肿瘤细胞的来源:B细胞性(CD20+,SIg+)或T细胞性(CD3+)。也有可能某些淋巴病来源于单核细胞(CD11+)成裸细胞而表现出非T非B。一旦确立为B细胞来源后,就应更进一步分析克隆增殖的性质:单克隆、少克隆、或是多克降珠。单克隆性的增殖往往是肿瘤的标志。可以用SIg的轻链和重链分别加以测试,往往轻链比重链更有价值。在不久的将来,或许可以直接用免疫球蛋白的基本加以鉴别。
对B细胞亚群的确定,目前并未定论,但某些B细胞被CD5(T1,OKT1)染色。正常B细胞中这些细胞较少,而多见于慢性淋巴性白血病和骨髓移植后的免疫缺陷时期。在B细胞的肿瘤病人中,10%的也可以出现CD20(B1)阴性反应,这是B细胞成熟而将分化为浆细胞的标志。在异常B细胞上,往往有一些B细胞的标记缺失或其它表现型出现,因而对异常B细胞的FCM的分析尤为重要。图10-17显示CD19—FITc (B细胞)和CD5-PE(T细胞)双染色的假三维图像分析。X轴为绿色荧光的Leu12(B细胞),Y轴为红色荧光的PE—Leu1(T细胞)。从图中可见,有较多的细胞表现出Leu12+tLeu1+,阴性区内为NK细胞和红细胞等。

图10-17 异常B细胞双染色的假三维图
(3)k-λ测定B细胞克隆:k、λ测定法是一种从正常B细胞中测定少量B细胞克隆生长的方法。其基本原理是:若有B细胞克隆存在,将改变某一种轻链(k或λ)的荧光强度的分布。若轻链为k的B细胞生长,则抗k的抗体能测试出这种变化,而抗λ的抗体的测试没有任何改变。正常情况下,B细胞的k和λ的荧光强度分布是一致的(见图10-18)。

图10-18 k-λ克隆的测定
正常情况,B细胞轻链分布图像,一致κ和λ的波形没有区别。但在异常时,若有单克隆生长,κ链有分布则与λ不一致,在总和的曲线形态上也会产生差异。
在实际应用中,血液、体液、组织细胞的悬浮液效果均较好,而对于骨髓,大量细胞的非特异性标记会影响测定的结果。这里面必须强调,正常B细胞中的克隆细胞生长并不意味着它们必然是肿瘤细胞,还必须结合其它指标再做结论。不过这种方法对确定肿瘤细胞的存在、细胞发育阶段、以及经治疗后病情控制的状况等,都可以提供一些有用的资料。
以上仅限于从外周血的白细胞分析这一侧面介绍了FCM的某些疾病中的临床应用。其实,它也仅只是问题的一个部分。例如,有研究工作表明:CD34抗原在由红系、巨核系、粒系和巨噬细胞三个细胞成株单元组成的成株细胞中有所表现。CD34+细胞在人的骨髓细胞中约占1~4%,而在外周血中却探测不到。又如,NK细胞近来被认为可能和人类的某些疾病的发病机理有关,对NK细胞的测量可以作为免疫治疗的免疫监测的重要参数和有效的预后征状的指示。以前是用放射性的51Cr的释放来检测NK敏感的靶细胞的毒理学活性从而评估NK的功能的,而采用荧光探针CFDA(car-boxy—fluorescein diacetate)标记则可用FCM技术更为安全可靠地进行测定。有报告指出,健康男人的数值为(67.1±22.7%)%,健康女人为(63.9±20.0%);患有妇科癌肿病人则为(38.5±23.1)%,明显偏低。这些工作表明,FCM的技术从免疫组织化学角度还会有所发展。在第二节 我们曾简单介绍了流式细胞分析技术在生物医学工程中应用的一些技术途径,这也可以启发我们借助于FCM来提高免疫组织化学的分析能力。可以预见,FCM一定会成为免疫组织化学的一项重要的技术工具,并将在医学科研和临床应用中发挥更大的作用。
附【美国Becton –Dickinson 公司可提供的FCM标准】荧光微球(Fluorescent beads);鸡红细胞核(Chicken erythrocyte nu-clei)和小牛胸腺细胞核(Calf thymocyte nuclei),用于DNA测量的质量控制;单克隆抗体试剂;以及用于免疫表型(immunopheno-typing)和其它临床应用的药盒。
参考文献
1.Holm DM, et al. An improved flow microfluoremeter for rapid measurement of cell fluorescence.Exp. Cell . Res. , 1973;80:105
2.Steinkamp JA, et al.Multiparameter analysis and sorting of mammalian cells . Exp . Cell Res. , 1974;84:15~32
3.Steen HB, et al. Differentialof light-scattering detection in arc—lamp –illumination flow cytometry.Cytometry, 1985;6(3):273~275
4.Loken MR, et al. Flow cytometryas an analyticaal preparetive tool in immunology. J. Immunol. Methods., 1982;50(3):85~112
5.Smart YC, et al. Flowcytometric ceumeration of absolute lymphocyte number in peripheral blood usingtwo parameters of light scatter. Cy-tometry, 1985;6(2):172~174
6.Dvaies EG, et al. Lymphocytesubpopulations in primary immunodeficience disorders. Arch . Dis. Child. , 1983;58:346~351
7.Campbell A, et al. Lymphocytesubpopulations in the blood of newborn infants. Clin. Exp . Immunol. ,1974;18:469~482
8.Shackney SE. The use of flowcytometry in the diagnosis and biological characterization of the nonHodgkin’slymphomas. Ann . NY. Acad. Sci., 1986;486:171~177
9. Foucar K, et al. Flowcytometry in lymphoma. Am. J. Surg. Pathol., 1986;10(8):584~585
10.Hoffonan RA, et al.Immunofluorescent analysis of blood cells by flow cytometry. Int. J.Immuno—Pharmacol, 1981;3(3):249~254
11.Fahey JL, et al. Quantitativechanges in T—helpper or T—suppressor /cytotoxic lymphocyte subsets that distinguishacquired immune defi-ciency syndrome from other immunesubset disorders. Am. J. Med., 1984;76:95~100
12. Eichner RD, et al.LAV/HTLV-III plays a dominant role in the etiology of AIDS. AIDS RES., 1984;1(4):237~241
13. Smith BR, et al. Circulationmonoclonal B lymphocytes in non—Hodgkin’s lymphoma. J. Med., 1984;311:1476~81
14. Committee on Human LeukocyteDifferentiation Antigens, IUIS-WHo Nomenclature Subcommittee. DifferentiationHuman. Leukocyte Antigens:a proposednomenclature. Immunol. Today, 1984;5:158~159
15.Cleary ML, et al.Immunoglobulin gene rearrangements as a diagnositic criterion of B celllymphomas. Proc. Natl. Acad. Sci. USA, 1984;81:593~597
16. Weinberg DS, et al.Cytofluorometric detection of B cell clonalexcess:a new approachto the diagnosis of B cell lymphoma. Blood, 1984;63:1080~1087
17. Gray JW, et al. Cell cycleanalysis using flow cytometry. Int. J. Radian . Biol., 49(2):237~255
18.Marti GE, et al. Normal humanblood density gradient lymphocyte subset analysis. An interlaboratory flowcytometric comparison of 85 nor-mal adults.Am.J. Jematol., 1985;20(1):41~52
19. Levy EM, et al. Defective Tcell differentiation in acquired immunedefecience syndrome (AIDS).J. Clin.Immunol., 1986;77(6):1756~1761
20. Schjnitzer B, et al. Americanadult T cell leukemja/lymphoma:aflowcytometric and morphological study. Ann . NY. Acad. Sci. 1986;486:256~267
21. Van dilla MA, et al. (eds )flow Cytometry:Instrument and Data Analysis. London:Academic Press, 1985
22. Melamed MR, et al, (eds) flowCytometry and sorting . 2nd ed . New York:John Wiley& Sons, 1990
23. Iwao Nishiya et al, (eds)flow cytometry and Image Analysis for clinical applications, Excerpta Medica.Netherlands, 1991
24.宋平根,等.流式细胞术的原理和应用.北京:北京师范大学出版社,1992
第十一章 免疫细胞化学在神经科学中的应用
免疫细胞化学的发展对许多领域的研究起到很大的推动作用,在神经科学的研究中尤为突出。本章 仅就免疫细胞化学在神经科学的基础研究方面的应用做一简要介绍。
一、确定神经递质的性质、定性和分布
早期的神经科学工作者应用传统的神经解剖学研究方法如甲基蓝染色法、镀银染色法等对中枢及外周神经系统的结构做了大量的研究工作,但由于技术方法的限制,对神经递质的性质无法确定。1949年Koelle建立了胆碱酯酶染色法(cholinesterase staining method, ChE)1964Rh ,Karnovsky 和Roots在此基础上改良并建立了一步完成的乙酰胆碱酯酶(Acetycholinesterase,AChE)直接染色法,使显示胆碱能神经成为可能。从生物测定来看,AchE和胆碱能神经的标志酶存在平行关系。因此,一般认为,在加用乙酰胆碱酯酶抑制剂的情况下,用Ache 显示胆碱能神经,仍不失为一种简便易行、可信的技术方法。但必须指出的是,一些接受胆碱能神经支配的细胞(称为胆碱能敏感细胞)和一些非神经细胞(如红细胞和骨骼肌)也可呈AchE阳性反应,甚至中枢神经系统内去甲肾上腺素(NA)能神经元集中的部位—蓝斑也呈现AchE阳性反应。因此,AchE阳性反应的不能就简单地确定为胆碱能神经元或神经。
50年代,Eranko就已发现用甲醛水溶液可使肾上腺髓质内含NA的神经细胞发生荧光。瑞典的Falck和Hillarp(1962)在此基础上改良并建立了用冷冻干燥和甲醛蒸汽诱发荧光,1974年Lindvall 和Bjorklund(1974)和de la Torre等(1976)相继建立和改良了乙醛酸诱发荧光法,开展了荧光组织化学的新篇章 ;为研究单胺类神经递质的定位和分布提供了手段。
70年代以来,免疫细胞化学技术的应用,使我们在对上述经典神经递质研究的基础上又迈进了一大步。与上述方法相比,免疫细胞化学技术具有较高的敏感性和特异性,例如应用胆碱能神经元的标志酶—胆碱乙酰移换酶(Choline acetylase, ChAc)的单克隆抗体就能较AChE法更准确地确定胆大能神经元,同样,应用多巴胺羟化酶(DβH)抗血清能较甲醛或乙醛酸诱发荧光法更为准确地研究NA神经元及其通路,而且不需借助显微分光光度计测定各种单胺递质呈现荧光的不同波长加以区别,免疫细胞化学应用不同的标志酶免疫染色就可区别各种神经元和/或确定神经元内所含的不同的神经递质。如DβH免疫反应阳性在哺乳动物即可做为NA能神经元的标志,因为哺乳动物不存在其它合成NA的酶,所有合成NA的部位均有DβH。酪氨酸羟化酶(TH)和多巴脱羧酶(DDC)阳性表示多巴胺(DA)能神经元系统,而TH,DDC,DβH和苯乙醇胺位甲基移酶(PNMT)免疫反应阳性即为肾上腺素(E)能神经元系统。
借助免疫细胞化学技术,至目前为止,还发现了有40种以上的神经肽分布于中枢神经、下丘脑、垂体、松果体、脊髓、神经节 及外周神经系统特定的神经元中。在脊椎动物,这些肽类物质在体内的分布呈多位性,不局限于神经组织或神经内分泌系统,如原先在脑或下丘脑、垂体中提取的神经肽如脑啡肽(ENK)、生长抑素(SOM)和血管活性肠肽(VIP)等也存在于消化道的内分泌细胞和壁内神经丛中,反之,一系列先从胃肠道分离的肽类激素如胆囊收缩素(CCK)、P物质(SP)等也在神经组织中发现,如CCK在人和猪大脑皮质含量非常丰富,达11nmol/每克脑组织,P物质在脑中30处以上的地方存在,这些多肽被称之为脑肠肽(brain gut peptides)。在外周器官如消化道、呼吸道中的肽类物质统称为调节 肽(regulatory peptide),包括存在于消化道与呼吸道等器官内分泌细胞内的多肽(在消化道又称胃肠激素)和存在于器官壁内神经丛中的神经肽。虽然神经肽,包括脑肠肽在机体中的确切生理作用还有待研究,是作为神经递质、神经调制物(neuromodulator )或神经激素(neurohormone)或二者兼而有之,还存在争论。但免疫细胞化学在神经科学中的应用已为我们开辟了一个新的研究领域,它确定在机体中除传统的胆碱能神经和肾上腺素能神经以外还存在第三上分枝—非肾上腺素能非胆碱能神经(non—adrener-gic non –cholinergic nerves, NANC)。Bloom等认为这第三种神经成分其末梢释放的递质是多肽类物质,又称肽能神经(Peptidergic nerves)。研究结果表明,机体全身的各个器官内都有不同种类和不同数量的肽能神经分布。在大鼠和丘脑下部、杏仁复合体,延脑内一些神经核和脊髓后角内均有较多的肽能神经元和纤维,小脑内仅有散在的肽能神经纤维,而大脑皮质内多数神经肽缺如,仅发现有CCK、SOM和VIP等数种。在消化道,存在一个壁内神经系统,Langley 称为胃肠神经系统(Enteric Nenvous System),现已发现其中含有VIP、SP、ENK、SOM等20余种神经肽,其它各脏器中也都有肽能神经分布。
参考文献
1.Abney ER, et al. Astrocytesependymal cells and oilgodendrocytes develop on schedule in dissociated cellcultures of embryonic rat brain. Dev Biol, 1981;83:301
2.Andrzejloeschand Burnstock G. Ultrasturctural identification of VIP-containing never fibresin the myenteric plexus of the rat ileum. J Neurocytol, 1985;14:327
3.BaumgartenHG. et al. Auerbach’s plexus of mammal and man:electron microscopic identification of threetypes of neuronal processes in myenteric ganglia of the large intestine fromrhesus mondeys, guineapigs and man. Z Zellforsch, 1970;106:376
4.BishopAE, et al. Peptidergic nerves. (Basic Science in Gastroenterology,Structure of the Gut, Eds Polak JM, Bloom SR, Wright NA and Daly, MI) , PP ,221Were Herst. UK Glaxo Group Research Limited, 1982
5.Cook RDand Burnstock G. The ultrastructure of Auerbach’s plexus in the guinea-pig. I.Neuronal elements. J Neurocytol , 1976;5:171
6.EpsteinLM, et al. Deyelopment of serotonergic neurons in the chick duodenum. DevelBiol, 1980;77:22
7.FriedG, et al. Evidence for differential localization of noradrenaline andneuropeptide Y in neuronal storage vesicles isolated from rat vas deferens. TheJ Neuroscience, 1985;5(2):450
8.HokfeltT, et al. In :Neural peptides and Neuronal communications, Eds:Costa E and Trabucchi M. PP. 1~23, 1980
9.KarnovsdyMJ and Roots L. A “direct-colouring”thiocholine method for cholinesterase. JHistochem CYtochem, 1964;12:219
10.Lindvall O and Bjorklund A. The glyoylic acid fluorescence histochemical method:a detailed account on themethodology for the visualization of central catecholamine neurons.Histochemistry, 1974;39:2>7
11.Larsson LI, et al. Localization of vasoactive intestinal polyptide (VIP) tocentral and peripheral neurons. Proc of the National Academy of Sciences USA,1976;78:3197
12.Larsson LI, et al. Occurence of vasoactive intestinal polypeptide (VIP)-likeimmunoactivity in certain cholinergic neurons of the cat:evi-dence from combined immunocytochemistry andacetylcholinesterase stainin.Neuroscience, 1979;4:1539
13.MantyhP and Hunt SP. Neuropeptides are present in projection neurons at all levels invisceral and taste pathways;from periphery sensory to cortex. Brain Ros,1984;299:297
14.Marangos PJ, et al. Developmental profile of neuronspecific (NSE)and non-neuronal enolase(NNE). Brain REs. 1980;190:185
15.Mirsky R et al. Myelin –Specific proteins and glyclipids in rat Schwann cellsand oligodendrocytes in culture, J Cell Biol,1980;84:483
16.Probert L, et al. Ultrasturctural localization of four different neuropeptideswithin separate populations of P-type nerves in the guinea-pig colon.Gastroenterology, 1983;85:1094
17. PolakJM and Bloom SR. Regulatory peptides of the gastrointestinal and respiratorytracts. Arch Int Pharmacol, 1986;280(suppl):16
18.Schwartz JP and Costa E,Hybridization approaches to the study ofneuropeptides. Ann Rev Neurosci, 1986;9:277
19.Sterit WJ and Krewtzberg W. Lectin bining by resting and reactive microglia.Neurocytol, 1987;16:249
20.朱长庚.免疫细胞化学在神经科学研究中的应用.解剖学杂志,1986;9(1):68
21. 杨恬蔡文琴.人胚胎期小肠六种肽能神经发生的研究.解剖学报.1994(25):84
22.韩济生,主编.神经科学纲要.北京医科大学、北京协和医科大学联合出版社,1993
二、探查和发现新的神经递质
免疫细胞化学可作为组织探针(Histological probe ),不断探查和发现新的神经递质。除上述的乙酰胆碱及其合成酶、肾上腺素及其合成酶、活性多肽以外,还可用以确定其它的疑义神经递质(Neurotransmitter chemical suspect)的性质和分布,包括5—HT及其有关酶类、γ—氨基丁酸(GABA)、甘氨酸、天门冬氨酸和牛磺酸等。
近年来,重组DNA工程与免疫细胞相结合而发展起来的原位杂交免疫细胞化学(In situhybridizationImmunocytochemistry)作为组织探针,在发现神经系统特有的蛋白质和肽类方面。具有更高的特异性和灵敏性。重组DNA工程系列用制备的脑的多聚腺苷酸的mRNA,反转录为互补DNa (cDNA),克隆后与组织切片中的mRNA杂交,再按其cDNA核苷酸顺序推断出氨基酸顺序合成新的多肽,以此作为抗原,制备抗血清进行免疫细胞化学的研究,以发现新的神经肽。原位杂交免疫细胞化学技术,简言之,就是利用放射性同位素(或生物素)标记的cDNA片段与组织或细胞中特异的mRNA进行杂交来观察mRNA在体内的分布(详第二十章 )。发展这项技术,对发现神经系统特有的蛋白质或肽类,具有极大的潜力,如脑内特有的mRNA有30000种,目前已知的数10种神经肽仅占其中的一小部分。
三、追踪神经束的行径及其投射区
免疫细胞化学技术的引入,使神经解剖学追踪神经束的行径及其投射区的研究方法从单纯的采用损毁核团或压榨、切断神经不引起溃变,然后用镀银或其它染色法观察溃变的神经细胞体和末梢这一传统的技术中解脱出来。与70年代的HRP技术和放射性自显影术相比,免疫细胞化学技术不但能追踪神经束的行径及其投射区,而且可以定性,确定神经细胞核团或神经束所含神经递质的种类。量单纯用免疫组化染色在连续切片上追踪,常不能获满意结果,因为神经组织的多肽含量较低,在免疫组化染色的连续切片追踪过程中常有丢失的可能。故现在普遍采用的是免疫细胞化学技术与其它技术相结合的“杂交技术”,如与HRP、荧光物和放射自显影技术等相结合的逆行或顺行标记法、与AChe 和单胺荧光组织化学技术相结合的多重染色法等。Westlund1983年应用DβH抗血清注入脊髓,经轴浆运输到胞体,证明脑桥的NA能神经细胞群是脊髓内NA能神经纤维和终末的唯一来源。利用免疫荧光与荧光素进行标记相结合的方法,Mathy 和Hunt查清了过去一直了解得不太清楚的内脏感觉和味觉的传入径路,证明在内脏感觉和味觉由周围感受器传导至感觉皮质,中继部位在延髓的孤束核,脑桥的解剖学工作者还发现用麦胚凝集素(WGA)或霍乱毒素(Cholera Toxin)结合的HRP(CT—HRp ),在神经束行径追踪方面,较游离的HRP灵敏数10乃至100倍以上,因为结合的HRP是通过受体介导而被神经元摄入的。万选才等的研究工作表明CT-HRP较之单纯的HRP在显示树突终末状结构方面有很高的灵敏性。结合HRP的优点可归结为四点:①灵敏度高;②剂量低微;③充分、恒定地显示轴突、树突顺行(离胞体)标记;④降解时间长。以古老的切断神经或损毁神经细胞核团的研究方法与免疫细胞化学技术相结合以追踪神经细胞的起源仍在沿用,如Hokfelt在研究小肠SOM免疫反应性神经的来源时发现,切除肠系膜神经后,小肠SOM免疫反应性神经减少,而结扎肠系膜神经后DβH和SOM免疫反应物在结扎的神经近端聚集,说明小肠的DβH和SOM主要是通过肠系膜神经传运来肠壁的。也可采用化学神经阻断剂如6—羟多巴胺(6--OHDA)、红辣椒素(Capsaicin)等代替手术切断,与免疫细胞化学技术结合应用探寻神经束的行径和反射。
总之,免疫免疫化学技术的应用,使能在中枢较前更迅速、准确地显示了一些神经束的行径、神经细胞核团的定位和定性以及外周器官神经纤维的来源等。
四、区别神经细胞、神经胶质细胞和神经内分泌细胞
免疫细胞化学的发展进一步揭示了神经组织成分的特殊化学性质,利用这些特征不仅能区别神经细胞、神经胶质细胞和神经内分泌细胞,而且可进一步区分不同的神经胶质细胞。S—100是一种从脑组织提取出来的酶性蛋白,是钙结合蛋白的一种,它主要存在于神经胶质细胞、周围神经的雪旺氏细胞、交感神经节 中的卫星细胞和肠肌间神经丛的肠胶质细胞(Entericglial cell)。S—100 也可用于人类肿瘤组织发生的分类,如星形胶质细胞瘤、少突神经胶质细胞瘤雪旺氏细胞瘤显示S—100免疫反应阳性而脑膜瘤和髓母细胞瘤为阴性反应。神经元特异性烯醇化酶(Neuron-specific Enolase, NSE)是从脑组织分离出的一种酸性可溶性蛋白,是烯醇酶的同工酶之一。NSE是神经元特异性蛋白质,存在于神经细胞和APUD系统的神经内分泌细胞中,可作为神经元和神经内分泌细胞的标志酶,在星形胶质细胞瘤、脑室管膜瘤、少突胶质细胞瘤、脑膜瘤和雪旺氏细胞瘤中,NSE呈免疫反应阴性,而神经母细胞瘤为NSe 免疫反应阳性。皮肤的Marker细胞,细胞学分类归属不明,经NSE免疫染色反应呈阳性结果,结合电镜观察证明在该类细胞中含有致密核心的大囊泡,属APUD系统的神经内分泌细胞。在APUD系统的其它细胞如垂体前叶中肽类细胞、肾上腺髓质细胞等以及APUD瘤中,NSE均呈阳性反应。NSE又是神经元分化的标志酶,可以用以研究体内、外神经元的分化发育过程。
近来,免疫细胞化学工作者又利用各种细胞中所含中间丝提纯制成特异性的单克隆抗体血清用于细胞学归属和病理学的检测。这些中间丝包括:①上皮细胞或上皮源细胞中的前角质蛋白(Prekeratin)或称细胞角质蛋白(cytokeratin);②心肌、平滑肌或骨骼肌细胞中的结蛋白(Desmin);③间质细胞或间充质细胞中的波形微丝(Vimentin);④神经胶质细胞中的胶质纤维酸性蛋白(Glial Fibrillory Acidic Protein,GFAP);⑤神经细胞中的神经微丝(Neurofilament, NF)等(详见第十二章 )。实验证明,GFAP是星形胶质细胞特异性标志蛋白,具有星形胶质细胞分化潜能的肿瘤如髓母细胞瘤也含有GFAP,而少突胶质细胞和小胶质细胞呈阴性反应。肠道肌间神经丝内胶质细胞原来细胞学分类归类不明,经GFAP染色呈阳性反应,说明其中与中枢星形胶质细胞属于同一细胞学范畴。O1—O4抗原和半乳糖脑苷脂(Galactocerebroside)只存在于少突胶质细胞,griffonia simplicifloia凝集素仅对小胶质细胞呈阳性反应(小胶质细胞膜上有2—d –半乳糖)。据此,可区分不同类型的神经胶质细胞。
总之,免疫细胞化学技术的发展,解决了过去依赖Nissl 、Cajal和Golgi等传统的神经组织染色法所不能完全解决的问题。进一步揭示了神经细胞的特殊化学性质,现在神经组织内已证实的物质包括蛋白质、肽类、酶类、神经递质和胺等不下50余种,其中神经系统的特异性蛋白质有20余种,与神经元有关的除NSE外,还有神经微丝蛋白,微管蛋白,碱性蛋白(只存在于大脑神经元内的一种组蛋白)和只存在于嗅球神经元中的嗅球蛋白等;与神经胶质有关的有:神经收缩蛋白、小泡蛋白、突触蛋白(Synaptin)、GP350和D1、D2、D3等,为进一步研究神经细胞、神经胶质细胞、神经内分泌细胞及其结构成分提供了有力的手段。
五、研究神经递质的超威结构定位
应用免疫电子显微镜技术(常用为PAP法或胶体金标记技术)可显示抗原在神经细胞内的超威结构定位及在突触水平神经元间的联系的化学本质。Pickel应用免疫电镜观察证明TH存在于DA和DA能神经元的细胞体、树突和近侧轴突。在胞体内此酶定位于内质网、Golgi器和微管上。神经终末枝的突触小泡一般认为是神经递质的亚细胞贮存部位,在电镜下观察神经末梢内突触小泡呈现不同形态,目前已有文献报道的近10余种,比较常见的为无颗粒小泡型(Small agranular vesicles , SAV)或称清亮小泡型(SmallClear Vesicles, SCV),其直径50~90nm,中心无颗粒(图11-1E);该型常混有不同比例含致密核心的大囊泡,直径80~150nm。其次是颗粒小囊泡型(Small granular vesicles, SGV),直径45~70nm,内含有电子密度高的致密核心(图11-1A)。第三是大颗粒泡型(large granular vesicles, LGV),直径80~160nm的突触小泡内含有电子密度高的致密核心(图11-1B)。其它还有扁平囊泡型、线粒体型等(图11-1)。是否不同形态的突触小泡代表了含有不同种类的神经递质尚有争论。有学者认为不同形态的突触小泡只是使用不同种类固定液的人工假象,然而越来越多的实验证明表明,固定液的种类固然有一定影响,但神经终末突触小泡的形态和内含递质的种类似乎存在一定的相关性,SAV型是取得比较一致意见的神经终末类型,它和骨骼肌运动终板(也是神经—肌肉的突触)内所含突触小泡的形态相一致,后者已证明为乙酰胆碱神经递质的贮存处,细胞化学示Ach阳性反应,电刺激时突触小泡减少,示释放现象。这种类型的突触小泡内可能含有乙酰胆碱。

图11-1 神经末梢突触中囊泡类型
SGV型一般认为是单胺介质的贮存部位,单胺类介质。包括儿茶酚胺和吲胺二种,属于前者的介质有去甲肾上腺素、多巴胺、肾上腺素、属于后者的介质为5—HT。在常规电镜生物样品处理的过程中,小颗粒囊泡不易显示,须应用0.1mol/L磷酸盐缓冲液(pH7.0)配制的3%高锰酸钾溶液(Richardson1966)或铬酸盐/重铬酸盐溶液(Tranzer 1976)固定,方能获得满意结果。认为SGV是单胺递质贮存部位的根据是:用利血平注射能使小泡内致密核心消失,而用伪介质(Pseudo—neurotransmitter )如5-羟多巴胺(5—OHDA )注射动物,由于伪介质能置换内源性单胺而被吸收和贮存于突触囊泡中,末梢中小颗粒囊泡的数目增加,电刺激交感神经可使小颗粒囊泡减少,而将α甲基去甲肾上腺素给予被拟交感神经药物或被电刺激耗竭了介质的动物,其神经末梢中的小颗粒囊泡又可重新出现。但1982年Wilson等应用多种实验证明,至少在小肠肌间神经丛内,肾上腺素能神经的终末支是扁平无颗粒囊泡型(flat agranular vesicles, FAV),而不是SGV型。1965年Taxi在两栖类动物的肠道中发现含大颗粒囊泡的神经终末支LGV,Baumgarten(1970)在哺乳动物肠道也发现了LGV型神经终末支,因其形态与丘脑下部含肽的神经末支相似,故命名为P型神经终末支,意即肽能神经(Peptidergic nerves)终末支,而有作者认为凡是颗粒囊泡,包括SGV和LGV都是单胺类递质的贮存部位。免疫电镜技术部分地解决了这一争论。应用PAP和胶体金免疫电镜技术证明VIP、SP、降钙基团相关肽(CGRP)和神经肽Y(NPY)等多肽类物质确实定位于大颗粒囊泡中(Larsson 1976, Bishop 1982, Probertet al, 1983)。有作者还认为不同种类的多肽分别被包含于不同直径的大颗粒囊泡中,如SP定位于直径85nm的大颗粒囊泡中;VIP:囊泡直径98nm;ENK:囊泡直径110nm等,但不同作者在不同动物种属和不同组织、应用方法不同报告结果各异,难以结论。Fried(1985)应用免疫组化、电镜技术和密度梯度离心法相结合,证明在大鼠输精管神经终末支小颗粒囊泡中含有NA,而大颗粒囊泡分为三种类型:单纯含NPY或NA,或NA与NPY共存于一个囊泡中。Burnstock还提出直径100~200nm的大的不透明囊泡(LOV型)系嘌呤能神经递质的贮存部位(图11-1,G),神经终末支内全为线粒体所充满的可能属感觉神经终末支(图11-1,H)。凡此种种,都说明虽然免疫电镜提供了神经递质超微结构水平定位定性的可能,但神经终末内突触小泡的形态与神经递质种类之间的关系始终还有待于进一步的研究。如SAV型在外周可能是代表胆碱能神经的终末支,在中枢能否说SAV内所含的都是乙酰胆碱,其它各型的突触小泡内所含神经递质的种类也还需要进一步研究。在技术方法上的运用,根据笔者体会,应用免疫电镜PAP法,免疫反应复合物相当大,有时很难准确地判断免疫反应复合物的定位,因在囊泡基质内和囊泡膜上雹有反应物附着,免疫胶体金电镜技术避免了上述缺点,胶体金颗粒的沉积比较集中于囊泡基质内,在递质超微结构定位的研究上似较PAP法优越。
六、神经递质共存的研究
免疫细胞化学在神经科学的运用打破了传统的一个神经细胞只产生和释放一种神经递质的概念。在中枢和周围神经系统,近年来,有较多的实验报告证明在一个神经细胞内存在两种或两种以上的递质,这种递质共存不是偶然和个别的现象,而是一种带普遍规律的问题。在光镜水平显示神经细胞内两种抗原的共存,其分辨率只限于胞体,观察神经纤维内两种抗原的共存,必须借助免疫电镜技术。共存情况可出现于:(1)经典神经递质间,如在大鼠颈上交感神经节 的相邻照片上,同一神经细胞分别显示NA和ACh阳性;(2)经典递质与单胺类递质间,如在松果体交感神经末梢中,不仅含有NA,而且含有5—HT;(3)经典递质和神经肽间,如在大鼠的椎前神经节 中,大约有60%的NA能神经细胞同时显示SOM免疫反应阳性,说明SOM与NA的共存,在交感神经系统中NPY与NA的共存,在副交感神经系统中VIP与ACh的共存,已得到较为普遍的证实;(4)单胺类递质与神经肽的共存,如大鼠输精管的交感神经终末支中NA与NPY的共存,在豚鼠肠道肌间神经节 中5—HT与SP免疫反应物共存一个神经细胞内,和(5)神经肽间的共存,如SP与CGRP常共存于感觉神经终末支,Gibbins等(1987)在豚鼠背根神经节 细胞中证明SP、CGRP、CCK和强啡肽(Dynorphin,DYN)四种神经肽的共存。对于神经递质共存的亚细胞部位,Hokfelt曾对肽和胺的共存提出了一种假说,即:①它们可分别贮存于同一神经终末内的不同形态的突触小泡内;②共存于大颗粒囊泡和小颗粒囊泡内;③仅共存于小颗粒囊泡中;④仅共存于大颗粒囊泡内;此假说尚待进一步证实。Fried 的实验结果表明,在大鼠输精管,胺和肽的共存仅发生于大颗粒囊泡内,Andrzejloesch 和Burnstock实验证明在豚鼠肠道肌间神经丛内VIP和ACh共存于SAV小囊泡内。应用胶体金免疫电镜技术,以不同直径的金粒标记不同的抗原,是研究递质共存的超微结构定位较为理想的手段。
关于递质共存的生理意义,目前还不十分清楚,有作者设想与经典递质共存的肽类可作为辅递质,在神经细胞释放时,对突触后膜上主递质的受体起调制作用,从而调制信息传递。Hokfelt(1980)提出两种递质共存的生理意义有以下五种可能性:①两种递质可穿过突触间隙作用于突触后细胞,作用于相同或不同的受体;②一种物质激活突触后细胞的受体,另一种物质则封闭另一种类型的受体,如在5—HT和SP共存的情况下,5—HT直接抑制突触后细胞,SP封闭其它末梢释放的ACh对突触后的细胞的兴奋作用;③一种物质作用于突触后细胞,第二种物质则作用于突触前末梢的自身受体(autoreceptor),从而调制细胞终末对神经递质的释放;④一种物质作用于突触后细胞,第二种物质则作用于其它末梢上的突触前受体;⑤一种物质作用于一类细胞,另一种物质作用于另一种细胞,在这方面典型的例子是汗腺,汗腺的交感神经元内含有VIP和ACh,前者作用于周围小血管,增加血流量;后者作用于腺体,刺激汗腺分泌。
总之,递质共存的研究是神经科学领域中一个崭新的课题,它的研究对进一步了解复杂的神经系统的结构和功能有重要意义,而在这项课题的研究中,免疫细胞化学(包括光镜和电镜)无疑是一项有力的工具。
七、个体和种族发育的研究
神经系统是一个历史发展的产物,有种族发育和个体发育的历史。在种系发生方面,有不同的发育规律,如一些神经肽自腔肠动物已经发生,而VIP自鱼类才开始发生。免疫反应的强弱和神经肽的含量亦因种属不同而异,如笔者对输精管的神经支配的研究表明,在大鼠、豚鼠和猫等动物,输精管管壁内有丰富的神经分布,而在人输精管神经分布异常稀疏。研究神经肽的发生可以帮助了解肽类的发生规律,有利于选择和建立实验动物模型。个体发育,不但指胚胎发育,也指动物出生后发育以至衰老的规律,神经系统的任何一个部分都可以从发育的角度去研究。在肠道,Epstein等在鸡小肠壁内神经丛的研究表明,在鸡胚发育的第7日出现胆碱能神经成分,5~7天出现5—Ht 神经细胞,NA神经终末出现于第12~16日,神经肽出现在这些递质之后。在小鼠、豚鼠和兔小肠壁内神经从发育规律的研究报告和鸡相似。神经肽的出现较晚,而神经对肌肉发育的作用更晚,如在豚鼠小肠,虽然在胚胎第25日出现了胆碱能神经细胞,但肌肉对神经的反应性出现在胚胎的第48日。各种神经肽的含量和含肽类神经细胞的数目都随发育、成长、衰老而产生规律性变化,如大鼠全脑或脑各分区中NSE的含量随发育而增高,在第13天胚胎时NSE含量为50ng/mg蛋白质,到成体(第40日)时为11000ng/mg蛋白质,而定位于神经胶质的非神经无烯醇酶(No-neuronal enolase, NNE),在第11日的胚胎为8500ng/mg蛋白质,出生后下降至5000ng/mg蛋白质,到成体(第60日)时为11000ng/mg蛋白质。以上结果表明,随着神经细胞的产生,NSE增加,而NSE/NNE比例显著增高,说明在大鼠脑神经元的分化过程中可能存在着由NNE转变为NSE的生物化学分子变化。杨恬、蔡文琴等(1994)报告了六种肽能神经在人胚胎期的发育规律,AChE神经出现最早,其它肽能神经出现时间不一,分别在第11~16周。同一个体不同器官肽能神经并非同时发生,如膀胱肽能神经出现较小肠为晚。总之,神经系统种族发育和个体发育这个领域的研究还有待于进一步发掘。
八、与神经组织培养技术相结合进行神经生物科学的研究
神经组织培养是从机体中取出组织或细胞,在模拟机体内生理条件下进行体外培养。免疫细胞化学技术可用于培养的单个细胞或组织片染色,单个细胞可直接固定或冰冻后进行免疫染色,而组织片在固定或冰冻后常需进行切片后染色。由于体外神经组织培养技术能使复杂的神经系统简单化,换而言之,能在神经系统的结构与功能的研究方面提供一个简单的模型,近年来,随着培养技术的发展和与其它科学的相互结合,在神经生物学这一研究领域中提供了不少的新资料,如利用免疫细胞化学技术可对原代分离培养的神经细胞和神经胶质细胞进行细胞的特异抗原标记(可以是细胞表面或细胞质内成分),从而区别其细胞类型,如用GFAP标记星形胶质细胞、半乳糖脑苷脂、髓磷脂碱基蛋白(myelin basic protein, MBP)标记少突胶质细胞、NSE标记神经细胞、Ran-α标记胶质细胞表面的抗原等,这些特异的标记在神经生物学和临床科研中有很大潜能,细胞表面标记能够区别活细胞,精确地研究细胞间特性和相互作用,细胞内标记能有助于对神经细胞结构、功能及相互作用的研究。Mirsky及其同事们利用半乳糖脑苷脂(GC)、硫脂(Sulphatide, S)和MBP对培养的雪旺氏神经胶质细胞和少突胶质细胞的研究表明,雪旺氏神经胶质细胞在与其所依附的轴突分离后不超过5~6天,GC、S和MBP的免疫染色均为阴性,表明雪旺氏细胞需要持续性地从相应的轴索获得信息(Signal)才能制造出可为免疫染色所检测出的髓鞘特异性糖脂和蛋白,而少突胶质细胞则否,在没有神经细胞存在的情况下培养数周,仍保持GC、S和MBP免疫反应阳性。本实验结果成功地证明少突胶质细胞和雪旺氏神经胶质细胞产生髓鞘的方式是不同的。Abney等利用培养的胚胎和新生大鼠的脑细胞混悬液进行特异性免疫标记染色,证实了不同类型细胞在脑内的发育顺序:破伤风毒素阳性神经细胞出现在第10天的胚鼠脑(测试的最早时间),GFAP阳性星状胶质细胞出现在15~16天的胚脑,而GC阳性少突胶质细胞直至出生后2~3天方才出现。利用18天胚鼠的小肠壁内神经丛培养后进行各种神经肽的免疫染色,Schultzberg等发现在这时的小肠壁内神经丛已具有内源性的VIP、SP、ENK和SOM免疫反应性神经元。
九、应用于受体的研究
由于免疫细胞化学所应用的各种标记物如铁蛋白、胶体金和荧光素等都能无例外地与配体(即与受体呈特异结合的物质)相结合,因此可应用于细胞表面(包括神经细胞和神经胶质细胞)表面受体的定位。Philips和Bennet(1987)应用抗肌球蛋白和荧光素标记的α-眼镜蛇毒素成功地显示了乙酰胆碱受体(Acetycholine receptor clusters)在鸟肌上的发育规律。近年来,应用免疫细胞化学技术进行受体再循环的免疫电镜观察,取得了令人瞩目的进展。Geueze利用胶体金-蛋白A-抗唾液酸糖蛋白的受体抗体在免疫电镜下观察证明,配体与细胞表面的相应受体结合后,由受体介导入肠作用而进入胞内,在入胞早期,唾液腺糖蛋白及其受体均存在于有覆衣囊泡中,并与囊泡内表面密切结合。在人胞囊泡内,则见配体游离于囊泡腔中,内移的受体可再循环回细胞表面加以利用。本实验结果为细胞膜受体的再循环提供了有力的证据。
十、神经系统的机能研究
免疫细胞化学在神经科学的应用已由单纯的形态学研究逐步向与机能研究、应用研究和临床实践相结合。如研究脑啡肽与镇痛的关系,SP与转导伤害性刺激的关系以及在各种生理和病理条件下神经肽的变化与病理生理作用机制的关系等。在研究方法上也不断改进,如免疫组化的定量研究由简单的积分法逐步走向与放射免疫测定相结合、与图像分析相结合,测定单位面积内和/或每个神经细胞内免疫反应物含量的变化。
第十二章 肿瘤免疫细胞化学
第一节 神经肿瘤免疫细胞化学
在神经系统肿瘤中,以胶质瘤最多见,次为脑膜瘤、神经鞘膜瘤和垂体腺瘤,再次为孤立性神经纤维瘤、神经纤维瘤病、丛状神经纤维瘤、节 细胞瘤、节 细胞神经母细胞瘤、神经母细胞瘤以及转移瘤等,其余各类肿瘤均属少见。这些肿瘤,一般情况下,应用H·E染色,在光镜下便可作出病理诊断。但是,有时对其细胞起源、细胞学类型、分化程度,特别是各肿瘤间的鉴别,诊断相当困难。近10多年以来,免疫细胞化学的兴起,尤其是PAP、ABC、ABPAP、免疫金银等灵敏性高的染色法,加上特异性很强的单克隆抗体的问世,使得常规石蜡切片可以被用作免疫细胞化学染色,从而开辟了免疫细胞化学在神经肿瘤领域里广泛应用的新途径,往日的一些难题有些已获得解决,有些正在深入研究并积累了经验。
肿瘤组织可产生多种多样的抗原,通过这些抗原成分可以识别各种肿瘤,迄今在石蜡切片上具有诊断价值的抗原已经有100多种,在神经肿瘤诊断和研究中具有重要价值的,有下述几种,它们可作为标记物供检测和研究应用。
一、细胞骨架中的中间丝蛋白
在细胞骨架中有三种结构,即微管(microtubules,MT )、微丝(microfilaments,MF)和直径介于上二者之间的中间丝(intermediate Filaments, IF)。各种细胞的IF都具有相同的结构和不溶于水的特性,但可根据其组织学分布、生物化学和免疫学特性,将其分为五种类型,即细胞角蛋白细丝(cytokeratin filaments, Ckfilaments)、波形细丝(Vimentin filaments)、结蛋白细丝(desmin fila-ments)、胶质细丝(glial filaments, GF)、神经细丝(neurofilaments NF),它们分别由细胞角蛋白(CK)、波形细丝蛋白、结蛋白、胶质细丝酸性蛋白和神经细丝蛋白构成。上述五型IF蛋白在组织学分布上具有一定的特性。这种特异性是各种组织在胚胎发育过程中获得并一直维持下来的,即使在肿瘤中瘤细胞仍能基本保持其起源细胞的IF类型,故IF蛋白的免疫组化定位有助于确定肿瘤组织的起源。对神经肿瘤具有诊断和鉴别诊断价值的主要有以下二种:
(一)神经细丝酸性蛋白
神经细丝酸性蛋白(glial fibrillary acidic protein, GFAP)可从正常人脑及病人脑中分离获得,含有丰富的天门冬氨酸和谷氨酸,分子量47000道尔顿。早期,Emg与Bigbee报道,GFAP抗体在星形神经胶质细胞及其肿瘤内呈特异性地定位,其它胶质成分、神经元及其肿瘤均不着色。后来,人们发现,GFAP不仅在星形神经胶质细胞及其肿瘤中存在,还见于各类型的星形细胞、混合性胶质瘤、多形性胶质母细胞瘤、室管膜瘤、室管膜下巨细胞性星形细胞瘤、含胶质成分的髓母细胞瘤和神经鞘瘤等肿瘤中。目前,人们认为,GFAP在神经肿瘤诊断和研究中的价值在于:①GFAP能确定肿瘤的胶质性质,特别是星形胶质细胞的起源,能清楚显示在H·E染色下难以辨认的混合性胶质瘤中的星形胶质成分,确定原始神经肿瘤的胶质分化,以及与转移瘤、脑膜瘤的鉴别。②GFAP与星形细胞瘤的分化程度相关,可根据免疫组化着色的程度评价肿瘤的恶性程度和细胞分化程度,为临床提供治疗和预后的参考。
GFAP在星形细胞瘤显示两种染色类型,一种是泡浆和细胞突起的弥漫性着色,主要见于分化好的星形细胞瘤,例如,纤维性星形细胞瘤和肥胖细胞性星形细胞瘤;另一种是胶质网的着色,在分化好的和间变性星形细胞瘤以及多形性胶质母细胞瘤中都可见到。在分化好的星形细胞瘤,阳性细胞多且免疫组化染色深;在间变性星形细胞瘤,阳性细胞少且染色浅;在肥胖细胞性星形细胞中,胞浆丰富的大瘤细胞阳性,小瘤细胞阴性。
GFAP在少枝胶质细胞瘤、脉络丛乳头状瘤、松果体实质细胞瘤、脑膜瘤和脑膜肉瘤、颅咽管瘤、血管母细胞瘤及黑色素瘤等为阴性。在室管膜瘤的报道中,各家说法不一,有阳性也有阴性的报道。这种情况可能与室管膜上皮的类型不同有关。一种室管膜上皮是立方形,数量多,胞浆中有8~10nm的中间丝,与星形细胞的不同,GFAP阴性;另一种室管膜上皮是伸张状细胞,数量少,散在于立方形细胞之间,GFAP阳性染色。上述二种上皮可各自形成室管膜瘤,GFAP染色各异。
(二)神经细丝
神经细丝(neurofilaments, NF)分布于神经原细胞体和轴突、树突,副交感神经节 ,肾上腺内外嗜铬组织等,因此,节 神经瘤、肾上腺内或外神经母细胞瘤、小脑神经母细胞瘤、副节 神经瘤均呈NF阳性反应,并且,分化较好的肿瘤的NF阳性瘤细胞数量要比分化差的多,在儿童的未分化神经母细胞瘤常呈弱阳性反应。NF免疫细胞化学染色有助于神经系统肿瘤的鉴别诊断和预后估计,特别在骨转移性神经母细胞瘤与原发性淋巴瘤及尤文氏瘤鉴别诊断中,前者阳性而后二者均为阴性,甚有作用。
二、神经特异性烯醇化酶
烯醇化酶是糖酵解过程中催化2—磷酸甘油酸与磷酸烯醇式丙酮酸互相转化的水解酶。已知烯醇化酶有多个同工酶,它们是三个基因位点的产物,由α、β和γ三种免疫学上不同的亚单位所组成的二聚体,αα、ββ和γγ三种为纯合的烯醇化酶,还有αγ和αβ二种杂合的烯醇化酶。神经烯酶化醇主要是γγ型,其次是αγ型。以前认为只存在于神经元,故命名为神经元特异性烯醇酶(neuron-specific enolase, NSE),出已证明,除神经元外,它们亦存在于神经纤维和神经内分泌细胞(APUD细胞),表现为细胞浆阳性染色。在星形胶质细胞瘤、脑室管膜瘤、少枝胶质细胞瘤、脑膜瘤和雪旺氏细胞瘤中,NSE染色为阴性。
对NSE的保存,福尔马林固定的组织免疫组化反应较弱,而苦味酸、多聚甲醛溶液反应良好。
三、S—100蛋白
1965年,Moor从牛脑浸液中分离出一种高度酸性钙结合蛋白,富含苯丙氨酸,分子量21kD,它在中性饱和硫酸铵溶液中100%溶解而命名为S—100蛋白(S—100protein)。早期,人们认为S—100蛋白是一种神经系统特异性蛋白,存在于胶质细胞和雪旺氏细胞以及它们的肿瘤中,后来的研究工作证明S—100蛋白也存在于一些非神经源性的正常细胞和肿瘤中。在福尔马林固定、石蜡包埋组织中,S—100蛋白保存良好,可用兔抗牛S—100蛋白抗血清进行染色,阳性细胞表现为胞浆或同时伴有细胞核弥漫性着色。S—100蛋白染色强度与瘤细胞的分化程度关系不大。
在中枢神经系统,S—100蛋白广泛分布于星形细胞、少枝胶质细胞、室管膜细胞及其起源的肿瘤中。连锦英等对122例颅内肿瘤作了S—100蛋白和GFAP分布的研究,发现S—100蛋白在各类型星形细胞瘤、混合性胶质瘤全部阳性,大多数少枝胶质细胞瘤、多形性胶质母细胞瘤和室管膜瘤阳性,绝大多数髓母细胞瘤中可见少量S—100蛋白阳性细胞。在部分脑膜瘤、颅咽管瘤、听神经瘤、血管母细胞瘤等亦可见S—100蛋白阳性。S—100蛋白有助于脉络从乳头状癌与转移性乳头状癌的区别,前者S—100蛋白阳性,后者为阴性。
在周围神经系统,S—100蛋白广泛分布于神经嵴起源的雪旺氏细胞及其肿瘤中。在神经鞘肿瘤和各种神经纤维瘤中,良性神经鞘瘤S—100蛋白含量最高,阳性细胞多,染色也强,An-toni A区的瘤细胞中S—100蛋白呈均匀地分布于胞浆和核内,而Antoni B区的瘤细胞排列疏松,S—100蛋白染色不规则,纤维化区缺乏S—100蛋白;神经纤维瘤中可见S—100蛋白阳性和阴性两种细胞,显示它们的来源可能不同,前者可能是雪旺氏细胞,后者可能是来源于神经周膜和神经内膜细胞。大部分神经源性肉瘤含有S—100蛋白,显示来自于雪旺氏细胞。这些肿瘤对S—100蛋白的反应一般比良性者弱,而且,在高度间变的肿瘤,由于瘤细胞的反向分化,常丧失合成S—100蛋白的能力。
在神经肿瘤诊断和研究中,除上述三种常用标记物外,还有一些标记物可供选择或配合应用:①谷氨酰胺合成酶(glutamine synthetase, GS),其组织中分布与GFAP相同;②髓鞘碱性蛋白(myelin basic protein, MBP),用于少枝胶质细胞、雪旺氏细胞及其肿瘤检测,特别对恶性神经鞘瘤诊断有意义;③髓鞘相关糖蛋白(myelin associated glycoprotein,MAG),可用于少枝胶质细胞、雪旺氏细胞及其肿瘤检测,但与多种肿瘤出现交叉反应;④少枝胶质细胞表面抗原,共有4个亚型,O1和O2出现在少枝胶质细胞及其肿瘤不成熟或分化低时,O3和O4出现于成熟或分化高时,等。
对某种类型的肿瘤来说,不是所有的这种肿瘤都表达相同的抗原;同样,对某一个肿瘤来说,也不是所有的肿瘤都有一样的抗原,因此,在神经肿瘤诊断上,二种以上标记物的联合应用比用单一标记物更为可靠。
第二节 神经内分泌肿瘤免疫细胞化学
人体存在两种形式分布的内分泌细胞,一种是内分泌细胞群集形成内分泌器官,如垂体等,另一种是内分泌细胞单个散在于其它组织细胞之间,形成弥散的内分泌系统(diffuse en-docrine system)。通过免疫细胞化学方法及超威结构观察,人们对内分泌细胞的分布形态与功能等不断有新的发现。1968年,Pearse观察到体内一些分泌肽类物质的细胞具有共的细胞化学特性,即具有摄取胺前体、脱去其羧基变为活性胺的能力(amine precursior uptake and decar-boxylation)而命名为APUD细胞,把这些细胞归属为APUD系统。现在,这上概念已扩展为体内分泌肽类和/或胺类活性物质的内分泌细胞的总称,所分泌的活性物质作为激素、神经递质而发挥作用;已知APUD系统的细胞有40多种,已确定的肽类产物有30多种。近年的研究表明,APUD细胞与下丘脑的一些神经内分泌细胞很相似,因此,提出弥散内分泌细胞、APUD细胞、神经内分泌细胞实际上同一类细胞,弥散分布、具有带膜的胞浆分泌颗粒以及分泌胺类和/或肽类激素是它们的共同特点。有人提出,一切摄取胺前体脱羧细胞都是神经外胚叶起源,但也有人对此持不同意见。事实上,若干肽类激素如生长激素抑制素即可在胃肠和胰腺内生成,也可在中枢神经系统内生成;而神经元的标志酶,即神经元特异性烯醇化酶(NSE),也可在肽激素生成性APUD细胞浆内检出,这些共性使人们将APUD系统归入神经内分泌系统的概念内。
APUD细胞或神经内分泌细胞发生的肿瘤称为APUD肿瘤(apudoma)或神经内分泌肿瘤,此类肿瘤包括肠胃道类癌、胰腺内分泌肿瘤、支气管类癌和一些肺小细胞未分化癌、甲状腺髓样癌、嗜铬细胞瘤以及垂体腺瘤,最近还不断提出一些新的肿瘤,如食管、宫颈、前列腺等部位的“小细胞”嗜银癌、子宫内膜“小细胞未分化型APUD瘤”、喉部“神经内分泌癌”、皮肤“神经内分泌癌”(Meckel细胞癌)等。这一类肿瘤在功能和形态上,有以下共同特点:①具有内分泌功能,患者血中可出现肿瘤分泌产物,如胃泌素、嗜铬粒蛋白(chromogranin)等,临床上也可表现相关症状;②肿瘤组织可提取相应的激素类物质,免疫细胞化学染色呈特异性阳性反应;③肿瘤细胞在电镜下可见其有被膜的神经分泌颗粒。以上这些特点可作为诊断神经内分泌肿瘤(A-PUD肿瘤)的依据。
神经内分泌肿瘤中,有的不伴有内分泌症状,此称无功能性肿瘤,但也有可能是这种肿瘤分泌产物量很少,不足以产生临床表现的内分泌症状;有的则伴有内分泌症状,临床表现取决于激素的性质。这些肿瘤中有的肿瘤分泌所在器官正常产生的激素,称为正内分泌瘤,如胰腺的胰岛素瘤;有的肿瘤则分泌非所在器官正常产生的激素,称为异内分泌瘤,如胰腺的胃泌素瘤。此外,尚有一种肿瘤内可含几种不同的细胞、分泌多种激素以及几个内分泌肿瘤可以在不同器官内同时存在等情况。
应用免疫细胞化学方法研究神经内分泌肿瘤,将进一步更新我们对这些肿瘤的经典概念,使我们能够从组织学角度准确地判断肿瘤细胞的分化程度及生物学行为。例如,过去应用常规组织学方法很难判断未发生转移的胰腺内分泌瘤的生物学行为,而今已证实,恶性功能性胰岛素瘤都含有与糖蛋白激素共同的α链,可应用免疫细胞化学方法加以检测,证实其良、恶性质。下面,我们介绍几种常见的神经内分泌肿瘤,及其免疫细胞化学和电镜的特点。
一、生体腺瘤
应用免疫细胞化学方法,按照肿瘤细胞内定位的垂体激素种类,垂体腺瘤可分为以下几种:
(一)生长激素腺瘤
可分为颗粒密集型及颗粒疏松型两种。
1.颗粒密集型临床上这类肿瘤伴有肢端肥大症。免疫细胞化学染色可见胞浆中有生长激素阳性反应物质。电镜下,这类瘤细胞胞浆内分泌颗粒数量多,球形,外周有界膜,直径300~500nm。
2.颗粒疏松型临床上也伴有肢端肥大症。免疫细胞化学染色可见胞浆中有斑点状的生长激素阳性反应物质。电镜下,瘤细胞胞浆内可见分泌颗粒,但数量少,直径大多约100~250nm。
(二)催乳激素腺瘤
也有两型。
1.颗粒密集型电镜下,分泌颗粒数量较多,体积大,直径可达1200nm。免疫细胞化学染色可见催乳激素在瘤细胞胞浆中呈明显阳性反应。
2.颗粒疏松型免疫细胞化学染色可能出现两种情况,一是在瘤细胞胞浆内发现催乳激素呈阳性反应,二是呈阴性反应。出现阴性反应的原因,可能是激素产生后不经过储存即直接排出细胞外。电镜下,分泌颗粒数量少,体积小,平均直径250nm。
(三)促甲状腺激素瘤
甚为少见,约占1%,常发生于长期甲状腺功能低下的病人,由于缺乏甲状腺素,通过负反馈作用刺激其细胞增生。光镜下常为嫌色性细胞腺瘤,胞浆含少量PAS阳性物质。电镜下分泌颗粒稀疏。
(四)促肾上腺皮质激素腺瘤
此瘤能合成促肾上腺皮质激素(ACTH)和其它肽类如内啡肽等,可引起Cushing 病。免疫细胞化学染色可证明瘤细胞胞浆中含有ACTH等。电镜下除见分泌颗粒(大小约为250~270nm)外,ACTH瘤细胞中往往可观察到平行排列的微纤维束,用免疫细胞化学染色可证实其属于细胞角蛋白,而与ACTH无关。
(五)促性腺激素腺瘤
多见于老年人。腺瘤合成卵泡刺激素或卵泡刺激素及黄体生成素,很少单纯合成黄体生成素。免疫细胞化学显示卵泡刺激素或/和黄体生成素阳性反应。
(六)多种激素性腺瘤
此瘤可合成一种以上的激素,如生长激素和促甲状腺激素、催乳激素和促甲状腺激素、生长激素、催乳激素和促甲状腺激素等,免疫细胞化学观察可见各相关阳性细胞。
(七)无功能活性腺瘤
多见于中老年人,一般不伴有特殊症状。免疫细胞化学显示多数细胞激素为阴性,少数腺瘤细胞可含有卵泡刺激素、生长激素及ACTH等。电镜下,分泌颗粒稀疏,大小为100~200nm。
随着垂体腺瘤研究工人的广泛和深入,按激素归类,大致可有单激素腺瘤、多激素腺瘤和无功能腺瘤三大类。近年研究发现,多激素腺瘤越趋增多,有报道可占30%~40%,提示垂体多激素腺瘤的研究可能促进垂体腺的细胞生理学和细胞病理学的发展,可能对垂体肿瘤临床诊治产生重要影响。
二、胰岛细胞瘤
胰岛细胞瘤是胰腺内分泌肿瘤。电镜下,在各类型肿瘤细胞浆内均可见带膜的分泌颗粒。应用免疫细胞化学方法,以多种内分泌激素抗体标记,可区分以下类型胰岛细胞瘤:
1.胰岛素瘤由胰岛B细胞组成。患者血浆胰岛素水平升高,有低血糖症。免疫细胞化学染色可见大部分瘤细胞胞浆呈胰岛素阳性反应。有些肿瘤患者不伴有明显的临床症状。但血液生化测定可发现轻度血糖降低,免疫细胞化学染色多呈阴性反应或数量不等的散在阳性细胞。此瘤少数(约5%)可为恶性,常规染色难以根据细胞形态判断其生物学行为,而是根据其有无转移。近年证明恶性胰岛素瘤分泌与糖蛋白激素共同的α链物质,可以免疫细胞化学方法检出。
2.胰高血糖素瘤由胰岛A细胞组成。临床上常伴有胰高血糖素综合征。大多数胰高血糖素瘤为恶性。免疫细胞化学染色可显示瘤细胞胞浆有胰高血糖素反应阳性物质。
3.生长抑素瘤由胰岛D细胞组成,约半数为恶性。免疫细胞化学染色可见瘤细胞胞浆有生长抑素反应阳性物质。
4.胰腺胃泌素瘤由胰岛G细胞组成。电镜下证明瘤细胞胞浆颗粒与胃窦部G细胞颗粒非常相似。免疫细胞化学染色可见瘤细胞胞浆有胃泌素阳性物质。
5.胰舒血管肠肽瘤亦称胰腹泻瘤,由胰腺舒血管肠肽(VIP)细胞(D1细胞)组成。此瘤约半数为恶性,常见肝脏转移。免疫细胞化学染色可见肿瘤细胞胞浆有VIP阳性物质。
6.胰多肽瘤由胰岛PP细胞组成。免疫细胞化学染色可见瘤细胞有PP阳性物质。
近年来,应用免疫细胞化学方法研究发现,有一些胰岛细胞瘤含有二种或二种以上的内分泌细胞,往往是以一种内分泌细胞为主,其它类型的内分泌细胞混杂其间。
三、甲状腺髓样癌
由甲状腺滤泡旁细胞(C细胞)产生的恶性肿瘤。此瘤在光镜下与甲状腺非典型腺瘤、未分化癌及转移癌有时难以鉴别。免疫细胞化学染色可见瘤细胞降钙素阳性反应,降钙素免疫反应物常聚积于瘤细胞核周胞浆中,此项检查具有诊断意义。电镜下,瘤细胞中可见二种分泌颗粒,I型颗粒直径约280nm,含有等电子密度的基质,紧邻界膜:II型颗粒直径约130nm,有致密核,由空晕与界膜相隔。免疫细胞化学染色证明二种颗粒内都含降钙素。
甲状腺髓样癌中除见降钙素阳性细胞外,常混有5—HT免疫阳性细胞,有的混有其它肽类激素阳性细胞,如ACTH阳性细胞等。
四、肺支气管类癌及肺小细胞癌
在肺癌中有一类来自神经内分泌细胞的癌,即支气管类癌及小细胞癌,它们都具有共同的超威结构特征,即癌细胞内含神经内分泌颗粒,可异位分泌多种激素,例如,支气管类癌可产生5—羟色胺,出现类癌综合征,小细胞肺癌可分泌ACTH,临床上出现Cushing’s综合征,等。近年研究发现,光镜下的小细胞癌并非都具有神经内分泌颗粒,因此,在诊断中常将光镜、电镜及免疫细胞化学等方法结合进行,但也有不同报道,例如,刘鸿瑞等对16例肺原发性小细胞癌手术切除标本,进行光镜、电镜及免疫细胞化学观察,其中燕麦状细胞细胞癌8例,中间型小细胞癌7例,复合小细胞癌1例。超微结构观察,全部瘤细胞内找到神经内分泌颗粒,但量较少。12例(12/15)神经特异性烯醇化酶(NSE)免疫细胞化学染色阳性。据报道,NSE对此类小细胞癌是一项特异、灵敏的标志。
五、食管燕麦细胞癌
1926年,Barnard提出苝麦细胞癌一词,当时仅是肺未分化癌的同义词。后来,这种形态的肿瘤不仅见于肺,也见于肺外部位,如鼻腔、喉、乳腺、胸腺、前列腺、宫颈等均有过燕麦麦细胞癌的报道。食管燕麦细胞癌很少见,自1952年Mckeown首次报道2例以来,文献中仅有零星病例报道。我国冼美生等报道7例,它们组织学表现相同,无论从组织结构、细胞形态均酷似肺燕麦细胞癌。3例经过Grimelius嗜银染色,证明瘤细胞胞浆内有嗜银颗粒,Fontana-Masson亲银染色阴性,电镜下见特征性神经内分泌颗粒。免疫细胞化学染色可见神经特异性烯醇化酶(NSE)阳性细胞。此瘤生长迅速,恶性程度甚高,70%死于6个月内。
六、皮肤神经内分泌癌(Merkel细胞瘤)
此瘤是近几年来确认的一种少见的高度恶性肿瘤,后来,Tan等(1978年)又通过电镜观察证实了这类肿瘤细胞含有神经内分泌颗粒,从而明确了此瘤的神经内分泌属性,同时,还提出它在组织发生学上可能与正常分布于表皮基底层且与触觉神经有关的Merkel细胞有一定联系。免疫细胞化学染色,在目前已知的阳性反应物中包括:NSE、NF、血管活性肠肽(Vasoactive in-testinal polypeptide)、胰多肽(pancreatic polypeptide )、ACTH、生长抑素(Somatostatin)、降钙素(Calci-tonin)及物质P(Substance P),除NSE 是唯一的对大多数瘤细胞呈强阳性反应之外,其它的在现在文献中尚无任何一种能充分地在大多数瘤细胞中表达,因此,NSE免疫细胞化学染色技术在此瘤的诊断与鉴别诊断中有重要意义。当然,皮肤某些其它原发或转移性肿瘤也可能显示NSE阳性反应,如恶性黑色素瘤等,故应强调临床、形态、免疫细胞化学及电镜等的多指标综合分析,最后作出准确诊断。
第三节 软组织与骨肿瘤细胞化学
软组织亦称间叶组织,它的广义包括结缔组织、脂肪组织、肌肉、血管、滑膜、周围神经以及骨组织等。本节 研究的对象为来源于这些组织的肿瘤,与一些与之相关但组织发生尚不太明了的肿瘤的免疫细胞化学标记。软组织恶性肿瘤虽然只占人体全部恶性肿瘤的1%左右。但由于这类肿瘤形态很相似。在常规切片下确定其组织发生,常是临床病理诊断中的难题之一,为病理工作者所关注。由于免疫细胞化学的发展,研制成许多标记抗体,提供了确定软组织肿瘤的组织发生的和鉴别诊断应用的标记抗体。但是有的抗体特异性不够,存在交叉反应以及肿瘤细胞的异质性、多向分化潜能等问题,致该项技术仅为临床诊断解决了部分问题,尚有许多问题有待进一步解决。
一、常用标记抗体
用于软组织肿瘤可在石蜡切片表达的抗体已有多种,请参见表12-1。
表12-1 软组织细胞可用的标记抗体
| 抗原名称 | 标记细胞 |
| (1)角蛋白(Keratin) | 上皮与肌上皮细胞 |
| (2)波纹蛋(Vimentin) | 间叶分化细胞、内皮细胞 |
| (3)结蛋白(Desmin) | 肌组织分化细胞 |
| (4)肌动蛋白(Actin) | 肌细胞,肌上皮细胞,肌纤维 |
| (5)肌浆球蛋白(Myosin) | 肌母细胞,部分内皮细胞及肌细胞 |
| (6)层粘蛋白(Laminin) | 平滑肌与雪旺氏细胞,基底膜 |
| (7)纤维连接蛋白(Fibronectin) | 间叶细胞,纤维—组织细胞及滑膜细胞,间皮细胞 |
| (8)第VII因子(Factor VII rag) | 血管内皮细胞 |
| (9)肌球蛋白(Myoglobin) | 骨骼肌细胞 |
| (10)S—100蛋白(S—100protein) | 周围神经,朗格罕氏细胞,黑色素细胞、单核/巨噬细胞,淋巴结内的小结树突细胞。 |
| (11)髓鞘基质蛋白(Myelin basic protein) | 周围神经细胞 |
| (12)a—1 抗胰蛋白酶(α—Antitrypsin) | 组织细胞 |
| (13)a—1 抗糜蛋白酶(α—1Antichymotrypsin | 组织细胞 |
| (14)溶菌酶(Lysizyme) | 组织细胞、粒细胞、软骨细胞 |
| (15)酸性磷酸酶(Acid phosphatose) | 骨与软骨细胞 |
| (16)碱性碗酸酶(Alkaline phosphatase) | 骨与软骨细胞 |
上述各种抗原抗体标记效果一般与其被标记细胞含抗原量呈正相关。一般良性瘤与正常细胞的反应相一致。而恶性肿瘤由于分化差,标记反应与分化程度呈平行关系,分化很低者则可呈弱或阴性反应。例如Lysozyme与myosin在恶性肿瘤可不表达。要注意中间丝抗体在各种间叶细胞之间有交叉反应。尤其是波纹蛋白抗体更为广泛。赖日权等报告(1990年)发现128例上皮性肿瘤中有45例(35.1%)有波纹蛋白表达。因此告诫我们最好应用几种同功效抗体一起标记,并结合组织学改变综合分析,评价标记效果更为准确。
二、软组织肿瘤免疫组织化学
(一)纤维组织与纤维组织细胞性肿瘤免疫细胞化学标记
纤维组织肿瘤缺少专一性抗体标记。特别分化较低的纤维肉瘤,一般应用Masson或Van Gieson染色,再用肌源性抗体等排除法来确诊,对双向分化的恶性纤维组织细胞瘤,应采用纤维与组织细胞两种标记抗体。即可应用Vimentin和抗胰蛋白酶或抗糜蛋白酶抗体标记取得满意的结果,如果是多形性恶性纤维组织细胞瘤常与多形性脂肪肉瘤及多形性横纹肌肉瘤相混,鉴别困难时,则应辅以肌球蛋白等抗体进行区别。
(二)肌源性肿瘤的免疫细胞化学标记
1.平滑肌肿瘤平滑肌肿瘤在HE染色组织学改变可与纤维性,神经纤维性及纤维组织细胞肿瘤相混淆。目前缺乏对平滑肌的专一性抗体,只有采用间接排除法。肌动蛋白,肌浆球蛋白及结蛋白对平滑肌肿瘤标记强阳性,而组织细胞阴性。加上肌球蛋白和S—100蛋白表达阴性则排除了纤维组织细胞瘤和神经源以及横纹肌肿瘤。层粘蛋白可在平滑肌和雪旺氏细胞肿瘤阳性表达,可用此区别纤维性肿瘤。
2.骨骼肌肿瘤多形性横纹肌肉瘤如果能找到有横纹的带状肌母细胞,比较易于确诊,但有时找不到带状肌母细胞,易与多形性恶性纤维组织细胞瘤混淆。小细胞性胚胎性横纹肌肉瘤则与软组织恶性淋巴瘤,尤文氏肉瘤,周围性神经母细胞瘤难于鉴别。应用比较特异的肌球蛋白抗体就可识别。肌浆球蛋白和结蛋白抗体亦可作阳性标记,因为平滑肌肿瘤不可能是小细胞性,另外加用白细胞共同抗原(LCA)和S—100抗体则能排除淋巴瘤和神经母细胞瘤。在实际工作中要引起我们注意的是有时一些小细胞肉瘤浸润人横纹肌组织,在瘤细胞中混杂一些萎缩状横纹肌细胞,出现肌球蛋白抗体阳性,而不是横纹肌肉瘤。另外子宫内膜混合性Mulleriam肉瘤,Wilm’s瘤及恶性蝾螈瘤中出现横纹肌源瘤细胞,肌球蛋白抗体标记阳性,这对预后估计有帮助。Eusebi强调侵入骨骼肌的恶性上皮性细胞也可呈现肌球蛋白阳性表达,应特别注意。
(三)血管源肿瘤免疫细胞化学标记
1.血管内皮瘤与肉瘤第Ⅷ因子抗体对血管内皮细胞是很有用的标记物,尤其是良性血管瘤或血管内皮瘤。而在血管内皮肉瘤,肿瘤性内皮细胞分化低者可为弱阳性或阴性。最近有文献报道,波纹蛋白对内皮细胞也有良好的标记作用。阳性内皮细胞位于网状纤维包围之中也是血管肉瘤的一个形态学特点。
2.血管周边细胞肿瘤血管周边细胞是包被在血管基底膜之外,是一种多能干细胞。它可能产生的肿瘤有血管周边瘤或肉瘤,血管球瘤及Kaposi’s肉瘤。分述如下:
(1)血管周边细胞瘤或肉瘤:瘤细胞包绕在裂隙状血管之外周,周边细胞第Ⅷ因子阴性而瘤细胞之间富于纤维连接蛋白。但这些抗体是非特异性的,最好用多种抗体来排除其他肿瘤的可能性。
(2)血管球瘤:目前认为其增生的瘤细胞也可能来自血管周边细胞,在瘤细胞内外均显丰富的肌动蛋白和肌浆球蛋白。诊断时要注意发生部位及组织学特点。
(3)Kaposi’s肉瘤:至今该瘤的组织发生尚有争论。多数认为是血管内皮细胞发生,但其临床表现与发展过程有别于血管肉瘤。其由恶性短梭形细胞组成,间以许多间隙,内有红细胞,新近Guarda等报道梭形细胞第Ⅷ因子阳性,但也有阴性。有的作者认为该肿瘤来源于淋巴管内皮的可能性大于血管内皮。Barsky指出,应用抗基底膜抗体可以区别血管与淋巴管,后者缺乏。
(四)双向分化的软组织肿瘤免疫细胞化学标记
这里的双向分化是指有纤维性与上皮性两种瘤细胞为主构成的肿瘤。电镜观察证明肿瘤细胞包括未分化间叶细胞,上皮性细胞以及介于两者之间的中间细胞,这里讨论的双向分化肿瘤包括滑膜肉瘤,间皮肉瘤、上皮样肉瘤脑膜瘤或肉瘤的免疫细胞化学标记,现分述如下:
1.滑膜肉瘤滑膜肉瘤是由纤维型与上皮型两种细胞组成的双向分化肿瘤。分化高者上皮细胞呈腺样或裂隙排列,与纤维型瘤细胞分界清楚。而分化低者两型瘤细胞混染组成,分界不清。也有以某一成分占优势的单相滑膜肉瘤。应用纤维连接蛋白纤维型瘤细胞浆内阳性。有别于其他肉瘤细胞在细胞外阳性。波纹蛋白亦可阳性。上皮型成分细胞角蛋白阳性。组织细胞标记抗体阴性。纤维细胞型单相滑膜肉瘤应与纤维肉瘤及纤维母细胞性恶性纤维组织细胞鉴别,可用纤维连接蛋白来区别。另外再加用组织细胞与上皮性标记来辅助区别。
2.上皮样肉瘤该肿瘤的组织发生尚未完全肯定。但认为与滑膜肉瘤有相关性。在电镜上得到支持。它亦有纤维型和趋上皮分化倾向。瘤细胞呈结节 状排列,中央易见到坏死。免疫组化显示细胞内纤维连接蛋白、肌动蛋白及波纹蛋白阳性表达。
3.间皮瘤或肉瘤按WHO分类分为上皮型,纤维型及混合型。一般波纹蛋白对梭形细胞及部分上皮型细胞阳性表达。而细胞角蛋白对上皮型及部分梭形细胞阳性。
4.脑膜瘤与肉瘤良性脑膜瘤一般易于诊断,但恶性(间变型)脑膜瘤常规切片确诊比较困难、组织学类型有纤维肉瘤样型,血管肉瘤样型,巨细胞肉瘤样型等。电镜证实由未分化原始间叶细胞、中间型细胞、梭形细胞、巨细胞、上皮样细胞组成,具有双向分化的特点。潘传敬等对18例间变型脑膜瘤做多种抗体标记显示:一般良性脑膜瘤不同型瘤细胞对波纹蛋白、EMA、角蛋白及S—100蛋白均呈阳性反应。而在恶性脑膜瘤则未分化细胞全阴性。而中间型细胞则除S—100以外其余抗体可均阳性。梭形细胞波纹蛋白与S—100阳性。巨细胞与上皮细胞与中间型细胞反应相同。
(五)脂肪源肿瘤免疫细胞化学标记
脂肪肉瘤由脂母细胞和前母细胞组成,有高分化型,粘液型,圆细胞及多形细胞型,后两型与未分化肉瘤与多形性横纹肌肉瘤,恶性纤维组织细胞瘤很难区别。如果仅凭有无脂母细胞来确诊是不行的。因为“恶性纤维组织细胞”亦有脂肪染色阳性细胞。但脂肪肉瘤缺乏特异性免疫组化标记抗体。S—100蛋白对成熟脂细胞阳性,但脂肪肉瘤阴性。目前只有采用系列性抗体来排除多形性横纹肉瘤与恶性纤维组织细胞而确诊。
(六)外周神经肿瘤免疫细胞化学标记
恶性神经鞘瘤常与纤维肉瘤、低分化滑膜肉瘤相混淆。但应用S—100、NSE、髓鞘基质蛋白均为阳性标记物。外周神经母细胞瘤与软组织淋巴瘤、Ewing肉瘤等难于区别。但应用S—100蛋白标记可阳性。
(七)组织发生未定的软组织肿瘤
至今组织发生尚未完全肯定的软组织肿瘤有颗粒细胞瘤,腺泡状软组织肉瘤,尤文氏肉瘤,粘液样软骨肉瘤,腱鞘透明细胞肉瘤等。现分述如下:
1.颗粒细胞瘤其形态学比较明确、HE亦易于确诊。但其组织发生未定。过去认为它是肌源性的。但肌球蛋白阴性。而S—100、NSE为阳性表达。表明其可能是神经源性、Fisher用电镜也证明了这点。
2.腺泡状软组织肉瘤本肿瘤形态特点也较明确。当初有人认为来源于雪旺氏细胞。但S—100阴性。Fisher等认为是肌源性发生,因为电镜发现瘤细胞中有中间丝结蛋白与波纹蛋白。而Mukai持反对意见。认为这是非特异性的。免疫组化,肌球蛋白阴性。有人认为是非嗜铬性副节 瘤。
3.软组织尤文氏肉瘤本瘤由小细胞肉瘤细胞组成。它与腺泡状横纹肌肉瘤。神经母细胞瘤及转移性小细胞癌很相似。它缺乏特异性标记抗体。波纹蛋白阳性,表明它来源于间叶细胞。应用肌球蛋白,S—100及NSE标记阴性而其他三种肿瘤分别阳性。再加作糖元染色,瘤细胞胞浆阳性而确定诊断。
4.腱鞘透明细胞肉瘤该肿瘤与腱鞘关系密切,成团的胞浆透明的瘤细胞。由于瘤细胞中含有一些色素。因此认为可能来源于滑膜或黑色素细胞。新近Chung和Enziger研究发现,至少有2/3的病例,S—100蛋白与melamin标记阳性。故来源于黑色素细胞的可能性大于滑膜。EM下瘤细胞中可见到发育不良的黑色素小体。
5.骨外粘液样软骨瘤(脊索样肉瘤)这是一种十分罕见的病变。常见于下肢深部。组织学特点是成索与旋涡状排列的小圆形瘤细胞。衬有粘液样基质,可相似于恶性脊索瘤。免疫组化显示溶菌酶阳性,但S—100蛋白阴性。而真正的脊索瘤相反。其他标记全为阴性。
三、骨及软骨肿瘤免疫细胞化学标记
骨肿瘤种类繁多,大体上分为生骨性,软骨性,纤维性,纤维组织细胞性,破骨细胞性以及各种软组织、骨髓细胞、胚胎残余细胞产生的肿瘤等等。看来复杂,实际上骨组织是由成骨(骨软骨)性组织与一般间叶性细胞构成。后者与前述软组织肿瘤相一致。总体上看骨肿瘤是在间叶组织基础上的特殊性肿瘤。现重点将成骨,成软骨及破骨性肿瘤的免疫细胞化学标记予以讨论。
1.良性骨与软骨肿瘤它们存在诊断上的困难是低分化的骨与软骨肉瘤与间叶性血管外皮瘤,巨细胞瘤,“恶纤组”等不易区别。尤其是骨肉瘤有骨母细胞性,软骨母细胞性,成纤维细胞性,毛细血管扩张性及小细胞性,则免疫组化标记将发生重要作用。成骨肉瘤中有无骨样组织是与其他类似肉瘤鉴别的关键。目前骨样组织较特异的标记抗体有碱性或酸性磷酸酶、骨生长骨白(bone growth protein, BGP)、骨形成蛋白(bonemorphogenetic protein, BMP)等抗体。骨肉瘤中胃样组织阳性、其他软组织肉瘤阴性。Iwasaki等报告MGP标记33/35例骨肉瘤,12/15例软骨肉瘤阳性表达。其中软骨肉瘤BGP阳性例数与病理性分级呈正相关。而“恶纤组”与巨细胞瘤中的多核巨细胞为阴性。而骨肉瘤中的瘤巨细胞(12/25)与骨样组织阳性。高奉浔等报告BMP、波纹蛋白、肌动蛋白表达阳性对骨母细胞型骨肉瘤有诊断意义。BMP、Vimentin Actiu 及UEA-1 (荆豆凝集素)受体表达阳性对纤维母细胞型骨肉瘤有诊断价值。BMP、Vi-mentin 、Actin、UEA-1Ⅳ型胶原表达阳性对纤维母细胞型骨肉瘤有诊断价值。其中BMP对骨肿瘤有共同的特异性,而其他软组织肉瘤为阴性。软骨肉瘤基质S—100表达阳性。
2.骨巨细胞瘤目前研究认为破骨性多核巨细胞系由血源性单核细胞到骨组织内演变而成。因此它具有组织单核细胞的相同标记。而BMP与BGP表达阴性。其纤维型瘤细胞可有Vimentin 、Actin阳性表达。
第四节 免疫活性细胞及其肿瘤的免疫细胞学
免疫活性细胞组成人体免疫系统组织、器官,是维持人体内外环境稳定,消除体内外抗原性物质之危害,起着免疫监视作用,是当代重视和研究地十分深入的领域。免疫活性细胞主要包括淋巴细胞、单核/巨噬细胞及网状细胞等。它们产生的肿瘤—恶性淋巴瘤,是预后差的一类肿瘤,其形态与分型十分复杂。由于淋巴网状组织学及功能的特殊性等因各种抗原性刺激而引起的淋巴网状组织反应性增生(Reactive Hyperplasia, RH)、改变复杂,其与恶性淋巴瘤在组织学方面鉴别很困难,误诊率可达10%~30%,是临床病理诊断中的难题。由于免疫细胞化学,分子生物学的发展,已有可能利用单克隆抗体(McAb)或多克隆抗体(PcAb)和IgH,TCR(T细胞受体)基因重排检测技术,将免疫活性细胞及其肿瘤细胞的细胞系及分化期、亚型、淋巴瘤良、恶性进行鉴别诊断。免疫细胞化学技术简单易行,具有一定的特异性。且可在组织原位标记。并可用于印片或细胞悬液,配合流式细胞仪,提供更为精细的信息。目前市场供应的McAb 与PcAb可已有百种。国际统一称之为CD系列。已往还有OKT系列和Leu系列。但仍有不足的一面,所有抗体在特异性,表达率均有不足。而且在良、恶性的鉴别作用更是有限。
一、免疫活性细胞的免疫细胞化学
(一)B淋巴细胞
B淋巴细胞从骨髓干细胞到分化成熟称为非抗原依赖期。成熟B小淋巴细胞受到抗原刺激后可产生增殖衍化,演变成浆细胞合成分泌Ig。B淋巴细胞存在细胞表面Ig(SIg)及细胞内Ig(CIg)。人们利用SIg 与CIg作为抗原制成许多标记抗体。SIg标记只存在于次成熟的转化淋巴细胞。且多数为IgM·G,而幼稚的前B淋巴细胞与浆细胞缺乏SIg标记。目前较常用的SIg标记McAb有CD19,CD20,CD22,需冰冻切处新鲜组织,而L26则可用于石蜡切片。后又增加LN—1,LN-2,LN-3,MB-1,MB-2及4KB5等石蜡切片标记抗体。称它们为全B抗体。
Cig可分Ig重链包括IgM、Igg IgA、IgD、IgE5种,轻链λ、k两种,CIg标记抗体表达在愈成熟的B淋巴细胞,幼稚者则阴性。在不同部位组织其表达也不一致。如淋巴结生发中心B细胞表达IgD,而肠粘膜淋巴组织中的生发中心B淋巴细胞则表达IgA。上述IgH、L抗体在一些因素的影响下,真正表达率只有75%左右,而且如巨噬组织、R-S细胞等可以吸收血浆中的Ig而出现假阳性。
表12-2 介绍了淋巴细胞分化各阶段的部位、免疫表型和相关肿瘤,请参阅。
表12-2B淋巴细胞分化各阶段细胞的部位、免疫表型和相关肿瘤

(二)T淋巴细胞
由于T细胞表面存在羊红细胞受体(E-R),人们利用T细胞受体作抗原制成多种McAb,如CD2,T11,OKT11,Leu5等。发育不同阶段的T细胞ER数量及亲和力不同。未分化T细胞与前T细胞缺乏ER,但它可用TdT抗体标记。T淋巴细胞又分辅助T/诱导(TH/T1)志抑制T/毒性T(TS/TK)两大亚型。TH标记抗体有CD4等,TS标记抗体有CD8。上述几种抗体要新鲜组织冰冻切片。一般难于广泛使用。最近制出UCHL-1,MT-1Leu22(L60)等石蜡切片全T性标记抗体,其中UCHL-1已被广泛采用。新近又推出A6,MCA6,比UCHL-1效果要好。OPD4可用于石蜡切片TH标记。CD5,CD6等McAb特异性不足,可以标记少数B淋巴细胞,粒细胞等。
表12-3 介绍了T淋巴细胞分布及各阶段细胞的部位、免疫表型和相关肿瘤,请参阅。
表12-3 T淋巴细胞分化各阶段细胞的部位、免疫表型和相关肿瘤

表12-2、12-3引自全国第六届淋巴瘤学术会议论文汇编,恶性淋巴溜和白血病的免疫组织化学(综述)上海肿瘤医院,朱雄增。
(三)NK细胞/K细胞
目前认为NK细胞是一种自然杀伤细胞,它杀伤特异性细胞,事先无需致敏,亦无MHC限制的淋巴细胞。K细胞是指能介导ADCC(抗体依赖性毒性淋巴细胞)。过去曾认为NK细胞是胞浆中含有粗大溶酶体的颗粒性大细胞。现已证明它在分化成熟后才有这一特征。它的表面有高亲和力的IL-2受体,在IL-2刺激下可以增殖和表达细胞毒性。活性后的NK细胞还可表达HLA-DR抗原。NK细胞的标记特点是CD56,CD2ER,Igg FcR/C3R均阳性表达,而CD3,CD7,CD19阴性表达。后发现CD57,CD56也是较特异性McAb。对K细胞与NK细胞之间的关系尚有不同意见,但多数认为二者系由同一细胞介导。
(四)单核/巨噬细胞与网状细胞
单核/巨噬细胞不仅参与抗原的提呈和免疫调节 ,而且是具有特异和非特异吞噬异物功能的免疫活性细胞。单核细胞起源于骨髓干细胞,进入血流,当它到达组织则称组织细胞。在出现吞噬时则称巨噬细胞。它分布于不同组织,如枯否氏细胞,肺泡巨噬细胞,腹腔巨噬细胞,脑小胶质细胞,甚至破骨细胞等,这类细胞统称为单核/巨噬细胞系统。不同组织的巨噬细胞其生物学特性亦有差异。应用的标记抗体有抗溶菌酶(lys),抗α1-胰蛋白酶(AAT),抗α1-糜蛋白酶(ACT)抗体均可用于石蜡切片标记。其中lys抗体反应较弱,敏感度不足。新近又推出Mac387,KP1标记抗体、效果十分满意。另外还有CD116,CD64,CD32等FCR抗体,需冰冻切片。
网状细胞,过去认为它是组织细胞同类细胞。但已证明它是固定于淋巴网状组织的一类无吞噬功能,但可传递抗原信息、调节 免疫功能。其细胞发生尚有争议。其中包括生发中心树突网状细胞(DRC),指突状网状细胞(IRC),在髓质淋巴窦附近的纤维母细胞网状细胞以及主要分布在皮肤表皮的朗格罕氏细胞(Langerhan’s cell)等。这类细胞均有类似巨噬细胞的HLA-DR抗原表达,但较弱。它们可对S—100蛋白阳性表达,是与巨噬细胞不同之点。
二、恶性淋巴瘤的免疫细胞化学标记
恶性淋巴瘤总的可分为非何杰金淋巴瘤(NHL)与何杰金氏病两大部分。NHL的免疫功能分类繁多。总体上各类型的瘤细胞的免疫细胞化学标记与相应的正常细胞标记相一致。但是由于瘤细胞的基因有变异,分化不正常,其抗原性也发生变化。因此瘤细胞比相应正常细胞的表达要弱或丧失。在此不分型描述,而从应用角度分为下列三方面进行讨论:
(一)恶性淋巴瘤与淋巴网状组织反应性增生的鉴别诊断
组织学鉴别,在早期滤泡内型滤泡型淋巴瘤与淋巴滤泡瘤样增生、高分化的NHL与RH及假阳性淋巴瘤鉴别方面存在相当的困难。必需借于其他有效技术方法。但免疫细胞化学标记有一定限制性。其中B淋巴瘤与RH鉴别中可以应用IgH和或Igl 标记,及有75%左右的恶性淋巴瘤为IgH和/或IgL单项阳性,即为单克隆性增生,相反如为2项以上阳性为多克隆性RH,但有时少数淋巴瘤可出现双克隆性,这方面应严格排除其他因素引起的假阳性和假阴性,故仍需紧密结合组织学改变。T淋巴瘤则缺乏单克隆性标记抗体,在应用全T性抗体标记出现单一性或高度优势标记,再结合组织学改变可以辅助识别良、恶性。新近报告富于T细胞的B淋巴瘤或富于B细胞的T淋巴瘤(在瘤细胞间伴有大量反应性成熟T或B淋巴细胞),这与良性反应性增生更为困难。若瘤细胞体积增大,出现T或B单一性标记,而反应性淋巴细胞呈现T、B及组织细胞混杂标记,则有助于良恶性炎鉴别,另外可加用PCNA(增殖细胞核抗原)或Ki—67标记,则瘤细胞一般为阳性。
(二)恶性淋巴瘤与非淋巴瘤网状组织肿瘤的鉴别
目前有较多的报告淋巴结外组织未分小细胞癌或网瘤,常规切片很难与恶性淋巴瘤区别,小细胞肉瘤有胚胎性横纹肌肉瘤、外周性神经母细胞瘤,Ewing’s肉瘤,Merkel细胞癌以及无色素性恶性黑色素瘤。应用免疫组化有较好的鉴别作用。首先应根据HE组织学改变,一般特殊组织化学染色初步确定某一类肿瘤的可能。再从总体上先作LCA(白细胞共同抗原)与EMA(上皮膜抗原)免疫细胞化学标记。确定是淋巴瘤还是未分瘤。如果两者均阴性则应加作其他淋巴瘤抗体标记。因为LCA抗体在浆细胞瘤,T淋巴母细胞淋巴瘤及何杰金氏病R—R细胞不表达。上述标记全阴性,则应作Vimentin标记,如为阳性,则为间叶组织源。再用肌球蛋白标记阳性为胚胎性横纹肌肉瘤。作糖元染色阳性为Ewing肉瘤,NSE阳性为Merkel细胞或肺小细胞癌,S—100阳性为神经母细胞瘤。
(三)恶性淋巴瘤的免疫细胞分型
淋巴瘤分型对病人预后的估计,临床治疗有指导性意义。但这不如良恶性鉴别重要。在日常外检中进行淋巴瘤分型,应挑选针对性强、特异性高、使用方便的标记抗体。如有条件的单位以新鲜组织冰冻切片标记、阳性率高。一般单位病理科则选用石蜡切片标记抗体。目前比较常用而效果稳定的石蜡切片标记抗体有L26(全B,除浆细胞瘤)UCL1(全T )KP1或Mac387组织细胞标记。T淋巴瘤应用CD4与CD8标记区别辅助T或抑制T。
以上为NHL标记分型。关于HD的R-S细胞标记。R—s 细胞的发生组织细胞至今尚未完全肯定、R—S细胞标记抗体最先应用LeuM1(CD15)抗体,它对HD—LPL—H型R—S细胞不标记。且对粒细胞、T细胞、单核/巨噬细胞,甚至上皮细胞也阳性。最近由体外培养的R—S细胞提取抗原制成的Ki-1McAb、对所有类型的R—S细胞均为阳性表达。但对活化的T或B淋巴细胞亦阳性。且需作冰冻切片染色。而可在石蜡切片表达的Ber—H2抗体问世,就解决了困难问题。
(四)在恶性淋巴瘤免疫表型分析中的注意事项
为了正确应用免疫细胞化学标记手段在恶性淋巴瘤诊断,分型等方面发挥更大的作用应注意下列问题:①免疫细胞化学在恶性淋巴瘤分析中应紧密结合组织学改变,有目的地选用高效、广谱的抗体,淋巴瘤常用标记抗体见表12-4。因为免疫细胞化学的结果受到多种因素的影响,可以出现假阳性或假阴性;②为了避免因抗体标记的局限性而造成漏诊,有条件的单位最好一次用同功能的几种抗体,这样可以起来抗体间的反应互补性,往往比单项抗体的标记率高;③标本固定要及时,应用中性福尔马林液或B5固定液,则抗原保存要好一些。尽可能应用低压,低温(60℃以下)浸蜡,减少抗原的破坏丢失;④抗体的浓度要适当,消除背景染色。加用二甲砷酸钠可除去背景着色。特别膜标记阳性时与背景着色很难区分。前者包绕细胞呈环状;⑤每次染色应有阳性对照和阴性对照;⑥目前淋巴瘤的基因重排检测技术已经建立。特别是多聚酶链反应(PCR)扩增技术的应用,提供了特异(无假阳性),敏感(可检测出1/100万瘤细胞)快速(当天可出报告)的淋巴瘤检测手段。作者科室已建立了该项技术。虽然其设备条件要求比较高。可作为疑难、早期、化疗后残留病灶病例的确诊。
表12-4 淋巴瘤常用标记抗体
| CD | 常用名称 | 抗原 | |
| 分子量(kD) | 反应细胞 | ||
| CD1 | T6,OKT6,Leu6 | 45 | 胸腺细胞/Langerhans细胞 |
| CD2 | T11,OKT11,Leu5 | 50 | 全T(E花结受体) |
| CD3 | T3,OKT3,Leu4 | 19~29 | 全T(T受体相关) |
| CD4 | T4,OKT4,Leu3 | 55 | T辅助(NHc II类) |
| CD5 | T1,OKT4,Leu1 | 67 | 全T,偶B |
| CD6 | T12,TU33 | 120 | 全T,偶B |
| CD7 | CDLeu9,TU14,EA1※ | 41 | 全T |
| CD8 | T8,OKT8,Leu2 | 32 | T抑制(TMHc I类) |
| CD9 | J2,BA2 | 24 | T,B,髓细胞 |
| CD10 | J5,BA3,ViLA1 | 100 | 前,B前,生发中心(CALLA) |
| CD11 | MO1,E11,MY8 | 94~155 | 髓细胞,单核细胞 |
| CD13 | MY7(MCS—2 ) | 160 | 髓细胞,单核细胞 |
| CD14 | Mo2,MY4,UCHM1 | 55 | 髓细胞,单核细胞 |
| CD15 | LeuM1※,,anti X-Hapten | - | 粒细胞,单核细胞,R-S细胞,上皮细胞 |
| CD19 | B4 | 95 | 全B(不包括浆细胞) |
| CD20 | B1 | 35 | 全B(不包括浆细胞) |
| CD21 | B2 | 145 | 生发中心,套区和周围血B滤泡树突细胞 |
| CD22 | Leu14(To15),SHCL1 | 135 | 全B |
| CD23 | TU1,Blast2 | 45 | 套区,?生发中心B,不包括周围血 |
| CD24 | BA1 | 45,55,65 | 全B,粒细胞,浆细胞 |
| CD25 | TAC | 55 | 活化T和B(IL2受体) |
| CD30 | Ki—1 | 90~110 | R-S细胞,活化T和B |
| CD33 | MX9 | 67 | 髓细胞,单核细胞 |
| CD34 | MY10,3C5 | 115 | 成髓细胞 |
| CD45 | LCA※,T29/33, PD7/26 | 220 | 白血细胞共同抗原(T,B,M) |
| CD45R | UCHL1※ | 全T | |
| X4KB5※ | 全B | ||
| - | TdT※ | - | 前B和前T,皮质胸腺细胞 |
| - | L26※ | 全B | |
| - | HLA—DR (Ia-Like) | - | 全B(不包括浆细胞)活化T(MHc II 类) |
※可用石蜡切片标记的McAb
第五节 上皮组织肿瘤免疫细胞化学
上皮组织来源的肿瘤是人类最常见的肿瘤。病理组织学上具有上皮特征的高分化肿瘤,一般不需要免疫标记即可明确其上皮性质。但对本质上为上皮组织来源而病理组织学上为低分化的肿瘤,仅靠病理组织学特征有时难以明确其起源,此时即有必要进行免疫标记。这一问题的解决包括以下三方面的含义:一是明确一个低分化肿瘤(不论原发生或转移性)究竟是否上皮组织来源;二是如果是上此组织来源的肿瘤,空间是来自什么器官,尤其是对转移性者;三是有些肿瘤虽然不是上皮组织来源,但由于它们能表达上皮性肿瘤的某些标记物,因此在鉴别诊断中有重要意义,本节 也作扼要介绍。
为了达到上述目的,得到具有良好特异性的上皮组织肿瘤标记物是关键的环。简言之,这种良好的特异性应当体现在下述两个方面:一是有的标记物能够成功地区分上皮组织(肿瘤)与其它组织,换言之,它们具有上皮组织特异性这一共性作用;二是有的标记物能成功地识别某一器官的上皮组织,构成了器官特异性免疫标记物。目前,对明确上皮组织起源这一目的而言,角蛋白仍是最可靠的标记物,较其它中间丝更具有诊断价值。因此,出于在肿瘤病理学诊断中实际应用的目的,本节 将重点介绍角蛋白在上皮组织肿瘤免疫细胞化学诊断中的有关问题,对某些器官特异性标记物和近年报道的新的上皮组织肿瘤标记物也作扼要介绍。
一、角蛋白
关于角蛋白(Keratin)的分子生物学特性本节 不作详述。考虑到临床病理工作的实际需要,只作扼要介绍。角蛋白是位于细胞内的多基因编码的非水溶性纤维性多肽,它存在于每种上皮细胞之中。到目前,已知人类上皮组织含有19(或更多)角蛋白分子,其中角蛋白I与最轻者(67kD)相对应。而角蛋白19与最轻者(40KD)相对应。其中亚型2~10被任何上皮所表达,但取决于细胞类型、胚胎发育阶段、细胞分化程度等因素。而最小分子的角蛋白(40kD)是单层上皮的特征,并且是在胚胎时期首先出现的,在肿瘤性上皮细胞中则常常出现。大分子量角蛋白可能是从简单的低分子量角蛋白进化而来。根据角蛋白的等电点、酸碱性及分子量大小,又可分为A(acidic)和B(basic)两大亚族。
(一)角蛋白抗体及其在肿瘤病理学中的应用
针对角蛋白家族不同成员的多克隆抗血清的敏感性和特异性存在着广泛的差异,很多商品化的抗血清对大分子角蛋白尤为敏感,因此在外科病理学中的诊断价值受到限制。相反,角蛋白的单克隆抗体较多克隆者,在敏感性和特异性方面都有许多优点,并且现在已可获得商品化的单一或混合抗体。角蛋白的单克隆抗体大体上可分为两组:一是广反应组(broadly reac-tive group),它能识别角蛋白家族中许多成员所共有的表位;另一是选择组,它仅识别少数角蛋白成员甚至某一种角蛋白。其中,识别小分子量角蛋白18和19的单克隆抗体在病理诊断中最为有用。
1.广特异性角蛋白单克隆抗体这组单克隆抗体对识别上皮细胞尤其是肿瘤细胞具有高的敏感和特异性。这些抗体包括AE1,AE3,CAM—5.235BHll,UCD/PR10.11c 以及KA4。这些单克隆抗体可以优先识别存在于A和B亚族中的小分子量角蛋白的表位。其中,AE1在不同的固定和染色条件下对角蛋白显示了很高的敏感性和广泛的特异性。因此,特别适合用于区分分化差的癌和非上皮性肿瘤。而CAM-5.2对识别神经内分泌癌优于AE1,这是因为CAM—5.2,UCD/PR10.11和35BH11以其各自理想浓度混合即可。另外,目前已有针对小分子量角蛋白的商品化的单克隆抗体混合物可供选择(MAK—6和AE1/AE3)。这些试剂对鉴别上皮组织肿瘤具有广特异性和很高的敏感性。①广特异性角蛋白单克隆抗体在正常组织的染色。用上述抗体在多数正常的上皮细胞可以获得很强的染色效果,但也存在一些差异。AE1和KA4对皮肤和附件上皮、非角化性复层上皮、单层上皮(如胃肠道等)、泌尿系上皮、分泌性腺体的管道、间皮、乳腺和胸腺上皮可以有很强的染色,但不染正常的肝细胞、唾液腺和胰腺腺泡细胞以及肾小管上皮细胞。这些细胞优先表达角蛋白18,不能被AE1和KA4所识别。相反,CAM—5.2则能识别角蛋白18,可染肝细胞,腺泡细胞和肾小管上皮细胞,但不能染正常的表皮细胞。而AE3单抗不论在冰冻切片,还是在酒精固定、石蜡包埋的切片上,都可以染所有正常的上皮细胞,但在福尔马林固定的组织阳性比例下降。因此,AE3可望成为识别所有角蛋白作为上皮组织起源的通用探针。②广特异性角蛋白单克隆抗体对肿瘤的染色。如前所述,虽然AE1和KA4对正常肝细胞和肾小管上皮细胞呈阴性染色结果,但很多肝细胞肝癌和肾癌却可微弱或局灶性表达它们识别的表位,这可能是肿瘤转化过程中抗原改变所致。角蛋白类型的变异表达在非肿瘤性病变的肝细胞中亦可出现。已经证明,Mallory 小体即是由在正常肝细胞所不能测出的角蛋白所组成,AE1和KA4对可将其染为阳性。
应当指出的是,广反应性角蛋白单克隆抗体与上皮组织肿瘤不起反应,但在上皮样肉瘤和滑膜肉瘤例外。另一个中胚层来源的肿瘤即间皮瘤,仅约有1%的病例可表达上皮特征。
2.广特异性角蛋白单克隆抗体在诊断中的应用
(1)未分化癌。使用上述抗体可以成功区分未分化癌与大细胞淋巴瘤和无黑色素性黑色素瘤。此时,最好同时使用黑色素瘤和白细胞标记物以避免阴性结果。同时,为了达到对未分化肿瘤精确诊断的目的,最好使用一组单克隆抗体,包括波形蛋白、白细胞共同抗原(LCA)、S—100以及黑色素瘤特异性抗原HMB—45的单克隆或多克隆抗体。值得指出的是,约有10%的大细胞淋巴瘤会因福尔马林固定而不能染出LCA,尤其是固定时间过长时,这在应用免疫细胞化学鉴别诊断时应当考虑。
(2)腺癌。所有腺癌,不论其细胞起源如何,均可表达用广反应性角蛋白单克隆抗体易于测出角蛋白。因此,上述抗体甚至可作为识别某些腺癌微转移灶,在正常时不含角蛋白的器官或组织,如淋巴结和骨髓中,甚至易于识别出单个转移性肿瘤细胞。
(3)胸腺瘤。当活检标本很小时,鉴别发生于纵膈的胸腺瘤和淋巴瘤有时相当困难。这种情况下,使用广反应性角蛋白单克隆抗体可以明确肿瘤细胞的上皮性质。在胸腺瘤,即便是淋巴细胞为主型,免疫细胞化学染色亦可揭示均匀分布于肿瘤之中的大量含有角蛋白的细胞。相反,累及胸腺的淋巴瘤为阴性结果,但偶可发现残存的胸腺组织灶。
(4)生殖细胞肿瘤。所有生殖细胞肿瘤,除精原细胞瘤外,均表达角蛋白。因此,在病理工作中遇到难以鉴别的间变性精原细胞瘤胚胎性癌时,使用广反应角蛋白单克隆抗体是有帮助的。因在胚胎性癌,总会有些肿瘤细胞表达角蛋白。在典型的精原细胞瘤,有时虽然可看到含有角蛋白的滋养层型细胞,但这种机会是很偶然的。
(5)梭形细胞癌。梭形细胞癌常见于皮肤,但在很多其它上皮组织器官亦可见到。梭形细胞癌组织像与梭形细胞黑色素瘤或非典型纤维黄色瘤等有时是难以区分的,是皮肤活检鉴别诊断中常常碰到的问题。使用广反应性角蛋白单隆抗体能够解决这一问题,特别联合使用其它抗体,如S100等,更为可靠。当然,由于上皮细胞向间叶样细胞表型的转移可能伴随角蛋白表达的下降或消失、致使某些梭形细胞癌仅可局灶性表达角蛋白,甚至有时用免疫细胞化学方法不能检测出来。因此,遇到难以诊断的皮下梭形细胞肿瘤时,当角蛋白阴性、S100与波形蛋白阳性时,宜诊断为黑色素瘤;而只有角蛋白阳性时,才可诊断为梭形细胞癌;当角蛋白和S100均阴性、而波形蛋白阳性时,诊断为非典型纤维黄色瘤。
(6)滑膜肉瘤和上皮样肉瘤。一般认为,这两种肿瘤乃起源于间叶组织的肿瘤,但能表达角蛋白。这一特征在与具有相似形态的其它肿瘤鉴别诊断中很有帮助。单相性滑膜肉瘤常需与纤维肉瘤、恶性神经鞘瘤及其它一些梭形细胞肿瘤鉴别,而单相性滑膜肉瘤时常有广反应性角蛋白的局灶性阳性表达,其它肿瘤则为阴性表达。上皮样肉瘤有时可误诊为透明细胞肉瘤、横纹肌肉瘤、甚至炎性肉芽肿。上皮样肉瘤表达角蛋白的特征,具有鉴别诊断价值,由于后三者并不表达角蛋白。
(7)脊索瘤。在某些情况下,难以区分脊索瘤与高度恶性的软骨肉瘤。由于前者表达角蛋白而后者不表达,这一问题即可得以解决。
(8)神经内分泌癌。神经内分泌癌包括雀麦细胞癌,可表达低分子角蛋白,但在雀麦细胞癌的表达可为局灶性的。因此,如果没有足够标本,则难以得到证实。皮肤的Merkel细胞癌有时与淋巴瘤难以区分,但Merkel细胞癌强表达角蛋白,并且其表达方式常常具有一定的特征性,即角蛋白分布呈包涵体样阳性,这种特性阳性表达形式在其它神经内分泌肿瘤亦常可见到,但在未分化小细胞癌则难见到。
(9)间皮瘤。文献报道,所有的间皮瘤包括上皮样型,混合型和肉瘤型都可广反应性角蛋白单克隆抗体有强反应。由于间皮瘤与多数腺癌对角蛋白的表达强度与在胞浆中的分布相似,因此,上述抗体对区分两者没有帮助。但是,使用不同表型角蛋白的抗体,可能对区分两者有一定价值。当然,通过使用针对其它非中间丝抗体在上述鉴别诊断中也会有所帮助。
3.有限特异性的角蛋白单克隆抗体本组抗体能通过对富含细胞骨架标本的凝胶电泳免疫反应,识别非共有的角蛋白表位,但并不一定说明这些单克隆抗体能通过组织学方法成功测定角蛋白的免疫表型。因而还不能肯定这些单克隆抗体对上皮组织肿瘤的进一步分类具有价值,这里不作一一介绍。但是,对已明确知道其免疫反应类型的某些抗体,则可予以使用。比如,对不能识别角蛋白18的单克隆抗体,如AE1特别适合在富含角蛋白18的组织(如肝脏)中弄清是否存在肿瘤性上皮细胞,因为只有肿瘤细胞才能被染色。又如CAM—5.2能够识别绝大多数腺癌。但不能染正常表皮,因此对佩吉特氏病(Paget’s)具有诊断价值。
(二)有关方法学应注意的问题
1.抗体的选择实践证明,角蛋白单克隆抗体较异源性抗血清有更多优点。但应该注意,有些单克隆抗体对大分子角蛋白具有特异性,然而组织固定能破坏其表位。大多数针对小分子角蛋白的单克隆抗体比异源性抗血清显示了高敏感性和特异性。
关于对照问题,参见有关章 节 ,这里只作扼要介绍。如同每个免疫细胞化学试验一样,角蛋白的免疫细胞化学研究也必须设计适宜的组织对照和抗体对照。组织对照包含以下三方面内容:一是应当应用明确不表达角蛋白的组织作为理想的阴性对照,如纤维母细胞、血管和淋巴细胞。这一目的在同一组织切片上即可达到,并且不会受到因重取标本时固定或处理过程不同等因素的影响;二是在某些标本中,残存的正常上皮组织可能作为阳性对照。此外,可以设计含有多种肿瘤或正常组织的石蜡包埋的组织块,亦可达到一举多得的目的。抗体对照时,一般应当采用与第一抗体同免疫球蛋白、同浓度的无关单克隆抗体作替代试验。
2.交叉反应问题由于中间丝有很多分子同源现象的共有区域,因此有些抗血清甚至单克隆抗体表现了对其它中间丝的反应性,但仍以异源性抗血清多见。在与角蛋白有关的交叉反应中,已经注意到有些上皮性肿瘤可以同时表达角蛋白和波形蛋白。但未分化癌的这种表达却十分罕见,即使见到,广反应性角蛋白的阳性反应远比波形蛋白强得多。此外,尚有个别角蛋白单克隆抗体,如KA4,偶可与神经胶质原纤维酸性蛋白(glialfibrillary acidic protein, GFAP)有交叉反应。由于肿瘤恶性转化中某些无关抗原的异常合成,也要予以考虑。总之,避免交叉反应所致的错误,诊断或鉴别时最好使用一组有关抗体,而不是仅用一个抗体。
3.显示角蛋白固定剂的选择与蛋白酶消化福尔马林固定有时可以破坏或遮蔽角蛋白的抗原决定簇。实践证明,酒精固定对保存角蛋白的抗原性优于甲醛固定,且不必消化。用蛋白酶消化以暴露其抗原决定簇,能提高免疫细胞化学的敏感性,但对某些肿瘤却有增加与其它中间丝的交叉反应的可能性。与消化有关的其它具体方法问题请见有关章 节 。
二、器官特异性及其它瘤标记物
如前所述,若我们把角蛋白视为上皮性肿瘤的共性免疫标记物,则对不同器官的上皮性肿瘤具有特别或优先识别作用的标记物,可看作为器官特异性或相对特异性标记物。经过长期实践的检验,一些上皮器官特异性标记物已为人们所接受。此外,也发出了一些效果较肯定、特异性较好、诊断作用较明确的新的标记物。现将其生物化学本质、肿瘤表达情况及诊断应用附表如下(表12-5),并将其在上皮组织肿瘤病理诊断中的作用分别予以扼要介绍。此外,考虑到对某些肿瘤标记物的生物化学性质及叙述的方便,对少数具有上皮广谱性的标记物也在此介绍。
表12-5 其它常用的上皮性肿瘤标记物
| 生物化学组成 | 标记物名称 | 相关肿瘤 |
| 糖蛋白 | CEA | 结肠癌,乳腺癌等 |
| AFP | 肝细胞癌,生殖细胞肿瘤 | |
| EMA | 上皮性肿瘤等 | |
| PSA | 前列腺癌 | |
| 粘蛋白 | CA15-3 | 乳腺癌 |
| CA125 | 卵巢癌 | |
| CA19-9 | 胰腺癌等 | |
| CA50 | ||
| 酶 | PAP | 前列腺癌 |
| NSE | 神经内分泌癌 | |
| 激素及有关物质 | TG | 甲状腺腺癌 |
| 降钙素 | 甲状腺髓样癌 |
※:标记物名称英文缩写及中文全名参见本节 有关部分。
(一)上皮膜抗原
上皮膜抗原(epithelial membrane antigen,EMA)是从人乳脂小球膜(human milkfat globules)上分离的糖蛋白的总称。针对此种抗原的抗体除了包括EMA抗体外,HMFC--2和CA15--3也属于该家族之中。EMA免疫细胞化学定位主要在细胞膜上,故得此名。EMA在Zenker、Bouin或B5等固定液中保存良好,在10%缓冲中性福尔马林溶液、石蜡包埋的组织中也能很好地被检出。常规福尔马林溶液固定的标本,经消化后也可满意检出。
EMA广泛分布于各种类型的正常上皮。虽然发生肿瘤时EMA的含量增加,其分布与正常上皮的分布也有所不同,但因在炎性或良性增生性病变时的含量也增加,因而借此不能或难以达到区分良恶性肿瘤的目的。但因EMA常存在于分化差的和未分化的肿瘤,一般不见于间叶组织肿瘤,所以它可作为上皮性分化的可靠标记物。应该说,也是一种上皮组织的共性标记物。因此,除腺癌,鳞状细胞癌及移行细胞癌均可表达MEA外,其它具有上皮分化的肿瘤,如滑膜肉瘤、上皮样肉瘤、间皮瘤及上皮型脑膜瘤等亦EMA表达。此外,在某些特殊类型的恶性淋巴瘤,也可有EMA表达,在鉴别诊断时应特别注意。至于HMFG-2和CA15-3,一般认为前者可做为乳腺癌的良好标记物,后者则不能,因在其它肿瘤也有表达,故不具有诊断价值,但对判断乳腺癌预后可能有所帮助。
(二)桥粒蛋白
最初,桥粒蛋白(Desmoplakins)是从牛鼻表皮细胞分离出的大分子蛋白质。目前主要有6种大分子蛋白成份与桥粒有关,其中,两种分子量分别为250000和215000者,称作Desmo-plakinⅠ、Ⅱ,尚有多肽带5(polypeptide band 5)和三种糖基化多肽(多肽带3和4a、4b),前三者定位于桥粒区。DesmoplakinⅠ和多肽带5存在于所有形成桥的上皮,Desmoplakin Ⅱ仅存在于复层上皮。目前已有商品化抗体可供使用。
与角蛋白抗体相比,桥粒蛋白抗体有一定优越性。一是因为它们表现出分布于细胞外周的特殊免疫染色类型,尤其在显示角蛋白等胞浆蛋白成份的信号较弱时,易于与其它反应背景相区别;二是desmoplakins在脊椎动物进化中具有相似的高度稳定性,而不像细胞角蛋白是一个多基因调控的大家族,对不同上皮、不同类型癌有着不同的表达。所以,Desmoplakins 对确定上皮本质是可靠的标记物。在肿瘤鉴别诊断中除绝大多数癌阳性表达外,各类型脑膜瘤及卵巢颗粒细胞瘤等也可表达桥粒蛋白。在正常组织的表达此外不作介绍。
(三)癌胚抗原
癌胚抗原(carcinoembryonic antigen, CEA)是人们熟悉的肿瘤标记物之一。最早是从结肠癌中分离的一种糖蛋白,分子量为180~200lkD,存在于细胞膜上,故易于脱入人体液之中。因此,临床上常常测定血清中的CEA水平帮助建立肠癌的诊断。但应该指出的是,随着大量资料的积累,已发现很多非恶性病亦可有血浆CEA水平的升高,包括肝脏、消化道、乳腺、肺及肾脏等器官的良性疾病,甚至吸烟亦可引起CEA的升高。因此,对于建立恶性肿瘤的诊断,只在参考价值。并且,在已明确的恶性肿瘤之中,CEA的升高也不仅限于结肠直肠癌,在很多其它肿瘤,如肺癌、胰腺癌、肝癌、胆管癌、甲状腺癌、宫颈癌及乳腺癌等都有CEA的升高。总的来说,CEA可以做为上皮性肿瘤的标记物,而不是某一种癌瘤的特异性标记物。
(四)甲胎蛋白
甲胎蛋白(Alpha-fetoprotein, AFP)是含有一条多肽链、分子量为70kD的糖蛋白。因在早期脐带血中被检出而得名。如CEA一样,AFP也是研究得最为充分的肿瘤标记物之一,在筛选高危肝细胞癌患者中已经得到了成功的应用。然而,AFP的升高并不只是原发性肝细胞癌所特有,也可见于生殖细胞肿瘤,以卵黄囊恶性肿瘤和睾丸胚胎性癌最多见。同时还应指出,在10~35%的非恶性肝脏疾病中,如肝硬变和肝炎,也可有轻到中度AFP升高。免疫细胞化学研究发现,AFP是一种胞浆抗原,在细胞内的分布可表现为胞浆、包膜型、核周型或局限型,主要存在于中等分化的肝细胞肝癌。在肝母细胞瘤中也经常出现,但在胆管细胞癌中未能检出AFP。因此,对区别肝细胞癌和胆管细胞癌有重要作用。
(五)前列腺特异性抗原和前列腺酸性磷酸酯酶
前列腺特异性抗原(Prostate-specificantigen,PSA)是由前列腺腺泡和导管上皮细胞产生的、分子量为33~34kD的一种糖蛋白,对正常、良性病变和前列腺癌组织均具有特异性。前列腺酸性磷酸酯酶(Prostateacid phosphatase, PAP )是前列腺分泌的正常成份,具有水解酶的功能。PAP的升高与前列腺癌的分期有关。它不仅出现于前列腺癌,在其它组织也可出现,因此,PAP作为前列腺癌的肿瘤标记物的作用是有限的。PSA的免疫细胞化学研究表明,PSA抗体可以成功应用于福尔马林固定、石蜡包埋的组织中。阳性反应位于上皮细胞的胞浆内,且在核周较强。但阳性反应的强度可随细胞与细胞、区域与区域以及原发性与转移性前列腺癌而不同。文献报道,对较多原发性和继发性前列腺癌病例以及非前列腺癌的研究发现,前两者都明确表达PSA,而后者无1例PSA阳性。鉴于此,PSA不仅能用于前列腺低分化腺癌的诊断而且对明确其它器官或部位的转移性前列腺癌也具有十分重要的作用。此外,鉴于前列腺和膀胱在解剖学上的密切关系,PSA对区分波及两个器官的肿瘤来源也和很有帮助。鉴于此上理由,PSA是比PAP更为优越的前列腺器官特异性肿瘤标记物也是目前公认的肿瘤特特性标记物之一。
(六)CA19-9及CA50
CA19-9是由结肠癌细胞株免疫小鼠所获的单克隆抗体的识别抗原。此种抗原是表达于癌细胞膜和胚胎性胃肠道上皮组织的糖脂和粘液成份。与CA-19-9有关的另一粘蛋白是CA50,其抗原表达谱与CA19-9相似。血清中CA19-9的升高可见于多种肿瘤,如胆道癌、胃、结肠与直肠癌,但升高幅度最大、机率最多的是胰腺癌。然而遗憾的是,在急慢性胰腺炎及其它良性病变也可有明显升高。
(七)CA125
CA125是从卵巢浆液性囊腺癌细胞株所获的抗原。分子量约500kD,表达于胚胎性体腔上皮组织。免疫细胞化学研究表明,CA125抗体能与80%以上的卵巢上皮性肿瘤起反应,但在非妇科肿瘤甚至某些正常组织,如胰腺,也能反应。血清CA125不仅在其它恶性肿瘤,如子宫癌、乳腺癌、肝癌、肺癌及胰腺癌等可以升高,而且在消化道、妇科的良性疾病也有升高。因此,CA125不能作为满意的肿瘤筛选工具。但是,CA125对判断卵巢癌的分期、进展或消退有较大的指导作用。
(八)神经元特异性烯醇化酶
烯醇化酶催化2-磷酸甘油酸与磷酸烯醇式丙酮酸转化的糖酵解酶。它有三种同工酶形式。其中α和β分别于脑和肌肉细胞。而γ烯醇化酶,即NSE,主要在神经元,与恶性肿瘤有关。在上皮恶性肿瘤中,血清NSE的升高主要见于小细胞肺癌、胰岛细胞癌,并与部分小细胞肺癌的进展有关。此外,NSE在其它上皮性神经内分泌肿瘤,如皮肤Merkel细胞癌、甲状腺髓样癌、类癌等也呈阳性表达。
(九)甲状腺球蛋白和降钙素
甲状腺球蛋白(Thyroglobulin, TG)是由甲状腺滤泡上皮细胞产生的大分子糖蛋白。甲状腺的良恶性疾病,包括结节 性甲状腺肿,突眼性甲状腺肿、亚急性甲状腺炎、甲状腺腺瘤和甲状腺癌都可引起血清TG升高。因此,对区分甲状腺的良恶性结节 没有价值。在某些其它恶性肿瘤,如乳腺癌和肺癌,血清TG可以升高,但一般不会超过100ng/100ml水平。TG的免疫细胞化学表明,不论原发性或转移性甲状腺癌的类型为何(滤泡或乳头状腺癌),都为TG阳性表达,只是随分化程度不同而表达强度不同,髓样癌则为阴性反应。由此可见,TG对鉴别上述两种肿瘤具有肯定价值,是较好的器官特异性肿瘤标记物。
降钙素(calcitonin)是甲状腺C细胞产生的调节 血清钙的肽类激素。虽然在非恶性疾病和其它恶性肿瘤也有升高,但在甲状腺髓样癌患者血清中常有显著升高,因而降钙素仍不失为甲状腺髓样癌的良好标记物。
(十)血型抗原
血型抗原(Blood group antigen, BGA)是一组存在于细胞表面的糖脂。目前已检出的有A、B、H、Leb、Lea、M、N、P等十余种,其中以A、B、H系统的抗原为最强。血型抗原除未在神经组织、结缔组织及肌肉组织发现外,几乎分布于机体所有正常细胞膜,只是在不同器官含量不同。
随着细胞的恶性转化,BGA的异常表达表现在下述两个方面:一是某种BGA的明显丢失或丢失;二是出现正常时不能测出的抗原。这种抗原表达的异常是由于肿瘤细胞不能完全合成低聚糖链等因素所致,在研究恶性肿瘤中具有很重要的价值。长期以来,人们对消化道腺癌、泌尿系移行细胞癌等做了大量研究。以移行细胞癌为例,上述异常表达表现BGA的丢失主要涉及ABH系统,而抗原出现表现为T抗原的表达。概括起来,BGA的异常表达在肿瘤发生与诊治的研究中具有以下四方面的作用:
(1)有助于判断肿瘤的良恶性。一般而言,良性增生细胞大多保留其BGA,而恶性肿瘤细胞常表现为不同的BGA的减少或消失或出现异常表达。但最近研究发现,在良性病变中,偶可发生BGA丢失。如多形性腺瘤常发生H、A丢失及Le(Y)表达减少。在肝脏疾病的研究中出发现,Le(X)抗原不仅可以出现在肝细胞肝癌和胆管细胞癌,在不同类型的肝硬变也为阳性表达,而正常肝细胞为阴性。
(2)有助于判断肿瘤的浸润与转移能力。BGA消失的肿瘤易于发生浸润与转移。
(3)肿瘤BGA保留与否,可以判断患者的预后,保留者预后好,否则预后不良。
(4)可以预见癌前病变的发展趋势。如在食道癌的癌前病变研究中发现,增生的基底细胞及不典型增生的上皮细胞常有Le(Y)的持续阳性表达。BGA与肿瘤病理生物学关系的研究,已经历了很长时间,并取得了大量有实用价值的结果,预计今后仍然会获得新的发现。
总之,在上皮性肿瘤标记物的研究中,共性标记物已经得到了广泛而成功的应用,满意的器官特异性免疫标记物为数却很少,其中以PSA较为理想。为了解决临床病理工作中常常遇到的难以明确转移性低分化肿瘤原发部位的问题,这方面仍需不断深入研究。同时应该指出,在上皮组织肿瘤的鉴别诊断中,除使用上皮性标记物外,常应同时使用LCA、NSE等标记物,以从不同角度取得证据,具体内容参见本章 有关部分。此外,涉及上皮组织肿瘤的标记物也不止本节 所介绍的内容,新的标记物不断出现。对文献报道不多、正在研究的与上皮组织肿瘤有关的标记物,如组织多肽抗原(Tissue polypeptide antigen )等本节 暂时不介绍。
(黄高升)
参考文献
1.Trojanowski JQ,et al. An immunohistochemical study of human central and peripheral nervoussystem tumors, using monoclonal antibodies against neurofilaments and glialfilaments. Human Pathol. 1984;15:248
2.罗欣鸣,等.星形细胞瘤的免疫组织化学研究.中华病理学杂志,1993;22(2):95
3.连锦英胡瑞德李瑛. 胶质纤维酸性蛋白和S—100蛋白在脑膜中的分布及其在诊断中的作用.中华病理杂志.1987;16(1):11
4.Osbor11M, et al.Tumor diagnosis by intermediate filament typing, a novel tool for surgicalpathology. Lab lnvest. 1983,48:372
5.刘开凤.免疫组织化学在外科病理学中的应用.中华病理学杂志,1990,19(2):148
6.Erlandson RD. Diagnosticimmunohistochemistry of human tumours. Am J Surg Pathol. 1984, 8:615
7.Gatter K, et al. Whichantibodies for diagnostic patnology. Histopathol.1987,11:661
8.Kahns HJ, et al. Role ofantibody to S-100 protein in diagnostic pathology.Am clin Patnol. 1983, 79:341
9. Loeffel SL, et al. Celluarimmunolocalization of S-100 Protein within fixed tissue section by monoclonalantibodies. Arch pathol Lab Med. 1985,190:117
10. 谭郁彬. 弥漫内分泌系统病理研究进展.中华病理学杂志,1990,10(2):81
11.Delellis RA. Multidirectionaldifferentiafion in neuronedocrine neoplasms.J Histochem Cytochem, 1984, 32:899
12.张福林. 等.垂体腺瘤的功能分类研究.中华病理学杂志,1990,19(2):97
13.张晓军, 等.垂体ACTH细胞腺瘤的免疫电镜研究.中华病理学杂志,1990,19(2):100
14.刘冬弋,等.垂体多激素腺瘤的免疫电镜研究.中华医学杂志,1993,73(4):223
15.李维华, 等.肺癌超微结构分类的研究.中华病理学杂志,1992,21(5):262
16. 冼美生段惠军.七例食道燕麦细胞癌的临床病理分析及超微结构观察.中华病理学杂志,1988,17(4):292
17.刘鸿瑞,等.肺原发性小细胞癌超微结构及免疫细胞化学的研究.中华结核和呼吸杂志,1988,11(5):285
18.吕宁,等.皮肤神经内分泌癌(Merkel)细胞瘤.中华肿瘤学杂志,1992,14(6):452
19.Silva EG, et al.Immunohistochemical studies in endocrine carcinoma of the skin. Am J Clinpathol, 1984,81:558
20.sibley RK, Dahl D. Primaryneuroendocrine carcinoma of the skin:An immunocytochemical study of 21 cases.Am surg pathol, 1985,9:109
21. Gould VE. et al.Neuroendocrine (Merkel) cells of the skin: hyperplasia,dysplasia, andneaplasms. 1985,52(4):334
22.蔡文琴王伯沄,主编.实用免疫细胞化学.成都:四川科学技术出版社,1988
23.刘彦仿主编.免疫组织化学.北京:人民卫生出版社,1990
24. Boulag CHE,DU,Immunohistochemistry of soft tissue tumors:A review. J of Pathol,1985;146:77~94
25. Corson JM, et al .Intracellular myoglobulin: A specific marker for skeletal muscledifferentiation in softtissues sarcomas. Am J Pntlol,1981,103:384
26. Tosokos MD.Immunohistochemical study of alueolar and embryonal rhabdomyosarcoma. LabInvestigation, 1983; 48:148
27. Leong AS-Y, et al. Expressionof cytonecatin and vineutin intermediate filaments in epithelial neooplasms: acorrelalion of immunocytochemical and ultrastructural findings. Proc th Asia –pacific confecence and workshop on eletcon microscopy. Bangkok, 1988:711
28.赖日权罗祝和安建成,等.恶性上皮性肿瘤角蛋白和波形蛋白的表达.中华病理学杂志,1990;19:119
29.张建中.S-100蛋白在神经嵴起源组织及其肿瘤中的分布.实用肿瘤杂志,1988;2:109~112
30.赖日权安建成彭保,等.横纹肌肉瘤病理形态及免疫组化观察.中华肿瘤杂志,1989;11:184
31.潘传敬汪感贤陈志远,等.间变型脑膜瘤的超微结构及免疫组织化学观察.中华病理学杂志1992;21:224~226
32.高奉浔李增鹏苏红.骨肉瘤组织学特点和免疫组织化学的研究.第三军医大学学报,1993;15(3):223~227
33.Tubbs RR. Sheibani K.Immunohistology of lympho - proliferative disorders.Seminrs in diagnosticpathol. 1984, 1:272~284
34. Aisnberg Ac. Current eonceptsin immunology, Cell surface markers in lymphoproliferative disease. N Eng JMed, 1979,301:512~518
35.Bo – Yec Ngan et al.Immunophenotypic diagnosis of non- Hodgkin’s lymphoma in paraffin sections (L60(Leu22)andL26antigen expnes-sion). Am JClin Pathol. 1989,91:579
36. Hsu SM, Ho ys, Hsu plLymphomas of lace hisliocylic origin. Am J Pathol.1991,138:1389~1404
37.Boulag CEH, DuImmunohistochemistry of soft tissues tumors: J of Pathol,1985;146:77~94
38. von Kleist S. What’s New inTumor Markers and their Measurements? Path Res Pract, 1988;183:95~99
39. Jacobs EL and Haskell CM.Clinial use of tumor markers in oncology.Current Problems in Cancer Mosby- Yearbook, Inc. 1991: pp301~360
40.Delellis RA. Advances inImmunohistochemistry. First ed. Raven Press New York, 1988;pp191~221
41. Javadpour N. Tumor Markers.First ed. Praeger New York Westport,Connecticut, London. 1987
42. Herberman RB and Mercer DW.Immunodiagnosis of Cancer. Second ED. Marcel dekker. Inc. New York, Basel HongKong. 1990
43. Fenoglio – Preiser CM,Weinstein RS and Kaufan N. New Concept in neoplasia as applied to diagnosticpathology. William & Wilkins Baltimore,London, Los Angeles, Sydney. FirstEd. 1986:pp225 ~241
44.Moll R, cowin P, Kapprell HP,et al: Desmosomal protein: New markers for identification and classification oftumours. Lab Invest, 1986;54:4~25
第十三章 消化器官免疫细胞化学
自1966年Crabbe首次应用免疫荧光技术进行胃粘膜抗体产生细胞研究以来,随着临床上纤维和电子内窥镜普遍应用,能通过活检取得新鲜组织标本,取材方便,材源丰富,为深入开展免疫细胞化学和组织化学技术对消化道疾病的研究起了重大的推动作用。消化道直接与各种口服抗原接触,是局部粘膜免疫反应场所和中枢器官,也是炎症、溃疡、感染和肿瘤等病变的好发部位。用免疫细胞化学和组织化学对分泌性IgA(SIgA)和各种抗体分泌细胞、T淋巴细胞、巨噬细胞和肥大细胞等免疫细胞和组织相关抗原等的研究,观察胃肠道疾病与局部免疫反应的关系,对进一步探讨某些疾病的病因、诊断和治疗有重要价值。胃肠道分泌的各种酶对食物的消化和吸收起重要作用。用免疫细胞化学研究胃蛋白酶、乳糖酶、溶菌酶等酶类的分布和定位对探讨消化性溃疡、腹泻和消化吸收不良综合症等疾病有重要临床价值。免疫细胞化学技术还能对消化道内分泌激素细胞和肽能神经准确定位,也能确定CEA,CA125和AFP等消化道肿瘤相关抗原和肝炎病毒等致病性抗原的产生和分布。随着单克隆抗体技术的应用和免疫细胞化学技术特异性和敏感性的提高,必将加速消化道疾病的病因和诊治研究的迅速发展。
第一节 胃肠道粘膜免疫细胞化学特点
胃肠道与外界相通,其粘膜表面附着各种细菌和病毒。粘膜含有各种组织溶解酶,而且胃粘膜呈酸性,肠粘膜偏碱性,因此在进行免疫细胞化学染色过程中,必须注意以下几个环节 :
一、抗原的稳定性
免疫细胞化学和组织化学就是检查、鉴定、定位和示踪组织中各种抗原成分。在组织加工过程中,必须保持抗原的形态、结构、抗原性和在组织中的位置保持不变,不引起组织产生自发荧光及其它非特异性着色。原则上越新鲜的组织越适于进行免疫细胞化学和免疫组织化学研究。
1.组织切片标本经胃镜、小肠镜和大肠镜等内窥镜取材可以在直视下根据研究的内容在不同部位进行取材,即准确又方便。一般组织块直径多在0.5~1.0mm左右,适合进行各种抗原的研究。
(1)取材方法:将取材部位调整到内窥镜视野中央,使活检钳与粘膜面垂直,然后钳取。活检钳应尽量下压深取达粘膜全层。取出活检钳并打开活检器时要轻,防止粘膜撕裂。立即将活检组织轻轻在粘在滤纸上,并尽量使粘膜面与滤纸平行。
(2)组织固定:根据所查抗原的种类采取相应的固定方法。我们的体会是:对某些蛋白类抗原,如免疫球蛋白、SC、CEA等一般用95%冷酒精固定较好。95%乙醇不但能固定蛋白抗原,而且保持与抗体的免疫反应能力,同样可以进行HE染色。除组织有部分收缩外,组织成分和抗原位置没有大的改变,组织块可以在冰箱内长期保存。我们对保存26个月的冷酒精固定组织进行CEA和SC的研究,效果仍很好。对多肽类激素的研究可以用4%多聚甲醛缓冲淮,Bouin 缓冲液或福尔马林缓冲液进行固定,或直接液氮固定后冷冻切片。冷酒精固定的组织不宜进行多肽类激素的研究。对陈旧性福尔马林的固定的组织可以在抗原表面形成蛋白衣,直接影响抗原抗体反应。有人用胰酶消化后暴露抗原部位,进行胃泌素细胞的免疫细胞化学染色,也获得较好结果。要进行胃肠道多肽类神经的免疫组化研究,可用含Triton的固定液和冰冻切片。对小白鼠等动物可向血管内注射多聚甲醛等固定剂,然后处死取材。进行细胞膜抗原的单克隆抗体研究时最好用Cryostat冰冻切片,然后丙酮或乙醇固定10min左右。
(3)组织加工:温度对抗原抗体均有影响。一般在4℃进行脱水和透明。包埋选用低熔点蜡(52℃~56℃),浸蜡时间以20min左右为宜(因组织块较小)。脱蜡和脱二甲苯也应在低温下进行。
(4)组织保存及切片:石蜡包埋或其它方法加工后最好立即进行切片和免疫细胞化学染色。根据不同的抗原也可以在低温下保存一段时间后再染色。组织切片的免疫细胞化学染色实际上使切面的抗原暴露后直接与抗体相结合,一般组织切片厚度以5~7μm为宜。如果观察神经纤维则以10~20μm为好。太厚则透射光不易通过,影响观察,易出现自发荧光。如果进行免疫电镜观察,最好超薄切片。
2.涂片或印片标本拉网和内窥镜下获得的胃肠道分泌物等可直接涂片,空气干燥,再用乙醇固定后进行免疫细胞化学染色。涂片和印片缺乏明确的组织结构,标本中常常混有不同形态的组织细胞和其它蛋白等无定形成份,很容易造成假阳性,观察时应当特别注意。
3.组织分离细胞将手术或活检组织块用机械研磨或胶原酶消化等方面可分离出细胞,加入培养基,在试管内进行活细胞免疫荧光或免疫酶等免疫细胞化学染色。流式细胞仪进行定量和定性分析。此法对细胞膜抗原的研究有较大价值。我们在试管内用免疫荧光技术对周围血分离的单核样细胞进行T淋巴细胞亚群和B淋巴细胞的研究中,发现OKT3、OKT4、OKT8和Ia的荧光均分布于细胞膜,随着细胞的滚动,犹如火球,非常清晰。
二、抗体的特异性
示踪抗原的抗体必须具有高度特异性,尽量减少非特异性染色和干扰。因此染色前必须测定抗体的工作效价,并用严格的阳性对照。组织切片应当有连续切片的HE染色作对照。
三、染色技术的选择性
应当根据设备条件,具备的抗体和示踪抗原的特点进行选择。我们的经验是:因胞浆性抗原含量较多,可以用简便和廉价的间接法甚至直接法免疫细胞化学染色;对膜抗原及其它一些微量抗原应当选用PAP或ABC法,如果同时进行两种以上抗原的检查,最好进行双标记和多标记免疫细胞化学染色;为了显示较弱的抗原,可以用对比染色技术,背景为另一种颜色,使阳性抗原着色更突出。
四、结果的可比性
1.如研究胃粘膜中抗体产生细胞应当掌握在HE染色时的车轮状核位于胞浆一侧,胞浆特别丰富,染色时仅胞浆着色而核不着色等特点。同时应了解所研究的抗原在组织中的大致定位及分布规律。如分泌5-羟色胺的内分泌细胞多位于固有层间质内,VIP和SP分布在固有层神经末梢及粘膜下层的神经元,胃泌素细胞分布胃肠腺体细胞之间。CEA多分布在腺癌细胞,如果在固有层内出现阳性细胞,要谨慎对待,必须排除污染、内源酶或自发荧光,同时与连续切片的HE染色切片对比观察才能作出判断。
2.阳性结果的定量分析免疫细胞化学和免疫组织化学染色受到的影响因素较多,最好在相同组织加工方面、统一批号抗血清和标记抗体、统一染色技术和结果判定方法,同时对病态和正常组织进行对照观察才能增加可比性。用免疫组织化学进行抗原定量分析时,可根据着色程度,选用某一基点为标准进行半定量计数,但容易受主观因素的影响。近年来,数字减影技术的应用,大大提高了定量研究的准确性。对阳性细胞的计数,多采取以下几种方法:
(1)直接计数法:以10~20个随意选择的高倍视野直接进行阳性细胞计数,或计算100~200个总细胞中阳性细胞的数量。由于阳性细胞分布的不均匀性,可能存在一定误差。
(2)体积计数法:测定单位面积内的细胞数,再算出每立方毫米体积内阳性细胞总数。一般组织切片只有5~7μm厚,与1mm厚度组织切片的细胞密度不可能完全一致。
(3)细胞密度计数法:即计算单位粘膜面积的阳性细胞数。有人提出以0.5mm宽,粘膜切面会层(约0.6mm)作为一个单位。因内窥镜取材时,组织块不规则,显微镜下要具体选择有一定困难,。我们用改良的Dellesses公式进行计算比较方便。原公式NV=N(P∑r2)×109,NV代表每立方毫米体积细胞数;N代表细胞总数,r为测微器小方格边长(μm);∑为切片厚度(μm);P为小方格数。我们只计算每平方毫米面积细胞数,即D=N/(P∑r2)(r单位为mm)。方和边长为0.5mm的测微器放在目镜下,物镜放大4倍,即用测微器去量放大4倍的物体,测出的边长必须缩小4倍才是物体的真正面积,已知r为0.5mm,将上述数据代入公式,得D=N(r/4)2=16N/(Pr2)=16N/(P(0.5)2)=64N/P。只要计算整个组织切片的细胞数和所占小方格数,即可得出阳性细胞密度(细胞数/mm2)。组织分离细胞可通过流式细胞仪进行计数。
第二节 胃肠道粘膜抗体产生细胞
一、抗体产生细胞的特点
抗体产生细胞(Antibody – producing cell)即光镜下所见浆细胞。有的呈圆形,核居中(称之为淋巴样浆细胞、幼浆细胞或过渡型浆细胞),也有的呈椭圆形,核偏于一边(称为典型浆细胞)。它们都具有丰富胞浆(HE染色呈红色),能产生和分泌各种抗体。一个成熟浆细胞只能分泌一种抗体。胃肠道粘膜中的各种抗体多由局部抗体产生细胞所分泌。一般认为骨髓的多潜能干细胞转化成细胞表面具有IgM和IgD标记的成熟B淋巴细胞后进入粘膜层或粘膜下层的散在淋巴滤泡或Peyer斑的生发中心。胃肠腔内抗原通过其靠腔面的M细胞进入粘膜固有层,通过巨噬细胞和树突状细胞将抗原加工后传递至生发中心,在转化生长因子β(β-trans-forming growth factor, TGF-β)、IL-4、IL-5、γ-IFN和抗原刺激下B淋巴细胞增殖并转移化成细胞表面含IgG、IgA、IgE等特异性B淋巴母细胞,一部分直接分散在固有层,大部分经淋巴细胞再循环返回胃肠道粘膜,在IL-2和IL-6刺激下转化成抗体产生细胞,分泌特异抗体,发挥体液免疫反应。因此测定粘膜中抗体产生细胞的分布对进一步认识局部体液免疫反应与胃肠道疾病的关系有重要意义。
二、双标记免疫荧光染色
抗体产生细胞胞浆内含有相对多的抗原,故采用直接或间接法免疫细胞化学技术可简化步骤,节 省时间,降低成本。为了清除组织间弥散的免疫球蛋白,我们在固定前用PBS浸洗,取得良好的效果。用双标记免疫荧光技术可以在同一张切片上显示出两种不同的抗体产生细胞。
1.组织加工根据研究目的的内窥镜直视下钳取胃、小肠或结肠粘膜。将取得的组织立即放入含4℃,pH7.2、0.01mol/l PBS烧杯内搅拌10~18h后直接放入4℃、96%乙醇中固定。在4℃环境下继续脱水和透明,56℃浸蜡和包埋,石蜡块冰箱保存。组织切片后,37℃温水展平,载片后干燥,装干燥盒置于冰箱,可以保存1周左右。4℃脱蜡和脱二甲苯,PBS洗涤后蒸馏水清洗,风干待染。
2.荧光素标记抗体 异硫氰酸荧光素(fluorescein isothiocynate, FITC)标记抗体的具体步骤详见第三章 。在标记络丹明B200(lissamine rhodamin B200,RB200)时应注意:
(1)PCI5极易吸收水份放出烟雾样刺激气体,RB200和丙酮混合后搅拌时也放出有毒的SO2Cl刺激性气体,故操作时最好在通风橱内进行。在室外操作时应戴口罩。
(2)丙酮极易挥发,一定要在密闭容器(如带盖的青霉素瓶)内搅拌。吸取丙酮时也要动作迅速。
(3)在标记过程中,RB200能产生HCl,容易使蛋白变性,必须用较多碱性缓冲液中和。具体步骤是:
①按50mg蛋白需10mg RB200和20mg PCI5的比例分别准确称取PCl5和RB200,放入青霉瓶内。经橡皮塞穿入玻棒拌混合5min。
②用吸管吸取0.5ml左右丙酮迅速注入瓶内,继续搅拌5min形成紫褐色溶液(A液)。
③1份抗血清(含蛋白10~20mg/ml)用等量或2份0.5mol/l p9.5碳酸缓冲液稀释后在4℃冰箱内用磁力搅拌器边搅边加入A液,并用混合液反复冲洗青霉素瓶内的A液,直至干净为止,然后继续搅拌30~60min。
④称取相当于蛋白半量的活性碳加入混合液内继续搅拌60min后,以4000r/min离心30min除去活性碳。
⑤用30%~50%饱和硫酸铵盐析1次,去上清液,沉淀物用少量PBS溶解,过G-25层析柱去除硫酸铵即得RB200标记的抗体。
⑥RB200的最大吸收光谱为570。用分光光度计分别测定570nm(RB200)和280nm(蛋白)的读数,根据Wells表算出F/P克分子比值。
⑦效价高的标记抗体加0.1% NaN3或硫柳汞(0.1%)数滴防腐,分装放置20℃以下可长期保存,4℃~10℃能保存半年左右。
3.染色步骤染色前进行对照试验、吸收试验和抑制试验,测定抗体的纯度和特异性,同时以琼脂扩散和染色效果确定工作效价。在连续切片中,用RB200标记的IgG稀释液分别与FITC标记的IgA和IgM混合(根据染色效价,分别以对方为稀释液)进行染色。在37℃温盒内孵育45min,PBS清洗,过一次蒸馏水后风干,50%缓冲甘油封片,在冰箱中可保存10天左右。
4.阳性结果观察及细胞计数用Olympus荧光显微镜观察。选择BG12激发滤板和0515抑制滤板可同时观察两种荧光。胞浆丰富、明显绿色荧光、核不着色的细胞为IgA或IgM产生细胞;胞浆红色荧光者为IgG产生细胞。少数胞浆黄色荧光的细胞核呈圆形,位于细胞中央,可能这些B淋巴母细胞能产生两种抗体,也可能是具有共同的轻链而引起的交叉反应。如果用α、β、γ、μ、δ等重链单抗进行研究,可以进行鉴别。在荧光显微镜下数出组织切片中阳性细胞总数(N),测微器放在目镜下测出组织切片所占小方格数(P)。测微器小方格边长为0.5mm,根据物镜放大倍数(4倍)用公式D=64N/P计算出每平方毫米组织切片中所含细胞数。
三、临床意义
抗体产生细胞主要分布在粘膜固有层。IgA产生细胞多沿上皮层分布,IgG和IgM产生细胞分布全固有层。小肠粘膜含抗体产生细胞增多,胃和结肠其次,食管最少。小肠粘膜中IgA、IgM、IgG产生细胞比例为81.9:15.7:2.5,IgA产生细胞最多,IgG产生细胞最少。结肠粘膜中抗体产生细胞分布与小肠相似,但IgM和IgG产生细胞数增加。对于胃粘膜各家报道不一。多数认为IgA产生细胞最多,IgG产生细胞其次,IgM产生细胞最少,胃体和胃窦无显着差异。我们的结果与国外报道一致。正常胃肠粘膜中IgD产生细胞极少,IgE产生细胞仅占2%,胃粘膜中多于结肠粘膜。这些抗体产生细胞分泌的抗体在粘膜局部免疫起着极其重要的作用。某些消化道疾病与抗体产生细胞数量、分布和比例的异常密切相关。
1.抗体产生细胞与胃部疾病70年代国外就重视慢性胃炎和胃溃疡组织中抗体产生细胞研究。多数报道认为表浅性胃炎以IgA和IgM产生细胞增加为主,轻度萎缩性胃炎以IgA产生细胞增多,可能与细菌或病毒等感染有关。中度以上萎缩性胃炎和恶性贫血病人胃粘膜中IgG产生细胞显著增加。部分病人有壁细胞、胃泌素细胞、内因子或胃组织其它成分的自身抗体。IgG产生细胞增加可能与特异性免疫反应有关。有人将壁细胞抗体阳性病人胃粘膜中分离出IgG与壁细胞共同培养,能直接破坏壁细胞。我们的结果还发现,中度以工萎缩性胃炎患者胃粘膜中T淋巴细胞和IgG产生细胞均增加,提示胃粘膜的萎缩不能排除抗体依赖的细胞毒(ADCC)作用的结果。部位原发性变异性低丙种球蛋白血症患者整个胃粘膜萎缩,粘膜中缺乏抗体产生细胞。对于胃溃疡,有人认为IgA、IgM和IgG产生细胞均增加,它们之间的比例是相对正常的,但IgE产生细胞明显增加(是正常人的10倍)。用放射免疫法测定也发现胃溃疡病人血清和胃液中IgE浓度也增高。推测IgE作用于肥大细胞后释放组织胺类物质在溃疡的病因中起重要作用。
2.抗体产生细胞与胃肠道恶性肿瘤1977年日本奥田晃三首次用免疫荧光法对89例进展期胃癌的抗体产生细胞进行测定,发现IgA、IgG和IgM产生细胞均明显减少,且与胃癌的分型和组织分类无关。我们对48例胃癌组织用双标记免疫荧光研究发现癌组织中IgA产生细胞显著减少,但IgG产生细胞显著增加,并有聚集现象;癌旁组织中抗体产生细胞增加更显著,其中IgG产生细胞增加6.2倍,肠型胃癌中IgG产生细胞显著多于胃型胃癌,肿块越大则IgG产生细胞越少。Jonder证实人类肿瘤细胞膜上有IgG的FC受体。有人将小白鼠肿瘤组织中的IgG提取证实为IgG2,在细胞培养中对癌细胞有杀伤作用。提示IgG产生细胞与抗胃癌免疫反应密切相关。我们还发现胃癌组织中IgA产生细胞只占28.5%,癌旁占40.2%,显著低于正常(55.1%)。IgA产生细胞减少可导致SIgA合成减少,引起粘膜免疫屏障功能失调。也有人认为肿瘤细胞产生某种抑制因子阻碍IgA产生细胞进入癌组织内。其确切机理仍在深入研究中。近年来,对肠癌组织中抗体产生细胞研究也有报道。发现癌组织中IgA产生细胞也显著减少,癌旁组织中IgG产生细胞增加13倍。认为与结肠癌特异性抗原或IgG的细胞毒作用密切相关。今后的研究在于从组织中分离出抗体的特异性部分在体外或体内直接作用于肿瘤细胞,筛选出能破坏癌细胞的抗体及其基因组,用分子生物学技术扩增,用于肿瘤的治疗。
3.抗体产生细胞与炎症性肠病慢性溃疡性结肠炎(CUC)和克隆氏病是病因未明的肠道感染性疾病。近年来有人发现炎症性肠病与肠道局部免疫反应有关。Golzayd等发现9例CUC肠粘膜中6例有大量IgA产生细胞浸润,认为可能与细菌或病毒感染有关。也有人发现以IgG产生细胞或IgE产生细胞浸润为主。Persson等报道克隆氏病的回盲部IgA产生细胞减少,IgG和IgM产生细胞增加,有人发现感染严重部位IgG产生细胞增加,粘膜完整部位IgM产生细胞最多。因此有人提出IgG和IgM能调节 局部T淋巴细胞免疫反应造成粘膜损伤,溃疡是IgE调节 的组织胺类物质释放过多和继发感染引起。也有人提出炎症性肠病虽然肠粘膜中抗体产生细胞增加,但细胞比例没有改变。因此炎症性肠病与体液免疫反应的关系仍需要进一步深入研究。
4.抗体产生细胞与慢性腹泻慢性腹泻是消化道常见病,粘膜免疫功能缺陷是重要原因之一。目前认为,不论体液免疫和细胞免疫缺陷,均可引起腹泻同时伴有肠道鞭毛虫、念球菌和霉菌等继发感染,这些病人胃肠道粘膜缺乏抗体产生细胞。虽然部分病人仍有IgGT和IgM产生细胞分布,但IgA产生细胞显著减少或缺如。可见IgA产生细胞在胃肠粘膜中起重要保护作用。也有人发现病人胃肠粘膜有不典型抗体产生细胞,产生的抗体很少,可能与缺乏辅助性T淋巴细胞有关。对这类病人除给予必要的抗菌素控制继发感染外,定期补充免疫球蛋白制剂或适当使用左旋咪唑和转移因子等T淋巴细胞激活剂可能使症状得到缓解。已经有人从乳汁中提取分泌性IgA治疗顽固性小儿腹泻获得成功。α-重链病患者小肠粘膜固有层大量抗体产生细胞浸润,分泌α-重链,引起肠粘膜萎缩,也能导致吸收不良和腹泻等症状。
第三节 消化道分泌生IgA
胃肠道产生的分泌性IgA(SIgA)在其粘膜表面形成重要的免疫保护层能防止抗原性物质进入粘膜,对局部炎症和肿瘤的发生发展起重要作用,也是近年来研究局部粘膜免疫反应的重要课题。
一、S IgA合成及其功能
人体内主要含有两种形式IgA。一种为s IgA单体,主要存在血清中,多来自脾脏、骨髓和肠系膜淋巴细胞的浆细胞。另一种是与分泌成分(secretory component, SC)结合的二聚体,即SIgA,沉降系数为11S,主要存在唾液、初乳及胃肠道等分泌液中。成人肠道每天能分泌3gSIgA。目前多认为胃肠道是s IgA的中枢器官。SIgA由SC、J链和二个IgA单体组成,形成过程包括:SC的合成、J链和IgA合成、IgA与SC结合和SIgA分泌。SC是分子量为83000dalton左右的糖蛋白,由549~558个氨基酸和20%糖组成,其转录基因在上皮细胞的第1对染色体上。我们用免疫细胞化学染色证实SC主要分布在分泌性腺上皮细胞基底侧膜及游离腔面的胞浆内。杯状细胞含SC很少。SC作为免疫球蛋白的受体在SIgA的合成中起重要作用。目前已经证实SC与胃肠道固有层IgA产生细胞分泌的二聚体和J链形成二硫键。虽然40%IgG和IgD产生细胞也含有J链,但很快被溶解,故SC不能与IgG与IgD相结合。SC能与IgM五聚体结合,但结构不稳定,易被消化酶破坏。SC与IgA结合及SIgA分泌过程是近年来研究的重点课题。SC作为特异性受体位于上皮细胞膜上,其膜外部分(最外层100个氨基酸残基,即SC1)非共价键与J链和IgA的α链可变区(Cα3)结合,SC紧靠细胞膜部分(SC5)与IgA二聚体的另一条链α链(Cα2)形成二硫键。结合的SIgA通过细胞吞饮作用(pinocytosis)进入胞浆,在上皮细胞腔面释放,近年的研究表明,小白鼠的肝细胞和人胆管上皮细胞也能合成SC。人胆汁中含有IgA单体多来自血液,少部分来自门脉区及胆管内皮细胞下浆细胞。有趣的是有人发现慢性肝硬化患者周围血B淋巴细胞也能产生IgA二聚体,其机理还不清楚。
SIgA分布在粘膜表面,能封闭细菌和病毒等抗原表面及其受体结合部位或与之凝集成团状,阻止病毒和细菌和粘附。SIgA与相应抗原结合还可激活补体的替代途径,造成抗原溶解,近年来也有人发出IgA也能通过ADCC发挥细胞毒作用。有人发现先天性缺乏SIgA的病人恶性肿瘤的发病率比正常人高20~50倍。小肠之所以很少发生恶性肿瘤,粘膜中含85%以上的IgA产生细胞是重要因素之一。因此,深入研究SIgA与消化道炎症,感染和肿瘤发生发展的关系有临床实用价值。
二、对比免疫荧光染色
1.染色特点
(1)要进行SC和IgA组织定位,必须有相应特异抗血清。SC抗血清国内没有生产。国内商品IgA抗血清的抗原多来自人乳中的SIgA,具有双重抗原性(SC和IgA),不能特异进行IgA组织定位,最好采用抗人α-重链抗血清。
(2)SC是糖蛋白,IgA是免疫球蛋白。在组织处理上虽然有人提出用冷冻切片或福尔马林固定胰酶消化的方法,我们的体会用冷酒精直接固定法既简单又方便。
(3)SC和IgA除一部分在细胞内,也可以分布于间质和粘膜表面。为了提高特异性,除了染色前用琼脂扩散、对照试验、吸收试验和抑制试验等方法检验抗体的特异性和敏感性外,可采用伊文氏蓝作对比染色。伊文氏蓝肉眼下是蓝色,在荧光镜下是红色,混合染色后能衬托FITC的绿色荧光,同时抑制非特异性荧光,不影响抗原抗体结合。如果特异性染色后再加伊文氏蓝,比较费时间,效果不一定最佳。先用伊文氏蓝染组织切片,再进行特异性抗体染色能抑制抗原抗体结合,不宜使用。
2.染色步骤
(1)组织加工、固定及切片与抗体产生细胞研究(不需PBS浸洗)相同。先做HE染色,选纵向连续切片,脱蜡后在4℃PBS中浸洗3~5min,过一次蒸馏水后风干待染。
(2)用伊文氏蓝PBS稀释FITC标记的SC和IgA抗体,加在连续组织切片上,放入湿盒,37℃温箱放置45min。
(3)取出切片,用BPS浸洗3次,每次5~10min。
(4)过一次蒸馏水后风干,50%甘油封片,荧光显微镜观察。
3.结果判断和分析荧光镜下组织切片底色为红色荧光,SC和IgA呈绿色荧光。IgA和SC主要分布在分泌性腺体腔面、上皮细胞侧膜及基底部,IgA还分布在间质及固有层IgA产生细胞浆内。可根据荧光强度进行SC和IgA半定量分析,也可以用荧光光度计或数字减影技术进行准确定量。
三、临床意义
1.胃十二指肠疾病我们用免疫荧光技术对胃和十二指肠疾病研究结果与Isaonacs相似,发现正常胃粘膜中胃体腺没有IgA和SC分泌,仅上皮层有少量IgA和SC荧光。胃窦腺体细胞的腔面及侧膜均有SC和IgA,间质有IgA荧光,但没有SC荧光,上皮层SC和IgA荧光较胃体强,证实SC为粘液分泌性腺体细胞所产生,在细胞侧膜与IgA结合。正常十二指肠上皮细胞层SC和lgA特别丰富。粘膜下层十二指肠体腔面也有SC和lgA分布,但较因有层腺体细胞的分泌能力低。杯状细胞缺乏分泌SC的能力。这可能与HLA-DR组织相关抗原有关。上皮层的SIgA可能是分泌后的功能定位。正常胃体能分泌盐酸和胃蛋白酶,细菌或病毒感染机会少。胃窦特别是十二指肠粘膜多偏碱性环境,细菌和病毒等停留机会较多,SIgA增多可代偿性增加粘膜免疫保护功能。
慢性浅表性胃炎时,腺体和上皮层SC及IgA荧光明显增强。HE染色发现部分胃体腺转化成粘液分泌性腺体(固有腺或幽门腺)即具备分泌SC和结合IgA的能力。间质出现较多IgA产生细胞。这些病人可能正常粘膜屏障功能被破坏以SIgA免疫屏障功能代偿。
在萎缩性胃炎中,正常腺体分泌SC功能增强,但肠上皮化生腺体及不典型增生腺体的SC荧光明显减弱。从免疫学角度支持肠上皮化生与胃癌的发生有较密切关系。
胃癌的发生和发展与SC和IgA的关系日益受到重视。在我们的研究中,发现部分癌细胞能分泌SC,与肿瘤的分化程度和组织分类无明显关系。临床上可以用SC鉴别其它部位转移肿瘤是否来自胃肠道,但也有人持不同的看法。肿瘤组织中IgA来源及s IgA在癌组织中的功能尚待进一步研究。
2.肠道疾病溃疡性结肠炎上皮细胞具有分泌SC的功能,但固有层IgA2产生细胞和J链的合成明显减少,IgA1产生细胞增加。IgA2能对抗IgA溶解酶的在破坏,有较强的免疫保护功能。故虽然SIgA的总量没有降低,但其免疫保护功能明显减弱,导致细菌或病毒感染,引起糜烂和溃疡。也有人发现炎症性反应性不典型增生的腺体分泌SC能力明显增强,具有癌变前期的不典型增生腺体明显减弱,而且随不典型增生程度加重,分泌SC和结合IgA能力减弱越明显,说明SC的免疫组织化学染色对鉴别良恶性不典型增生有一定价值。有人认为吸烟可能抑制SIgA合成,降低结肠粘膜免疫屏障功能,引起结肠癌。多数的报道认为结肠癌细胞分泌SC能力与肿瘤分化程度有关。分化程度越低,分泌SC的功能越差。双倍染色体癌细胞分泌SC的能力明显高于多倍体癌细胞。但SC与肿瘤之间的关系及其机理都在研究中。
3.其它疾病选择性免疫球蛋白A缺乏症患者虽然肠粘膜中IgA产生细胞显著增加(90%),因缺乏SIgA,不能中和和或制止过敏原的吸收,易发生哮喘和食物过敏;抗原抗体复合物进入体内易诱发红斑狼疮、类风湿性关节 炎和甲状腺炎等;易引起乳糜泻及梨形鞭毛虫感染;致癌病毒或致癌物质吸收增加。有人报道9例缺乏IgA患者5例发生消化道肿瘤。爱滋病患者是HIV感染所致。有人报道病人小肠末端IgA产生细胞减少和IgM产生细胞增加,明显IgA缺乏,但在直肠没有明显改变。最近曾报道SC缺乏的患者发生肠道白色念珠菌感染。这种患者血清IgA含量正常,粘膜固有层IgA产生细胞数量不减少,但肠分泌物中SIgA缺乏。可能这些IgA产生细胞不分泌IgA或上皮细胞的SC合成障碍。
SIgA是胃肠道粘膜第一道免疫屏障,影响因素较多。上皮细胞感染和维生素A缺乏可引起继发性SC合成减少和SIgA转化障碍。营养不良可选择性减少IgA产生细胞数量。吸烟、双苯丙酰脲等药物、精神郁抑和剧烈运动均可能影响IgA合成。因此s IgA与疾病的内在联系及其机理还需进一步深入研究。
第四节 胃肠道粘膜T淋巴细胞
一、T淋巴细胞分布及其特点
胃肠道T淋巴细胞分布在上皮层、固有层、粘膜集合和散在淋巴滤泡及肠系膜淋巴结内。随着免疫细胞化学技术广泛应用和各类T细胞亚群单克隆抗体的制备成功,为进一步研究不同部位T淋巴细胞的分类和功能起极其重要的作用。
1.上皮内T淋巴细胞上皮内淋巴细胞(intraepithelial lymphocyte, IEL)是指位于上皮层基底部的T淋巴细胞。近年来,对IEL对邻近上皮细胞有压迹,位于两个上皮细胞交界处,并未进入上皮细胞内。近年来,对IEL研究非常深入。已经证实75%以上成人小肠IEL是TCRγαβ阳性细胞,说明它们来源于胸腺,接受过抗原刺激。其中大部分为诱导、杀伤性T淋巴细胞(CD8或OKT8阳性),10%左右为CD7阳性和CD3阴性的IEL,类似NK细胞,有细胞毒作用,但无NK细胞标记,对NK的靶细胞无破坏作用。10%~20%左右为TCRδ阳性IEL,不受胸腺的影响,其中70%CD4和CD8均阴性,为T淋巴细胞前体。说明人的部分IEL通过胸腺外途径进行分化。内毒素等腔内抗原与肠上皮细胞微绒毛、肠腺隐窝细胞、巨噬细胞和树突状细胞膜上的组织相关性抗原分子(鼠为MHL-II,人为HLA-DR、HLA-DP和HAL-DR)相结合后,将抗原分子传递到CD3阳性T淋巴细胞受体(t lymphocyte receptor, TCR)中的α和β亚单位可变区进行结合,在CD8分子作用下导致IEL增殖和分泌大量γ-干扰素(γ-INF),α-肿瘤坏死因子(α-TNF),和少量的白介素-2(IL-2),发挥细胞毒性作用,调节 上皮细胞再生和增强对食物抗原的耐受。
2.固有层T淋巴细胞固有层T淋巴细胞(lamina propria lyphocyte, LPL)分散在固有层,约占固有层免疫细胞总数10%左右。其中CD4阳性细胞(CD4LPL)显著多于CD8阳性细胞(CD8LPL)。40%CD4LPL表达CD45RO抗原,能产生大量IL-2、IL-4和γ-INF,为记忆性T淋巴细胞,能辅助B细胞转化成抗体产生细胞并促其分泌抗体。60%CD4LPL表达CD45RA和CD8抗原,能直接抑制抗体产生细胞转化和分泌。这两种细胞的比例在调节 抗体分泌中起着重要作用。CD8LPL也可以分两种:一种表达CD28抗原的LPL,能通过ADCC或直接溶解靶细胞。另一种表达CD16抗原,具有自然杀伤功能。LPL能被IL-2激活,激活的LPL能释放大量IL-2、IL-4、γ-INF和IL-5、IL-2又能激活LPL,起着自身分泌作用。IL-5能促进抗体产生细胞分泌抗体。
3.胃肠道相关淋巴组织T淋巴细胞胃肠道相关淋巴样组织(gut – associated lymphoid tissue,GALT)主要包括肠系膜淋巴结和粘膜中集合和散在淋巴滤泡。GALTT淋巴细胞多们于生发中心的外周部位,约占40%。其中CD8和CD4阳细胞比例与周围血相似。动物研究证明,肠系膜淋巴结内的CD4阳民生细胞多于固有层。分子生物学研究发现GALTT淋巴细胞含有IL-4和IL-5基因,激活后产生大量IL-4和IL-5,能特异性增加B和T淋巴细胞增殖。抑制B淋巴细胞分化。其表面糖蛋白主要为CD45RA和leu8(CD8),证明是幼稚T淋巴细胞。它们对抗原刺激的增殖反应低,对刀豆素A等有丝分裂促进剂的增殖反应高,产生IL-2和γ-INF低,辅助作用弱。GALTT淋巴细胞如何调节 B淋巴细胞转化成IgA产生细胞和其它免疫细胞的增殖及功能,并不十分清楚。有待进一步研究。
近年研究发现,除M细胞和巨噬细胞外,胃肠上皮细胞在接受和传递抗原中也起重要作用。免疫细胞化学发现正常小肠上皮细胞微绒毛和侧膜有斑片状MHc II类抗原,人小肠为HLA-DR糖蛋白,能识别、加工和传递抗原使粘膜内T淋巴细胞产生免疫反应。HLA-DR表达受γ-IFN诱导。因此免疫反应中组织相关性抗原与IEL和LPL淋巴细胞互相进行调节 。
二、研究方法
1.组织切片中T淋巴细胞80年代以前多用玫瑰花瓣试验和酸性酯酶方法进行组织切片中T淋巴细胞研究,特异性较差。近年来多用OKT,Leu或CD等系列T淋巴细胞单克隆抗体进行研究,特异性高,可以分类出各种亚群。免疫组化染色中应注意以下几个方面:
(1)抗体的选择:根据不同目的选择相应的抗体,如要对人胃肠道组织进行研究,可选用OKT系统单抗;对鼠类等进行研究可选用Leu 或Thy系列。如要研究辅助性T淋巴细胞可用OKT4或CD4;研究抑制性T淋巴细胞可用OKT8或CD8等单克隆抗体。
(2)组织加工方法选择:目前所研究的特异性T淋巴细胞抗原决定簇多位于细胞膜上,用陈旧或普通组织固定和加工方法可能使抗原破坏,应采用新鲜组织和低温处理。具体方法是:手术或活检获得的组织立即用液氮冷冻,或用OCT复合物包埋后再放入液氮中,便于切片,Cryostat冰冻切片后室温下风干,用4℃纯乙醇或丙酮固定10min,PBS冲洗后即可进行免疫细胞化学染色。
(3)染色方法的选择:因抗原较微量,而且位于细胞膜,应采取敏感性强、特异性高、非特异性着色少的方法。虽然有报道采用间接荧光或间接酶标技术也能显示特异性T淋巴细胞,我们推荐最好采用PAP或ABC染色技术。具体方法参阅第三,四章 。
2.粘膜分离液中T淋巴细胞一定重量粘膜组织中分离出来的T淋巴细胞也可以用免疫细胞化学进行定量和定性研究。下面介绍用间接免疫荧光技术研究IEL的大致过程:
(1)将手术取得的肠管纵形剪开,将上皮层与固有层分离。
(2)上皮层放在无镁离子、含100U青霉素和链霉素及0.2%叠氮纳的PB中清洗,无血液和其它杂质后用解剖剪将组织剪碎,用匀浆器磨碎或用超声粉碎或用胶原酶溶解上皮细胞。
(3)匀浆液通过脱脂棉、尼龙筛(只允许淋巴细胞滤过,除去粘液、碎屑和上皮细胞凝集块)或金属网(200目)获得淋巴细胞悬液。
(4)将硅化玻璃球高压消毒,冲洗和平衡后将悬浮液过柱,得到的细胞液直接计数。也可以用淋巴细胞分离液提取,用台盼蓝测定其活性,并加10%FCS-RPMI细胞培养液,淋巴细胞数应达5×106/ml。
(5)试管内加0.1ml细胞液后加OKT系列单抗0.1ml,同时用另一试管加0.1mlPBS作对照。混合液在4℃放置30~60min(也可以在冰箱过夜)后,PBS(含RPMI)冲洗3次,离心后细胞沉淀物再加PBS至0.1ml。
(6)加0.1mlFITC标记的抗鼠IgG(根据工作效价),4℃放置20~30min,PBS洗3次,离心后加在红细胞计数板上,荧光显微镜观察。
(7)阳性细胞为细胞膜上有绿色荧光,有的呈颗粒样,随细胞滚动。荧光镜下可计算200个淋巴细胞中阳性细胞所占的百分率,或根据血细胞计数板中阳性细胞算出细胞总数及百分率。
三、临床意义
1.IEL在胃肠道粘膜中起重要免疫屏障作用正常成人空肠100个上皮细胞有20个IEL,回肠有13个,结肠只有5个,这也可能是恶性肿瘤不发生在小肠的重要因素之一。我们发现胃粘膜也有IEL。在胃部炎症和溃疡时,上皮及腺体隐窝细胞间的IEL明显增加。IEL不但参与免疫反应,而且通过伪足与上皮细胞接触,加速上皮细胞再生。电镜下胃粘膜也发现这种现象。IEL与乳糜泻(coeliac disease, CD)关系最密切。近期研究表明,第12型腺病毒与麦胶蛋白有同源性。CD病人肠道感染这种病毒后,服用麦胶数小时粘膜中IEL显著增加。在上皮细胞HLAII抗原糖蛋白分子作用下与TCR结合,激活TCRαβlEL,发挥细胞毒作用,导致肠粘膜萎缩,引起脂肪吸收不良和腹泻等一系列临床症状。增加的TCRγδIEL调节 TCRαβ的杀伤作用。停服含麦胶食物后,TCRαβIEL明显减少,上皮细胞再生恢复,临床症状消失。CD病人出现疣状胃炎也是IEL参与的免疫反应结果。CD病人的肠道淋巴瘤也是来自IEL增殖。器官移植后的宿主排异反应、结肠炎、热带性腹泻、牛奶过敏和某些自身免疫性疾病均有IEL增加。也有人发现克隆氏病和溃疡性结肠炎患者结肠IEL细胞毒性作用明显减弱。当然,IEL增加是继发或是原发,是否IEL是这些疾病的病因,临床治疗和诊断价值如何,还不清楚。而且IEL受年龄、抗原、免疫调节 剂(考的松对IEL无影响,环磷酰胺显著降低IEL数量)等因素影响,因此需要深入进行研究。
2.粘膜固有层T淋巴细胞在局部体液免疫中起重要调节作用在GALT中有开关性T淋巴细胞使生发中心的淋巴母细胞转化成IgA产生细胞。这些细胞减少或功能缺乏可导致免疫球蛋白A缺乏。有人分离出克隆氏病和溃疡性结肠炎病人固有层T淋巴细胞进行研究,发现辅助性T淋巴细胞减少,抑制性T淋巴细胞显著增加,可能导致局部免疫失调,引起细胞毒性或迟发性过敏反应等,致使炎症和溃疡发生。
3.胃肠道肿瘤细胞中T淋巴细胞研究倍受重视我们及国内外一些报道均证明胃癌组织中T淋巴细胞显著增加,且其细胞毒性大于非癌组织。胃癌病人周围血T淋巴细胞毒性低于粘膜T淋巴细胞。但有人发现胃癌组织中T淋巴细胞的ADCC作用较弱。提示粘膜T淋巴细胞可能直接通过细胞毒作用或通过释放淋巴因子对癌细胞有杀伤作用。近年来有人将癌组织中提取和分离出具有细胞毒作用T淋巴细胞,体外加入IL-2,促其增殖,再注入病人体内进行治疗,取得明显疗效。
4.上皮细胞的MHC表达也与临床疾病密切相关有人发现克隆病、溃疡性结肠炎、放射性和感染性结肠炎和结节 病性肠炎患者小肠和结肠HLA-DR明显增加,而且不成熟的腺体隐窝细胞也有表达。CD急性期和复发时HLA-DR表达明显增加,缓解期明显减少或恢复正常,说明MHC的固有性和变易性所导致的免疫反应的复杂性,在消化道疾病的发生和发展中起着重要调节 作用。
第五节 癌胚抗原的免疫细胞化学
一、癌胚抗原的特点
癌胚抗原(carcinoembryonic antigen, CEA)是分子量约20万的糖蛋白,具有二级以上结构。不同肿瘤中提取的CEA虽然抗原性相似,但所含唾液酸及其它糖组分的含量不一定相同,故有多个抗原决定簇,能与非特异性反应抗原NCA、NCA-2和正常胎儿粪抗原等发生交叉反应。NCA存在于正常肺、胰腺、粒细胞、单核细胞及巨噬细胞内,也存在于正常肠粘膜、胃粘膜肠化生腺体细胞及胆汁内。临床血清学检查CEA对结肠癌、肺癌、胰腺癌、胃癌及其它腺上皮性恶性肿瘤等的诊断有较大价值。免疫细胞化学研究可以明确CEA的定位和分布,也可以通过组织切片和分泌物涂片进行临床诊断和鉴别诊断。
二、癌胚抗原的免疫细胞化学染色
1.组织加工有人提出用冰冻切片进行CEA免疫细胞化学染色。由于非特异性荧光和需要一定设备条件,有人改用福尔马林固定和胰酶消化的方法。从我们的体会看,福尔马林固定后的切片CEA的部分抗原决定簇被遮盖,阳性结果显着受到影响。但是用冷酒精固定后的组织切片,CEA的阳性率明显升高,而且结果仍很清晰。goldenbery等同时进行CEA酶标记组织,而福尔马林固定的组织切片中CEA检出范围为3.0~7.0ng/g组织,酒精固定的组织切片比福尔马林固定者敏感2~3倍。有趣的是我们用酒精固定26个月的切片进行染色,效果仍然很好。说明冷酒精固定法便于进行回顾性研究。虽然酒精固定后组织收缩比较明显,但不影响组织结构及形态,而且可以进行多种抗原的定位研究,操作简单,是值得推荐的一种组织固定方法。冷酒精固定方法和步骤同抗体产生细胞的研究。
2.染色方法的选择根据实验条件和抗体特点选择染色方法。PAP和ABC技术可以采用,但试剂价格较昂贵,步骤较复杂。我们认为间接荧光或间接酶技术即可获得满意结果。间接酶染色技术步骤如下:
(1)冷酒精固定的组织石蜡包埋,组织切片,常规脱蜡后在PBS中放置5min,过一次蒸馏水清除玻片上的沉淀物后风干,加含3%H2O2甲醇一滴在切片上,放置20min后再PBS冲洗3次,过蒸馏水后风干。
(2)加稀释好的兔抗CEA血清(稀释度根据染色工作效价)在37℃湿盒内放置45min。
(3)PBS清洗3次后风干,再加HRP标记物的羊抗兔IgG(稀释度也要根据染色工作效价),37℃湿盒内放置45min。
(4)PBS清洗3次后加新鲜配制的含3%H2O2pH7.6Tris缓冲液(10ml溶液中含二氨基联苯胺5mg)中暗处反应5~8min(边反应边在显微镜下观察),自来水冲洗,用1%甲基绿复染2~5min,再次自来水冲洗,常规脱水、透明和封片,在光镜下观察。
3.阳性结果判断及计数检查前应当对CEA的分布有一定理性认识,而且用正常结肠组织和阳性组织作对照观察。CEA以三种形式出现在胃肠道组织切片中:①腔面分布。沿腺腔面的胞浆有棕红色酶着色。这是胃粘膜中肠上皮化生腺体、高分化腺癌和正常结肠腺体的CEA分布形式。②胞浆分布。在低分化粘液细胞癌中,CEA多位于胞浆。③粘液分布。在高分化腺癌的腺腔和粘液细胞癌周围的粘液中有CEA着色。
4.腹水免疫细胞化学染色临床上鉴别良恶性腹水可采用免疫细胞化学技术。抽取200~300ml腹水,离心后取细胞沉淀进行直接涂片、干燥、酒精固定后采用间接荧光染色。具体的方法是:在腹水涂片上加兔抗CEA抗血清(1:25稀释,稀释液为BPS缓冲液),在37℃湿盒内放置45min后BPS冲洗,共10min,再加入FITC标记的羊抗兔IgG(1:20稀释,稀释液为0.1%伊文氏蓝缓冲液),在37℃湿盒内放置45min后,PBS冲洗3次,共10min,用50%甘油封片,荧光显微镜观察。有绿色荧光阳性细胞的片子再进行HE染色,做对照观察和判断。也可以将细胞沉淀物在试管内直接进行间接荧光染色(方法同T淋巴细胞染色)。我们发现,不论采用哪种方法,都可能出现非特异性着色。少数淋巴细胞也能出现荧光或酶着色。其机理尚不清楚,如果采用伊文氏蓝作对比荧光染色,可明显减少非特异性荧光,而且淋巴细胞较小,腺癌细胞较大,有利于进行鉴别诊断。
三、临床意义
免疫细胞化学技术可以确定CEA的组织发生部位,根据阳性特点可以判断癌细胞的位置。我们的研究发现正常结肠组织CEA为弱阳性,多非常清晰分布在腔面。但结肠癌组织中CEA着色带较宽,多为强阳性,而且不规整。对胃粘膜的研究发现正常胃腺体均为阴性,肠化生腺体细胞弱阳性。胃腺瘤细胞也含有CEA。70%以上胃癌细胞CEA强阳性,特别是粘液细胞癌,光镜下癌细胞分散浸润,无法确定其转移及浸润范围。用免疫荧光或免疫酶技术进行染色,根据阳性细胞分布可作出正确判断。在肝脏或其它部位转移癌有时因细胞分化不良,无法确定其组织来源。如果用免疫细胞化学染色,发现CEA阳性细胞说明来源于腺上皮的癌肿,可能来自胃肠道或卵巢等组织。用胸腹水进行免疫细胞化学染色对临床诊断有实用价值。Walts对26例肿瘤病人渗出液和抽吸液离心后做免疫酶染色,发现13例有CEA阳性细胞。11例常规细胞学检查阴性的肿瘤病人发现8例胸腹水中有CEA阳性细胞。如果胆高CEA抗体的特异性,改进组织加工方法,排除非特异性着色,可望提高诊断价值。已经有人在血清学监测CEA诊断胃肠道肿瘤的基础上,将CEA标记125I进行放射扫描定位诊断和用CEA标记131I或抗癌药物进行肿瘤治疗的报道。
第六节 胃肠道溶菌酶
一、溶菌酶在胃肠道的分布
消化道含有大量酶类,这些酶多由胃肠道粘膜中的相应细胞产生和分泌。用免疫细胞化学研究酶的分布及含量改变对某些消化道疾病的病因和诊断有较大价值。近年来,对溶菌酶的研究较多。以往的研究认为溶菌酶是粒性白细胞所分泌。现在发现巨噬细胞、单核细胞和血清中含有溶菌酶。用免疫细胞化学染色发现胃肠道某些腺体细胞也能分泌,且在不同病变中出现不同分泌特点。
二、溶菌酶的免疫细胞化学染色特点
1.组织固定和加工用冰冻组织切片可直接进行溶菌酶免疫细胞化学研究。用冷酒精固定,4%福尔马林缓冲液或1.5%戊二醛固定均能进行免疫细胞化学染色。但浸蜡时温度不能超过60℃,载玻片应涂薄层明胶以防组织切片脱落。载片后,组织切片应放在50~56℃的烤箱中干燥但不能放在底层,因烤箱底层温度不均匀。组织切片应避免接触含油类的手和容器。组织块应放在4℃密闭容器内干燥保存。脱蜡一定要完全。
2.染色方法的选择根据具备的抗体和标记抗体,免疫荧光和免疫酶技术均可采用。间接法、PAP法和ABC等方法均可以选择。大部分报道多采用冷冻切片和ABC染色方法。ABC方法特异性强,敏感性高,非特异性染色少。目前国内已有ABC试剂盒生产。普遍认为国外Vectastain 实验室生产的Vectastain Elite ABC kit试剂盒较好,其敏感性比Vectastain ABC peroxidase kit高5倍。如果加大第一个抗体的浓度,可进行快速染色,整个染色过程只需30min。如果要进行双标记染色,可在DAB显色液作用后组织切片再进行另一种抗体染色,最后在DAB显色液中加氯化镍,使阳性部位显示紫色。与DAB显示红棕色比较,反差明显。
3.ABC染色步骤叠氮钠能抑制过氧化酶活性,不宜用以稀释ABC试剂盒中的试剂。第一抗体应用0.1%结晶状的牛血清白蛋白溶液稀释。所用缓冲液最好新鲜配制,ABC试剂用玻璃瓶装的蒸馏水稀释,去离子水可能含过氧化酶抑制剂,能降低敏感性,不宜采用。具体步骤是:①新鲜组织冰冻切片后空气干燥或风干10min。②切片用丙酮或95%酒精固定10min后PBS冲洗3次,共10min。(也可先固定,后切片,再清洗)。③在0.3%H2O2甲醇中放置20min后PBS冲洗3次,每次5min。④用正常兔血清稀释孵育20min后,用滤纸吸取过多的血清,并擦干载片中组织周围的液体,但不能使组织干燥,并用彩色笔在组织周围圈画以防抗体液流失。⑤加鼠抗溶菌酶稀释抗血清,在室温下放置30min或在4℃过夜后BPS洗10min。⑥加生物素化的兔抗鼠血清稀释液,在室温下放置30min后PBS洗20min。⑦加稀释好的Vec-tastain Elite ABC试剂盒中的AB混合液(在使用前30min配好),再孵育30min,PBS洗10min。⑧组织切片在含0.1%DAB(1mg/ml)和0.02%H2O2的0.1mol/l pH7.6 Tris缓冲液中反应2~7min,自来水冲洗5min(在显微镜下观察结果,决定反应时间)后甲基绿或苏木精对比染色,脱水和封片,显微镜观察。
4.结果判断溶菌酶主要分布在腺体细胞胞浆内,其中以潘氏细胞和杯状细胞中最明显,也可以分布在腔面或粘液中。炎性组织中粒性白细胞、巨噬细胞等炎性细胞浸润较多,也有明显着色。但是这些细胞多位于固有层内,即使个别细胞位于上皮层,其形态与腺体细胞不同,容易鉴别。当然,这些阳性细胞需与内源酶引起的着色相鉴别。
三、溶菌酶的研究的临床意义
溶菌酶的主要功能是能溶解细菌表面的糖蛋白,具有抗感染的作用。也有人认为能增加吞噬细胞作用,能与各种阴离子分子形成复合物。高浓度溶菌酶能改善细胞膜的功能。溶菌酶的研究包括组织中的分布和血清中含量测定。有人对不同病态胃粘膜进行研究,发现除正常幽门腺细胞能合成溶菌酶外,其它胃腺体细胞均无此功能。表浅性胃炎时,胃体胃窦的颈粘液细胞开始具有分泌溶菌酶的功能。肠化生腺体中的潘氏细胞、杯状细胞、不典型增生的腺体细胞也能产生溶菌酶。作者推测可能慢性胃炎时细菌等感染机会增多,是机体局部产生的对感染的调节 反应。有趣的是在胃癌细胞中也发现溶菌酶而且分化程度越高,分泌溶菌酶功能越强。转移性胃癌细胞和胃腺瘤细胞增色能分泌溶菌酶。其机理还不清楚。
有人对肠道进行研究,发现正常小肠粘膜杯状细胞和潘氏细胞能分泌溶菌酶,但含量较低。间质内粒性白细胞和巨噬细胞也有溶菌酶。但是,正常结肠和直肠上皮细胞表面和粘液腺体隐窝细胞中没有溶菌酶,固有层有溶菌酶阳性粒性白细胞。在15例溃疡性结肠炎病人中7例在结肠的直肠上皮细胞胞浆出现溶菌酶,8例克隆氏病人中只有1例阳性。作者认为用免疫细胞化学方法进行溶菌酶的定位研究有助于克隆氏病和溃疡性结肠炎病人的鉴别诊断。也有人对结肠癌进行研究,认为溶菌酶的分布与胃癌相反,结肠癌分化越高,分泌功能越低、其机理尚不清楚。
血清溶菌酶浓度的测定也曾作为无并发症的溃疡性结肠炎和活动性克隆氏病的鉴别诊断指标之一。由于80%以上血清溶菌酶多来源于粒性白细胞,不论溃疡性结肠炎或克隆氏病都可能引起周围血管局部粒性白细胞、单核细胞和巨噬细胞增多,因此,血清溶菌酶含量受到影响的因素较多,特异性不高,诊断价值有待进一步研究。
第七节 消化管壁内神经丛的免疫细胞化学
胃肠道(包括胆囊及肝外胆道)的植物性神经分布有二个来源:①外源性神经(extrinsic nerve),指神经来自胃肠道以外的其它部位。②内源性神经(intrinsic nerve),指神经来自胃肠及胆道壁内的神经丛。要应用免疫细胞化学技术对消化道内源性神经进行研究,必须先了解消化管壁内神经丛的结构。
一、内源性神经的结构
内源性神经系指消化道的壁内神经丛。在胃肠道的壁内神经丛包括两个主要的神经丛:肌间神经丛(Auerbach丛)和粘膜下丛(Meissner丛)。有的作者建议将粘膜下丛分为:最近肠粘膜肌面的Meissner丛,最近环肌内表面的称Henel丛。现较普遍采取的Furnes 和Costa 的建议,将壁内神经丛分为粘膜丛、粘膜下丛、肌深丛、肌间神经丛和浆膜下丛(图13-1)。神经节 主要位于肌间神经丛和粘膜下丛。神经丛由神经节 和节 间连接来组成,节 间连接束连接散在分布、形状不规则的神经节 ,组成图案样的网状结构。这些神经丛自食管下端的平滑肌部起,一直延伸到肛门的括约肌部,并与胆囊及肝外胆道的壁内神经丛相互连接,形成一个局部的神经系统。因此,早在19世界初期,Langley就建议将胃肠道这个局部的神经系统命名为肠道神经系统(enteric nervous sys-tem),并建议作为植物性神经系统中的,与交感和副交感神经系统并列的第三个部分。随着近代组织学技术的发展,大量实验资料证明,肠道神经系统的独特性,组织连接的复杂性和神经细胞类型的多样性,确实不同于其它两部分植物神经系统。

图13-1 肠道神经丛分布模式图
(一)神经丛的模式
在胃肠道及胆道的分层铺片,用镀银、甲基蓝、乙酰胆碱脂酶(Ache )和菸碱腺嘌呤双核苷酸黄递酶(Nicotinamide adenine dinucleotidediaphorase , NADH)染色法,可以见到壁内神经丛的全貌。由于胃肠道各段神经节 的大小、形态不同,节 间连接束的粗细和长短的不同,神经丛的模式因胃肠道的不同部位、动物的种属不同而异。甚至在同一肠段,如结肠近腹膜附着方向,神经丛的分布远离腹膜附着的方向密集。胃小弯部神经丛的分布密集,神经节 较大,而胃大亦部神经的分布极少或无,胃肠道的粘膜下丛的神经节 小,分布较较稀疏,与胆道的神经丛相似。
(二)神经元的数目和大小
胃肠道各段的神经细胞密度(每平方厘米胃肠道壁所含的神经细胞数)也有不同,虽因染色方法和肠道扩张度的不同,各家报告数字略有不同。一般神经细胞的密度似与胃肠道肌层厚度有关。肌层愈厚,神经细胞密度愈高。在哺乳类动物,结肠的神经细胞密度较小肠高。动物愈大,神经节 分布愈稀疏,单位面积内的神经细胞也愈低。在出生后的发育过程中,肌间神经丛内的神经细胞逐渐增加。新生大鼠小肠神经细胞总数为420000,至成年时增为1850000。而在小肠的单位面积内的神经元数,在新生小鼠为64345个/cm2,在成年仅为9405个/cm2。换而言之,神经细胞数的增长远远落后于肠道肌层的发育。至于出生后神经丛内新生神经细胞的来源,是通过神经细胞的分裂或其它细胞的分化还是一个有待探索的问题。
与其它植物性神经节 相比,壁内神经丛内神经细胞大小的变异较为明显。肌间神经丛内神经细胞大小的变异较粘膜下丛更为明显,如在大鼠盲肠的神经丛内,神经细胞的表面积为100~200μm2。小肠肌间神经丛内的小神经细胞明显多于大神经细胞,而在胃肠道其它各段,则以大神经细胞居多。神经细胞大小的变异是否代表不同功能的神经细胞亚群,尚不清楚。
(三)神经细胞的类型
依形态学分类:Dogiel建议将肠道神经元分为三种类型:
1、I型具有许多短的、不规则的树突和一根细而长的轴突。
2、II型有一个短而局限于节 内轴突和许多长的延伸到神经节 外的树突。
3、III型具有中等长短的树突,终止于同一或邻近的神经节 。
Dogiel认为I型属运动神经元,II型属感觉神经元。肠道神经节 内存在dogiel I型和II型细胞,还存在其它的中间型细胞,如在猫的粘膜下神经丛中,单极和双极的神经细胞占83%,多极的神经细胞占17%。这说明肠道神经细胞形态的多样性。然而对于其形态与功能的相关性,是否I型与II型分别代表感觉及运动神经元,多数学者持怀疑态度。
依所含化学物质分类:可分为含乙酰胆碱神经细胞、含胺神经细胞、含嘌呤核苷酸神经细胞和含多肽神经细胞。免疫细胞化学技术是显示含多肽神经细胞的有力工具。现已知在消化管壁内神经丛内含有血管活性肠肽、生长抑素、物质P和脑啡肽等多肽。用双重免疫染色法可证明一种以上的多肽共存于神经细胞内。
二、消化道全层铺片技术
用消化道切片结合免疫细胞化学染色固然能显示壁内神经丛的神经细胞及纤维。但由于壁内神经丛为扁平的网状结构,欲窥其全貌,则以消化道全层铺片技术进行免疫细胞化学染色效果最佳。消化道全层铺片在英文文献中通常称为whole mount stretch preparation,即整装撕片。即根据消化管壁内神经丛的结构特点,分纵层肌、环层肌、粘膜下层等分层撕开铺片,以暴露不同的壁内神经丛。以肠道为例,简述消化道的分层铺片技术。
动物麻醉后,用Zamboin’s液行主动脉灌注固定,剖腹取任何一段肠管放入上述固定液中4℃下3h,然后移至4%多聚甲醛液固定3h,再移至20%蔗糖4℃过夜,于次日行全层铺片。选择一大小适宜的吸管或玻棒穿入肠管,使其被动扩张,然后用钟表镊在肠系膜附着处沿肠管纵轴划痕,用镊尖沿划痕轻轻剥离分离纵肌层,将剥离的纵肌层放在载玻片上(浆膜面向下)。在解剖显微镜下,用镊尖轻挑去附于神经丛上的环层肌,即得纵、环肌之间的肌间神经丛。再将肠管的粘膜面向外翻套在吸管或玻棒上,用镊子或手术刀反复刮去表面的上皮层,即可获固有层表面的粘膜丛,重刮时刮去表面的粘膜层,即可暴露粘膜下层的粘膜下神经丛。
撕片放入0.1mmol/L的PBS溶液中,等待进行免疫染色。其步骤与切片染色同,只是由于撕片较厚,为增强抗体的穿透性,常于染色前在系列酒精中反复脱水后,再进行免疫染色。一般撕片进行免疫染色地漂浮法为佳,可增加壁内神经丛与抗血清的接触。如撕片数量少,为节 约抗血清也可用载片法,此时载玻片上需涂抹一层粘附剂如铬矾明胶或多聚赖氨酸,以免撕片在染色过程中脱落。
第八节 肝脏疾病免疫细胞化学
一、乙型肝炎免疫细胞化学
乙型肝炎是由乙型肝炎病毒(HBV)引起的传染病。乙型肝炎的发病是乙型肝炎病毒与机体之间相互作用的结果。目前研究证明,乙型肝炎病毒并非直接引起肝细胞的损伤,而是由于人体感染乙型肝炎病毒后,引起细胞免疫和体液免疫的应答。因此,人们认为机体免疫应答是引起肝细胞损害的重要原因。乙型肝炎病毒侵入机体后,在肝细胞内进行复制繁殖。乙型肝炎病毒基因组DNA在肝细胞核内进行复制,转录,在合成核心颗粒后,被转运到肝细胞浆内,在通过内质网和细胞膜时合成其外壳部分,并以发芽的形式释放出肝细胞。Dane 颗粒的核心部分含有核心抗原(HBcAg),细胞核内较多,尤其是免疫抑制者更明显。在血清中,HbcAg总是与核心抗体(抗-HBc)形成复合物。故在循环血液中不存在游离的核心颗粒。Dane颗粒的外壳部分含有表面抗原(HBsAg),在释出肝细胞过程中装配上有肝细胞成分。HBcAg 和HBsAg都能引起细胞免疫及体液免疫反应,特别是HBsAg诱发的免疫反应可以引起肝细胞的损害,以细胞免疫反应起主要作用。近年来,对乙型肝炎病毒分子生物学研究证明,HBV基因组有4个可被转录的区域(或4个开放读框),称S,C,P和X区。S区又进一步分为前S1(pre-S1)前S2(pre-S2)和S基因区,主要为组成病毒外壳的三种不同的蛋白编码。前S1和前S2区肽段被认为和病毒对肝细胞的附着有关。目前已明确,HBV有5种抗原表达即HBsAg前S1,前S2,HBcAg(包括HBeAg)和HBxAg。它们在体内均可产生相应的抗体,发生免疫反应。
(一)乙型肝炎的免疫反应发病机理
人体感染乙型肝炎病毒后,可引起细胞免疫及体液免疫应答,并激发自身免疫反应及免疫调节 功能紊乱,致使病变的肝细胞产生或释放大量正常或异常的蛋白质,进一步促使免疫损害加重,使病情不断发展。
1.体液免疫反应在乙型肝炎发病中的作用体内发生HBV感染后,可以产生各种抗原,这些抗原激发机体免疫系统而产生相应的抗体,如抗-HBs,抗-HBc,抗-HBe,抗-HBs1,抗-HBs2和抗-HBx等。这些抗体能对血中的乙型肝炎病毒进行反应加以杀灭。乙型肝炎病毒抗原大多位于胞浆内(HBcAg主要位于核内),部分亦位于胞膜上及核内。因此在抗原抗体发生免疫反应过程中,受病毒感染过的肝细胞亦遭到攻击,使肝细胞受到损害。近来有人报道在肝细胞膜上存在着两种不同的受体:一种受体是能直接和前S1抗原结合,另一种受体是通过多聚人血清白蛋白(PHSA)与前S2抗原结合。前S1或S2抗体出现于HBV感染的早期血清内,具有中和病毒及阻断抗原和肝细胞结合的作用,在抗原抗体发生免疫反应过程中引起肝细胞的损伤。抗原和抗体之间量的不平衡程度决定了乙型青炎病变的程度。当抗原抗体过多时,则出现大量的抗原抗体复合物,可导致暴发型肝炎;当抗原量少,体内产生的抗体可以逐渐清除抗原,则表现为普遍型肝炎;当体内产生的抗体不足以清除抗原时出现抗原过剩,则表现为慢性肝炎;当HBV进入机体后,机体不产生的抗体,无临床症状,则为健康带毒者。目前研究认为,无球蛋白血症的患者(基本上无体液免疫反应),不仅可以发生慢性肝炎,亦可以发生急性肝炎;有些乙型肝炎患者血清中抗原抗体复合物的含量与肝细胞损害的程度不一致,因此,乙型肝炎病毒对肝细胞的损害并非完全通过体液免疫反应。
2.细胞免疫反应在乙型肝炎发病中的作用目前研究认为,细胞免疫反应是乙型肝炎病毒感染后引起肝细胞损害的主要机理。细胞免疫反应是通过杀伤性T细胞(K细胞),自然杀伤细胞(NK细胞)及抗体依赖细胞毒作用而发生。近来研究表明,在细胞免疫反应中,靶细胞抗原包括HBsAg,HBcAg,pre –S1,pre-S2及LSP(肝细胞膜脂蛋白)等。一般来说,急性肝炎靶细胞抗原可能主要为HBcAg,pre-S2,慢性活动性肝炎可能为HBcAg及LSP。近年来研究表明,HBcAg除位于肝细胞核内,也位于胞浆内及胞膜上。HBcAg位于细胞膜表面,可提供为T细胞毒的靶抗原,而且血清中抗-HBc可以和特异性细胞毒性T细胞竞争结合在肝细胞膜上的HBcAg,阻断T细胞的攻击。有人提出,HBcAg的免疫应答对HBV感染有保护作用。有人研究证明,在肝细胞膜上有HBcAg 表达者,细胞毒试验为阳性,且可被抗-HBc封闭,用抗-HBs无效。这表明位于肝细胞膜表面的HBcAg为T细胞的靶抗原。亦有人提出在肝细胞膜上仅有HBsAg,而未发现HBcAg或HbeAg,因此认为HBsAg也是T细胞的靶抗原。在细胞免疫反应中,T细胞要求对靶细胞的特异性抗原和组织相容性抗原(HLA)的双重识别。HBeAg阳性的乙型肝炎患者,肝细胞膜上HLA仅为轻度阳性,而抗-HBe阳性患者则显著增强,提高T细胞清除感染细胞的作用,这可能为干扰素抗病毒的疗效机制之一。在细胞免疫反应中,T细胞除细胞毒效应外,还有淋巴因子效应。致敏的淋巴细胞可以释放各种淋巴因子,如淋巴毒素、细胞毒因子、趋化因子、巨噬细胞移动抑制因子、转移因子等。有人发现淋巴因子可以引起肝细胞广泛坏死,呈小叶中央性或中间带分布。NK细胞在乙型肝炎发病机理中的作用仍不太清楚,亦可能参与细胞免疫反应的调节 作用。由于细胞免疫反应的不同,就出现不同类型的肝炎,表现不同的临床病理特点。如T细胞功能正常,感染病毒量多,毒力强,受感染的肝细胞多而严重,则受到免疫损伤的肝细胞多而且重,表现为急性重型(暴发型)肝炎;如果感染病毒量少,毒力较弱,则发生急性普通型肝炎;如果病毒量很少,毒力很弱,则表现为轻型或亚临床肝炎。如果T细胞呈免疫耐受状态或机体免疫机能缺陷,病毒与宿主共生,病毒在肝细胞内不断复制,感染的肝细胞不发生免疫损,则表现为无症状病毒携带者。如果在T细胞功能不足,免疫反应仅能清除部分病毒及部分肝细胞受到免疫损伤,未被清除的病毒可以反复感染肝细胞并进行复制,于是不断出现肝细胞的损害,表现为慢性肝炎,特别是慢性活动性肝炎。
(二)乙型肝炎与自身免疫反应
正常人由于T细胞对自身抗体系统的调控,在清除老化或破坏的肝细胞时,虽可产生自身抗体,但并不发生自身免疫性疾病。在慢性肝炎,特别是慢性活动性肝炎时,由于T细胞免疫机能缺陷,乙型肝炎抗原(包括HBsAg,HBcAg及HBeAg)与宿主肝细胞表面或内部的蛋白质相互作用,形成含自身组织蛋白的抗原,具有较强的免疫原性,可引起持续的自身免疫反应;也可能由于病毒使机体免疫系统稳定性发生紊乱,细胞免疫失去调控,体液免疫反应亢进,对宿主的自身组织产生抗体,发生自身组织免疫反应,引起肝细胞损伤。有研究表明,慢性活动性肝炎的患者出现对肝细胞表面肝特异性脂蛋白的特异性细胞免疫反应。有人报道,根据肝炎患者肝细胞上免疫球蛋白的沉积,提示存在与HBsAg无关的自身免疫机理。有人认为,肝炎患者病毒性损伤可释放肝特异抗原,使宿主致敏,并使肝损伤持续存在。因此,自身免疫反应在慢性活动性肝炎发病中具有一定的作用。目前已知在慢性活动性肝炎患者常出现某些自身免疫现象,如常伴有关节 炎、皮疹、肾小球肾炎、慢性甲状腺炎及干燥综合症等自身免疫性疾病,患者血清中IgG、IgA及IgM明显升高,血清中可查到抗平滑肌抗体、抗核抗体、抗线粒体抗体、抗肝细胞膜特异性脂蛋白抗体及类风湿因子等自身抗体;有15~30%的患者可查到狼疮细胞。
(三)乙型肝炎肝细胞内病毒抗原的定位及分布
近年来,对乙型肝炎病毒(HBV)分子生物学研究表明,HBV基因组有四个开放读框(Open reading frame, ORF),其中S基因区能编码HBV外壳的结构蛋白,即小S蛋白(主蛋白,HBsAg),中等S蛋白(前S2抗原)和大S蛋白(前S1抗原),它们都具有较高的免疫原性。P区编码具有反转录酶活性的病毒DNA多聚酶。X区编码145至154个氨基酸的多肽,编码蛋白为HBxAg。C区编码HBV的核心部分,即HBcAg 和HBeAg。目前通过免疫组化及免疫电镜等技术均可观察到HBV各种抗原在肝细胞定位及分布状态。
1.HBsAg pre –S1,pre-S2在肝细胞内的分布HBsAg ,前S1和前S2抗原在乙型肝炎,特别是慢性活动性肝炎的肝细胞内检出率为52~65%。HBsAg ,前S1和前S2抗原阳性经常出现于同一部位,甚至同一细胞内。前S1阳性反应比HBsAg和前S2强。有的病例三者并非同时出现,并非在同一位置。少数情况下,HBsAg 阳性,而前S1和前S2阴性,反之,HBsAg 阴性,而前S1和S2阳性;绝大多数情况下前S1和前S2并存在同一部位或同一细胞之内,少数情况下,HBsAg ,前S1阳性而前S2弱阳性或阴性。HBsAg、前S1和前S2抗原主要位于乙肝的肝细胞浆内,部分位于胞膜上,少数位于胞核内。HBsAg ,前S1和前S2抗原阳性物质在肝细胞内的分布大致有三种形态:①包涵体型:阳性物质聚集成团块状,轮廓清楚,呈圆形或卵圆形,位于核的一侧,或者只占据胞浆的小部分,或占据胞浆的大部分,将核推向一侧,此型最为多见;②全胞浆型或弥漫型:阳性物质均匀分布于肝细胞的胞浆内,核往往为阴性位于中央,此型亦较常见;③胞膜型或周边型:阳性物质沿着胞膜或胞膜内侧分布,有人把胞膜型再分为胞膜抗原I型和II型,前者主要表现为S抗原聚集在肝窦侧的肝细胞膜上,呈线条状排列;后者主要累及整个肝细胞膜,呈颗粒状或串珠排列。上述S抗原在肝细胞内分布的三种类型往往是两者或三者联合出现,只是以某一种为主而已,单独存在者少见。S抗原阳性细胞的分布有三种类型:1)散在型,在切片中只见少数散在的阳性细胞,此型多见于慢性迁延性肝炎或静止期肝硬变组织内;2)局灶型,阳性细胞呈簇分布于切片的某一区域,此型多见于急性轻型肝炎或慢性活动性肝炎的组织内;3)弥漫型,多数阳性细胞弥漫分布于切片内,此型多见于慢性活动性肝炎,急性重型肝炎或肝硬变的整个结节 内。不同病例S抗原反应强度及阳性细胞检出率是不同的,就是同一病例不同部位也不尽相同。S抗原阳性物质反应的强弱取决于S抗原的含量。
2.HBcAg 和HBeAg在肝细胞内分布HBcAg多见于乙型肝炎、肝硬变的肝细胞内,特别是肾脏移植病人,有内HBcAg检出率特别高。一般来说,在慢性肝炎HBcAg的检出率在10%~30%不等,其检出率明显低于HBsAg。这可能是由于HBcAg和抗-HBc在核内形成免疫复合物,HBcAg被封闭之故。HBcAg多位于肝细胞的胞核内,少数位于胞浆内及胞膜上。HBcAg阳性物质位于核内常呈细颗粒状均匀分布,少数为斑点状或网状;而在胞浆内则为细颗粒状或絮状;在胞膜上则为均匀细颗粒状。经常出现的是以核型、浆型和膜型同时存在于一个肝细胞内,亦可单独存在。HBcAg阳性肝细胞的分布和HBsAg相似,亦分散在型、局灶型和弥漫型。局灶型经常见于慢性活动性肝炎;弥漫型经常见于肾移植的肝;散在型经常见于急性肝炎或迁延性肝炎。HBeAg阳性物质在肝细胞内的分布状态与HBcAg相似。HBeAg 和HBcAg经常位于同一细胞核内,用罗达明标记双染色证明HBcAg和HBeAg之间有密切关系。HBeAg阳性主要见于HBsAg阳性的慢性活动性肝炎的肝细胞内。
3.HBxAg在肝细胞内分布HBxAg经常见于慢性肝炎的肝细胞内,其检出率为65%左右,比HBcAg和HBsAg高。特别在慢性活动性肝炎检出率更高,约73%;而慢性迁延性肝炎则为43%左右。HBxAg阳性物质为均匀细颗粒状,主要位于肝细胞的胞浆内,少数位于胞核内及胞膜上。不同病例HBxAg阳性物质的分布及阳性反应强度不同,就是同一病例不同部位其结果亦不尽相同。HBxAg阳性肝细胞的分布状态和HBsAg相似,亦呈散在型,局灶型和弥漫型。在慢性活动性肝炎以局灶型多见,其次为弥漫型。有些病例,HBxAg阳性细胞围绕小血管分布,有的则沿着纤维隔分布。HBxAg阳性物质亦见于少数肝内胆管上皮内及kupffer细胞内。
4.IgG(抗-HBc)在肝细胞内分布用免疫荧光及免疫酶技术证实在肝炎组织中存在Igg ,这种IgG 可能就是抗-HBc,该抗体经常和HBcAg以复合物的形式存在于肝细胞核内,少数也见于胞浆内及胞膜上。Rey(1979)还证明这些IgG只见于含有HBcAg 的肝细胞核内。IgG(抗-HBc)阳性物质的分布及其阳性细胞的分布同HBcAg。
二、肝硬变免疫细胞化学
肝硬变或称肝硬化(liver cirrhosis)是多种原因引起的慢性肝脏疾病,其中原因之一是和HBV慢性感染有关,特别在中国HBV可能是引起肝硬变的主要原因。HBV感染引起乙型肝炎,部分病例变成慢性活动性肝炎,进而转变成肝硬变。其中大部分为门脉性肝硬变(小结节 型肝硬变),小部分为坏死后性肝硬变(大结节 型肝硬变)。近年来在我国通过临床、病理及免疫病理的研究证明,HBV感染与肝硬变的发生有十分密切关系,在肝硬变内HBsAg检出率为70%~90%。世界其它一些国家和地区,如日本、印度、非州、香港等也有类似的报道。肝硬变的发生可能是由于机体免疫机能不足,不能将HBV完全杀灭和排除。在机体内HBV不断复制繁殖,并通过免疫机制使肝细胞反复遭受破坏,以及肝细胞结节 状再生,纤维组织不断增生,形成纤维隔,致使正常的肝小叶结构破坏,最后形成肝硬变。下面用免疫细胞化学(PAP),亲合免疫细胞化学(ABC)等方法对HBV抗原、纤维结合蛋白(FN)、III型胶原和细胞角蛋白在肝硬变组织内定位及分布进行描述。
(一)肝硬变组织内HBV抗原的定位及分布
用免疫细胞化学(PAP)及免疫亲合素(ABC)方法在肝硬变组织内对HBV抗原(HBsAg ,pre –S1,pre-S2,HBcAgHBxAg)进行了检测,观察了它们在肝细胞,kupffer 细胞内等定位和其分布状态。
1.HBsAg 、pre –S1和pre-S2在肝细胞内分布HBsAg在肝硬变组织中检测率为70%~80%,其中86%伴有肝细胞不典型增生;pre –S1和pre-S2的检出率为60%~70%,其中84%伴有肝细胞不典型增生。HBsAg 、pre –S1和pre-S2抗原经常出现于肝硬变组织的同一部位,甚至同一细胞内。少数情况下,HBsAg阳性,而pre –S1或pre-S2阴性,反之,HBsAg 阴性,而pre –S1或pre-S2阳性。HBsAg 、pre –S1和pre-S2抗原主要位于肝细胞浆内,部分位于膜上,少数位于核内。在部分肝硬变病例中,HBsAg 、pre –S1和pre-S2在也见于kupffer细胞内及肝内胆管上皮细胞内。
2.HBcAg 在肝细胞内的分布HBcAg 在肝硬变组织内的检出率为20%左右,其中82%伴有肝细胞不典型增生。HBcAg 阳性检出率明显低于HBsAg 、pre –S1和pre-S2,这可能是由于HBcAg 和抗-HBc在核内形成免疫复合物,以至HBcAg 被封闭之故。HBcAg 主要位于肝细胞核内的形态表现为分布与肝炎的相似。在少数病例HBcAg 阳性物质也见于汇管区的纤维组织内及肝窦壁上。
3.HBxAg 在肝细胞内的分布HBxAg在硬变组织的检出率为80%左右,其中85%伴有肝细胞不典型增生。HBxAg的检出率和HBsAg相似。HBxAg阳性物质呈细颗粒状。主要位于肝细胞浆内,少数位于胞核内及胞膜上。HBxAg在肝细胞内的形态表现及阳性细胞的分布状态与HBsAg相似。有部分病例HBxAg沿着肝硬变的纤维隔分布。HBxAg阳性物质也见于肝内胆管上皮细胞及kupper细胞内。
4.IgG(抗—HBc )在肝细胞内的分布在肝硬变组织内可观察到抗-HBc的存在,其阳性率与HBcAg相似。该抗体经常和HBcAg以复合物的形式存在于肝细胞核内,少数也见于胞浆内及膜上。抗-HBc阳性物质在肝硬变细胞内的存在和阳性细胞的分布状态与HBcAg相同。
(二)肝硬变组织内纤维结合蛋白(FN)的定位及分布
纤维结合蛋白(fibronectin, FN)是一个非胶原性的大分子糖蛋白。近年来研究发现它与损伤修复及器官硬化有密切关系。在肝硬变及慢活肝的组织内FN沉积增加,可能与肝硬变时纤维组织隔形成有关系。在肝硬变组织内,FN阳性物质位于肝细胞内及kupffer细胞内,其阳率分别为59%、65%。FN阳性物质弥漫分布于胞浆内,阳性细胞多呈三五成群地分布于假小叶边缘、中央静脉旁及肝实质内灶(片)状杯死区域的附近。汇管区及纤维隔内可见数量不等的FN阳性的组织细胞和纤维母细胞。此外。有的病例肝窦壁、血管内皮及小胆管基底膜也呈阳性反应。FN阳性检出率和HBsAg阳性呈正相关,在FN阳性病例中有80%HBsAg阳性。而活动性肝硬变FN阳性明显高于非活动性肝硬变(P<0.01)。上述结果表明,在由HBV感染引起的肝硬变过程中,FN参与了肝硬变的形成。
(三)肝硬变组织内III型胶原的定位及分布
在肝硬变时,I、III型胶原增加,这与肝纤维化有密切关系。实验结果证明,在惭性迁延性肝炎→慢性活动性肝炎→肝硬变之间,Ⅰ、Ⅲ型胶原的分布呈逐渐增加的趋势。除汇管区Ⅰ、Ⅲ型胶原增多外,中央静脉周围及小叶内坏死区、炎症区也增多,形成小叶内纤维化与从汇管伸向小叶内纤维组织相连形成纤维隔。在部分肝硬变病例,肝细胞内有Ⅲ型胶原阳性反应。在纤维隔及假小叶的窦壁上Ⅲ型胶原阳性率为100%,在肝细胞内为34%。Ⅲ型胶原在宽大纤维隔内呈弥漫密集分布,在窦壁上为连续线状分布,在肝细胞浆内呈弥漫分布。阳性肝细胞主要位于小叶边缘或近纤维隔处。动物实验证明Ⅰ、Ⅲ胶原是由肝细胞合成产生的,并参与肝硬变的形成。
(四)肝硬变组织内角蛋白定位及分布
在正常肝脏中肝细胞和胆管上皮细胞各有其特征性的细胞角蛋白(CK)组型,它们是各自形态发生的过程中建立的。研究结果表明在肝硬变组织中有81%呈角蛋白阳性反应,但阳性反应程度各病例是不相同的。CK阳性的肝细胞主要位于汇管区周围。尤其是碎屑状肝细胞坏死附近,并常伴有肝细胞小管状化生、弧立肝细胞团块形成及胆管或胆小管增生,它们之间在细胞形态和阳性强度上有移行关系,有的病例整个假小叶CK阳性。部分肝小多角型细胞也呈阳性反应。在肝硬变组织内CK阳性反应与HBsAg阳性呈正相关。CK阳性的肝硬变中绝大多数HBsAg也阳性,这一结果HBV感染所致的慢性肝脏病变可引起CK的异常表达。
三、肝癌免疫细胞化学
原发性肝细胞癌(简称肝癌)是世界上较常见的恶性肿瘤之一,特别在非洲和亚洲一些地区肝癌发病率较高。自从发现乙型肝炎抗原(HBAg)以来,给HBV与肝癌发病关系的研究开辟了新的途径。近年来用免疫细胞化学技术及分子杂交技术对HBV与肝癌发病关系的研究更加深入和广泛,并取得一定成果。全世界各地通过大量的流行病学、免疫病理学、分子遗传学等研究结果表明,HBV感染与肝癌的发病有密切关系,普遍认为HBV是肝癌发病的主要原因。目前尚不完全清楚HBV致癌机理,是具有直接致癌作用或间接致癌作用,这有待进一步研究。
(一)HBV与原发性肝癌的流行病学证据
HBV与原发性肝癌关系的研究已有20余年,目前对HBV作为肝癌病因的证据日益增多,特别是对HBV的分子生物学的研究表明,HBV可能具有直接致癌作用。如下事实可作为临床学和流行病学的证据:
(1)原发性肝癌常发生在HBV流行区,而非流行区则发病率很低。
(2)血清学研究表明:生活在HBV流行区的肝癌病人50%~90%HBsAg阳性,而对照组仅为5%~15%;抗-HBc为80%~90%,而对照组为15%~35%。近年来研究表明,肝癌病人抗-GBx的检出率在85%左右。而对照组很低。些标志物被认为是目前正在发生HBV感染或先前有HBV持续感染的证据。甚至在欧美肝癌发病率很低的国家,肝癌病人HBsAg,抗-HBc和抗-HBx检出率也明显比对照组高。从大量的研究结果表明,在HBV流行区HBV携带者肝癌发病的相对危险性比非携带者高十倍,甚至几百倍。
(3)在HBV流行的人群中,HBV携带者与肝癌家庭聚集性的早期观察,生活早期婴儿从母亲传播感染是HBV慢性携带者,后代亦易成为慢性携带者。Larouze 等发现塞内加尔患肝癌的母亲中71%HBsAg阳性,而相应的对照组仅为13%,在朝鲜和我国台湾省也观察到同样的现象。预防母-婴的HBV传播,对预防肝癌的发生具有重要意义,从研究家族病例来看,大多数最终发生肝癌的个体在出生时或是出生后第一年内从携带HBV的母亲或兄弟姐妹间获得感染。
(4)约80%的肝癌病例发生在肝硬变或慢性活动性肝炎的基础上,而肝硬变和慢性活动性肝炎双往往由HBV慢性持续性感染引起的。在亚洲和非洲一些地区,肝硬变病人90%以上HBsAg阳性,慢性活动性肝炎病人75%以上HBsAg阳性,而对照组只有6%~14%HBsAg阳性。
(二)肝硬变与肝癌的关系
大多数肝癌病合并有肝硬变,部分肝硬变病人可发展为肝癌,这一事实早已被人们所注意。大多数报道肝癌合并肝硬变为80%~90%。肝癌合并肝硬变的类型主要为坏死后大结节 型肝硬变,约占70%~80%,少数为混合型,合并小结节 型肝硬变少见。肝硬变发展为肝癌的百分率,各报道差别较大,但大多数报道为20%左右。坏死后大结节 型肝硬变与乙型肝炎病毒感染有密切关系,HBsAg阳性率很高,达70%~80%。Blumberg等(1977)报道在84例肝硬变中有24例HBsAg阳性,其中6例(25%)发展成肝癌。Obata(1980)指出,HBsAg阳性的肝硬变有23%发生癌变,Nayak(1977)报道,肝硬变发生癌变的机会和其HBsAg阳性有关,HBsAg阳性的肝硬变发生肝癌的机会为51%,而与HBsAg阳性的大结节 型肝硬变有密切关系。大结节 型肝硬变常伴有肝细胞的不典型增生,而伴有不典型增生的肝硬变HBsAg阳性检出率很高,表明肝细胞不典型增生与HBsAg慢性持续感染有密切关系。有人认为不典型增生的肝细胞是一种癌前期病变。
(三)肝细胞肝癌及癌周肝组织内HBV抗原的分布
目前用组织化学、免疫组织化学及免疫电镜等技术可以在人肝癌及癌旁肝细胞内检测到HBsAg、前S1、前S2、HBcAg(HBeAg)及HBxAg等。
1.肝癌及癌周肝组织内HBsAg定位及分布在肝癌组织内,HBsAg阳性率一般来说比较低,大多数报道其阳性率在10%~15%,少数报道阳性率可高达25~44%。肝癌细胞内HB-sAg阳性主要见于分化好的肝癌病例,少数亦见于中度分化及分化差的肝癌病例。一般来说,癌周肝组织内HBsAg阳性率明显高于癌组织。大多数文献报道,癌周肝组织内HBsAg阳性率为60%~80%,少数报道在90%以上。癌周肝组织内HBsAg阳性主要见于癌周肝硬变中,特别是大结节 肝硬变中。这一结果表明,HBV与肝癌的发生有密切关系。肝癌及癌周肝组织内HBsAg阳性的形态和分布状态,不同病例表现不同,就是同一病例不同部位也有很大差异。HBsAg阳性细胞分布亦不规律。绝大多数HBsAg阳性物质位于胞浆内,部分位于胞膜上,少数位于核内。HBsAg阳性物质呈细颗粒状、絮状或网状。HBsAg阳性物质在细胞内分布有三种类型:全胞浆型,阳性物质充满整个胞浆;包涵体型,阳性物质集聚成团,位于核旁一侧;胞周型或核周型,阳性物质沿着泡膜或核膜分布,呈环状。在肝癌及癌周肝组织内包涵体型或全胞浆型较多见。HBsAg阳性细胞的分布有三种类型:弥漫型,多数阳性细胞弥漫分布于切片内;局灶型,少数阳性细胞集聚于某一区域;散在型,阳性细胞较少,孤立的或零散的分布于切片内。一般来说,癌周肝组织HBsAg阳性反应强度和阳性细胞检出率比癌组织高。癌组织检出率低的原因,可能是由于癌组织不适于HBsAg的复制,或是由于HBv DNA和宿主DNA发生整合,而HBsAg不易表达所致。至于HBsAg在肝癌发病中的作用,目前尚不清楚。一般认为HBsAg作为靶抗原,通过免疫反应,造成肝细胞的损伤,肝细胞增生,不典型增生,最终可能导致癌变。
2.肝癌及癌周肝组织内前S抗原的定位及分布对肝癌及癌周肝组织内前S(pre-S1和pre-S2)抗原的研究远不及对HBsAg的研究。近来,国内外文献有少数报道。在肝癌组织内前S1和前S2抗原的检出率为20%左右,略比HBsAg检出率高。在癌周肝组织前S1和前S2抗原的检出率为60%左右,这个和HBsAg的检出率基本相似。在绝大多数HBsAg阳性的病例前S1和前S2抗原亦阳性,而在部分前S1和前S2阳性病例,HBsAg却呈阴性反应。因为在基因构成上,前S1包括前S2和HBsAg,前S2包括HBsAg的部分,故前S1和前S2的表达要比HB-sAg强。用免疫组化方法染色,前S1和前S2阳性物质呈棕红色呈均匀细颗粒状,主要位于癌细胞及肝细胞的胞浆内,有些病例则和/或位于胞膜上及核内。阳性物质反应的强弱和前S1或前S2抗原的含量有关。一般来说,前S1或前S2阳性反应强度和阳性细胞检出率,癌周肝组织比癌组织强。这一规律和HBsAg相同。前S1或前S2阳性物质在细胞内的分布情况及其阳性细胞分布状态和HBsAg的基本相似。目前对前S1或前S2抗原在肝癌发病中的作用尚不完全清楚。有人研究证明,在人肝细胞膜上存在两种不同的受体,一种受体可以直接与前S1蛋白结合;另一种受体通过多聚人血清白蛋白(PHSA)与前S2蛋白结合。所以HBV通过PHSA介质结合在肝细胞上,从而形成靶抗原,通过免疫反应引起肝细胞的损伤,进而可能发生肝细胞的增生,不典型增生,最终导致癌变。
3.肝癌及癌周肝组织内HBcAg(HBeAg)的定位及分布到目前为止,在肝癌细胞内发现有HBcAg只有少数报道。所有的报道,HBcAg的检出率都不太高,大多在10%~20%左右。HBcAg和HBeAg在肝癌及癌周肝组织内不易检出或检出率较低的原因,可能是由于HBcAg 和抗HBc常以免疫复合物的形式存在于胞核内,HBcAg被封闭之故;亦可能由于HBcAg基因和宿主基因进行了整合,使HBcAg不再表达出来。HBcAg和HBeAg经常并存,因此HBeAg亦经常不易单独检出。HBcAg或HBeAg阳性物质呈均匀细颗粒状分布于胞核内,少数见于核仁内。位于核内常呈圆形或卵圆形,围绕核仁占据整个核或占据核的大部分。少数病例HBcAg阳性物质位于胞浆内或胞膜上,有的病例核、膜及浆内同时阳性。HBcAg阳性细胞的分布与HBsAg的分布相似。
关于肝癌的免疫学方面的研究,血清学方面的研究较多,组织学研究的较少。大量的流行病学和临床学方面的资料表明,肝癌患者血清中抗-HBc明显高于对照组,其阳性率高达70%~95%。用免疫组化技术在肝癌及癌旁肝组织内亦发现有抗-HBc的存在。有人证实抗-HBc为IgG,这种IgG经常和HBcAg以复合物的形式存在于细胞核内,少数也见于胞浆及胞膜上。并证实,IgG只见于含有HBcAg的胞核内,而无核内HBcAg,就无抗-HBc存在。因此,如果能测出IgG(抗-HBc),也就间接地证实了HBcAg的存在。IgG(抗-HBc)阳性呈圆形或卵圆形位于核内或以包涵体位于胞浆内。IgG阳性细胞的分布状态和HBcAg的分布相同。IgG(抗-HBc)在肝癌发病中起何作用,目前尚不清楚,有人认为IgG和HBcAg形成免疫复合的,由于免疫反应,在慢性活动性肝炎发病中和肝硬变形成中起重要作用,而慢活肝和肝硬变又是肝癌发生的重要环节 。HBcAg和抗-HBc形成的免疫复合物是否为癌变的始动因素,还有待进一步研究。
4.肝癌及癌周肝组织内HBxAg的定位及分布近年来,对HBV分子生物学研究发现了HBV另一种抗原,即HBxAg。HBxAg和肝癌发生的关系密切,已引起人们广泛的重视。目前,国内外已有少数文献报道关于HBxAg和肝癌发病的关系的研究。在人原发性肝癌组织内HBxAg的检出率大约为60%~80%,这明显高于HBsAg的检出率。在癌周肝组织内HBxAg阳性检出率在70%~80%,这和HBsAg的检出率基本相似。用PAP或ABC方法检测HBxAg,其阳性物质呈棕褐色均匀细颗粒状,主要位于癌细胞和肝细胞胞浆内,部分病例除胞浆阳性外,胞膜或核亦阳性(约20%),单独膜型或核型少见。不同病例HBxAg阳性物质的分布及阳性反应强度是不同的,就是同一病例不同部位,其结果也不尽相同。一般来说,癌周肝组织内HBxAg阳性检出率及阳性反应强度比癌组织内高。其反应强弱与HBxAg含量多少有关。HBxAg阳性细胞分布与HBsAg阳性细胞分布相似,亦分为散在型,局灶型和弥漫型。在癌周硬变组织内,HBxAg阳性细胞有时围绕小血管分布。有的则沿着纤维膈分布。在HBxAg阳性病例,有24%在癌组织内伴有HBsAg和/或HBcAg,有72%在癌周肝组织内伴有HBsAg和/或HBcAg。HBx-Ag在肝癌发病中的作用,目前尚不完全清楚。有人报道在肝癌患者血清中含有较高的抗-HBx,其检出率高达85%。Miyaki等(1986)发现在所检查的原发性肝细胞癌组织中都存在和HBV的X基因相同的DNA序列。有些作者认为,宿主细胞DNA和HBv DNA的整合是通过X基因区特殊的重组来完成的,其翻译产物-HBx蛋白(HBxAg)对癌基因具有反式激活作用,而引起细胞癌变。最近有人通过HBV的X基因在转基因小鼠中诱发肝癌的动物实验证明,HBx蛋白能够改变宿主基因的表达,并导致肝细胞癌的发生。因此,有些作者认为HBxAg在肝癌发生中具有重要作用,并认为HBV可能具有直接致癌作用。
(四)肝内胆管细胞癌及癌周肝组织内HBV抗原的分布
在原发性肝癌中,最常见的是肝细胞肝癌,而肝内胆管细胞癌比较少见,在我国大约为10%。长期以来,人们对肝内胆管细胞癌的病因及发病机理研究甚少,认识不清。早年候宝璋曾报道,胆内提管细胞癌的发生与中华分枝睾吸虫感染有关。最近有文献报道,在肝内胆管细胞癌及其癌周肝组织内检测出HBv 5中抗原(HBsAg、pre-S1、pre-S2、HBxAg和HBcAg),而且检出的阳性率很高。王文亮等报道(1993),在20例肝内胆管细胞癌中,HBxAg阳性检出率为75%,pre-S1和S2各为40%,HBsAg为10%;在19例癌周肝组织中,HBxAg阳性检出率为84%,pre-S1和S2各为47%,HBsAg t HbcAg分别为32%。在20例肝内胆管细胞癌的病例中有17例(85%)有不同HBV抗原的表达,其中HBxAg阳性检出率为80%。这一结果表明,肝内胆管细胞癌的发生与HBV感染有密切关系。HBV5种抗原在肝内胆管细胞癌及其癌周肝组织内的阳性反应及阳性细胞分布状态与肝细胞肝癌相同。肝内胆管细胞癌的发病过程可能与肝细胞肝癌不完全相同。肝细胞肝癌80%伴有肝硬变,特别是大结节 型肝硬变。一般认为大多数肝细胞肝癌是由于HBV感染→慢性肝炎→肝硬变→肝癌。而肝内胆管细胞癌很少伴有肝硬变,它的发生过程主要不是通过肝硬变这一重要环节 ,而是由慢性肝炎,肝细胞不典型增生或中间型细胞演变为肝癌。HBV是否有直接致癌的作用尚有等进一步研究。
(五)肝细胞癌中的HBV的分子生物学
近10年来,国内外对原发性肝细胞癌中乙型肝炎病毒DNA的存在,分布及意义进行了广泛的研究,并取得了可喜的成果。用southern blot 分子杂交技术及原位分子杂交技术,在肝癌患者血清中和肝癌组织中检测HBV-DNA的分布状态。用HBV-DHA基因或其亚基因标记同位素(32P、35S等)及生物素地高辛等作为探针和肝癌及癌旁肝组织中的DNA进行杂交,通过放射自显影法检测HBV-DNA存在状态(是整合或游离);原位分子杂交经过染色反应观察细胞内HBV-DNA的定位和分布状态。有人用southern blot方法检测肝癌病人血清中HBV-DNA的情况,只有少数病例血清中有微量的HBV-DNA,则慢性乙型肝炎患者血清却多为阳性,提示在HBsAg阳性肝癌病人血清中很少或没有可测出的HBV-DNA。目前,国内外已有不少文献报道,在肝癌组织中有整合的HBV-DNA。例如,Shafritz等(1981)检测了20例来自南非的肝癌患者,有15例HBV-DNA整合人宿主细胞DNA中,其中12例HBsAg阳性,3例HBsAg阴性而抗-HBs阳性。Tiollais(1981)检查了15例来自欧洲的肝癌标本,HBsAg或抗-HBs阳性病例,检查结果HBV-DNA均以整合形式存在。他们还观察了32例HBsAg阳性的肝癌病人,结果证明在所有肝癌组织中均有HBV-DNA。国内大多数报道在肝癌组织中HBV-DNA检出率为60%~80%。上述结果表明,人原发性肝细胞癌的发生和HBV感染有极为密切关系。
(六)肝癌发生中HBV分子遗传学及免疫机理
免疫病理学及分子生物学的研究表明,HBV不仅有间接致肝癌作用,而且还可能有直接致癌作用。HBV致癌作用的分子机理目前集中对于HBV的分子遗传学和分子免疫学的研究。在原发性肝细胞癌发生中,HBV致癌作用可能有两个模式:一是病毒的癌基因模式,就是表达病毒的癌基因(HBV-DNA);另一个是细胞癌基因模式,在肝细胞癌变过程中,细胞癌基因可能发生启动子插入,染色体异常(缺失、重复、易位)及点突变等。研究证明,机体感染HBV后,HBV将其本身的基因掺入到肝细胞核内,和宿主细胞基因发生整合,从而使正常的肝细胞转变为癌细胞。这需要经过一个复杂的演变过程。在肝癌的HBV-DNA整合部位,常发生染色体缺失、重复或易位。Slagle等(1990)研究发现,有44%的肝细胞癌病人发生染色体的丢失,而17P的丢失常包括抑癌基因P53的丢失,这可能是肝细胞癌发生的原因。Blum(1985)认为在HBV-DNA整合位点附近宿主细胞基因有重排现象。Tiollais等认为病毒DNA整合人宿主细胞DNA或与DNA发生重排,产生HBV激活的基因或激活细胞的原癌基因,进而导致细胞的转化,最终发生肝癌。有人通过实验研究证明病毒插入到细胞原癌基因附近,作为一种诱变剂,可能直接参与肝细胞癌的发生。Seifter等(1990)在体外进行X基因的转化实验,将HBV-DNA或X基因序列连在SV40早期启动子的加强子上,用以转化传代鼠肝细胞及传代鼠纤维母细胞,转染成功的能稳定复制HBV的肝细胞表现出恶性生长的特征,将其接种裸鼠,显示出致癌性,并激活细胞原癌基因c-fos过量表达。这提示,HBV-DNA含有致癌基因序列,可以促进细胞向恶性转化。HBV基因组中编码加强子和X蛋白的碱基序列也有某些致癌活性。尽管如此,到目前为止,HBV致癌的分子机理尚不完全清楚,有待进一步研究。
(王文亮)
参考文献
1.张忠兵,等.双标记免疫荧光法研究胃粘膜中抗体产生细胞分布.上海免疫学杂志,1983;3(2):304~305
2.张忠兵,等.正常胃十二指肠粘膜抗体产生细胞分布-冷酒精固定法免疫荧光研究.中华消化杂志,1983;3(3):167~168
3.张忠兵,等.胃癌及其周围组织抗体产生细胞的免疫细胞化学研究.中华肿瘤杂志,1984;6(5):326~328
4.ZhangZhongbing, et al. Immunocytochemical and histochemical studies on T lymphocytesand immunoglobulin- producing cells in gastric carcinoma. Chinese MedicalJournal, 1985;98(3):197~202
5.ZhangZhongbing, et al. Sc,IgA and IgA- producing cells in gastric muscosa of chronicgastritis and gastric carcinonia and their clinical significance. ChineseMedical Journal, 1988; 101(10):755~760
6.ZhangZhongbing, et al. Gastric musoca T lymphocyte, IgG-,IgM- and IgA- producingcells distribution in chronic gastritis. Biological Abstracts, 1989;87(1):2774
7.张忠兵,等.用Ia和OKT单克隆抗体研究胃癌和食管癌患者的免疫功能.解放军医学杂志,1987;12(5):352~354
8.张忠兵,等.冷冻治疗对直肠癌患者免疫功能的调节 .癌症杂志,1990;9(50:365~368
9.ZhangZhongbing , et al. Studies on gastrin in duodenal ulcer. Chinese Medical Joural, 1990;103(1):45~49
10.ZhangXueyong and Zhang Zhongbing. Antral D and G cell istribution in gastric andduodenal ulcer. Chinese Medical Joural, 1987;100(10):827~830
11.BraudtzaegP, et al. Ontogeny of the mucosal immune systtem and igA deficiency.Gastroenterology clinics of North America,1991;20(3):397~440
12.MesteckyJ, et al. Selective transprot of IgA: Cellular and molecular Aspects.Gastroenterology clinics of North America, 1991;20(3):441~472
13.Nadine cerf –Bensussan and Delphine Guy –Grand. Intestinal intraepitheliallymphocytes. Gastroenterology Clinics of North America, 1991;20(3):549~578
14.Stephen P. James. Mucosal T- cell funciton.Gastroenterology clinics of NorthAmerica, 1991;20(3):597~612
15. KutluT, et al. Numbers of T cell receptor (TCR) αβ+but not of TcRr+intraepitheliallymphocytes correlate with the grade of villous atrophy in coeliac patients ona long term normal diet. Gut, 1993;34(2):208~214
16.Sachdev GK, et al. Human colonic intraepithelial lymphocytes suppress in vitroimmunoglobulin synthesis by autologous peripheral blood lymphocytes and laminapropria. Gut, 1993;34(2):1993;257~263
17.RuthleinJ, et al. Anti- CD2and anti –CD3induced T cellcytotoxicity of human intraepithelial and laminal propria lymphocytes. Gut ,1992:1626~12632
18 HongP, et al. Epithelial cells bearing class II nolecules stimulate allogenic humancolonic intraepithelial lymphocytes. Gut ,1992;33(8):1089~1093
19. CaiWQ(蔡文琴)and Gabelle G. Innervation of thebiliary pathways in guinea –pigs. J Anat., 1983;136:97~101
20.李巍,等.小肠铺片PAP染色的体会.第三军医大学学报,1990;12(3):224~225
21.蔡文琴.胃肠道植物性神经分布的研究进展.何译涌,主编.组织与胚胎学进展.人民卫生出版社,1987:83~102
22. 蔡文琴.豚鼠小肠壁内神经丛的形态学观察.解剖学杂志,1985;8(2):95~99
23. 王正品,蔡文琴.大鼠小肠血管活性肠肽、P物质、亮氨酸-脑啡肽和生长抑素的正常分布.解剖学报,1989;20(1):68~73
24. 黄祯祥,主编.病毒性肝炎研究进展.北京科学技术出版社,1986:65~76, 167~205
25.张定风,乙型病毒性肝炎免疫及临床.科学技术出版社重庆分社,1985:48~87,139~171
26.梁英锐.乙型病毒性肝炎的免疫病理学.国外医学:生理病理学分册,1981;1:21
27. 周庆均,主编.病毒性肝炎.人民卫生出版社,1980:29~51
28.王文亮,等.肝癌及其周围组织内的乙型肝炎表面抗原(HBsAg).中华肿瘤杂志,1979;1:101
29.王文亮,等.肝癌及其周围组织内的乙型肝炎核心抗原(HBcAg).中华医学杂志,1980;60:99
30. 谭承项,等.肝组织内HBsAg的免疫组织化学研究一、细胞膜HBsAg的观察.中华内科杂志,1983;22:13
31. 王文亮,等.肝癌及其周围组织内IgG(抗-HBc)的分布及意义.中华病理学杂志,1983;12:30
32.张晓东,等.肝硬变组织内HBv DNA 和HBsAg的分布及意义.第四军医大学学报,1991;12:405
33.王文亮,等.慢性肝炎,肝硬变和原发性肝癌内HBxAg的表达及意义.第四军医大学学报,1992;13~88
34. 王文亮,等.慢性肝炎和肝硬变内HBV的前S1和S2抗原的表达及意义.中华消化杂志,1993;13:8
35.王文亮,等.慢性肝炎和肝硬变内HBxAg的分布与HBsAg和HBcAg的关系.第四军医大学学报,1992;13:244
36.李煊,等.纤维结合蛋白在肝硬变组织的免疫化学研究.中华病理学杂志,1988;17:124
37. 朱明华,等.III型胶原在肝炎、肝硬变和肝细胞癌的免疫组化定位.第四军医大学学报,1993;14:32
38. 苏勤,等.慢性乙型肝炎和肝硬变中肝细胞角蛋白的异常表达.中华病理学杂志,1992;12:287
39.应越英,等.原发性肝细胞癌与肝硬变和乙型肝炎的关系.肿瘤,1981;1:1
40.王家駹,等.原发性肝炎与肝癌、肝硬化关系的探讨.中华消化杂志,1981;1:104
41.步宏,等.肝细胞癌与乙型肝炎病毒感染.国外医学:肿瘤学分册,1990;5:260
42.金 灵,等.肝癌组织内乙型肝炎病毒X抗原的检测.中华病理学杂志,1990;19:228
43.陈梅龄,等.用原位杂交技术对肝细胞性肝癌HBv DNA分布的研究.中华病理学杂志,1989; 18:178
44.王文亮,等.人原发性肝癌内乙型肝炎病毒S1和S2抗原的表达及意义.中华病理学杂志,1992;14:83
45.王文亮,等.人原发性肝癌内乙型肝炎病毒X抗原(HBsAg)的免疫组化研究.中华肿瘤杂志,1992;14:330
46.PughJc, et al. Expression of x gene of hepatitis B virus.J Med Virol, 1986; 20:229
47.PasekM, et al. Hepatitis B virus gene and their expression in E. coli.Nature,1979;282(5739):575
48.MeyersML, et al. Hepatitis B virus polypeptide X:expression in E. Coli andidentification of specific antibodies in sera from hepatitis B virus infected humans. J Virol,1986; 57:101
49. KinEM, et al. HBx gerne of hepatits B virus induces liver cancer in transgenicmice. Nature, 1991; 351(6324):317
50.WangWL, et al. HBxAg in the liver from carrier patients with chronic hepatitis andcirrhosis .Hepatology, 1991; 14:29
51. WangWL, et al. Hepatitis B x antigen in hepatitis b virus carrier patients withliver cancer. Cancer Res, 1991;51:4971
52.TheilmannL, et al. Detection of pre-S1proteins in serum and liver of HBsAg-positive patients: a new marker for hepatitis b virus infection. Hepatology,1986;6:186
53.Alberti A, et al. The pre-S/anti- pre –s systems in hepatitis B virus infection. In: Robinson W, eds. Hepadna viruses.New York: Alan R Liss Inc, 1987:397
54.KlinkertMQ, et al. Pre- S antigens and antibodies early in the coures of acutehepatitis B virus infection. J virol,1986; 58:522
55.PontissoP, et al. Human liver membranes contain receptors for the hepatitis B viruspre- S1region and via polymerized human serum albumia, for the pre-S2region . J virol, 19889;63:1981
56.Shafritz DA, et al. Identification of integrated hepatitis B virus DNAsequences in human hepatocellular carcinoma. Hepatology,1981; 1:1
第十四章 肾脏疾病免疫细胞化学
60年代初期,人们已认识到肾小球肾炎为一种免疫性疾病,是溶血性链球菌、葡萄球菌等病原体侵入人体后引起的变态反应性疾病。1968年Dixon根据荧光显微镜的观察结果,提出肾小球肾炎的发病机制可分为抗肾小球基底膜性肾炎和免疫复合物性肾炎两个类型。1980年Couser根据多个学者的动物实验观察,又提出了除循环免疫复合物可沉积于肾小球内而引起肾小球肾炎外,尚可在肾小球内有原位免疫复合物形成而导致肾小球肾炎发生。1982年Cameron又指出,多价大分子抗原与多量高亲合力之抗体相遇时,可形成大分子的不溶性免疫复合物,当系膜细胞清除能力降低时,即沉积于肾小球系膜区内而引起肾小球肾炎。此外,除上述之体液免疫发病机制外,目前已有多数学者证实细胞免疫亦在肾小球肾炎的发病机制中起重要作用。所有这一系列肾炎发病机制的深入研究,皆有赖于免疫学理论的不断进展和免疫细胞化学技术的应用。目前,应用免疫细胞化学技术对肾脏疾病的诊断更为重要的意义。过去对于肾脏疾病的诊断手段过于简单而落后,一般仅依据病人的临床表现(如尿量变化、水肿及高血压等)和化验室尿常规检查结果(如蛋白尿、血尿、管型尿等)进行诊断。即使Iverson和Brun于1951年开展明穿刺后,病理学家也仅能进行光学显微镜的一般形态学观察,根本无法作出正确的诊断和分类。近年来由于免疫细胞化学技术的迅速发展,为肾脏疾病的诊断提供了有力的武器,肾脏病理学因之有了迅猛的发展,各型肾小球疾病的病理实质才为人们进一步深入认识。本章 将较系统地介绍免疫细胞化学技术在肾脏疾病领域中的应用。
第一节 免疫细胞化学技术在肾脏疾病中的应用范围
在肾脏疾病时,免疫细胞化学技术主要应用于肾脏穿刺组织的检查,也可应用于血清或肾脏洗脱液及尿液的特殊检查,兹分述如下:
一、肾脏组织的检查
肾穿刺组织一般应切割为三小块,分别作冰冻切片、石蜡切片及超薄切片,进行荧光显微镜、光学显微镜及透射电镜观察。所应用的免疫细胞化学技术包括免疫荧光、免疫酶标及免疫电镜,兹分述如下:
(一)免疫荧光细胞化学技术的应用
自1938年超高压汞灯荧光显微镜问世后,Coon于1942年首先应用荧光素标记抗体检查肺炎球菌,为荧光抗体技术的发展奠定了基础。1961年Dixon开始在肾脏疾病中应用,对肾脏的免疫病理研究起了重要的推动应用,并逐渐成为在肾脏疾病的病理诊断中不可缺少的重要环节 。主要用于冰冻切片,具体操作技术如下:
1.切片及染色肾组织要求为未经任何处理的新鲜组织,应立即送入恒温冷冻切片机(cryostat)内,将肾组织放置于金属托上,周围添加OCt compound 包埋剂(如无包埋剂,滴加数滴生理盐水亦可),迅速冷冻至-20℃,切出3~5μm厚的冰冻切片附贴于载玻片上,至少需切10张以上备用。继而使用荧光素标记之各种抗体进行免疫荧光染色(具体操作步骤参见第三章 )。所使用之荧光标记抗体包括羊或兔抗人各种免疫球蛋白(IgG、IgA、IgM、IgE、IgD)、抗人补体各种成分(C1q、C4、C2、C3、C5、备用素、B因子等)以及抗人纤维蛋白元等,以期了解肾小球内有何种免疫球蛋白沉积、补体激活的途径和有无凝血机制启动。此外,目前尚有应用荧光标记之抗纤维连接蛋白(fibronectin)、抗层粘连蛋白(laminin)、抗α-纤溶酶抑制因子(α-PI)、抗纤溶酶原(P1q)等特殊抗体,以探讨研究各种肾小球肾炎时肾小球内纤维连接蛋白和层粘连蛋白分布情况的变化以及凝血和纤溶系统成分的变化。常使用之荧光素为异硫氰酸荧光素(FITC,显绿色荧光)及异硫氰四乙基罗达明(Rodamine B-200,显橙红色荧光),对各种抗体进行标记。必须指出,每种荧光抗体只能检测一种相应抗原,因此必须准备多张冰冻切片,才能满足检查要求。一般在检查每一种抗原时,只能使一种相应抗体用荧光显微镜进行观察。如果同时需要检查二种抗原时,可同时使用FITC及RB-200标记的不同抗体进行双标记法观察。
2.荧光显微镜观察一般要求使用质量较高的荧光显微镜,最好使用落射光型,以提高在高倍镜观察时之清晰度,并应配备电子摄影装置,以便及时进行记录。进行荧光显微镜观察时,滤光片之配合使用十分重要。以常用之日本olympus荧光显微镜为例,观察FITC标记之抗体时,激发滤光片须使用RG-12,而压制滤光片应使用O-350,如观察RB-200标记之抗体时,激发滤光片须使用UG-1,而压制滤光片应使用R-610。观察时应做以下记录:①使用抗体的种类。②荧光显示的部位:如显示于肾小球毛细血管壁、系膜区、肾球囊壁、肾小管基底膜、间质血管壁及间质细胞等。③荧光显示的型式、:为连续线形、不连续颗粒状、团块状或短线状,不规则状等。④荧光显示的强度:可分为(—)荧光弱、(±)为荧光微弱、(+)为明确可见荧光、(++)为明亮荧光、(+++)为耀眼荧光。在特殊情况下可进行双重标记,即分别使用FITC标记和RB-200标记的两种不同抗体,在同一切片上进行染色,使用不同滤光片进行观察及摄影,以绿色荧光和橙红色荧光在同一张切片上显示两种抗原分布的部位。
3.荧光显微镜摄影技术使用荧光显微镜观察时,由于光源紫外线的照射,切片标本上抗原的荧光亮度常很快逐渐减弱,并可发生荧光淬灭现象;且免疫荧光染色的切片不能长期保存,因此必须立即及时进行显微摄影以记录所观察到的情况,以作为诊断根据和作为资料保存。摄影时一般应使用感光速度较快的彩色胶片,以160或400ASA为宜,才能保证拍摄出良好的荧光图像。必须指出的是,在标本的荧光强度不太明亮时,使用自动曝光摄影设备常不能取得良好的摄影效果。由于在摄影过程中,荧光强度逐渐减弱,照像机快门常长期不能关闭,以致影响摄影效果。因此,各个实验室应根据所使用的荧光显微镜的具体情况,以手动控制自动摸索适宜的摄影条件。一般应首先使用黑白胶片在低倍镜及高倍镜下对中等荧光亮度的标本以不同曝光时间进行摄影,根据底片曝光效果找出合适的曝光时间。待积累一定经验后再使用彩色胶片进行摄影。根据个人的经验,以Olympus落射光型荧光显微镜为例,中等荧光亮度的标本,使用160ASA彩色胶片,于低倍镜下摄影,曝光时间为1~2min即可,高倍镜下摄影时曝光时间需延长1倍。曝光时间适宜之彩色胶片,洗印后荧光呈绿色;如呈现黄色,即为曝光过度,应减少曝光时间。一般在荧光显微镜摄影时,最好应准备3个照像机暗盒,分别拍摄彩色正片(作幻灯片用)、彩色负片(作实验记录用)及黑白负片(供发表文章 用),以保存完整之资料。
必须指出,肾组织冰冻切片的免疫荧光染色法特异性强、敏感度高,对荧光标记物的分布部位、分布型式扩荧光强度显示极为明确。可在组织及细胞水平进行定位观察,为国际上公认的较好观察方法。但因其需要恒温冷冻切片机、荧光显微镜等昂贵设备,且切片不能长期保存为其不足之处。
如未能及时制作冰冻切片,亦中使用石蜡切片进行荧光染色。石虹节 片需经二甲苯脱蜡,降酒精至水,用0.1%胰蛋白酶在37℃温箱内消化20min,以暴露其抗原决定簇。再用各种荧光标记抗体按常规步骤进行染色后,荧光显微镜观察。石蜡切片之荧光观察效果不佳,其结果仅可作为参考。
(二)免疫酶标细胞化学技术的应用
由于免疫荧光技术的应用受一定的条件限制,1966年Nakane 使用辣 根过氧化物酶(HRP)代替荧光素对抗体进行标记,通过酶的显示使抗原定位,称为酶标记抗体技术。其后,1969年Mason,1970年Sternberger又在基础上发展了非标记酶抗体法。包括酶桥法和过氧化物酶-抗过氧化物酶复合物法(PAP)。这一技术的建立,为医学、生物学的各个领域提供了一个很好的研究手段,在免疫学和免疫病理学的研究和诊断工作中已日益广泛应用。
1.免疫酶标技术及其进一步发展 免疫酶标细胞化学技术较免疫荧光细胞化学技术有不少优点。首先,酶标法染色之切片使用普通的光学显微镜即可观察,切片可以长期保存;用苏木素进行细胞核的重复染色后,还能对组织结构和抗原进行细致确切的观察和定位。PAP法的特异性和敏感性皆优于荧光抗体法,且操作简便,适合于一般实验室应用(详见第四章 )。
免疫酶标技术以明确的颜色(棕褐色或鲜红色)显示抗原沉积的形式(细线状、颗粒状或团块状),又可精确地定位,不但可以判断抗原沉积于肾小球毛细血管壁或系膜区,也可辨别出抗原在毛细基血管基底膜内外侧的沉积部位。故免疫酶标法在此方面的优于免疫荧光法,但其反应强度受力人为因素干扰较大(如作用时间的长短、抗体浓度的差别等),且有时背景出现非特异性染色,而影响对结果的判断。如果组织内源酶未消除干净,亦可出现假阳性结果。
近年来,由于单克隆抗体的制备成功和应用,推动了免疫细胞化学技术的进一步发展。单克隆抗体是通过细胞融合技术,建立杂交瘤细胞株而产生的高纯度抗体。由于免除了抗原种或株间的交叉反应,因而提高了抗原抗体反应的特异性和敏感性。在肾脏疾病的研究中,主要用于肝炎病毒抗原的检测,如使用抗HBsAg或抗HBeAg单克隆抗体,用ABC法检测肾小球中肝炎病毒抗原的存在部位和数量等。
目前,由于分子生物学的进展,原位核酸分子杂交技术已与免疫细胞化学技术相结合,而成为分子杂交免疫细胞化学技术(详见第二十章 )。这一技术在病理学上的应用可以从核酸及其功能活动水平上,在细胞或组织的原位显示有助于诊断或研究的信息。目前常使用乙型肝炎病毒(HBV)的DNA标记后作为探针,研究乙肝病毒相关性肾炎肾组织中HBV-DNA之存在状态。
2.光学显微镜观察及摄影技术由于免疫酶标技术的应用,使用光学显微镜可对肾组织内沉积的抗原性物质(包括免疫复合物)进行定性、定位及定量观察。例如肾小球内沉积的IgG、IgA、IgM等免疫球蛋白C1q、C3等补体成分以及纤维连接。蛋白(fibronectin)和HBV病毒抗原等的存在部位、分布形式和状况及量的多少,并结合形态学观察,研究其与形态学变化之间的关系。观察时常需使用油镜。观察结果需进行摄影记录。摄影时应使用研究用显微镜附有摄影设备及自动曝光装置。摄影技术在具备自动曝光设备条件下简便易行,但滤光片之选择甚为重要。在拍摄彩色反转片(制作幻灯片时)时,应使用灯光型彩色反转片,滤光片无需使用,直接用钨丝灯泡之黄光即可进行摄影。如使用普通之日光型彩色反转片时 ,则需使用蓝色滤光片。在拍摄彩色负片(制作彩色照片用时),由于皆为日光型胶片,故需使用蓝色滤光片。拍摄彩色胶片时,首先需注意胶卷之感光度,应将自动曝光装置调至相应位置;另需在拍摄每张胶片前皆需调节 色温,以保证获得良好的彩色效果。在拍摄黑白胶片(供发表论文用)时,应使用绿色滤光片,以加强反差,提高摄影效果。
(三)电镜免疫细胞化学技术的应用
免疫电镜在细胞超微结构水平应用抗原与相应抗体能特异性结合的原理,使用标记抗体对细胞内存在的抗原性物质进行定性、定位和定量观察,是免疫细胞化学技术在亚细胞水平的进一步发展。
1.免疫电镜标本制备肾脏组织的免疫电镜标本制备与一般透射电镜标本的制备有所不同,其具体步骤如下:
(1)固定与包埋:肾脏组织一般采用低浓度戊二醛为固定剂,而不使用锇酸,以尽可能多地保存抗原活性,常使用甲醛-戊二醛固定液(甲醛4%,戊二醛0.05%~0.5%)。包埋剂常使用 Lowicryl K4M(丙烯酸酯类化合物)或LRWhite 树脂在-20~35℃低温下包埋,以紫外线照射使之聚合。避免使用常规之环氧树脂包埋,因环氧树脂需加热使之聚合,而使标本之抗原活性下降。
(2)修块、定位及切片:包埋后之组织块经初步修块后,先在超薄切片机上用玻璃刀(勿用钻石刀)切出一张0.5~1μm厚的半薄片,用1%硷性复红或美蓝溶液进行染色,在光镜下观察组织内肾小球的数量及病变情况,挑选出一个病变最为典型的肾小球,作出标记。然后在组织块上定出相应部位,用刀切去周围组织,修成约0.1mm大小之组织块,再用超薄切片机切出500 。A厚度的超薄切片。
(3)免疫标记:目前应用最多的是胶体金标记抗体(详见第七章 )。
2.免疫电镜观察肾组织标本皆采用包埋后染色,第一抗体为特异性抗血清(如兔抗人IgG),第二抗体为胶体金标记之抗体(如猪抗兔IgG,金标记Au10)。最后用枸椽酸铅(或醋酸铅)作对照染色,在透射电镜下观察。根据金颗粒的分布状况,可作定位、定性及定量观察,了解肾小球超微结构成分的变化、探讨肾脏疾病的病原及研究免疫复合物(沉积之电子致密物质)的组成成分等(详见后)。
二、血清或肾脏洗脱液的检查
肾脏疾病时,血清学检查亦甚为重要,现仅就与免疫细胞化学有关者介绍如下:
1.血清或肾脏洗脱液内抗肾小球基底膜抗体的测定在快速进行性肾小球肾炎(RPGN)及Goodpasture综合征病人血清中常存在有抗肾小球基底膜抗体,对病人血清进行检查有重要的诊断意义。动物实验中,对马杉氏肾炎等实验性肾小球肾炎动物,进行肾脏洗脱液的检查,以确定有无抗肾小球基底膜抗体的存在。一般常用免疫细胞化学技术进行检查,先将病人血清与灵长类(如猴等)的肾组织冰冻切片在37℃湿盒内孵育半小时,再将切片用FITC荧光素或HRP标记的抗人Igg 抗体处理。如果病人血清中存在有抗肾小球基底膜抗体,即可与切片上的肾小球基底膜相结合,进一步与荧光标记抗人IgG抗体相反应,而显示沿肾小球毛细血管壁呈连续线形之荧光分布(酶标抗体亦显示同样之连续线形分布)。本方法又可用于与抗肾小管基底膜抗体和抗核抗体的鉴别。
2.血清中循环免疫复合物内IgG亚类的分析以3%聚乙二醇(PEG)沉淀病人血清中大分子蛋白质,分别使用鼠抗人IgG亚类IgG1、IgG2、IgG3、IgG4的单克隆抗体,以ELISA法测定免疫复合物内IgG亚类的分布状况。以同样方法亦可测定肾小球中沉积的免疫复合物内的IgG亚类。Noel 报道,不同肾炎时肾小球内沉积之IgG亚类有所不同。原发性膜性肾炎之沉积物为Igg 1和IgG4,狼疮性肾炎之沉积物为IgG1、IgG2和IgG3。
3.血清中Tamm-Horsfall糖蛋白(THP)的测定 THP是由肾小管髓袢升支厚壁段及远曲小管上皮细胞合成的糖蛋白,主要存在于正常人的尿中,血清中含有微量。当肾功能减退时,血及尿中THP明显降低,尿毒症时则血及尿中几乎测不出THP。目前可使用抗THP单克隆抗体,用ELISA夹心法测定血清中THP的含量。第一抗体使用鼠抗人THP单克隆抗体,第二抗体为HRP标记的兔抗鼠IgG。
4.其它血清中自身抗体如抗核抗体、抗双链DNA抗体、抗Sm抗体等的测定,对狼疮性肾炎有诊断意义。抗着丝点抗体的测定对进行性系统性硬化(硬皮病)有诊断意义,以上测定皆使用免疫荧光法,具体操作不再赘述。
三、尿液的检查
1.尿中THP测定如前所述,使用抗THP单克隆抗体进行测定。除在慢性肾功能损害时血中及尿中THP下降以外,目前提出当肾移植急性排斥反应时或毒性物质导致肾小管大量破坏时,尿中可出现THP升高。
2.尿中抗体包裹细菌的测定尿路感染可分为上尿路感染(肾盂肾炎)和下尿路感染(膀胱炎、尿道炎及前列腺炎)。上尿路感染时,细菌来源于肾组织,机体对细菌产生抗体而包裹于细菌表面,形成抗体包裹细菌(ACB)。抗体为IgG、IgA或IgM组成,可用荧光素标记的抗人lgG、lgA、或lgM与之结合而使其显示荧光。反之,下尿路感染之细菌,一般不能形成抗体包裹细菌,用免疫荧光检查常为阴性,故能对上下尿路感染进行鉴别诊断。
3.尿沉渣中管型及粘液丝中免疫球蛋白之测定使用直接荧光进行观察,肾小球肾炎病人尿沉渣中管型及粘液丝可观察到IgG、IgA或IgM。一般认为是由于病变肾小球漏出之免疫球蛋白,与肾小球内沉积之免疫球蛋白可能无关。但泌尿系感染时尿中粘液丝中很少检出免疫球蛋白。故本检查有助于肾小球肾炎与泌尿系感染的鉴别。
四、肾小球细胞的体外培养
肾小球的固有细胞有3种,即系膜细胞、脏层上皮细胞及内皮细胞。近年来随着细胞培养技术的发展,肾小球的体外培养亦受到了重视。1969年Bernik首先在体外培养肾小球成功,并初步培养出系膜细胞,1975年Fish 正式分离培养系膜细胞获得成功,1978年Kreisberg分离培养上皮细胞成功,1984年Striker分离培养内皮细胞成功。目前,国内亦有不少单位从事肾小球细胞体外培养工作,已取得一定成绩。肾小球细胞的体外培养,不仅限于正常人及兔、鼠等动物,目前亦发展至肾脏病人肾穿刺组织进行细胞培养。经体外培养的一生长之原代培养细胞需进行鉴定,除使用光学显微镜及电子显微镜观察其形态及结构外,尚需进行免疫细胞化学染色而使用一系列免疫酶标记的相应抗体。例如使用抗结蛋白(desmin)单克隆抗体和抗肌动蛋白(actin)单克隆抗体(ABC试剂盒),对上皮细胞进行鉴定,二者皆为强阳性。使用抗细胞角蛋白(cytokerfatin)单克隆抗体(ABC试剂盒),对上皮细胞进行鉴定,以硷性磷酸酶为底色,上皮细胞胞浆内可见红色颗粒。内皮细胞之鉴定则使用抗Ⅷ因子单克隆抗体(因第Ⅷ因子只在内皮细胞内生成)。
此外,目前已认识到天很多生物活性因子如白细胞介素-1及6、血小板源性生长因子(PDGF)、转化生长因子(TGFβ)、内皮素等皆可对系膜细胞、上皮细胞及内皮细胞起作用。使用其合成及分泌多种细胞因子如血小板活化因子、前列腺素E2、白细胞介素-1、6、8等。人们可应用分子杂交免疫细胞化学技术,探知系膜细胞、上皮细胞或内皮细胞中相应细胞因子mRNA的表达,从而了解在不同肾小球疾病中各种细胞功能的变化。对肾小球体外培养细胞的分子生物学研究,开拓了研究肾小球疾病机制的广阔领域。
第二节 荧光或酶标抗体在肾脏内显示的部位及形式
在不同的肾脏疾病时,荧光标记抗体或免疫酶标记抗体在肾脏内显示的部位、分布情况和型式(pattern)皆有所不同。现根据其在肾脏内显示的不同部位叙述如下:
一、肾小球毛细血管壁
荧光标记或酶标记抗IgG抗体在肾小球毛细血管壁沉积的型式可分为线条状及颗粒状。连边续线形荧光常为抗肾小球基底膜抗体所致的肾炎,如Goodpasture综合征。不连续颗粒状荧光常为循环免疫复合物或原位免疫复合物所致的肾炎。但当抗肾小球基底膜性肾炎的肾小球毛细血管壁因遭受破坏而断裂时,连续线形荧光可变为不连续的短线状。反之,免疫复合物性肾炎的沉积物过于密集时,可以出现假线条状荧光。而抗补体各种成分(如C1q、C3、B因子等)的抗体及纤维蛋白元抗体在肾小球毛细血管壁的沉积往往呈颗粒状。
根据荧光标记或酶标记抗体沉积的范围,可分为下列三种情况。
1.弥漫型 颗粒状荧光普遍而均匀地分布在肾小球毛细血管袢的各个部位。常见于膜性肾小球肾炎、毛细血管内增生性肾小球肾炎和狼疮性肾炎的弥漫型。
2.不规则型 颗粒状荧光或短线状荧光不规则地分布于肾小球毛细血管袢,常见于快速进行性肾小球肾炎。
3.局灶性节 段性型 仅部位肾小球的某个节 段有颗粒状荧光,而大部位肾小球不显示荧光。常见于局灶性节 段性肾小球硬化及狼疮性肾炎的局灶节 段型。
二、肾小球系膜区
某些免疫球蛋白可沉积于肾小球系膜区而呈颗粒状或团块状荧光。如Iga 肾病时系膜区有IgA沉积,IgM肾病时系膜区有IgM沉积,狼疮性肾炎的系膜型可在系膜区有IgG、IgA、IgM沉积。除上述之免疫球蛋白可在系膜区沉积外,目前对系膜区细胞外基质的研究已逐渐深入,酶标记抗体可分别显示系膜区内纤维连接蛋白、Ⅲ型胶原及Ⅳ型磁原之分布状况。
三、肾小球毛细血管壁及系膜区
免疫球蛋白沉积于肾小球毛细血管壁,同时也沉积于系膜区,呈颗粒状。常见于系膜毛细血管性肾小球肾炎及狼疮性肾炎的弥漫型。
四、新月体性
新月体性肾小球肾炎时,在新月体内可见有IgG及补体C3呈颗粒状沉积,并常出现纤维蛋白元(Fb)沉积。在Goodpasture 综合征时常可有多数新月体形成,亦可在新月体内出现IgG及纤维蛋白元的颗粒状沉积。
五、肾小球球囊腔
在急性毛细血管内增生性肾小球肾炎伴有球囊腔内渗出性病变时,可于球囊腔内出现IgG及纤维蛋白元的颗粒状沉积。在眦癜性肾炎及Wegener’s肉芽肿时,偶可于球囊腔内有纤维蛋白元沉积。
六、肾小管
狼疮性肾炎时,免疫球蛋白既可沉积于肾小球,也可沉积于肾小管基底膜,有时肾小管上皮细胞的胞核亦可显示荧光。
七、小动脉
系统性硬化(硬皮病)、紫癜性肾炎、Wegener’s肉芽肿及恶性高血压病时,小动脉壁及细动脉壁可有纤维蛋白元沉积呈颗粒状。
八、紧间质
狼疮性肾炎时,肾间质可见有多种免疫球蛋白及补体C3沉积。Sjogren综合征的部位病例可于肾间质内有IgG呈颗粒状沉积。在以单核细胞浸润为主要表现的间质性肾炎,肾间质中可用Tamm – Horstall糖蛋白的沉积。
第三节 免疫细胞化学技术在肾脏疾病中应用的意义
一、免疫荧光或免疫酶标技术在肾脏疾病中的应用的意义
(一)肾小球疾病发病机制的研究
应用免疫荧光或免疫酶标技术,可对肾小球内免疫复合物沉积的机制、补体系统的激活途径、凝血机制的启动等进行研究,兹分述如下:
1.免疫复合物的形成及沉积的机制 有下列三种情况:
(1)抗原及抗体在血液循环中结合形成循环免疫复合物沉积于肾小球:常见于毛细血管内增生性肾小球肾炎,抗原(如链球菌、葡萄球菌等)侵入人体后,免疫系统产生相应抗体。抗原与抗体在血液循环中形成免疫复合物,经血液流至肾脏而沉积于肾小球内。荧光显微镜可见IgG沿肾小球毛细血管壁有弥漫性不连续的颗粒状荧光,一般其分布不太均匀,大小亦不太一致。
(2)肾小球抗原导致的原位免疫复合物形成:在感染或某些因素作用下,肾小球基底膜的结构成分了生改变而具有抗原性,可刺激机体免疫系统而产生抗基底膜抗体,可与肾小球基底膜结合而形成原位免疫复合物。在荧光显微镜下可见IgG沿肾小球毛细血管壁呈连续线状荧光。常见于Goodpasture 综合征。
(3)非肾小球抗原导致的原位免疫复合物形成:外源性抗原在一定条件下可先植入肾小球基底膜,抗原刺激免疫系统可产生相应抗体而出现于血液中,这种循环抗体当流经肾小球时与原先植入肾小球基底膜的抗原在原位结合而形成原位免疫复合物。在荧光显微镜下可见IgG沿肾小球毛细血管壁呈大小一致的、分布均匀的颗粒状荧光。常见于膜性肾小球肾炎。
2.补体系统激活的途径 补体系统一方面参与机体的正常防御功能,另一方面又可参与变态反应而引起组织损伤。补体的成分既可直接破坏靶细胞,又可产生炎症介质(如过敏毒素和趋化因子)而促发炎症反应,并可启动凝血机制,故在肾小球肾炎的发生发展过程中起着重要作用。补体的激活途径有二,即经典途径和旁路途径。
(1)经典途径:抗原与抗体结合形成免疫复合物后,抗体的Fc 段被激活,暴露其补体结合点,可与补体C1q结合,进一步使C1r、C1s活化, 再依次活化C4及C2,而使C3活化,继之C5、C6、C7、C8、C9相继活化。
(2)旁路途径:细菌内毒素或脂多糖可使血清中C3激活剂前体(C3PA)转化酶被激活,在备解素作用下,使C3PA(又称B因子)转化为C3A(C3激活剂),而使补体C3激活,然后依次激活C5至C9。
在多数肾小球疾病,补体之激活皆为通过旁路途径:仅少数肾小球疾病,如狼疮性肾炎、Wegener’s内芽肿等,其补体之激活为通过经典途径。因此,了解肾小球疾病时补体系统激活的途径有重要的鉴别诊断意义。例如在肾小球系膜区有多量IgA沉积时,同时有备解素B因子显示阳性,即其补体激活为旁路途径,此时则可诊断为IgA肾病。但如C1q、C4、C2显示阳性,即其补体激活为经典途径,则应诊断为狼疮性肾炎。
3.凝血机制的启动 在肾小球肾炎时,由于炎症造成肾小球毛细血管内皮细胞的损伤,毛细血管基底膜的暴露,以及补体C3b的免疫粘附作用使血小板聚集,而激活凝血因子Ⅲ、凝血因子ⅩⅠⅠ和血小板因子3,启动了凝血机制,结果使血浆中的纤维蛋白元转变为纤维蛋白(即纤维素)而于肾小球毛细血管内形成微血栓。如果炎症严重而发生渗出时,肾小球毛细血管内的纤维蛋白元也可渗出至球囊腔内,进一步转变为纤维素。球囊腔内的纤维素可刺激球囊壁层上皮细胞增生而形成新月体,使病变逐渐恶化。因此,对纤维蛋白相关抗原(FRA)的免疫荧光或酶标染色观察有重要的意义。
(二)判断肾脏疾病是否为免疫性疾病
在肾小球或肾小管如发现有免疫球蛋白或补体沉积时,一般皆为免疫性疾病,说明体液免疫参与其发病机制。其表现多种多样,已如前述。如未能发现有免疫球蛋白及补体沉积时,一般提示为非免疫性疾病,如Alport综合征、Fabry’s综合征及良性复发性血尿等。但慢性硬化性肾小球肾炎时,往往不能发现有免疫球蛋白或补体的沉积,有时偶可发现不规则而稀疏的免疫球蛋白散在性分布,这是由于硬化的肾小球病变陈旧,已无免疫反应参与。又如微小病变肾病,临床表现有严重的肾病综合征,但其肾穿刺标本荧光显微镜检查为阳性,无任何免疫球蛋白及补体沉积,这仅能说明体液免疫未参与其发病机制。现已证明本病为细胞免疫球蛋白及补体沉积,这仅能说明体液免疫未参与其发病机制。现已证明本病为细胞免疫异常所致,故仍为免疫性疾病。此外,在糖尿病性肾小球硬化时,常可见到肾小球内有IgG沿毛细血管壁呈连续线形沉积,这种现象目前认为是IgG的非特异性沉积,不能认为是免疫性疾病。
(三)有助于某些肾小球疾病的确诊
某些肾小球疾病,虽然其临床表现多种多样,但其肾穿刺组织检查有其免疫荧光或酶标染色的特征性表现,往往有助于肾小球疾病的确诊,甚至在光镜观察及电镜观察之前即可作出诊断。例如IgA肾病在临床上除表现为反复发作性血尿外,也可表现为蛋白尿、高血压、肾病综合征等。但如荧光显微镜发现肾小球系膜区有IgA沉积,并有备解素或B因子显示为旁路途径激活补体时,即可确诊为IgA肾病。如同时伴有皮肤紫癜、腹痛或关节 疼痛时,即可确诊为紫癜性肾炎。又如IgM肾病之诊断依赖于肾小球系膜区的IgM大量沉积;膜性肾小球肾炎之诊断则可根据沿肾小球毛细血管壁均匀一致的颗粒状荧光;局灶性节 段性肾小球硬化的诊断有赖于IgM在部分肾小球的节 段性沉积。又如肾小球内有多种免疫蛋白沉积,并伴随有C1q、C4或C2的沉积,显示补体系统为经典途径激活,即可确诊为狼疮性肾炎。因此,荧光显微镜的观察在诊断上占有很重要的地位。
(四)其他
目前对免疫球蛋白轻链和肾小球系膜内的细胞外基质,以及肾小管间质性疾病进行了研究,现介绍如下:
1.免疫球蛋白轻链在各型肾小球疾病中的分布 各种免疫球蛋白的重链,根据其结构及抗原性的不同,而可分为IgG、IgA、IgM、IgE、IgD。轻链则仅有两种类型,即Kappa 及Lambda(κ轻链及λ轻链)。目前使用荧光素标记之羊抗人κ及λ单克隆抗体,对人类各型肾小球肾炎观察轻链分布之情况。初步观察结果为:系膜增生性肾小球肾炎、系膜毛细血管性肾小球肾炎、局灶性硬化性肾小球肾炎、膜性肾小球肾炎、狼疮性肾炎时,κ与λ的轻链的沉积皆无明显差异,而IgA肾病时主要为λ轻链沉积,淀粉样变时则为大量κ轻链沉积。目前又有轻链性肾病的提法,常见于多发性骨髓瘤患者,可见有大量κ轻链沿肾小球底膜、肾小管基底膜、肾小球系膜区、小血管壁及间质中沉积,实际上仍为类似淀粉样之病变。
2.细胞外基质(ECM)的研究 肾小球中细胞外基质的变化与肾小球硬化的发生有十分密切的关系,目前已受到重视而成为研究的重点。ECM是种多种成分形成的高度有序列的网络结构,主要包括胶原、糖蛋白及蛋白多糖三类大分子物质。
(1)胶原:ⅠⅡⅢ型胶原呈纤维束状分布,Ⅳ、Ⅴ、Ⅵ型胶原呈纤维网状分布。
(2)糖蛋白:起将细胞粘着于细胞外基质的作用,主要包括纤维连接蛋白(fibronectin,FN)和层粘连蛋白(laminin, LN)。
(3)蛋白多糖:包括硫酸肝素、硫酸软骨素、透明质酸等。
从形态上,肾小球中ECM可分为系膜基质和肾小球基底膜两部分。近10余年来,ECM多种成份分离纯化的成功,相应抗体的制备,为利用免疫荧光或酶标技术对研究肾小球ECM的组成和分布提供了有利条件。目前研究结果表明,系膜基质及基底膜皆含有网状的Ⅳ、Ⅴ、Ⅵ型胶原,系膜基质中含纤维连接蛋白较多,而基底膜中含层粘连蛋白较多,且硫酸肝素含量丰富。肾脏间质中则主要为束状的Ⅰ、Ⅱ、Ⅲ型胶原。这些正常分布状况在肾小球疾病时可发生变化。目前已证实,在系膜增生性肾小球肾炎时,系膜基质中可出现Ⅰ型及Ⅲ型胶原,一般认为由系膜细胞所产生。此外,如前所述,很多生物活性因子可对系膜细胞起作用,使其增殖并合成及分泌Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型胶原、FN、LN及蛋白多糖,促进ECM的增多,逐渐使肾小球发生硬化。应用分子杂交免疫细胞化学技术,可对系膜细胞等探知相应分子的mRNA表达,从而更深入地研究肾小球硬化的发生机制。
3.肾小管间质性疾病 与免疫异常有关者有二种情况:
(1)肾小管间质中免疫复合物沉积:常见于狼疮性肾炎,可见IgG、IgM、IgA及C3呈颗粒状沉积于肾小管基底膜、肾小管周围毛细血管壁或散在于肾间质中。这种颗粒状沉积还可见于肾移植排斥反应。少数Sjogren 综合征的少数混合性冷球蛋白血症,也可见于特发性间质性肾炎。
(2)抗肾小管基底膜抗体性肾小管间质性疾病:在Goodpasture综合征时,除可见沿肾小球基底膜有IgG呈连续线形荧光外,同时也可看到肾皮质部的肾小管有IgG和C3呈连续线形沉积,最初常出现于近曲小管。这说明体内有抗肾小管基底膜抗体产生。此外,在一些药物性间质性肾炎、特发性间质性肾炎或肾移植急性排斥反应时也可见IgG及C3沿肾小管基底膜呈连续线形沉积。
二、免疫电镜技术在肾脏疾病中应用的意义
1.用以研究正常和病理状态下肾小球的超威结构成分及其变化 应用免疫酶标记的各种ECM成分的单克隆抗体,使用免疫电镜观察正常肾小球中各种结构成分如各型胶原、纤维连接蛋白、层粘连蛋白、硫酸肝素等在基底膜和系膜区的分布状况,并对比观察在病理情况下出现的变化。这有助于深入了解肾脏疾病的时超威结构成分的分布和数量变化。
2.探讨肾脏疾病的病源 应用免疫电镜可清晰显示乙肝病理在肾小球及肾小管的分布部位及数量,以及确定其在细胞内之位置(胞浆内或胞核内)和与在上皮下或内皮下沉积之免疫复合物间的关系。目前并 可利用分子生物学技术鉴别乙肝病毒有无复制,从而深入探讨乙肝病毒相关性肾炎的发病机制。
3.研究肾小球内沉积之免疫复合物的组成成分及其形成过程 应用不同大小胶体金颗粒标记多种免疫球蛋白,以显示肾小球中沉积的电子致密物质(即免疫复合物)中各种免疫球蛋白的组成情况,以分析免疫复合物的组成成分。在动物实验中,可动态地观察肾小球肾炎时免疫复合物的形成过程。例如在动物的被动性Heymann肾炎时观察到特异抗体首先沉积于肾小球上皮细胞膜表面的有被小窝内,进一步聚集成帽,而后脱落至上皮下而成为上皮下沉积物的动态过程。这有助于对肾小球肾炎发病机制的深入研究。
4.有助于正确评价免疫荧光的观察结果 糖尿病性肾小球硬化病人的肾穿刺标本,免疫荧光观察显示IgG沿肾小球毛细血管壁呈连续线形荧光。目前有人应用免疫电镜技术未能证实有相应免疫球蛋白存在,这提示糖尿病时的免疫荧光阳性结果可能为肾小球基底膜通透性增加而导致的非特异性沉积所致。
第四节 各种肾脏疾病的病变以及免疫荧光(酶标)表现特征
各种肾脏疾病各有其特殊病理改变,亦有其相应的免疫荧光(酶标)表现特征,现介绍如下:
一、原发性肾小球疾病
1.微小病变肾病 临床表现为肾病综合征。光镜下可见肾小球上皮细胞轻度肿胀。电镜下可见上皮细胞足突融合,荧光观察无免疫球蛋白沉积。
2.局灶性节 段性肾小球硬化 临床表现为肾病综合征。光镜可见部分肾小球有节 段性硬化及玻璃样变。电镜可见上皮细胞足突融合,部分肾小球有节 段性毛细血管袢塌陷和系膜基质增多。荧光可见部分肾小球有节 段性IgM呈颗粒状沉积,主要沿毛细血管壁沉积,偶可有系膜区沉积,有时可见C1q及C3沉积。
3.局限性肾炎 临床表现为血尿、蛋白尿和肾脏综合征。光镜可见部分肾小球有增生、渗出、坏死或硬化性病变。电镜可见系膜细胞增生、系膜内沉积物、毛细血管血栓及坏死。荧光可见C1q、IgA及C3呈局灶性节 段性系膜区沉积,纤维蛋白元(Fb)沉积,偶可见C1q及C3呈线形 沉积。
4.弥漫性膜性肾小球肾炎 临床表现为肾病综合征或有血尿。光镜可见肾小球毛细血管壁弥漫性增厚,钉突及上皮下沉积物。电镜可见弥漫分布之上皮下沉积物及钉突,有时可出现基底膜内沉积物。荧光可见肾小球毛细血管周围有C1q、C3呈均匀一致性颗粒状沉积,偶可见IgM、IgA、C1q、C4及Fb沉积。
5.弥漫性系膜增生性肾小球肾炎 临床表现为镜下血尿或蛋白尿,严重时可出现肾病综合征及肉眼血尿。光镜可见弥漫性系膜细胞增生、系膜基质增多及系膜内沉积物。电镜可见系膜区沉积物,上皮细胞足突变平或消失。荧光可见系膜区有IgG、IgA、C3或有IgG及C3呈弥漫性颗粒状沉积。
6.弥漫性毛细血管内增生性肾小球肾炎 临床表现为急性肾炎综合征或肾病综合征。光镜可见内皮细胞及系膜细胞增生,系膜区有单核细胞或中性白细胞浸润,肾小球毛细血管腔变狭窄。电镜可见上皮下沉积物(驼峰),偶可见内皮下及系膜内沉积物。荧光可见肾小球毛细血管周围有IgG及C3或有IgM、IgA呈颗粒状沉积,偶可有C1q、C4、备解素及Fb沉积。
7.弥漫性系膜毛细血管性肾小球肾炎(膜增殖性肾小球肾炎I型及III型) 临床表现为肾病综合征,或为急性肾炎综合征有肉眼血尿,可能出现快速进行性肾衰。光镜可见系膜细胞增生及“间位”,基底膜呈双层化。肾小球增大而呈分叶状,III型并可见有钉突形成。电镜可见系膜细胞有插入现象(间位),I型可见内皮下沉积物,III型可见上皮下沉积物。荧光可见C3呈粗大不规则颗粒状沉积于肾小球毛细血管周围及系膜区,常伴有IgG、IgM、C1q、X4、备解素及Fb沉积。
8.致密沉积物性肾小球肾炎(膜增殖性肾小球肾炎II型) 临床表现为肾病综合征、肉眼血尿及快速进行性肾衰。光镜可见肾小球基底膜为PAS、伊红及Masson染色呈强阳性,而银染色着色甚浅,有1/3病例可出现新月体。电镜可见基底膜致密层内有电子致密物质沉积。荧光可见C3呈粗大颗粒状沉积于系膜区或毛细血管周围,但不见有免疫球蛋白沉积。
9.弥漫性新月体性肾小球肾炎 临床表现为快速进行性肾炎综合征,偶有肾病综合征。光镜可见50%~80%肾小球有各型新月体(细胞性、纤维细胞性、纤维性)。电镜可见肾小球基底膜有裂口,有时有内皮下沉积物。荧光可见新月体及肾小球毛细血管腔内有Fb沉积,有时可见IgG及C3沿毛细血管壁呈连续线形沉积。
10.弥漫性硬化性肾小球肾炎 临床表现为慢性肾衰。光镜可见大量肾小球呈球性硬化,球囊壁增厚、粘连,肾小球萎缩,间质纤维化。电镜可见反映原始病变之变化。荧光可见IgG、IgM、C3呈不规则、稀疏的非特异性沉积。
二、继发于全身性疾患的肾小球疾病
1.狼疮性肾炎 临床表现为蛋白尿、血尿、肾病综合征、肾功能减退、低补体血症,抗核抗体(+)。光镜下可分为六型,即轻度病变、系膜增生、局灶性节 段性增生及坏死、弥漫增生(接种环样病变及新月体)、系膜毛细血管性及膜型。电镜可见系膜内、内皮下及上皮下沉积物,指纹状沉积物、管泡状小体、苏木素小体。荧光可见各种Ig 、C1q、C4、C3、Fb沿肾小球毛细血管壁及系膜区呈颗粒状沉积,肾小管基底膜和血管壁亦有同样荧光。
2.IgA肾病 临床表现为持续性或复发性血尿,蛋白尿,偶有肾病综合征,缓慢发展为肾功能不全。光镜可见弥漫性或切段性系膜细胞增生及系膜区增宽、基质增多,偶有新月体形成。电镜可见系膜内沉积物,偶可有上皮下及内皮下沉积物。荧光可见IgA及C3在系膜内呈颗粒状或团块状沉积,可伴有IgG及IgM。
3.紫癜性肾炎 临床表现为血尿、蛋白尿,皮肤紫癜,偶可有肾病综合征。光镜可见系膜增生,局灶性节 段性坏死及增生,系膜毛细血管性或新月体性肾炎病变。电镜可见系膜内、内皮下及上皮下沉积物。荧光可见IgA、IgG、C3及Fb在系膜内沉积,Fb在毛细血管腔、毛细血管壁及球囊腔内沉积。
4.Goodpasture综合征 临床表现为肺出血及肾炎。光镜可见局灶性坏死性肾小球肾炎,有多量新月体形成。电镜可见内皮下电子透亮区,一般无沉积物。荧光可见IgG及C3沿肾小球毛细血管壁呈连续线形沉积,偶可呈颗粒状沉积。另可见有Fb沉积。
5.细菌性心内膜炎时的肾小球肾炎 临床表现为血尿、蛋白尿、急性肾炎综合征、快速进行性肾炎。光镜可见系膜细胞增生、局限性坏死及新月体形成。电镜可见系膜细胞增生,系膜内及上皮下、内皮下沉积物。荧光可见IgG、C3呈颗粒状沉积,有时有IgM、IgA及Fb沉积。
6.分流性肾炎 临床表现为肾病综合征、镜下血尿、氮质血症。光镜可见弥漫性系膜毛细血管性肾小球肾炎。电镜可见基底膜双层化及内皮下沉积物。荧光可见IgG、IgM、C3沿毛细血管壁呈颗粒状沉积。
7.疟疾性肾病 临床表现,急性型为血尿、蛋白尿,慢性型为肾病综合征、肾功能不全。光镜:急性型为轻度系膜增生性肾小球肾炎,慢性型为毛细血管壁增厚,可伴有细胞增生。电镜可见系膜内沉积物,基底膜增厚,上皮下或基底膜内沉积物。荧光可见IgM、IgG、C3沿毛细血管壁呈颗粒状沉积,偶可见C1q及C4。
8.血吸虫性肾病 临床表现为肾病综合征、镜下血尿、慢性进行性肾衰。光镜为系膜增生性肾小球肾炎、系膜毛细血管性肾小球肾炎及局灶性节 段硬化。电镜及系膜细胞增生,系膜内及上皮下或内皮下沉积物。荧光可见IgG、IgM、C3在系膜区及沿毛细血管壁沉积,偶可见IgA及IgE。
三、结缔组织病时的肾脏损害
1.结节 性动脉周围炎及Wegener’s肉芽肿 临床表现为血尿、蛋白尿、高血压及急性肾衰。光镜为肾小球局灶性节 段性坏死、弥漫性增生、系膜毛细血管性肾小球肾炎及新月体形成。电镜为肾小球毛细血管内血栓、系膜增生、基底膜破裂。荧光为IgG、IgM及C3沿毛细血管壁呈颗粒状沉积,于坏死节 段及血管壁有Fb沉积。
2.系统性硬化(硬皮病) 临床表现为蛋白尿、偶有肾病综合征、氮质血症、恶性高血压。光镜为小叶间动脉内膜增厚、粘液样变性或纤维素样坏死,肾小球毛细血管袢皱缩、栓塞及梗死。电镜为毛细血管皱曲、基底膜增厚、系膜基质增多。荧光可见纤维素、各种免疫球蛋白及C3于坏死区沉积。
3.干燥综合征(Sjogren’s综合征) 临床表现为口眼干燥、肾小管性酸中毒。光镜为中度~重度间质性肾炎,肾小管萎缩。电镜无改变。荧光为肾间质内浸润之浆细胞内有IgG沉积,肾小管基底膜有灶性IgG、IgM及C3沉积。
四、血管性疾患导致肾脏的损害
1.良性肾硬变 临床表现为高血压、镜下血尿、轻度蛋白尿。光镜为细动脉玻璃样变,肾小球毛细血管袢皱缩,系膜区增宽,纤维性新月体。电镜为系膜基质增多,偶有少量系膜内沉积物。荧光为阳性。
2.恶性肾硬变 临床表现为严重高血压、血尿、蛋白尿、肾衰。光镜可见肾小球毛细血管袢缺血性皱缩及切段性坏死,新月体形成。电镜可见基底膜皱曲,内皮下透明带。荧光可见肾小球及动脉壁有纤维素沉积。
3.溶血性尿毒症综合征 临床表现为溶血性贫血,血小板减少性紫癜,肾小血管内血栓,急性肾衰。光镜可见人球细动脉、小叶间动脉及弓形动脉分支管壁有纤维素样坏死及血栓形成,肾小球毛细血管袢皱缩及节 段性纤维素样坏死。电镜可见基底膜皱曲,内皮下透明带,小动脉内皮细胞脱落,腔内有纤维素及红细胞碎片。荧光可见肾小球及动脉壁有纤维素、IgG及C3沉积。
五、代谢性疾患引起的肾脏损害
1.糖尿病性肾小球硬化 临床表现为蛋白尿,偶有肾病综合征、中度高血压,晚期出现肾衰。光镜:弥漫型为系膜基质增多,系膜区增宽;结节 型为K—W结节 、假性动脉瘤及“玻璃帽”,肾小球及肾小管基底膜增厚,人球细动脉玻璃样变。电镜可见基底膜显着增厚,系膜基质增多,偶见基底膜内及系膜区沉积物。荧光可见IgG沿肾小球毛细血管壁、球囊壁及肾小管基底膜呈连续线形沉积,偶可见IgM及C3在系膜区沉积。
2.淀粉样变 临床表现为蛋白尿、肾病综合征,偶有肾静脉栓塞,急性或慢性肾衰。光镜可见肾小球毛细血管壁及系膜区有淀样物质沉积,甲紫及刚果红染色阳性。电镜可见淀粉样原纤维,上皮下钉突样结构。荧光可见淀粉样变区域有IgG及C3沉积,Kappa轻链阳性,抗淀粉样蛋白A(AA)阳性,抗淀粉样蛋白中血浆成分(AP)阳性。
3.多发性骨髓瘤 临床表现为Bence—Jone蛋白尿,急性及慢性肾衰,偶有肾病综合征。光镜可见系膜结节 ,肾小管萎缩,层次管型及多核巨细胞。电镜可见系膜结节 ,内皮下沉积物及肾小管周围沉积物。荧光可见Kappa轻链于肾小球毛细血管壁及肾小管周围沉积,管型亦有明显荧光,主要为IgG及Kappa轻链。
4.Waldrenstrom’s巨球蛋白血症 临床表现为蛋白尿,偶可有肾病综合征,Bence Jone蛋白尿,急性肾衰。光镜可见系膜结节 ,肾小球毛细血管内巨大玻璃样血栓。电镜可见系膜结节 ,内皮下沉积物,肾小管周围沉积物。荧光可见IgM沉积于玻璃样血栓内。
5.混合性冷球蛋白血症 临床表现为蛋白尿、肾病综合征、血尿、急性肾衰。光镜可见系膜毛细血管性肾小球肾炎,肾小球毛细血管堵塞(玻璃样血栓),系膜区沉积物。电镜可见内皮下及系膜内沉积物,内皮细胞胞浆中可见菱形或圆形之结晶体。荧光可见IgM,Kappa轻链及C3沿肾小球毛细血管壁呈颗粒状沉积。
六、某些特殊疾病时的肾脏损害
1.乙肝病毒相关性肾炎 临床表现为轻度蛋白尿,镜下血尿。光镜可见膜性肾小球肾炎或系膜毛细血管性肾小球肾炎。电镜可见上皮下、内皮下、基底膜内及系膜区沉积物。荧光可见IgA、IgG、IgM、C3及HBsAg、HBeAg沿肾小球毛细血管壁呈颗粒状沉积。
2.肝病性肾小球硬化症 见于肝硬变病人,临床表现为轻度蛋白尿及血尿。光镜可见肾小球系膜区增宽、系膜基质增多,毛细血管基底膜呈不规则增厚。电镜可见系膜区沉积物,基底膜增厚,内皮下出现电子密度稀疏区。荧光可见IgA及C3于系膜区呈颗粒状沉积(有人称之为继发性IgA肾病)。
3.镰状细胞贫血性肾病 临床表现为蛋白尿、肾病综合征、血尿。光镜可见局灶性节 段性肾小球厚化或系膜毛细血管性肾小球肾炎。电镜可见系膜细胞增生及插入,系膜区及内皮下沉积物。荧光可见IgG及C3沿肾小球毛细血管壁及系膜区呈颗粒状沉积。
七、遗传性和先天性肾病
包括Alport综合征、良性复发性血尿(薄基底膜综合征)、先天性肾病综合征(Finish type)、婴儿肾病综合征(French type)、甲一髌综合征、Fabry’s病等,荧光显微镜观察皆为阳性。
八、杂病
1.妊娠毒血症性肾病 临床表现为蛋白尿、高血压、或有镜下血尿。光镜可见肾小球毛细血管内皮细胞高度肿胀,使毛细血管腔变狭窄。电镜可见内皮细胞及系膜细胞肿胀,内皮下及系膜区沉积物。荧光可见纤维素沿肾小球毛细血管壁呈颗粒状沉积,可伴有IgG、IgM及C3。
2.放射性肾炎 临床表现为蛋白尿、高血压及肾衰。光镜可见肾小球毛细血管壁增厚及皱曲,节 段性坏死及硬化。电镜可见内皮细胞剥离,内皮下沉积物。荧光为阴性或有IgM呈节 段性沉积。
九、肾移植
1.超急性排斥反应 发生于移植后几分钟至几小时,临床表现为高热、腰痛、无尿。光镜可见肾小球和间质的毛细血管内大量中性白细胞集聚,继而形成血栓并有血管壁纤维素样坏死。电镜可见肾小球毛细血管内有纤维素,内皮细胞剥落,基底膜疏松肿胀。荧光可见lgG、lgM、和C3沿肾小球毛细血管壁呈线形沉积,间质小动脉壁有纤维素沉积。
2.加速性排斥反应(严重急性排斥反应) 发生于移植后一个月内,临床表现为高热、腰痛、血尿、少尿并发展为无尿。光镜可见肾小球毛细血管及肾小动脉壁有纤维素样坏死及广泛微血栓形成,常继发出血及梗死。电镜所见与前大致相同。荧光可见血管壁有纤维素沉积。
3.急性排斥反应 发生于移植后二个月,临床表现为发热、腰痛、少尿及血压升高。光镜可见肾间质水肿及小圆形细胞湿润,人球小动脉及小叶间动脉管壁水肿、内皮细胞剥脱,甚至管壁纤维素性坏死。电镜所见与前大致相同。荧光可见IgG、IgM、C3及纤维素在小动脉壁沉积。
4.慢性排斥反应 发生于移植后数月至数年,临床表现为蛋白尿、高血压及肾功能减退。光镜可见细动脉及小动脉的闭塞性血管内膜炎,肾小球毛细血管袢皱缩,基底膜增厚,系膜基质增多,并有局灶性和弥漫性肾间质纤维化。电镜可见内皮下电子密度疏松区。荧光可见IgG、IgM及C3于肾小球系膜区和动脉壁有颗粒状沉积。
十、肾小管间质性疾病
主要介绍过敏性间质性肾炎,多由磺胺、青霉素、庆大霉素、卡那霉素等药物引起。临床表现为蛋白尿、少尿甚至无尿。光镜可见肾间质水肿,有淋巴细胞、单核细胞及嗜性白细胞浸润。肾小管上皮细胞有灶状坏死,管腔内有蛋白管型。发展至慢性时,肾间质有淋巴细胞浸润及纤维化,肾小管萎缩。荧光可见IgG及C3于肾小管基底膜呈线形沉积。
参考文献
1.Dixon FJ. The pathogenesis ofglomerulonephritis. Am J Med, 1968; 44:453
2.CouserWG, et al. In situ immune complex formation and glomerular injury. Kidney Int,1980; 17:1
3.CameronJS, et al. A role for insoluble antibody – antigen complexes inglomerulonephritis. Clin Nephrol, 1982; 18:55
4.Bhan AK,et al. Evidence for a pathogenic role ofa cell - mediated immune mechanism inexperimental glomerulonephritis. J Exp Med, 1987;148:246
5.SeymourAE, et al. Contributions of renal biopsy studies to the understandings ofdisease. Am J Pathol, 1971; 65:550
6. Coons AH, et al.Localization of antigenin tissue cell . II. Improvements ina method for the detection of antigen by means of fluorescent an-tibody . J Exp Med,1950; 91:1
7.Heya M,et al. Study on the intraglomerular fibronectin in primary and secondaryglomerular lesions. Jpn J Nephrol, 1986; 28:105
8.NakanePK, et al. Enzyme labeled antibodies: Preparation and application for thelocalization of antigens. J Histochem Cytochem, 1966;14:929
9.Mason TE, et al. An immunoglogulin – enzyme bridgemethod for localizing tissue antigens. J Histochem Cytochem, 1969; 17:563
10.SternbergerLA, et al. The unlabeled antibody enzyme method of immunohistochemistry.Preparation and properties of soluble antigen –an ╟ tibody complex (Horseradish peroxidase – antiborseradishperoxidase ) and its use in identification of spirochaetes. J Histochemcytochem, 1970; 18:315
11.HsuSM, et al. Use of avidin –biotin peroxidase complex (ABC) in immuno ╟ peroxidasetechnique: A comparison between ABC and unlabeled antibody (PAP) procedures. JHistochem Cytochem, 1981; 29(4:)577
12.方利君,等.小儿乙肝病毒相关性肾炎肾组织中乙型肝炎病毒DNA的存在状态.中华肾脏病 杂志,1992; 8(2):65
13.Faulk WP & Taylor GM. An immuno colloid goldmethod for the electron microscope.Immunocytochemistry, 1971; 8:1081
14. NoelLH, et al . Glomerular and serum immunoglobulin G subclasses in membranousnephropathy and anti – glomerular basement menbrane nephritis. Clin Immunol Immunopathol, 1988;46:186
15.RoncoP, et al. Characterization of monoclonal antibodies against human Tamm – Horsfallprotein. Kidney Int ,1985; 28:694
16. RobertH, et al. Tamm -Horsfallglycoprotein and renal allograft rejection . Transplantation,1973; 16:83
17.FairleyJK ,et al. Protein composition of urinary casts from healthy subject and patients withglomerulonephritis. Brit Med J, 1983; 287:1838
18.BernikMB, et al. Contractile activity of human glomeruli in culture, Nephron, 1969; 6:1
19.FishAJ , et al. Human glomerular cells in tissue culture. Lab Imvest, 1975; 33:330
20.KreisbergHI, et al. Isolation and characterization of rat glomerular epithelial cells invitro. Kidney Int , 1978; 14:21
21.StrikerGE, et al. Isolation, Characterization and propagation in vitro of humanglomerular endothelial cells. J Exp Med, 1984; 160:323
22.AtkinsRC, et al. Tissue culture of isolated glomeruli from patients with glomerulonephritis. KidneyInt , 1980;17:515
23.YoshiokaaK, et al. Glomerular localization ofType III collagen in human kidney disease. Kidney Int, 1989;35:1203
24.周希静, 等.免疫球蛋白轻链在肾小球疾病中的分布.中会肾脏病杂志,1991; 7(4):214
25.FloegeJ, et al. Increased synthesis of ECM in mesangial proliferativeglomerulonephritis. Kidney Int,1991; 40:477
26.KerjaschkiD, et al. Initial events in the formation of deposits in passive Heymann nephritis.J Exp Med, 1987;166:109
27.王海燕, 等.免疫电镜技术及其在肾脏病领域中的应用.中华肾脏病杂志,1991;7(5):312
28.JacobChurg & LH Sobin. Renal disease classification and Atlas of glomerular diseases.Igaku - Shoin. Tokyo. New York , 1982:7~17
第十五章 自身抗体的免疫组织化学检测方法和应用
Friou等(1957)首先用免疫荧光细胞化学技术检查系统性红斑狼疮病人血清中的抗核抗体后,随后,在多种自身免疫性疾病的诊断中,广泛应用了免疫细胞化学方法,为这类疾病的诊断和研究提供了重要的依据。
所谓自身免疫性疾病是指自身免疫反应引起组织损伤的疾病。在临床方面,有的自身免疫性疾病已明确是自身抗体直接作用于自身抗原产生的自身免疫应答所致;有的则难以证实自身免疫应答是组织损伤的原因。但是,在自身免疫疾病患者中能查出自身抗体,这一点却是一致的。至今,已无人对自身免疫现象及自身免疫性疾病的存在发生怀疑。
Mackay 和Bune从临床角度提出六点作为自身免疫性疾病的特征:①血清免疫球蛋白在1.5g/100ml以上;②有自身抗体;③病变部分有免疫球蛋白的存在;④病变部位有淋巴细胞和浆细胞浸润;⑤用肾上腺皮质激素治疗有效;⑥在同一个体与其他自身免疫疾病共存。
根据上述标准将自身免疫疾病归纳为如下三类:①全身各脏器组织发生广泛性进行性病变,并可查出自身抗体的疾病,如系统性红斑狼疮(SLE)(抗核抗体),类风湿关节 炎(类风湿因子)等;②对特定脏器发生局限性自身免疫疾病,并可检查出特定脏器组织细胞抗体的同时,出现局限性病变的疾患,如自身免疫性溶血性贫血(抗红细胞抗体),桥本氏病(抗甲状腺抗体)等;③一过性自身免疫疾病。如咽喉,扁桃体感染在远离病灶的器官,由于自身免疫机制而引起一过性病变,如肾小球肾炎,风湿热等。
不论从临床诊断,治疗和预后随访,或是对自身免疫疾病的机理研究,自身抗体及其检查方法的研究是一个重要的问题。目前,对于自身抗体的研究越来越广泛,现在已有多种自身抗体被发现。用免疫荧光细胞化学方法,检查自身抗体已广泛应用于临床检验中,并已列入某些疾病的常规检查项目。用免疫荧光技术间接法检查病人血清中对自身某种成分的抗体,其突出的优点是抗体和相应组织成分结合后,通过观察发现明亮荧光的组织成分的形态特征而直接查出相应自身抗体,对于自身抗体的定性和定位同时进行,这种准确简便和快速性是其它方法难以达到的。早年在报告检查自身抗体多用人体组织作抗原切片,后来发现一些动物组织如小白鼠和大白鼠的器官组织,也可以和人血清中某些自身抗体结合,用动物组织代替人类组织作抗原更有利于这一检查方法的开展。现在,更进一步制备多种器官和组织的复合抗原切片标本,可以同时检出数种自身抗体,如慢性肝炎病人血清同时查出抗核抗体(ANA),抗平滑肌抗体,抗线粒体抗体等自身抗体。这样更有利于过筛初检,方便病人和检查人员。
在荧光抗体检查阳性结果的基础上,许多实验室进一步作自身抗体的滴度检查,对诊断和鉴别诊断,疗效和病情随访都有一定的意义。荧光定量法可能具有更好的效果。目前,少数报告用显微分光光度计测定细胞的荧光量获得成功,这项技术和设备将促进荧光抗体技术向更精确的新阶段发展。
用荧光抗体法检查自身抗体的免疫球蛋白属性的工作已较普遍开展,对于所得阳性结果多数实验室是先用人γ-球蛋白或IgG荧光抗体检查所得,随后再分别用抗人IgA、IgM、IgD、IgE等单价荧光抗体检查,鉴别确定自身抗体免疫球蛋白属性。
第一节 自身抗体的免疫组织化学检测方法
1.
(1)取大白鼠的肝、肾、心、小白鼠胃,人甲状腺,横纹肌等单独或制成复合冰冻切片(4~5μm,)。其中1片用56℃甲醇固定3min,另切一片不固定,分别放入湿盒中。
(2)将病人血清用0.01mol/l Ph7.2~7.4磷酸缓冲盐水(PBS)作1:5稀释,滴加覆盖抗原切征,置湿盒中,37℃,30~60min。
(3)切片用PBS洗2次,每次5min。用电磁搅拌或振荡帮助洗净不参与反应的血清蛋白。吹干。
(4)滴加抗人IgG或γ-球蛋白荧光抗体(用0.01%伊文氏蓝稀释)覆盖切片,37℃中放置30min。
(5)用PBS洗2次,方法同步骤(3),随后,再用蒸馏水洗1min。
(6)缓冲甘油(pH9.0~9.5,PBS或碳酸盐缓冲液1份和1份甘油混合)封片。
2.对照试验可作空白,替代,一步法抑制或吸收等对照,以证明阳性结果的特异性。
3.荧光显微镜检查阳性荧光呈明亮的黄绿色荧光,抗原组织成分呈现出阳性荧光时,即证明病人有对该组织成分的自身抗体,如细胞核呈明亮的黄绿色荧光即报告抗核抗体阳性。对阳性结果根据需要可进一步作滴度检查。
近来一些报告认为用培养细胞作某些自身抗体检查,可以取得良好的效果。
在检查自身抗体中常常可出现某种非特异性荧光,如粘液腺分泌物,粘液细胞,白细胞,胃粘膜表现的食物残渣,心肌异嗜性抗体反应等,以及有时用大白鼠胃组织切片出现的壁细胞非特异荧光等,容易引起混淆。这些问题都可通过对照试验(包括用正常人血清)和观察者的经验加以排除。
4.结果报告根据荧光显微镜观察的结果一是形态特征,二是荧光的亮度。在报告时先报告阳性荧光的形态名称加抗体如抗核抗体,再描述荧光亮度,主要靠观察者的主观目测,可分阴性和阳性两种结果,阳性又可分“+”为可见较弱的荧光,“++”为明亮的荧光,“+++”为耀眼的荧光。虽然这样的目测记录精确度可能在不同观察者之间有差别,但经过训练和有较多的观察经验后,这种方法基本上是可靠的,也便于推广应用。
近年使用荧光显微分光光度计和图像分析仪等定量检测方法,结果比较客观,将结果打印报告更适合于临床诊断和科学研究,应争取采用这些先进仪器和方法,改进结果的判断,记录和报告。
5.免疫酶组织化学检测自身抗体方法免疫酶组织化学间接法可以代替免疫荧光法用于自身抗体的检测,但尚未普遍采用。其优点是可以用普通显微镜观察结果,更适合于基层实验室使用,标本也可长期保存。
(1)抗原(与免疫荧光法相同)。
(2)操作方法:
①抗原切片先用0.01mol/L pH7.4PBS洗1次,吹干,放入湿盒中。
②滴加1:5稀释的待检血清,37℃,30min。
③PBS洗2次,每次5min,吹干。
④滴加适当稀释的酶标记A蛋白或抗人IgG抗血清,37℃,30min。
⑤用辣根过氧化物酶底物显色(同前述免疫酶法),室温10min。
⑥水洗。
⑦0.1%伊文氏蓝或苏木精染色5min。
⑧水洗,常规酒精脱水,透明封片。
结果:阳性为棕色,阴性为蓝色。在第3步之后可用1%H2O2作用15min消除内源酶干扰。
6.自身抗体的联合检测方法在血清中存在的多种自身抗体,可用多种组织抗原组合制作成复合抗原检测。抗原组成可包括以下组织:
(1)肝脏:①检出抗核抗体;②抗肝细胞膜抗体;③抗胆管上皮细胞抗体;④抗核仁抗体等。可用大鼠或小鼠肝组织。
(2)胃:①检出胃壁细胞抗体;②平滑肌抗体;③抗核抗体。必须用小鼠胃组织。
(3)甲状腺组织:①检出甲状腺球蛋白抗体;②检出甲状腺微粒体抗体;③检出抗第二胶质抗体;④检出抗核抗体。可用人、猴、兔等甲状腺组织。
(4)肾:①检出线粒体抗体(远端肾小管);②抗核抗体;③抗基底膜抗体。
(5)心肌:抗心肌抗体。
(6)横纹肌:①肌无力全并胸腺瘤A带(暗带)抗体;②肌无力I带(明带)抗体和H带抗体;③肌无力白纤维骨骼肌抗体;④肌无力骨骼肌红纤维抗体。
(7)人结肠;抗结肠粘膜抗体。
(8)胰腺:胰腺细胞抗体。
(9)肾上腺:肾上腺皮质细胞抗体。
(10)神经组织:根据需要将多种抗原组合。
按间接法进行检测,如发现某种自身抗体,再作滴度测定,这是一种联合筛选试验,十分简便,已作常规应用。
7.微波增敏快速自身抗体检测方法近年微波技术用于免疫组织化学检测自身抗体方法,取得了良好的效果。微波是一种高频电磁波,经微波辐射引起离子极化,旋转,分子间磨擦,使能量发生转换,产生热能而加快了抗原抗体反应的速度,适用于临床快速检验和诊断。
(1)抗原切片(同免疫荧光法)。
(2)微波增敏快速方法
①抗原切片先用PBS洗,吹干,放入湿盒中(用有机玻璃制作,内放少许蒸馏水)。
②滴加1:5稀释的待检血清,将湿盒移入微波炉内转盘上,调中档微波强度辐射1min,放置5min。
③PBS洗2次,各1min。
④荧光抗体反应1min(同步骤2),放5min 。
⑤PBS洗2次,各1min。
⑥缓冲甘油封片。荧光显微镜检测。
(3)结果:阳性为黄绿色荧光,阳性为红色。微波炉型号不同,应经预实验选定强度和时间。
第二节 在研究和诊断自身免疫性疾病中的应用
在自身免疫性疾病的诊断中,目前常常用免疫细胞化学技术检查相应的自身抗体作为重要诊断依据之一,并以此探讨自身免疫性疾病发生的免疫机理。
用免疫荧光法可以检查的自身抗体日益增多,具有器官特异性的自身抗体如甲状腺球蛋白抗体和甲状腺微粒体抗体,甲状腺第二胶质抗体,肾上腺抗体,胃壁细胞抗体,皮肤表皮间粘合质(Intercellular Cement of epidermis)抗体和基底细胞层抗体,唾液腺导管细胞抗体,胰岛细胞抗体,肾小球基底膜抗体,结肠粘膜上皮多糖物质抗体,精子抗体,卵巢抗体,胃G细胞抗体等。
用免疫荧光法可以检查出的非器官特异性自身抗体,有抗核抗体,平滑肌抗体,线粒体抗体、横纹肌抗体、神经髓鞘(外周)抗体、抗网状纤维抗体等。
还有报告用免疫荧光法检查血细胞自身抗体如抗白细胞(淋巴细胞)、红细胞,血小板抗体等。
一、抗核抗体(Antinuclearantibodies, ANA)的检测
Friou等(1957)首先用免疫荧光法检查出存在于SLE病人血清中的NAN,Alexander和Duthie(1958)证实了Friou等的结果。Friou等(1958)检查了28例SLE病人血清中有27例ANA阳性。一例阴性属临床长期不活动性病人。以后大量报告都指出用免疫荧光间接法检查ANA对于临床诊断SLE有重要价值,其阳性率在80%~100%之间,阳性对于SLE病有确诊价值,但阴性不能完全排除SLE,因为少数活动性SLE其ANA可能维持阴性,Fessel氏认为可能是一种亚型。正常人0%~4%,类风湿关节 炎、皮肌炎、硬皮病、sjogeren’s综合征,混合性结缔组织病、慢性活动性肝炎等多种疾病也呈不同程度的ANA阳性率,ANA可能是一种自身免疫反应的一个重要指标。ANA在各种疾病中的百分率见表15-1。
表15-1 抗核抗体在各种疾病中的百分率
| 临床诊断 | 人次 | 阳性率(%) | 临床诊断 | 人次 | 阳性率(%) |
| SLE | 61 | 98.5 | Grave’s病 | 15 | 23.5 |
| SLE(?) | 14 | 57.1 | 风湿病 | 30 | 23.3 |
| DLE | 19 | 52.6 | 风湿性心肌炎 | 54 | 20.3 |
| 类风湿病 | 66 | 31.8 | 心肌炎 | 145 | 8.3 |
| 皮肌炎 | 21 | 60.6 | 病毒性心肌炎 | 25 | 24.0 |
| 重症肌无力 | 9 | 66.6 | 冠心病 | 281 | 3.6 |
| 甲状腺炎(桥本氏病) | 24 | 29.1 | 心肌梗塞 | 17 | 35.4 |
| 亚急性甲状腺炎 | 15 | 40.0 | 心肌病 | 42 | 16.6 |
| I130治疗后甲亢 | 46 | 32.6 | 糖尿病 | 37 | 24.3 |
| 甲状腺机能亢进(甲亢) | 300 | 22.0 | 慢性萎缩性胃炎 | 96 | 8.3 |
| 甲状腺机能低下(甲低) | 17 | 23 | 胃炎 | 36 | |
| 结缔组织病 | 13 | 59.2 | 胃溃疡 | 23 | |
| 疑为自身免疫性疾病 | 869 | 23.5 | 胃癌 | 35 | 11.4 |
| 急性肝炎 | 82 | 22.7 | 非特异性溃疡性结肠炎 | 11 | 54.5 |
| 乙型肝炎 | 82 | 65.8 | 十二指肠溃疡 | 8 | 37.5 |
| 慢性肝炎(HBsAg) | 132 | 27.3 | HBsAg带菌者 | 23 | 4.3 |
| 慢性活动性肝炎 | 9 | 77.7 | 慢性气管炎 | 791 | 20.8 |
| 慢性迁延性肝炎 | 44 | 19.1 | 过敏性紫斑 | 3 | |
| 肝硬化 | 61 | 27.3 | 烧伤 | 12 | |
| 胆汁性肝硬化 | 3 | 高脂血症 | 6 | ||
| 肝癌 | 18 | 27.7 | Adison’s病 | 3 | |
| 肝黄萎缩 | 27 | 18.5 | 雷诺氏病 | 3 | 2例阳性 |
| 地方性甲状腺肿 | 21 | 28.6 | 扁平苔藓 | 11 | |
| 地方甲状腺肿手术后 | 25 | 正常对照 | 281 | 5.3 |
Hargraves对狼疮细胞(1948)已进行了大量的研究,证明引起狼疮细胞发生的因子,为抗核成分的抗体。抗核抗体是一组对细胞核内DNA,RNA或组蛋白、或这些物质的分子复合物的自身抗体,目前发现至少有十七种。这些抗核抗体对于结缔组织病的致病病因的探讨和临床诊断均有重要帮助。这些结缔组织病各有不同的抗核抗体谱(Antinuclear Antibodies profile)。
目前,国内已建立了11种测定方法,提高了结缔组织病的诊断水平。
用作检查ANA的抗原很多,如鸡的红细胞核,人白细胞,皮肤,甲状腺、脾脏、淋巴瘤、胸腺、肾、羊膜细胞、颊细胞等,还有Hela细胞,大小白鼠的肝和肾冰冻切片(4~6μm)等,以成年小白鼠的肝切片最为常用。用动物细胞核作抗原,可以避免血型的干扰因素。Konice氏等(1978)报告用马疫锥虫(Trypanosoma equiperdum, TE)作抗原测定SLE病人血清中抗双链DNa (dsDNA)因TE的核和动基体为不含蛋白的纯dsDNA,抗原性纯一,特异性强,不需提纯,为天然的dsDNA底物,据认为抗dsDNA抗体为SLE所特有,一些研究指出dsDNA抗体与SLE病情活动及狼疮肾炎的发病机理有密切关系,持续高滴度的抗dsDNA抗体是狼疮肾炎的不祥之兆。
1.抗核抗体的荧光形态及临床意义ANA的荧光形态和其相应抗原有密切关系,ANA的抗原性质和自身免疫性疾病有关,所以,观察荧光形态与临床诊断可能有一定联系。
(1)周边型(或称核周型):可见荧光以核边缘强,核轮鲜明,靠核膜的荧光呈绒毛状,核中心荧光弱或无。这是天然DNA或去氧核糖蛋白的抗体产生的一种荧光形态,肝细胞核,肾小管上皮细胞核和鸡红细胞核较典型。常见于活动性系统性红斑狼疮病人血清中。药物引起的狼疮样综合征也常出现。这些病人病情严重,肾受累的约占56%,与疾病进行性发展和狼疮细胞现象密切相关。
(2)均质型(或称弥散型):可见全核呈均匀一致的黄绿色荧光,核轮廓明确。血清中这种抗体用脱氧核糖蛋白吸收可以消除。证明是由核蛋白抗体(主要是IgG类)与核中脱氧核糖蛋白反应的结果。此种荧光形态常见于活动性系统性红斑狼疮病人,偶见于恶性病或结缔组织病。滴度多在1:160以上。如将血清适当稀释即可出现其它染色形态,证明其中尚有其他荧光形态的抗体混在其中。弱阳性均质型意义不明,供血员有3%~10%的阳性。
(3)斑点型(或称小结型):核轮廓不鲜明,核内呈斑点状荧光。由核内Sm抗原引起的一种抗体,包括IgG、IgM或IgA三类抗体。当用原血清染色时,斑点呈大团块状,稀释血清时变为分散的斑点状。主要见于硬皮病及肢端动脉痉挛病(雷诺氏病),也见于系统性红斑狼疮。
(4)核仁型:仅是核仁呈现黄绿色荧光,血清中此类抗体较少见。用肝细胞核和培养细胞作抗原可以检查出来。因血片中粒细胞及正常淋巴细胞中缺乏核仁抗原,检查不出此抗体。此型抗体可有IgG、IgM或IgA类。最常见于系统性硬化症、硬皮病、皮肌炎和sjogren’s综合征,其他胶原病很少见。
其次,还可见核膜型、结节 样网状型等,没有明确的诊断意义。ANA的相应抗原和荧光类型见表15-2。
表15-2 ANA的相应抗原和荧光类型
| 相应抗原 | 荧光类型 | |
| 抗DNA抗体 | dsDNA | 周边型 |
| SSDNA | 周边型 | |
| dsDNA+SSDNA | 周边型 | |
| 抗核蛋白抗体 | 脱氧核蛋白 | 均质型 |
| 组蛋白 | 均质型 | |
| 可溶性核抗原(ENA) | 斑点型 | |
| 抗核仁抗体 | 低分子RNA | 核仁型 |
| 核糖体系RNA | 核仁型 |
2.ANA的滴度与病情的关系Tablonska等的研究认为活动期红斑狼疮ANA的滴度在1:160或更高,国内的报告滴度在≥1:80则显示病情的活动性,滴度高是系统性红斑狼疮诊断的依据之一,高滴度与病情活动性相平行。高俊达(1979)对于ANA滴度变化的临床意义研究指出,60例系统性红斑狼疮病人血清中ANA滴度的变化与病情活动性、脏器损害、预后和其他化验指标的关系如下:
(1)ANA滴度在1:80~160以上有80.5%属临床活动性,有89.5%~97.8%缓解期病人在1:160以下。
(2)ANA滴度变化与临床症状是一致关系,但先于疾病的活动而升高,后于症状的缓解而下降。
(3)ANA滴度变化与狼疮细胞、血沉、尿蛋白和血清γ球蛋白含量异常一致。
(4)ANA滴度可作强的松用量的选择参考,ANA滴度在1:160以上者要加紧积极治疗,1:40以下者可减至维持量。
ANA的免疫组织化学检查对于诊断没有皮肤损害的红斑狼疮病帮助更大,取病人的皮肤作冰冻切片,用ANa IgG荧光抗体直接法染色,可见在表皮与真皮连接处显示荧光带。Tuffanelli报告病人有皮肤损害,直接免疫荧光检查ANA的阳性率为90%,在正常皮肤中红斑狼疮病人ANA的阳性率可达56%,而后者在其他疾病极少见,因而有较大的诊断意义。
二、双链DNA抗体(Double strand DNA antibody, dsDNA)的检测方法和应用
目前的研究指出,用免疫细胞化学检查病人血清中的dsDNA抗体为作为系统性红斑狼疮的诊断依据之一。佐佐木毅等和徐世玉等发现一些临床症状和血清学检查不典型的红斑狼疮病人,在发病早期就出现抗dsDNA抗体,认为这可能有助于早期诊断。
1.用马疫锥虫抗原检测抗dsDNA抗体方法
(1)底物制备:用马疫锥虫感染小鼠2~4天后,取小鼠的外周血,按血液细胞计数法作马疫锥虫计数,达到4.3×106~5.6×106时即采尾血涂片,空气干燥后直接使用或4℃保存备用。
(2)方法和结果:血涂片加入少量水溶去红细胞,待干。加入一滴被检血清于其上,移湿盒中,在室温中30~40min,用0.01mol/lpH7.4PBS洗5~10min,取出吸干,加兔抗人IgG荧光抗体,在湿盒中染色30~45min,再按上法洗片,待干,荧光显微镜检查。阳性者可见锥虫的核及动基体发出明亮绿色荧光。
2.用短膜虫抗原检测抗dsDNA抗体方法
(1)底物制备:用北京生物制品研究所制备的短膜虫涂片标本作抗原。
(2)方法和结果:用上述马疫锥虫抗原的间接免疫荧光染色法。短膜虫是一种血鞭毛虫,动基体中含纯净的dsDNA可作为抗原,阳性结果可见虫体近尾或中部有一致密荧光亮点,为动基体,近头部有一淡绿色亮点,为细胞核。阴性结果动基体上无荧光。阳性血清自1:5稀释,测定效价。
3.用酸洗脱鼠肝细胞抗原检测抗dsDNA抗体方法(参考Ta的方法)
(1)底物准备:将6个月小白鼠剪断上腔静脉,立即用0.01mol/l pH7.4 的PBS从门静脉灌洗至鼠肝发白,取出肝组织剪成接触面为0.15cm×0.5cm的小块,印片,空气中干燥后用丙酮固定10min,再空气干燥。浸入0.1mol/l HCl中洗脱30min,并轻轻的摇动,随后,再用0.15mol/l PBS pH7.4洗2次,每次10min,再用0.01mol/l pH7.6的PBS洗5min,空气干燥。即可用或在4℃中贮存。
(2)方法和结果:用间接免疫荧光法检测,阳性结果可见细胞核呈黄绿色荧光。用酸洗脱鼠肝细胞标本作抗原与马疫锥虫、短膜虫法比较结果,和马疫锥虫法符合率达93%,其中马疫锥虫法4例阳性,为系统性硬皮病,而此法为阴性,说明此法较马疫锥虫法更特异。此法与短膜虫法比较,符合率为95%,P>0.05,说明二法无显著差别。其中此法阳性而短膜虫法阴性的3例,均符合系统性红斑狼疮诊断,并均有肾损害。短膜虫法阳性而此法阴性的6例均为待查病例,不能证实为系统红斑狼疮诊断,说明此法在特异性方面更佳。
三、抗核仁抗体的检测法
用HEP-2细胞或大鼠肝细胞作抗原,作间接免疫荧光染色。结果可见细胞核核仁呈现明亮的黄绿色荧光。抗核仁抗体在硬皮病、皮肌炎、系统性硬化症等中最多见。
四、抗组蛋白抗体的检测方法
1.组蛋白的提取方法取大白鼠肝40g加入160ml0.01mol/l Ph7.4 Tris HCl缓冲液,制成匀浆后进行浓度梯度离心(27000rpm×60min),沉淀物中加入蒸馏水90ml,再以超声粉碎仪将细胞打碎,离心(3000rpm×15min)取上清液,再加入一定量的1mol/l 硫酸,使硫酸的最终浓度为0.2mol/L,混匀后,离心(3000rpm×15min),取上清液,加入4~5倍体积的无水乙醇,置于-20℃冰箱3天后,离心(3000rpm×15min)以乙醚洗涤沉淀,真空干燥,储存于-20℃冰箱中备用。
2.酸处理的鼠肾底物 鼠肾冰冻切片(厚度4μm),以丙酮固定后吹干,密封,在-20℃冰箱中储存备用。用前再于0.1mol/L盐酸中浸泡30min,然后再置于0.01mol/l pH7.4PBS中浸泡2次。
3.组蛋白重建的鼠肾底物在上述酸处理的鼠肾底物上加入30μl乙制备好的组蛋白,稀释浓度为25μl/ml,在室温中湿盒内孵育30min后,以0.01mol/l p7.4PBS浸2次。
4.检测方法用组蛋白重建的鼠肾底物,做间接免疫荧光测定。
5.结果1960年Kunkle首先在SLE中发现抗组蛋白抗体(Antihistone antibody ,AHA),是诊断药物性SLE的一项较好的指标。在活动期SLE中AHA可达90%。
五、抗着丝点抗体的检测方法
1.HEP-2细胞涂片的制备HEP-2细胞系人喉癌上皮细胞,在完全Eagle培养液中,37℃,二氧化碳孵育48~72h,使细胞生长达到一定数量,约1.2~1.5×106/ml,经胰酶消化后,可以传代或分装到置有玻片的培养皿中,继续用Eagle液培养及上述条件孵育,48h细胞不仅贴附于玻片上并已长成单细胞层。取出玻片用丙酮固定15min,自然干燥后待用,或保存于-20℃或4℃中。
表15-3 各种抗核抗体及临床意义
| 抗体名 | 别名 | 临床意义 |
| 抗Sm抗体 | SLE标记抗体,阳性率15~28%,常伴抗RNP抗体,有补体减少及肾受累 | |
| 抗RNP抗体 | ||
| 抗U1-snRNP抗体 | 抗MO抗体 | 各种自身免疫病均可出现,单独高效价见于混合结缔组织病(MCTD)。 |
| 抗SS-B抗体 | 抗La抗体 | 干燥综合征的标记抗体(27%) |
| 抗Ha抗体 | SLE 5%,同时抗SS-A阳性 | |
| 抗SS-A抗体 | 抗RO抗体 | 干燥综合征为78%阳性,SLE49%系统性硬皮病23% |
| 抗Scl-70抗体 | 抗Og抗体 | 系统性硬皮病的标记抗体44% |
| 抗Scl-86抗体 | 抗Scl-抗体 | 阳性系统性硬皮病进行性。局部者阴性。 |
| 抗Ki抗体 | SLE特有12%阳性。 | |
| 抗PCNA抗体 | 抗Ne抗体 | SLE阳性1%。 |
| 抗JO-1抗体 | 多发性肌炎的标记抗本(24%),阳性者多有肺病变 | |
| 抗KO-1抗体 | 多发性肌炎60% | |
| 抗PM-1抗体 | 多见于系统性硬皮症(55%) | |
| 抗Ma抗体 | 分类不明的胶原病 | |
| 抗MOS抗体 | 同上 | |
| 抗RANA抗体 | 抗SS-C抗体 | 类风湿性关节 炎80%~90% |
| 抗dsDNA抗体 | SLE所特有60% | |
| 抗ssDNA抗体 | 见于各种胶原病 |
注:Sm(Smith);RNP:核糖核蛋白;Sn:为小核;SSB:干燥综合征B;SS-A:干燥综合征-A,Scl-70:硬皮病70,抗原分子量70000;PCNA:增殖细胞抗原;PM-1:多发性肌炎-;RANA:类风湿性关节 核抗原;dsDNA:双链DNA;ssDNA:单链DNA。
2.染色方法用间接免疫荧光法。
3.结果着丝点抗原是紧附于染色体着丝点的DNA蛋白质,当与相应抗体结合后荧光图型为约46个圆的荧光亮点。国际上多用HEP-2细胞,因这种细胞核大,分裂相旺盛,着丝点容易显露,这种抗体在进行性系统性硬化症(PSS)中阳性率可达31%~98%,是PSS的CREST型的标记抗体,CRESF是指具有软组织钙化,雷诺现象,食管功能低下,指端硬化,毛细血管扩张的PSS患者。
六、抗甲状腺自身抗体(ThyroidAutoantiodies)的检测方法
Roitt等(1956)和Witebsby等(1957)就发现桥本氏病人血清中有对甲状腺提取的抗体活性,后来White(1957)首次用间接免疫荧光染色方法研究桥本氏病人血清存在对甲状腺胶质(thyroidcolloid)的抗体获得成功。此后,Landing等(1958)和Holbrow等(1959)以不固定的甲状腺切片作抗原。检查出慢性甲状腺炎(Chronie thyroiditis)病人血清中有和细胞浆结合而呈现明亮染色的抗体。Blizzard等(1960),Doniach 等(1960)发现第二胶质抗体,血高γ球蛋白,沉淀素阴性,鞣酸细胞血凝试验阴性,抗甲状腺微粒体补体结合试验阴性。Balfoour等(1961)用免疫荧光法研究一些甲状腺病人时总结指出:甲状腺胶质抗体有三种不同的荧光形态:一种是呈三维状云絮状,是一种血清沉淀素阳性产生的抗甲状腺球蛋白抗体。另一种是胶质部分荧光呈裂纹形,胶质无明显阳性荧光,而胶质边缘和裂纹处呈明亮荧光,鞣酸化细胞血凝反应阳性,沉淀素反应阴性。第三种即上述的胶质呈均匀荧光形状,证实这是一种称第二胶质的抗体。近30多年的研究证明免疫荧光方法检查甲状腺自身抗体是一个特异、敏感、简便的方法,对于临床诊断和治疗,随访和预后,甲状腺某些疾病的自身免疫性质的发病机理研究等,都有一定的实用价值。我们20年大量研究结果也证明确实如此。用免疫荧光法检查甲状腺自身抗体已成为许多国家中,诊断甲状腺疾病的常规检查项目之一。
检查这种抗体的免疫荧光方法要求取正常人的甲状腺或手术摘出的甲状腺组织,用冰冻节 片(3~6μm)用作甲状腺球蛋白抗体检查切片需要经56℃纯甲醇固定3min;用作甲状腺微粒体抗原切片无需固定处理,因固定会破坏微粒体的抗原性。按常规间接方法进行。
关于甲状腺抗体的研究已报告有甲状腺球蛋白抗体,微粒体抗体,第二胶质抗体,甲状腺刺激免疫球蛋白抗体,甲状腺激素T4及T3抗体,细胞表面的促甲状腺激素受体的抗体等。
表15-4 不同甲状腺疾病甲状腺自身抗体的阳性率(%)
| 诊断 | 甲状腺上皮微粒体抗体(%) | 甲状腺球蛋白抗体(%) | 甲状腺抗体总阳性率(%) | LATS(%) |
| 桥本氏病 | 89 | 78 | 98 | - |
| Graves’s病 | 37 | 85 | 53 | 80 |
| 原发性甲低 | 57 | 52 | 75 | - |
| 正常对照 | 5 | 7 | 6 | - |
七、平滑肌抗体(Smooth muscle antibody , SMA)的检测
Johnson(1965)首次用免疫荧光组织化学间接法在狼疮样肝炎病人血清中发现了SMA,用鼠胃滑肌作抗原。Whitingham用病人自身平滑肌作抗原,证实了SMA的自身免疫性。狼疮性肝炎或慢性活动性肝炎病人血清中SMA的阳性率可达80%以上。Donidht和Whitehouse先后报告了急生病毒性肝炎病人血清中SMA为IgM,而慢性活动性肝炎病人血清中SMA在发病初期(1~4期)为IgM,而后为IgG。Anderson利用纯化肌浆蛋白为抗原与肝炎病人血清中分离的IgM和IgM类SMA进行吸收试验,证明了SMA的特异性。Holborrow Gamel和Renbe先后观察了SMA与鼠肝细胞,肾小球及人的甲状腺上皮细胞和血小板等组织为抗原的免疫荧光染色结果,证明这些组织的抗原性均与平滑肌肌动蛋白有着共同性抗原。
现在多以大白鼠胃壁和肾组织血管壁平滑肌的4~6μm冰冻切片和抗原,附贴在干净的盖玻片上,电扇吹干,放入4℃干燥剂中保存,用前可固定于95%(4℃)酒精中1min,或不固定进行间接免疫荧光检测。
染色结果可见胃壁平滑肌,粘膜肌层和肌丝,小血管壁平滑肌等呈现出明亮的黄绿色荧光。有人用荧光检查急性期甲、乙二型肝炎暂时出现SMA的阳性率达80%,稀释血清应在1:10以上的确定为阳性,一般认为,肝细胞表面存在肌动蛋白样物质。慢性活动肝炎患者滴度在1:80以上,急性肝炎患者SMA属IgM类,滴度1:25以上,慢性迁延性肝炎患者SMA也常阳性,滴度1:25左右。使用皮质激素者SMA转阴或滴度降低。健康输血员用原血清或1:5稀释,常有9%~18%的低滴度SMA阳性,似无诊断意义,SMA与性别,年龄无关。
非肝病的SMA阳性者,主要见于传染性单核细胞增生症,类风湿性关节 炎,支原体感染疣,恶性肿瘤(如乳腺癌)。除传染性单核症滴度可达1:320外,一般常≤1:25,其血清与非肌性结构细胞不产生反应。
平滑肌抗体是抗肌球蛋白和肌纤维收缩蛋白的抗体,当肝细胞损害时,释放抗原引起的自身免疫反应。已证实慢性活动性肝炎病人血清中平滑肌抗体是具有特异性的血清学标志,但必须是高效价(1:80)以上,因在人群中常见低效价(1:10~1:20)。临床的研究指出,平滑肌抗体与生化指标改变程度相关,说明高效介平滑肌抗体与肝脏损害有关。Kurki等研究SMA在慢性活动性肝炎等的意义。
Middelton等报告检查了70例肾衰病人自身抗体,肾移植后3个月平滑肌抗体IgM类阳性率占76%,而移植前14%。SLE常是SMA呈阴性结果,可作鉴别诊断参考。
八、肝细胞膜抗体(Antibodyto the hepatocyte membrane, HMA)的检测
Lee等用Rouin氏液固定的大白鼠肝切片作抗原,作间接免疫荧光(IIF)检查,在慢性活动性肝炎(CAH)病人血清中成功的发现了HMA,肝细胞膜呈现黄绿色荧光,12例CAH中11例HMA阳性(93%)10例原发性胆汁性肝硬化(PBC)全部阳性,20例胶元-血管疾病1例阳性(5%)7例非免疫肝病中1例阳性(14%),正常人22例中仅1例阳性(5%)。
Bouin氏液固定大白鼠肝冰冻切片和IIF检查HMA的方法很简便,特异,对于诊断CAH和PBC,研究病因是很有价值的。
免疫荧光方法:取Wistar大白鼠复合组织(胃窦、肾皮质和髓质和肝)用恒冷箱冷冻切片机作冰冻切片,4μm厚,贴于玻片上,在空气中干燥至少30min。在室温中用Bouin氏液(75ml饱和苦味酸溶液,24ml甲醛,19ml冰醋酸)固定10min。切片在pH7.40.01mol/LPBS中洗3次,15min,同时搅拌,切片在空气中干燥后立即应用,或存放在-20℃备用。作间接免疫荧光染色。
表15-5 平滑肌抗体在不同疾病中的百分率
| 临床诊断 | 例数 | % |
| SLE | 61 | 9.8 |
| 急性肝炎 | 150 | 26.9 |
| 慢性迁延性肝炎 | 14 | 64.28 |
| 慢性活动性肝炎 | 50 | 80.2 |
| 肝硬化 | 32 | 34.3 |
| 肝黄萎缩 | 4 | (全部阳性) |
| 慢性肝炎 | 154 | 54.2 |
| HBsAg阳性携带者 | 12 | 41.7 |
| 甲状腺机能亢进 | 114 | 18.4 |
| 慢性萎缩性胃炎 | 37 | 13.5 |
| 慢性气管炎 | 382 | 15.7 |
| 类风湿性关节 炎 | 12 | 11.1 |
| 皮肌炎 | 11 | 36.4 |
| 肝癌 | 9 | 11.1 |
| 肾小球肾炎 | 18 | 22.0 |
| 心肌炎 | 107 | 18.7 |
| 冠心病 | 247 | 10.1 |
| 糖尿病 | 37 | 27.1 |
| 甲状腺炎(桥本氏) | 8 | 37.5 |
| 正常对照 | 236 | 9.7 |
九、线粒体抗体(Mitochondrial antibody, AMA)
用人肾(新鲜手术或尸检6h以内)采用肾皮质或大白鼠肾脏冰冻切片不需任何固定,作检查AMA抗体的抗原底物,间接免疫荧光结果可见远端肾小管上皮细胞浆呈现均匀的荧光。Walker等(1965)首先用此法在原发性胆汁性肝硬化,隐原性肝硬化和慢性活动性肝炎中发现AMA,以原发性胆汁性肝硬化(158例/188例)阳性率最高(84%),由于阻塞性肝胆疾病不产生这种抗体,可作鉴别诊断的指标。
这种抗体可以是IgG,IgM及IgA,无组织和器官特异性。
Klarskin等(1972),Walker等(1970,1972),对于这种抗体的临床应用进一步作了证实。AMA对疾病的发生的作用尚不明确,有人认为不起作用,有人则认为是造成肝细胞胆小管细胞进行性破坏的自身免疫过程的一个标志。而这两种细胞受累的程度将决定性地导致原发性胆汁性肝硬化。慢性活动性肝炎和隐原性肝硬化33例中阳性率为60%,233例门脉性肝硬化和332例病毒性肝炎中未查出AMA。Vandell等对106例B型萎缩性胃炎患者检查AMA全部阴性。我们很少见到AMA阳性的原发性胆汁性肝硬化病例。
表15-6 AMA亚类及其临床意义
| AMA亚类 | 临床意义 |
| 抗M1 | 梅毒 |
| 抗M2 | PBC(原发性肝硬化)混合型CAH(慢性活动性肝炎)-PBC |
| 抗M3 | 假性红斑狼疮综合征 |
| 抗M4 | 混合CAH-PBC |
| 抗M5 | 原发性非肝性自身免疫性疾病 |
| 抗M6 | 异烟酰异丙肼所致肝炎 |
由表15-6可以看出,AMA不同亚类所对应的抗原存在的差异,其病理意义也各不相同。原发性胆汁性肝硬化患者血清中主要检出抗M2型AMA,抗原位于线粒体内膜。
十、胃壁细胞抗体(Gastricparietal cell antibodies, PCA)的检测
Taylor等(1962)和Iruine等(1962)同一年发现PCA,以恶性贫血病人血清中阳性率最高(90%~100%)。慢性萎缩性胃炎国外报告阳性率20%~60%,伴有恶性贫血者可达90%。其次,甲状腺疾病,糖尿病、肾上腺皮质机能减退及缺铁性贫血等疾病,常伴有PCA阳性。我国恶性贫血发病率低,PCA阳性率在15%~25%之间,正常人2%~5%,60岁以上可高些(16%)。Strickland等(1973)称PCA阳性萎缩性胃炎为A型胃炎,胃窦炎的发病率低,大部分为胃体广泛性萎缩病变,发展后果为恶性贫血。B型患者PCA阴性,胃窦炎的发病率高,胃体部仅有局限性萎缩病变。各种疾病PCA检出阳性率见表15-7。
表15-7 各种疾病PCA检出阳性率
| 疾病 | 阳性率(%) |
| 恶性贫血 | 90~100 |
| 慢性萎缩性胃炎A型 | 90 |
| 缺铁性贫血 | 36 |
| 甲状腺功能亢进 | 24 |
| 甲状腺功能低下 | 55 |
| 糖尿病 | 18 |
| 肝炎 | 37 |
Odger等(1968)发现恶性贫血病人胃粘膜内含IgA细胞减少到正常的10%,IgM细胞减至50%,而IgG细胞则增加至15%,后者选择性的出现在残余的壁细胞周围。Baur等(1968)用人胃粘膜匀浆中微粒体部分标记荧光素和9例恶性贫血病人胃粘膜切片反应,其中7例PCA阳性者的胃粘膜因有层见特异性吸附荧光的浆细胞,证实PCA是炎性浸润的浆细胞所产生。
十一、胃泌素细胞抗体(GastrinCell antibodies, GCA)的检测
慢性表浅性胃炎病人有33%血清中GCA阳性,慢性萎缩性胃炎病人也有32%阳性。提示慢性表浅性胃炎与慢性萎缩性胃炎可能是相同本质的病变,可能有着共同的自身免疫反应的背景和发病基础。
GCA的检查方法,杀死雄性小白鼠后立即取胃窦组织,固定于4%MFF液中3天(MFF液的配法:在60℃的蒸馏水25ml中加入4g多聚甲醛,加4滴1N NaOH,再用NaOH或Na2HPO4调ph 至7.4后,再加入0.1mol/lPB Ph7.4 25ml)。组织脱水后,用56℃石蜡包埋,切片3~5μm。56℃烤干,脱蜡至水洗,取病人血清滴加在切片上,37℃45min,用常规间接免疫荧光法染色。荧光显微镜观察,可见G细胞浆呈黄绿色荧光,即是GCA阳性。
十二、胰岛细胞抗体(Isletcell antibady, ICAb)的检测
Bottazzzo(1974)用人胰腺,近年有人用兔胰腺的冰冻或石蜡切片抗原,间接免疫荧光法检测糖尿病人血清中有ICAb,发现约在60%~70%的新诊断的胰岛素依赖型糖尿病(IDDM)病人不论年龄大小,其ICAb均呈阳性。ICAb对胰岛四种细胞均起反应,一般是暂时性的。只有约20%或更少的ICAb阳性者可持续2~5年。而单纯饮食控制的非胰岛素依赖型糖尿病阳性率很低,和对照组相似(约0.05%)。在IDDM病人中,有85%的糖尿病人于症状发作后,立即出现ICAb,并随病程的持续而减少。Leudrum等(1976)报告用间接免疫荧光细胞化学发现ICAb在依赖胰岛素的糖尿病人中阳性率为38%(319/829)。而非依赖胰岛素的糖尿病人中阳性率只有1.7%(3/177)是ICAb阳性。
ICAb是针对胰岛细胞细胞质成份的抗体,或许是在症状发生之前,紧接着细胞损害而出现的。提示IDDM的发病可能具有自身免疫反应的免疫病理机理。
十三、抗肾小球和肺泡基底膜抗体的检测
免疫病理证明基底膜抗体是引起肺出血肾综合征即Goodpasturesymdrome的主要病因。需要取病人的痛和肺穿刺活检组织,作冰冻切片,用直接免疫荧光细胞化学方法检测Igg ,IgM和C3等在基底膜上沉着的情况。在肾小球和肺组织基底膜上呈线形荧光分布。在人急性肾小球肾炎中可见呈线形荧光,而膜性肾小球肾炎中,抗原抗体复合物沿肾小球基底膜呈结节 状沉积,藉以诊断和鉴别诊断。
1.抗原切片取病人肾穿刺或肺穿刺组织,作冰冻切片,厚4~6μm,不固定。肾切片应先在显微镜下选取有肾小球的用作免疫荧光染色。
2.直接法免疫荧光细胞化学染色方法分别用抗人IgG、IgA、IgM和补体C3荧光抗体染色。同时作对照试验。
3.荧光显微镜检查肺出血肾综合征病人的肺泡基底膜,肾小球基底膜上都呈现明亮的线形荧光。主要是IgG类抗体,补体C3荧光也呈线形,沿基底膜线形弥散分布。
十四、抗皮肤成分自身抗体的检测
抗皮肤成分的自身抗体在疱疹性皮肤病中具有诊断和鉴别诊断意义,寻常性天疱疮具有鳞状上皮细胞间隙抗体,类天疱疮具有基底膜带抗体。这种自身抗体无种属特异性。用直接免疫荧光法检测皮肤活检组织,间接法可用以检测病人血清中的抗皮肤成分抗体。
1.抗原切片直接法免疫荧光细胞化学检查,可以取病人皮肤活检组织作冰冻切片。
间接法检查常用大白鼠,豚鼠的食道上1/3部分作冰冻切片。也有人曾用猴、人、小白鼠和兔的食道上皮组织,人的正常皮肤,大白鼠、猴、豚鼠和兔唇和舌等作冰冻切片。认为人正常皮肤,小白鼠食道和大白鼠舌,可作为常用抗原,材料来源方便,经济,易推广应用。
2.免疫荧光细胞化学染色方法
(1)直接法:取病人皮肤活检组织一部分作常规石蜡切片,HE染色,作常规病理组织学诊断,一部分作冰冻切片的直接法免疫荧光染色。荧光抗体用抗人IgG、IgA、IgM和补体C3分别染切片。同时作对照试验。
(2)间接法:用病人血清与食道等抗原切片反应后,分别用抗人IgG、IgA、IgM荧光抗体染色阳性结果,可以进一步作滴度检测。同时作对照试验。
3.荧光显微镜检查直接法检测结果可见疱疹性皮肤病中各有一定的荧光形态,可见免疫球蛋白的沉积。
刘荣卿等(1987)用直接免疫荧光组织化学方法,对临床拟诊为天疱疮或大疱性类天疱疮病例进行检查,活检取病变附“正常”皮肤标本,用羊抗人IgG、IgM、IgA及C3荧光抗体染色,结果可见天疱疮9例中,取自“正常”组织标本均见表皮细胞间有IgG沉积,1例并有IgM、IgA,2例有C3,7例毛囊上皮和(或)汗腺上皮细胞间有IgG、IgM、IgA、C3沉积。用间接免疫荧光检测8例均阳性,大疱性类天疱疮8例中,取自“正常”皮肤标本均阳性,主要为基底膜出现IgG(7例),C3(8例),1例为IgM,1例伴有IgA。天疱疮及大疱性类天疱疮均为自身免疫性疾病,皮肤及血液中分别存在抗表皮细胞表面抗体、天疱疮抗体及抗基底膜抗体-类天疱疮抗体,这些自身抗体结合在皮肤、粘膜的相应部位。
不同疱疮性皮肤病的间接荧光图形如表15-8
表15-8 皮肤抗体阳性荧光分布
| 上皮区 | 上皮基底膜 | 表皮核 | |
| 寻常天疱疮 | + | - | - |
| 类天疱疮 | - | + | - |
| 疱疮性皮炎 | - | - | - |
| 多形性大疱性皮炎 | - | - | - |
| 红斑性天疱疮 | + | - | + |
(Clinical Immunology P146, 1971)
十五、唾液腺外分泌导管上皮自身抗体的检测
在诊断Sjogren’s综合征时检测唾液腺外分泌导管上皮细胞抗体具有重要意义,阳性率达65%,用人或猴唾液腺组织(O型)不固定的冰冻切片,间接免疫荧光细胞化学法检测,可见导管上皮细胞浆呈黄绿色荧光。
十六、抗横纹肌自身抗体的检测
抗横纹肌自身抗体出现在50%以上的肌无力症和胸腺瘤病人,正常人未发现。属IgG类抗体,用间接免疫荧光法检测此抗体,准确简便。
1.抗原切片取人或大白鼠骨骼肌,沿肌纤维平行方向作冰冻切片,不固定。
2.间接法免疫荧光染色方法染色的方法步骤与其他自身抗体间接法相同,但在荧光抗体染色之后,要延长PBS洗涤时间,3次PBS洗涤,每次30min。封裱切片。
3.荧光显微镜检查可见横纹肌A-带呈阳性荧光,无例外的都是胸腺肿瘤病人。单纯肌无力病人主要与I带和H带呈现阳性荧光有关。某些肌无力病人血清只含与“白纤维反应抗体,另一些只含有与”红纤维反应的抗体,呈斑点状荧光。横纹肌抗体和胸腺髓细胞、心肌呈一定程度的交叉反应。当血清稀释至1:60时,可获得更清晰的横纹荧光图像。
十七、肾上腺自身抗体的检测
抗肾上腺自身抗体是对肾上腺皮质细胞浆成分的一种器官特异性抗体。主要见于慢性肾上腺皮质功能减退症(阿狄森氏病)病人。用间接免疫荧光法检测,阳性率约50%,其他自身免疫病阳性率2%~5%。
1.抗原切片抗原用新鲜肾上腺尸检或手术切除标本,常用皮质醇增多症(柯兴氏病)病人手术切除的肾上腺。或取猴肾上腺组织,作冰冻切片。不需固定。
2.间接免疫荧光检查方法
3.荧光显微镜检查可见特异性荧光在皮髓质连接区最清晰,定位于皮质网状带细胞胞浆,髓质细胞不与抗体反应。
十八、类风湿因子(Rheumatoidfactor)的检测
类风湿因子是一种抗轻度变性的IgG的自身抗体,可与人或动物的热聚合IgG或抗原结合的IgG(即免疫复合物中的IgG)反应,而不与正常IgG反应。类风湿因子为IgM类抗体。主要见于类风湿性关节 炎产现人血清和组织中。
1.直接法
(1)用病人关节 滑膜或淋巴结,冰冻切片,冷丙酮固定10min。
(2)标记变性IgG或球蛋白:取人血清提取的γ球蛋白(20~25mg/ml),按常规法标记FITC,去游离荧光素后,将标记溶液置63℃水浴加热10min,使γ球蛋白热变性。加入40%2.17mol/L硫酸钠使热聚合体沉淀,置冰箱4h(4℃),然后在低温下离心30min(10000rpm)。取沉淀以预冷至4℃的蒸馏水溶解至原体积半量。用蒸馏水透析24h(4~6℃),再用pH7.6生理盐水透析24h。高速离心(12000rpm)30min除去不溶性聚合物,取上清分装,-20℃保存备用。
(3)直接免疫荧光染色:切片分别用以下染色试剂处理
①加标记变性γ球蛋白溶解。
②加标记抗IgM或γ球蛋白荧光抗体。
③加未标记变性γ球蛋白,作用切片后,洗涤,再加标记变性γ球蛋白。
①,②在适当稀释的试剂染色后呈特异性荧光,大多数活动性类风湿性关节 炎,可见阳性荧光的浆细胞堆集。③阴性或荧光显著减弱。
2.间接法用以检出病人血清中的类风湿因子。
抗原:用溶血素致敏的绵羊血细胞涂片。丙酮固定10min。
常规间接法染色。病人血清中有类风湿因子,与绵羊红细胞上的溶血素(变性IgG)结合,再加入γ球蛋白荧光抗体,与类风湿因子结合。因而红细胞呈现亮明的荧光,即证明类风湿因子阳性。
十九、抗中性白细胞胞浆自身抗体(Anti-eutrophilcytoplasmic autoantibody ANCA)
Davies 等(1982)首次报告在坏死性肾小球肾炎患者血清中发现ANCA。Hall等(1984)在4例系统性血管炎中也发现ANCA,其中3例表现为坏死性肾小球肾炎。Vander woude等(1985)报告血清中ANCA的滴度与诊断活动性Wegener氏肉芽肿的病情有密切关系,随着病情缓解,ANCA的滴度逐渐降低,所以认为是诊断Wegener氏肉芽肿很敏感的指标。随后一些研究表明检查ANCA对诊断结节 性多动脉炎和特发性新月体肾炎均有较高的敏感性。1989年和1990年分别召开了第一和第二届国际ANCA专题研讨会,引起了国际上的广泛重视。
ANCA抗原存在于中性白细胞的胞浆颗粒中,分子量为29kD,已证实是一种丝氨酸蛋白酶,与存在于中性白细胞嗜天青色颗粒中的丝氨酸蛋白酶-蛋白酶3(PR3)十分相似。所以,胞浆型ANCA(C-ANCA)能与PR3发生特异性反应。另一型称核周型ANCA(P-ANCA)的主要抗原成分是髓过氧化物酶(MPO),在坏死性肾小球肾炎和系统性血管炎患者,约90%的P-ANCA能与MPO发生特异性反应。由于有时P-ANCA同时伴有细胞核荧光,为排除假阳性,必须证明是MPO-ANCA。ANCA可以为IgG、IgM、或IgA类抗体,在不同疾病时三者的出现机率不同。
间接免疫荧光检查ANCA:用肝素抗凝血分离中性白细胞,以0.01mol/l Ph7.4 PBS洗细胞3次,制涂片,吹干。无水酒精固定5min。加待测血清,37℃孵育40min,PBS冲洗。加1:10稀释的抗人IgG-FITC荧光抗体,37℃孵育30min,PBS洗3次,每次3min,磷酸缓冲淮甘油封片。荧光显微镜观察。
ANCA的荧光可表现为C-ANCA和P-ANCA二种类型:C-ANCA荧光在胞浆中,分叶核之间有强的弥散性荧光、核无荧光。P-ANCA的荧光集中核周围,形成环状或不规则块状。
ANCA的致病机理:ANCA能使中性白细胞活化,发生呼吸爆炸,释放胞浆中的多种水解酶,氧自由基等活性物质而导致组织损伤。由于PR3和MPO都带正电荷,它们能与肾小球基底膜结合,PR3-ANCA和MPO-ANCA与之发生免疫反应导致肾小球基底膜损伤,另外,沉积在基底膜上的PR3和MPO还能通过介导细胞免疫,参予肾组织损伤。
二十、增殖细胞核抗原抗体(Proliferativecell nuclear antigen antibody, PCNA)
培养细胞经促细胞分裂剂刺激,核内DNA开始合成G期,到最大增殖期(S期),细胞核特异的出现DNA的复制,利用这一特点,制成抗原DNA聚合酶S的辅助蛋白。取培养细胞或人末稍血淋巴细胞经PHA,ConA刺激后涂片,间接免疫荧光检测。结果可PHA刺激后48hDNA合成开始的S期出现很强的斑点型荧光,(G)期细胞无反应。
在SLE病人血清中出现有特异性诊断价值,出现率为3%~5%。
二十一、抗类风湿关节 炎相关核抗原的抗体(Antirheu-matoidarthritis associated nuclear antigen antibody, RANA)
又称SSC抗体,RAP,可有免疫荧光间接法检测,用人二倍体B细胞(Wil-2)或Raji细胞为抗原片,细胞滴片吹干,37℃干燥固定,因丙酮,乙醇等可使RANA失活。荧光阳性呈核内斑点型。对诊断类内湿关节 炎和伴有口眼干燥综合征的病人有参考意义。近年发现其他结缔组织病和正常人出率也很高,其特异性尚待进行深入研究。
二十二、抗精子抗体(Anti-spermantibody, ASA)
在正常情况下由血睾屏障将精子抗原与免疫系统隔离,当此屏障发生破坏,精子抗原通过副睾间隙组织的淋巴管或毛细血管而进入免疫系统,就会引起自身免疫反应,产生自身抗体。抗精子抗体也可在一些女性体内产生。男性不孕症患者血中可检出很高阳性率的ASA。女性不孕症也可因ASA引起精子运动障碍,导致不孕。
抗精子抗体的作用是:①ASA可使精子运动障碍不能通过子宫颈管;②精子顶体酶活性被ASA抑制,使精子不易穿透包绕卵细胞的卵丘,放射冠和透明带;③抑制了精子与卵细胞膜的融合;④导致胚胎死亡和流产。⑤ASA的作用可使精子发生凝集,制动和结合三类。凝集抗体有精子头对头,尾对尾及混合型三种。
荧光抗体法和固相酶染色法常用于检测抗精子抗体。
固相酶免疫细胞化学方法:液化新鲜精液离心弃上清,沉积的精子用PBS洗3次,加0.5ml小牛血清混匀,校正精子浓度为5×107ml,涂于载玻片上,室温自然干燥,甲醇固定10min,PBS洗2次,吹干,加被检血清,37℃湿盒,30min,PBS洗3次,每次3min,加酶标记抗人IgG抗体,免疫荧光法则加抗人荧光抗体,37。C湿盒30min,PBS洗3次,每次3min(或荧光显微镜检查),用DAB-H2O2显色(同前述免疫酶细胞化学方法)。常规脱水、透明树胶封固。油镜观察结果。阳性反应精子呈棕黄色,阴性兰色(用伊文思蓝复染)。阳性可见在精子顶体、中体,后核帽、中片、尾及尾尖等。
二十三、其他自身抗体的检测
目前已发挥许多自身抗体,如抗胆小管抗体,见于原发性胆汁性肝硬化病人,阳性率达75%。用大白鼠肝的胆小管作抗原,间接免疫荧光染色阳性荧光定位于胆小管上皮细胞,呈均匀荧光。抗生殖细胞的自身抗体除精子外还有卵巢细胞抗体,常见不孕症患者。
心肌抗体常见于心脏手术后综合症和心脏移植的受体。
结肠粘膜抗体可见于溃疡性结肠炎患者的血清中,还有抗网织纤维抗体等。
近年对垂体细胞自身抗体研究发现,在多内分泌自身免疫疾病中存在抗促乳素细胞抗体,生长激素细胞抗体,ACTH细胞抗体等。
在神经系统中抗神经髓鞘成分的自身抗体,常见于神经脱鞘性疾病。
在一些眼科疾病中存在的自身抗体如抗晶体成分抗体,抗眼肌抗体等。
用大白鼠组织作抗原检查自身抗体,在心肌间质,肝枯否氏细胞,平滑肌和横纹肌模,胃及肾、肝的间质,肾小管近曲管刷状缘等出现阳性荧光,这是所谓异嗜性抗体(Heterophile anti-body),它和自身抗体易发生混淆,必须注意区分。
免疫细胞化学技术在自身免疫性疾病诊断中以免疫荧光技术应用最广泛,但应用免疫酶技术和免疫金-银技术也可以取得良好结果,作用用葡萄菌A蛋白的辣根过氧化物酶标记物代替荧光抗体作自身抗体检测,所得到的结果可用光学显微镜检查,适于在没有荧光显微镜的实验室应用。
第三节 自身抗体产生的机理
关于自身抗体产生的机理众说纷纭,十分复杂,免疫细胞化学和其他方法的结合,有助于从形态、功能和代谢三个方面深入探讨。根据目前研究的情况,有以下几种学说。
一、自身淋巴细胞免疫调控反应紊乱学说
Opelz等将T细胞与先经放射线照射的自身非T细胞共同培养时,发现了T细胞的增殖反应(3H-TdR渗入增加)。这是T细胞识别非T细胞单核-巨噬细胞、B细胞、Null细胞上的自身HLA-DR分子而发生的反应,即在无非已抗原的参加下,只通过识别自身万分就可诱导产生TH、TK功能。其反应过程中,首先OKT4+的TH与单核-巨噬细胞上的DR分子相互反应,一方面导致TH活化,细胞膜上出现白细胞介素-1(IL-1)受体,另一方面也导致单核-巨噬细胞释放IL-2,IL-2,再刺激某一OKT4+TH亚群产生辅助B细胞的B细胞生长因子(BCGF)和B细胞分化因子(BCDF),同时也刺激已活化的OKT4+细胞分化,增殖抑制或杀伤功能,对B细胞和TH细胞实施抑制。自身淋巴细胞间的免疫调控反应,对于维持免疫系统的自身稳定十分重要。当机体的某种自身成分受到化学或生物因素的修饰成为自身抗原时,在正常的这种调控反应下,将自身抗原成分清除。若此控调反应发生紊乱,IL-2生成受阻,自身抗原成分不能被清除和形成长期的刺激TH及B细胞失控,导致产生大量的自身抗体,引起机体发生自身免疫反应和发生疾病。因此,在自身免疫性疾病的病变和血清中可查出自身抗体。
二、T细胞旁路(t cell by - pass)学说
免疫系统对自身抗原产生免疫耐受的机制,与抗原决定簇结合的载体分子的特异性有密切关系。各种多糖、脂类、核酸、蛋白质等形成的自身抗原,以各自的抗原决定簇与不同的载体即自身各种组织成分结合后,以不同的方式达到了自身免疫耐受。一旦这种自身免疫耐受机制破坏,即可导致自身免疫反应,产生自身抗体。T细胞旁路学说认为,高浓度的自身抗体可使T4和B细胞免疫耐受,低浓度的自身抗原只使TH产生耐受。后者B细胞虽未致耐受,但因缺乏TH的辅助作用,也不能接受自身抗原的刺激而产生自身抗体。当自身抗原被修饰后而产生新的抗原决定簇,或与药物等半抗原结合获得新的抗原决定簇,或当病原体感染,外来抗原如同时载有外来的和自身的或模拟自身的抗原表位(epitopes)时,TH的耐受状态可以解除,恢复对B细胞的辅助作用,B细胞活化而产生自身抗体。
三、独特型-抗独特型网络缺陷学说
独特型(idiotype)是存在于抗体或淋巴细胞受体上的独特型抗原决定簇,即同一个体内不同的抗体形成细胞所产生的免疫球蛋白具有各自不同的抗原特异性。此种抗原特异性受各自细胞内的基因控制,故又称个体基因型。独特型存在于抗体分子的Fab段。
独特型的抗体即称抗独特型。独特型与其抗独特型网络的免疫调节 学说认为,当抗原刺激免疫系统时,随即出现有个体型决定簇的TH和TS细胞,它们调控B细胞产生特异性抗体(Ab1),Ab1分子上的个体型决定簇对机体又是一种新抗原,就可以诱导出抗独特型抗体(Ab2)及带有Ab2个体型的TH和TS细胞;Ab2能抑制Ab2的生成,并能诱导出产生Ab3和带有Ab3个体型的TH、Ts细胞。Ab3能抑制Ab2生成并解除Ab2对Ab1生成的抑制。从而形成独特型-抗独特型网络。
Zanetti提出有关独特型-抗独特型网络参与自身抗体产生的可能途径:①独特型抗体直接活化载有互补独特型的自身反应性B细胞克隆。②独特型抗体具有自身抗原相关表型的影像功能(影像效应)。③独特型抗体具有双功能分子的作用,即带有可刺激载有互补独特型的克隆,也带有起影像效应的独特型,可活化有自身抗原受体的克隆。④抗无关外源性抗原(细菌、病毒、药物等)的抗体(Ab1b)可能与抗特定自身抗原的抗体(Ab1a)偶然地有共同的独特型,因而抗Ab1b的独特型抗体(Ab2b)可特异性刺激载有互补交叉反应性独特型受体的B细胞,引起自身抗体的产生。
四、遗传因素
自身抗体的产生和遗传因素关系密切。Bell等的研究发现,全身性红斑狼疮患者抗SS-A抗体阳性患者,HLA-B8抗原出现率为81%,HLA-DR3出现率为100%。显着高于抗Ro与抗nRNP阴性或nRNP阳性的患者。
自身抗体的产生机理是十分复杂的问题,尚待深入探讨,使各种学说综合统一还要进行大量的实验研究,明确自身抗体在发病机理中的作用,对诊断和治疗自身免疫性疾病有重要意义。
参考文献
1.王伯沄.自身抗体的免疫荧光检查法.汪美生主编”免疫学基础”.陕西科学技术出版社,1981;290~294
2.WangBaoyun (王伯沄)&Hu Shaowen (胡绍文).Prelimary study of certain autoantibodiesin thyroid diseases. Chinese Med J.1990; 93:717
3. 王伯沄.正常人和病人血清中某些自身抗体的发生率.第四军医大学学报,1981; 1:30
4.王伯沄.国人疾病和正常人抗核抗体(ANA)的阳性率-3884人次ANA检查结果.第四军医大学学报,1981;2:135
5.WangBaoyun(王伯沄).Incidences of certainautoantibodies in sera of human normals and patients (By immunofluorescenttechnique).Printed by Miles Laboratories Inc in USA. 1982; P506~519
6.王伯沄.A蛋白在免疫细胞化学中的应用—检查病人血清自身抗体IgG(ANa , PCA)免疫细胞化学方法.第四军医大学学报,1982;1:42
7.王伯沄.自身抗体的免疫荧光检查方法及其在研究和临床诊断中的应用.中国免疫学杂志,1985; 1:60
8.潘伯荣.抗核抗体的研究及其临床应用.医学文摘,1986;3:1
9.唐福林,等.抗Sm抗体的测定及对系统性红斑狼疮(SLE)的诊断价值.中华内科杂志,1983;22:488
10.sharpGC. Anti- RNP & anti –Sm antibodies .Arthritis Rheum. 1982; 25:757
11.唐福林,等.ENA的提取及RNP抗体:Sm抗体的测定.中华医学检验杂志,1983; 6:169
12.Gaudreau A, et al. Clinical significance of antibodies to solubleextractractable nuclear antigen (AntiENA).Ann Rheu Dis, 1987; 37:321
13. 王伯沄.自身抗体的免疫荧光检查法和临床应用.陕西医学检查,1987;291:63
14.WickyG. et al. clinical significance of Immunofluorescence Technoklogy: selectedAmsterdamIP151~155,248~251.1982
15. 刘彦仿,等.免疫荧光法检查自身抗体中非特异性抗体.第四军医大学学报,1982;2:104
16. 蒋明, 等.系统性红斑狼疮血清抗组蛋白抗体测定的初步观察.北京医学,1986;8:87
17. 胡大文,等.短膜虫(Crithidia luciliae)免疫荧光法对血清抗体双链DNA抗体的测定及临床应用.中华内科杂志,1983;2:336
18. 戴玉琳,等.丙酮盐酸处理肝切片间接免疫荧光法检测双链DNA抗体.中华医学杂志,1984;64:203
19.刘荣卿,等.天疱疮及大疱性类天疱疮外观正常皮肤的免疫荧光检查.中华皮肤科杂志,1987;20:138~140
20.Macisaac AI, et al. Antie neutrophil cytopklasm antibody (ANCA)associatedvasculitis. Clin Nephrol,1990; 34:5
21. 刘志红 黎磊石.抗中性白细胞胞浆抗体相关性肾脏病-肾脏病的一处新概念.中华肾脏病杂志.1992,8(3):180~182
22.潘根娣,等.间接免疫荧光试验检测肝细胞膜抗体.临床检验杂志,1986;4(2):80
23. 王慧珍.自身抗体免疫荧光图形手册.香港:香港桑亚出版社,1992
第十六章 病原体的免疫细胞化学快速检查方法和应用
用免疫细胞化学方法可以检测任何一种细菌和病毒,其突出的优点是快速、敏感、简便,又能同时进行形态学鉴定。此外,它还可更广泛地使用已知抗原间接法检查血清中抗体帮助诊断。更多地应用单克隆抗体进一步提高特异性和应用的广泛性。
第一节 在细菌学中的应用
免疫细胞化学在细菌学中主要用于菌种鉴定和抗原结构的研究。细胞都各自有其特异性抗原,应用特异性抗体的荧光素或酶标记物,可以鉴定任何一种细菌。已经成功地用于鉴定几乎所有致病菌的纯培养。尤其是应用免疫荧光技术具有较其他血清学方法简便、快速和敏感等优点,并能直接进行细菌形态观察。可用于鉴定的材料也比较多样,如培养物、感染组织、病人分泌排泄物,外环境中采集材料(土壤、水、杂物等)。由于此法对某些传染病原能较常规方法作出更快速的诊断,因而具有特殊意义。
免疫细胞化学方法用于研究细菌抗原结构和形态学观察,由于单克隆抗体的应用,比其他方法更为有效。

图16-1 免疫荧光在病原细菌诊断程序中的应用时机
从患者咽部粘膜用棉拭子取标本,作涂片用甲组溶血性链球菌荧光抗体染色,能够很快作出诊断。对于痢疾杆菌、霍乱孤菌、布氏杆菌、炭疽杆菌和脑膜炎双球菌、肺炎双球菌等的实验诊断均有较好的效果(如表16-1)。
利用间接免疫荧光或酶标记抗体法,检测患者血清中的抗体更有价值,广泛用于临床诊断和流行病学研究。
表16-1 免疫荧光细胞化学方法在细菌诊断中的应用评价
| 菌种 | 疾病 | 标本 | 方法 | 敏感性 | 特异性 | 意义 |
| 甲组链球菌 | 急性咽峡炎 猩红热 |
咽部培养物 | DIF | 高 | 高 | 诊断 |
| 急性风湿热 | ||||||
| 乙组链球菌 | 新生儿败血症 | 阴道拭子 | DIF | 高 | 中 | 快速 |
| 脑膜炎 | 临床标本 | 鉴定 | ||||
| 牛型乳腺炎 | 培养物 | |||||
| 致病性大肠杆菌 | 婴儿腹泻 | 大便 | DIF | 高 | 中 | 过筛 |
| 杆菌 | ||||||
| 伤寒沙门氏菌 | 肠伤寒 | 大便 | DIF | 高 | 高 | 诊断 |
| 沙门氏菌 | 肠炎 | 大便 | DIF | 高 | 高 | 诊断 |
| (大多数血清型) | 肠热脑膜炎 | 食品 | 过筛 | |||
| 环境标本 | ||||||
| 培养物 | ||||||
| 志贺氏菌属 | ||||||
| 宋内氏菌 | 菌痢 | 大便 | DIF | 高 | 高 | 快诊 |
| 福氏菌 | 菌痢 | 大便 | DIF | 高 | 高 | 快诊 |
| 百日咳杆菌 | 百日咳 | 鼻咽涂片 | DIF | 高 | 高 | 快诊 |
| 流感嗜血杆菌 | 细菌性脑膜炎 | 脑脊髓 | DIF | 高 | 高 | 快诊 |
| 肺炎球菌 | 细菌性脑膜炎 | 脑脊髓 | DIF | 高 | 高 | 快诊 |
| 脑膜炎球菌 | 细菌性脑膜炎 | 脑脊髓 | DIF | 高 | 高 | 快诊 |
| 出血点 | (差) | |||||
| 军团菌病 | 小叶肺炎 | 痰,肺渗出物 | DIF | 高 | 高 | 诊断 |
| 肺组织切片 | IIF | 快诊 | ||||
| 李氏菌 | 李氏单核细胞 | 体液涂片 | DIF | 高 | 高 | 诊断 |
| 增多症 | 组织切片 | |||||
| 布氏杆菌 | 布氏症 | 胎盘 | DIF | 高 | 高 | 诊断 |
| (牛、羊、猪型) | (人、畜) | 病理组织培养物 | DIF | 高 | 高 | 诊断 |
| 结核杆菌 | 结核病 | 痰及其消化液 | DIF | 高 | 高 | 诊断 |
| 胎儿孤菌 | 孤菌病 | 子宫阴道粘液 | DIF | 高 | 中 | 诊断 |
| 类丹毒菌 | 动物感染 | 血液、组织、培养物 | DIF | 较高 | 高 | 诊断 |
| 放线菌 | 放线菌病 | 扁桃腺病理排泄物 | DIF | 高 | 高 | 诊断 |
| 钩端螺旋体 | 钩体病 | 尿沉渣,新鲜组织刮片或切片培养物 | DIF | 中 | 高 | 诊断 |
| 奈瑟氏淋球菌 | 淋病 | 结膜、皮肤破损,关节 液 | DIF | 较高 | 中 | 过筛 |
| 绿脓杆菌 | 肺炎 | 病理组织 | DIF | 较高 | 中 | 诊断 |
| 类鼻疽杆菌 | 类鼻疽 | 排泄物 | DIF | 高 | 高 | 诊断 |
| 病理组织 | DIF | 中 | 高 | 诊断 | ||
| 马疽杆菌 | 鼻疽 | 排泄物 | DIF | 高 | 高 | 早诊 |
| 病理组织 | ||||||
| 脆弱类杆菌 | 败血症 | 血及其他有关临床标本 | DIF | 高 | 较高 | 诊断 |
| 黑色素源标菌 | 牙周病物 | 病变部位分泌物 | DIF | 高 | 高 | 辅诊 |
| 脏器脓肿 | ||||||
| 梭状芽胞杆 | 肉毒中毒 | 食物 | DIF | |||
| 菌属 | 动物黑腿病 | |||||
| 变部组织 | ||||||
| 羊炭疽 | 大便等 | DIF | 高 | 较高 | 辅诊或诊断 | |
| 气性坏疽 | ||||||
| 破伤风 | ||||||
| 结肠炎等 | ||||||
| 沙眼衣原体 | 沙眼 | 结膜刮片 | DIF | 高 | 高 | 诊断 |
(引自,黄策:免疫荧光和荧光免疫。1983)
一、甲组溶血性链球菌的快速检查法
(一)试剂制备
用抗甲组溶血性链球菌的抗体,以FITC标记,制成荧光抗体,再用C和G链球菌充分吸收;或用抗I型链球菌M蛋白成分的血清,标记后吸收,都有可靠的特异性。
(二)检查方法
(1)以棉拭子擦拭患者咽部粘膜,取标本。
(2)将拭子浸入1ml肉汤小试管内,37℃培养2~3h。
(3)取出棉拭了作分离培养,常规鉴定。将肉汤液离心3~4min,3000r/min,弃上清,沉淀加0.01mol/l Ph7.2 PBS 洗涤,再离心沉淀,弃上清。
(4)以沉淀涂片,直径约1cm,涂两个圆形区。
(5)将标本放入95%酒精中固定1min,然后浸入PBS中洗1次,取出室温晾干。
(6)直接法染色,左侧标本作对照,加非溶血性链球菌荧光抗体染色。右侧加甲组溶血性链球菌荧光抗体染色。置湿盒中孵育20~30min,再用PBS洗2次,每次5min,振动洗涤,滤纸吸干标本周围的水。
(7)加缓冲甘油封裱,立即荧光显微镜观察。
免疫荧光检出的阳性率较培养法为高,因为前者可以检出抗菌素治疗后的死菌。二者符合率达95%。
二、脑膜炎双球菌的快速检查法
(一)制备荧光抗体
可用多价和I、II、III、IV型单价的脑膜炎球菌抗血清,分别制备多价和单价荧光抗体。
(二)检查方法
用患者咽拭子,脑脊液或培养标本制备涂片,晾干,火焰或乙醇固定,37℃中染色30min,荧光显微镜检查。
抗脑膜炎双球菌的荧光抗体有很高的特异性,可以快速检出和鉴定脑膜炎双球菌。有人应用免疫荧光检查267例脑膜炎病人脑脊液中脑膜炎双球菌,阳性率73.4%,培养和普通染色则只分别为41.9%和34.4%。
三、霍乱弧菌和副霍乱弧菌的快速检查法
霍乱和副霍乱是严重的传染病,快速诊断才能及早防治。取病人粪便标本直接涂片荧光抗体染色检查,与常规培养法比较,具有快速特异和检出率很高的优点。尤其适用于急性期病人的诊断。
四、鼠疫杆菌的快速检查法
鼠疫是烈性传染病,快速及时的诊断对于控制流行和救治病人有决定性意义,免疫荧光快速诊断方法是一种特异和敏感的手段。直接法和间接都可应用,以直接法更简便。
五、炭疽杆菌的快速检查法
炭疽也是一种烈性传染病,早期快速诊断对救治病人有决定性意义。免疫荧光检查方法对炭疽杆菌的检出率很高。应用抗夹膜荧光抗体检查炭疽杆菌有十分确定的诊断意义。也可用间接法检测血清中抗夹膜抗体。
六、致病性大肠杆菌的快速检查法
(1)制备当地常见的致病性大肠杆菌荧光抗体。
(2)取病人大便标本或直肠拭子以生理盐水搅和涂片,晾干,火焰固定。
(3)直接法免疫荧光染色,立即荧光显微镜检查。
由于本菌较其他非致病性大肠杆菌组有特殊的抗原,不易发生强交叉反应。所以,在儿童肠炎和引起人群暴发性肠炎时更准确、快速和简便。
七、结核杆菌的快速诊断方法
结核杆菌感染机体后可以诱导产生抗体,可用间接法检查血、胸腹水和脑脊液中的抗体。
也可用抗结核杆菌的荧光抗体直接法检查抗原。
八、其他细菌的快速检查方法
对军团杆菌、布氏杆菌、土拉杆菌、产气夹膜杆菌等的快速诊断,效果良好。
九、钩端螺旋体的检查法
(1)根据当地钩端螺旋体的型别制备多价抗体、标记FITC制成荧光抗体。
(2)检查方法:
①血液标本的检查:取发热期的病人或发病动物的血液约2ml,制取血浆,并加入钾明矾(0.058g/ml),振荡混匀后置室温10~15min,然后中速离心沉淀,取沉渣涂片,晾干,95%酒精固定。免疫荧光染色,镜检。
②尿液标本检查:取病人或动物尿液约2~3ml,高速离心,取沉渣涂片,无水乙醇固定,免疫荧光染色,镜检。
③脏器标本的检查:取发病动物的肾脏皮质部分,以刀片切出整齐断面,滤纸吸去血液,再以洁净载玻片压印制片,晾干后以丙酮在4℃固定。经10%甲醛固定的组织可作冰冻切片,依丙酮-乙醇-甲醇的次序固定,荧光抗体染色前以3%表面活性剂如Tween20处理切片,据称,这样可使荧光强度增加4倍。
④培养液检查:同尿处理。
⑤特异性抗体的检查:用适当血清型的钩端螺旋体作抗原,用间接法检查病人血清中的特异性抗体,可用于流行病学调查和临床追溯诊断。此检查适用于人类和家畜等。
本法诊断钩端螺旋体,一般只具有属的特异性,鉴定抗体则可能达到型的特异性。
十、梅毒螺旋体的检查法
免疫荧光细胞化学应用于梅毒血清学诊断有很多文献报道。70年代应用PAP法又将敏感性提高了许多倍,此法已作为梅毒诊断的常规方法。用间接免疫荧光法可PAP法,取已知梅毒螺旋体作抗原,检查病人血清中的特异性抗体。
(一)抗原制备
以标准株(如Nicol株)梅毒螺旋体感染家兔睾丸,约1周后待睾丸产生明显炎症,剖腹将睾丸摘除,仔细清除精索、附睾和包膜,然后以灭菌器械将其剪成薄片,置于烧瓶内,加入20ml生理盐水,振荡30min,使螺旋体逸出,2000r/min离心10min以除去组织碎块和血细胞,将上清高速离心(10,000r/min)30min,去上清,沉淀以5ml生理盐水洗涤,再高速离心,洗涤,反复3次以上,以尽可能除去组织成分和家兔球蛋白,最后以pH7.2PBS(内含0.01%硫柳汞或数滴福尔马林以防腐)将沉淀制成敏感毫升约含10,000,000螺旋体的悬液,置4℃保存备用。有效期约半年。
(二)荧光抗体
用抗人IgG和IgM荧光抗体。为诊断新生儿先天性梅毒,必须用抗人IgM荧光抗体。
所有稀释用PBS 0.1mol/L Na2HPO4-KH2PO4,0.15mol/lNaCl Ph7.2含1%Tween-80。
(三)间接免疫荧光染色方法(FIA试验)
1.定性检查先将待检血清灭活。在载玻片上以白金耳取抗原液涂片,每片涂4个点,在室温中晾干,丙酮固定10min。各点分别加-1:50稀释待检血清;②-1:200稀释阳性血清;③-1:50稀释阴性血清;④-PBS。放入湿盒,在37℃或室温中放置20min,用PBS振荡洗涤10min,再加适当稀释的抗人IgG和IgM荧光抗体,再同上条件下放置20min,水洗,封裱,镜检。结果如①、②荧光阳性,③、④阴性,待检血清即判断为阳性。阳性时梅毒螺旋体呈明亮的黄绿色荧光,亦有人将待检血清稀释1:200作定性检查,这样可排除低稀释时正常人可出现的假阳性反应,此法又称FTA-200试验。
2.滴度测定如定性检查阳性,则被检血清应进一步稀释成1:100,1:200,1:400,1:800,1:1600……以定出染色滴度,滴度疑点以螺旋体发“++”荧光为标准。
(四)荧光梅毒螺旋体抗体吸收试验(Fluorescent treponemal antibody – absorption Test 简称FTA-ABS)
FTA-200试验敏感性较差,有时查不出潜伏期和晚期梅毒。FTA-ABC试验不但敏感性高,而且特异性更好。方法是将非致病性螺旋体Reiter株的培养液于121℃高压加热10min,然后高速离心、沉淀,取其上清浸液作为吸附剂,并用以稀释病人血清(1:5),然后如上法(FTA试验)进行染色检查。
FTA-ABC所用的反复洗涤过的纯梅毒螺旋体抗原,推荐置1.0%清蛋白、0.0375mol/l葡萄糖、0.01mol/L二氯化镁和0.85%氯化钠溶液(用0.1mol/L磷酸钾缓冲液pH6.8配制)中冰冻干燥保存,其中清蛋白起保护剂的作用,葡萄糖可增加折光率,二氯化镁维持螺旋体的形态学,缓冲液稳定pH。
(五)梅毒螺旋体的直接检查法
取梅毒局部硬结渗出液涂片,用直接法或间接法免疫细胞化学染色,更容易发现隐藏在细胞碎片之间的螺旋体。免疫荧光检出效果和暗视野检一样敏感。如用RB200标记牛清蛋白作初染色,图像更为清晰。
第二节 在病毒学中的应用
免疫细胞化学在病理学中的应用最为广泛,并取得了很大成果。
一、病毒抗原定位
免疫细胞化学技术十分适合于病毒和病毒抗原在组织培养和机体细胞内的生长繁殖定位的观察。
1.
2.先核后浆定位水痘、流感(甲、乙)、鸡瘟、假狂犬病、单纯疱疹、腺病毒2,3,4,5,7型,多型瘤、劳斯探氏肉瘤病毒,先在核复制,随后在胞浆中定位。
3.先浆后核定位痘苗、脊髓灰质炎、麻疹等病毒是先在浆中复制,后进入细胞核。
4.
5.胞浆内定位腮腺炎、新城疫、仙台病毒、流感、口蹄疫、鹦鹉热、狂犬病、小鼠脱足病、痘苗、墨内山谷脑炎、马脑炎、埃及101病毒、黄热、乙型脑炎、痘病毒、天花等病毒。
二、病毒感染过程
用免疫细胞化学方法可以看到病毒从宿主的细胞到细胞,丛一个部位到另一个部位的扩散过程,如用免疫荧光技术看到了犬肝炎病毒的血行扩散;犬瘟热病毒的淋巴和血行扩散。免疫荧光双重染色法用以观察双重病毒感染,如蜱传染毒(TBE)和麻疹病毒同时感染羊胚肾细胞,看到双重感染细胞中病毒抗原和核酸的分布不同于单种病毒感染者。
三、肿瘤与病毒
用免疫细胞化学可以观察肿瘤病毒和细胞,病毒抗原和肿瘤抗原之间的互相关系。如在不能查出传染病毒的肿瘤细胞中发现了病毒抗原;在典型的肉瘤细胞胞浆中发现了劳斯(Rous)氏肉瘤病毒;对EB病毒与非洲淋巴瘤、鼻咽癌和白血病等的关系进行了有价值的研究,并发现了与Eb 病毒感染有关的两类抗原,调查了某些疾病病人和正常人血清中抗EB病毒抗体的分布情况。王文亮等在原发性肝癌细胞中发现了乙型肝炎病毒核心抗原(HBcAg)和核心抗体。
四、病毒计数
五、病毒的快速诊断
免疫细胞化学为病毒感染性疾病的快速诊断开创了一个广阔的道路(参见表16-2),最先用免疫荧光法作流感病毒快速诊断,证明有较高的特异性。随后,对流行性乙型脑炎,脊髓灰白质炎、呼吸道和肺炎腺病毒、疱疹病毒等进行了临床快速诊断,提高了诊治效果。近年,利用免疫细胞化学方法检测EB病毒IgA抗体诊断鼻咽癌取得突破性成果,对于早期诊治鼻咽癌作出了重大贡献。在早期诊断流行性出血热方面,免疫细胞化学方法更显示了其优越性,利用感染流行性出血热病毒的细胞培养标本,可以在发病的早期查出IgM抗体,作出早期快速诊断。检测患者血清中的抗体和效价,更有利于病毒感染性疾病的防治,也可直接检查病变中的病毒。
表16-2 免疫细胞化学在病毒学的应用
| 疾病 | 检出对象 | 标本 | 方法 | 敏感性 | 特异性 | 意义 |
| 各种立克次体病 | 抗体 | 血清 | IIF | 高 | 高 | 诊断 |
| 抗原 | 病变组织 | DIF | 中~高 | 高 | 流病 | |
| 调查 | ||||||
| 呼吸道病毒感染 | 抗(IgM,IgG,IgA)病毒(RS,流感甲、乙副流感1,3,4,6b,腺病毒组、麻疹、腮腺炎、风疹) | 血清、脑脊液、其它体液、鼻咽部洗液、呼吸道分泌物、病变组织、活检及尸检材料、组织培养材料 | IIF | 高 | 高 | 诊断 |
| IIF | 中~高 | 中~高 | 同上 | |||
| DIF | 诊断 | |||||
| 病毒性肝炎 | HBsAg | 血清、组织 | DIF | 高 | 高 | 辅诊 |
| HBV | IIF | |||||
| HBcAg | 血清、组织 | IIF | 高 | 高 | 辅诊 | |
| DIF | ||||||
| HAV | HA Ag | 肝活检 | IIF | 高 | 高 | 研究 |
| 疱疹病毒感染 | ||||||
| 单纯疱疹 | 抗原 | 皮肤刮屑 | IIF | 高 | 高 | 诊断 |
| 巨细胞病毒感染 | 抗体 | 血清 | IIF | 高 | 高 | 诊断 |
| ACIF | ||||||
| 带状疱疹 | 抗体 | 血清 | IIF ACIF | 高 | 高 | 辅诊 |
| EB病毒感染 | 抗体 | 血清 | IIF | 高 | 低 | 辅诊 |
| 狂犬病 | 抗原 | 犬脑 | DIF | 高 | 高 | 受伤人确诊 |
| 抗体 | 血清 | IIF | 中 | 中 | 诊断 | |
| 虫媒病毒感染 | 抗体 | 血清 | IIF | 高 | 高 | 诊断和流 |
| 马脑炎 | 病调查 | |||||
| 登革、黄热圣路易脑炎 | 抗体 | 血清 | IIF | 高 | 中 | 同上 |
| 乙型脑炎 | 抗体 | 血清 | IIF | 高 | 高 | 诊断 |
| 无菌性脑炎 | 抗体 | 血清 | IIF | 高 | 高 | 诊断 |
| 出血热、拉赛热 | 抗体 | 血清 | IIF | 高 | 高 | 诊断流病 |
| AIDS病毒 | 抗体 | 血清 | IIF | 高 | 高 | 调查 |
注:ACIF:抗补体免疫荧光法:DIF:直接免疫荧光;IIF:间接免疫荧光(引自:黄策:免疫荧光和荧光免疫,1983)
作者等用免疫荧光和ABC法在人肾组织中发现了流行性出血热病毒抗原。
免疫荧光细胞化学技术为病毒感染的快速诊断开辟了一条很有希望的道路,一方面可用于病原体检出,另一方面可用于抗体的检出。
(一)病毒的检查
1.原发感染材料的直接制片检查取病人或感染动物的末梢血液、尿、大便、脊髓液,咽喉鼻腔拭子、含嗽液、表皮病变渗出物、以及尸检材料等。进行直接法免疫荧光染色检查。可在2~3h以内得出初步结果。
2.组织培养物检查将取自病人或感染动物的材料感染培养细胞,待病毒在细胞内发育繁殖到一定程度后才能作免疫荧光检出,一般需10h以上。
3.接种动物感染材料检查将取自病人的感染材料接种实验动物如小鼠、鸡胚,使其发病,然后以免疫细胞化学方法检查实验动物的各种感染标本。
(二)抗体的检查
用已知病毒感染的细胞培养物为抗原,现酮固定10min,用病人待检血清与抗原反应20min,再用抗人IgG和IgM荧光抗体分别染色30min,按常规洗涤、裱封、镜检。一般需在发病过程中,前后两次检查(急性期和恢复期各一次),证明被检血清的染色强度有4倍以升高时,方能确定诊断。它比常规血清学方法操作简便,对有些病毒感染敏感性较高。张新生等利用金黄色葡萄球菌表面蛋白A(SPA)能与IgG的Fc段结合这一特点,用全菌体作为标记靶吸附病毒,形成花环状结构,再用2%磷钨酸负染色后在电镜下观察,操作简便,易于推广。
(三)常见病毒的快速检查方法
1.乙型肝炎病毒抗原的快速检查方法作者用免疫荧光间接法,PAP法和ABC法分别对人活体肝穿刺组织和尸检的肝炎、肝硬化和肝癌组织、先用10%甲醛固定、石蜡包埋切片,进行了乙型肝炎病毒HBsAg、HBcAg 和HbcAb的检查,在肝细胞、胆管上皮细胞和癌细胞内发现了这些抗原或抗体,对诊断和发病机理研究有重要意义。
2.狂犬病毒的快速检查方法可直接检查活检和尸检材料或查角膜印片中的狂犬病毒抗原,用直接法最成功。也可用间接法检测IgM抗体进行早期诊断。最好用免疫荧光法。
3.疱疹病毒的快速检查方法疱疹病毒(HSV)的抗原用直接免疫荧光检查,常取眼结合膜细胞,皮肤刮片,活检和尸检材料。
4.巨细胞病毒的快速检查方法用抗补体荧光抗体方法作此病毒抗原的特异性检查,常取尿沉渣中的细胞涂片标本进行检查。
5.流感病毒的快速检查方法最早用免疫荧光法检查流感病毒,一般采用直接法检查鼻咽部脱落细胞涂片中的病毒抗原。也可用间接法检测抗体,必须使用单价特异性羊抗人IgG荧光抗体,以避免与上皮细胞上的IgA发生非特异性荧光。
6.麻疹病毒的快速检查方法检查麻疹病人出疹前后的鼻咽部分泌物和眼结合膜中的细胞可快速检出病毒抗原。也可用尿沉渣细胞标本直接法检出抗原。用间接免疫荧光法可检出病毒抗体作快速诊断。
7.流行性出血热病毒快速检查方法直接法检查白细胞中的抗原,单克隆抗体可制备高效价的荧光抗体。用间接法可快速检出病人IgM抗体,对病人进行早期诊断是我国的创新,世界卫生组织向各国推荐。
8.爱滋病病毒抗体免疫荧光检查方法目前常用以下方法检查患者血清中的AIDS病毒抗体,对高危人群和可疑患者进行病毒抗体检查具有重要的意义。
抗原片:将AIDS病毒感染的Hu-T-78细胞用PBS制成悬液,滴于玻片上,吹干,丙酮固定,装入塑料袋中,密封,-40℃保存。阴性对照用Hu-T-78细胞,同上法滴片处理。
间接免疫荧光检查法。
(1)先将待检血清用PBS作1:16稀释,取30μl滴加在抗原片上,放入湿盒,37。C30min。
(2)用0.01mol/L,PBSPh7.0洗涤2次,每次3min。
(3)滴抗人IgG荧光抗体,湿盒37℃3min。
(4)PBS洗2次,每次3min。
(5)缓冲甘油封片,荧光显微镜检查。
结果:抗原片细胞浆内出现弥散荧光,阴性对照无荧光。
9.其他病毒的快速检查方法腺病,带状疱疹病毒,付流感病毒,流行性腮腺炎病毒,呼吸道细胞病毒,风疹病毒,肠道病毒,乙脑病毒,森林脑炎病毒,登革热病毒等已有报告用免疫荧光法检查抗原或抗体作快速诊断。
第三节 在寄生虫学中的应用
在寄生虫学中应用免疫细胞化学方法,对于人体大多数寄生虫都较其他血清学方法敏感。图象鲜明,易于观察。在诊断方面,免疫荧光间接法最常用于检查宿主的抗体。抗原制备容易,只需要作成切片、涂片或压印片标本,不需提纯可溶性抗原;有些可溶性抗原固定于醋酸纤维滤纸上,反应后以荧光计读数,可以定量。
但是,对于血中缺乏抗体的寄生虫如皮肤利什曼病,则难以诊断。还有些寄生虫(如扁形蠕虫)抗原性的变化,则需制备多种抗原。丝虫等有较强的抗原交叉性,解释结果必须慎重。
一、血吸虫病
(一)抗原
可用尾蚴成虫。
1.尾蚴抗原将每毫升300条左右的尾蚴悬液与等量20%福尔马林混合。作用5min后,用PBS洗涤离心2次,取尾蚴沉淀备用。在4℃保存。
2.成虫抗原 可将成虫制成切片,甲醇固定10min,低温保存备用。
(二)待检血清
可按常规静脉采血分离血清,也可自指尖或耳垂微量采血(约0.05ml),滴于优质滤纸上干燥,试验时用生理盐水浸取可溶性免疫球蛋白成分。干燥于滤纸上的血样,在室温中(22~26℃)或普通冰箱中保存3个月以上,可以邮寄。
(三)荧光抗体
可用抗人IgG或IgM荧光抗体,其特异性需经免疫电泳鉴定。
(四)检查方法
1.尾蚴染色法可将抗原沉淀以白金耳挑取涂片,干燥后以甲醇固定10min。然后按常规间接法染色。
2.成虫染色法同一般切片间接法。
据报道,此法敏感性可达80%~98%。
二、疟疾
免疫荧光间接法用于研究人和实验动物对疟原虫感染的免疫反应,疟疾流行病学调查和临床诊断有很大的实用价值。
1.抗原标本人疟原虫标本制备:采用多种疟原虫混合抗原,制作涂片,甲醇或丙酮固定。要每个高位中视野含裂殖体总数约15个即可。或用易感猴的各种疟原虫感染的红细胞。
鸡疟原虫抗原标本制备:取感染疟原虫后第9~11天之间的鸡血制备血膜,贮于4℃或-20℃下,用前丙酮固定10min。
2.待检血清采血方法同血吸虫法。
3.荧光抗体常用抗人IgG荧光抗体。
4.检查方法待检血清以1:20起始稀释,按间接法染色,镜检。
5.结果判断阳性结果,人类疟原虫包涵体呈现明亮的黄绿色荧光。鸡疟原虫抗原主要显示胞浆染色。1:16或1:20稀释待检血清阳性时,可以继续稀释作滴度检查。低于1:20的结果无意义。用人类疟原虫多种混合抗原和单抗原,病人抗体染色效价可达1:65536,1:1024~1:4096者占1/3。以鸡疟原虫作抗原,效价最高1:640,以恶性疟最高为1:150,间日疟为1:40。
三、阿米巴病
用间接免疫荧光方法检查阿米巴肝腔肿病人血清抗体,阳性率可达90%~100%。血清抗体滴度在1:80或1:160有诊断意义。治疗后抗体滴度下降。肠道阿米巴疾病阳性率较低(59%~91%)。
四、锥虫病
用间接免疫荧光方法检查各种锥虫病患者血清抗体,对于恰加斯氏病(克氏锥虫所致)的血清抗体诊断,有高度的敏感性和特异性。用于检查非洲锥虫病的阳性率为85.9%(WHO,1976)。冈比亚锥虫和罗德西亚锥虫所致非洲昏睡病的血清抗体诊断,在检测特异性抗体时,同种抗原比异种抗原好,可达到最高的敏感性。
五、丝虫病
应用丝虫成虫冰冻切片抗原作间接免疫荧光检查适用多种丝虫病免疫诊断。很有价值。如魏氏棘唇线虫抗体阳性率可达905。用作流行病学调查,可反映流行的准确情况。已用于盘尾丝虫、班氏丝虫、犬恶丝虫、广州管圆线虫等抗体的检测。
六、弓形虫病
已证实免疫荧光间接法检查弓形虫抗体,是一种诊断弓形虫病的特异和敏感的方法,阳性率可达98%。用死虫体作抗原很简便,检查IgM抗体可诊断新生婴儿先天性感染。
七、旋毛虫病
用旋毛虫冰冻切片作抗原,间接免疫荧光方法检查病人血清抗体,很敏感、特异和经济,节 省时间。
八、其他寄生虫病
已用间接免疫荧光方法对蛔虫病,弓蛔虫病,钩虫病,线虫病,吸虫病(肺吸虫和肝吸虫)、绦虫病(包括囊虫病和牛肉绦虫以及猪肉绦虫)等进行快速诊断,取得较好的结果。
第四节 在真菌学中的应用
真菌感染的疾病包括白念珠菌病,曲霉菌病和新型隐球菌病。常规镜检和培养,检出率低,早期诊断困难。免疫细胞化学检查方法可能具有一定的快诊价值,正在研究改进中。新型隐球菌抗体的免疫荧光检测取得良好的结果,阳性率可达79%。
参考文献
1.许屏,荧光和免疫荧光染色技术及应用.人民出版社,1983:100~102
2.Nairn RC, Fluorescent proteintracing. F & S .Living stone LTD. Edinburgh and London. Third Edition. 1969:152~246
3.王文亮,等.肝癌及其周围组织内乙型肝炎表面抗原(HBsAg).中华肿瘤杂志,1979;1:101
4.Yan Pei– song, et al. Pathologic renal changes in epidemic hemorrhagic feveraccompanied by chronic renal failure in one case.Chin Med J, 1986;996:503~506
5.五九一七五部分.荧光显微术.上海科学技术情报研究所,1976:244~288
6.CoonsAH, et al. The demonstration of pneumococal antigen in tissue, by the use offluorescent antibody. J Immunol, 1942;45:159~170
7.谭承项,等.乙型肝炎组织内HBcAg的免疫组织化学研究.中华病理学杂志,1987;16(2):90
8.晏培松,等.流行出血热肾小球的光学显微镜,电镜及免疫荧光观察.第四军医大学学报,1982;1:15
9.黄策.免疫荧光和荧光免疫.北京:全军三防医学会议大会论文报告,1983
10.张新生,等.具有标记靶作用的固相免疫电镜快速诊断法.电子显微学报,1985;4(4):14
11.LiuYanfang , et al. Intrauterine infection of epidemic hemorrhagic fever (EHF)viaplacenta. Chinese Med J, 1987;100(9):756
12. 杨守京,等.流行性出血热患者组织中红细胞病毒抗原、抗体及补体的原位检测.中华微生物学和免疫学杂志,1993;2(2):130~135
第十七章 免疫细胞化学在皮肤病学的应用
免疫细胞化学技术已被广泛应用于皮肤科学领域,尤其在皮肤科的自身免疫性疾病如天疱疮、大疱性类天疱疮、红斑狼疮的诊断、病情和疗效判定及发病机理的研究方面,起着重要作用。现将免疫细胞化学在皮肤病学的应用简要介绍如下。
第一节 角朊细胞
一、对角质层抗原与角质层自身抗体、角蛋白抗原的研究
角朊细胞从上到下可分为角化(质)层、粒层和基底层。角质层位于表皮外层,是一种特殊的结构,由许多已角化的扁平细胞组成。电镜下仅见增厚的胞膜和紧密排列的张力微丝。角质层很少或根本不与免疫系统相通。应用免疫荧光技术表明,所有正常人血中都含有低滴度的抗角质层自身抗体,免疫荧光呈局灶状或颗粒状分布于角质层内。在体外,角质层抗体与其产生者自身的角质层发生反应,因而证明是自身抗体,但在正常人体内不发生反应。下列两种情况可使其在体内与角质层发生反应:①外伤;②银屑病鳞屑内。银屑病人血清中的抗角质层自身抗体与正常人无差别,但在银屑病的鳞屑浸出物中发现有Ig。这种抗体是能与补体结合的IgG和IgM型抗体。
角质层抗原与角化细胞的细胞膜或/和细胞间质有关,近年来通过对角蛋白多肽的研究发现至少一些角质层的自身抗体是针对角蛋白的。
抗角质层自身抗体的应用:抗角质层自身抗体存在于正常人血清中,但并不引起疾病。该种抗体可能对于清除损伤了的表皮细胞有一定的作用,银屑病中角朊细胞的过度增生可能与这种抗体的沉积有关。与抗角质层自身抗体有关的疾病尚有类风湿关节 炎、关节 病型银屑病、外伤等。
制备的抗角蛋白抗体:近10年来,应用免疫动物的方法制备了多种抗角蛋白多抗或单抗,可以针对不同分子量的角蛋白成分。角蛋白是上皮细胞的中间丝成份,抗角蛋白抗体可以作为上皮组织和由上皮组织起源的肿瘤的有用标记之一。
二、对天疱疮的研究
天疱疮是一类自身免疫性疾病,其临床特点为皮肤和粘膜的自发性的、松弛性的水疱形成,病理特点是由棘层松解引起的表皮内水疱。临床上可分为寻常型(PV)、红斑型、落叶型(PE)、增殖型、疱疹样型五型。
1.免疫荧光检查应用IIF检查,天疱疮病人中85%~90%血清中有抗表皮棘细胞间抗体(Pab)存在,活动期更高。血清中Pab滴度与病情严重程度相平行。免疫荧光图形是棘细胞间均一的线型。作IIF检查时,底物很重要。Michael等比较猴食道及豚鼠食道上皮作为PV和PF的底物情况,发现PV以猴食道上皮作底物较好,而PF则以豚鼠食道上皮作底物较好。唐书谦等认为作IIF时首选人表皮和猴食道上皮,而小白鼠食道及大白鼠舌粘膜亦可作为一般常用的底物。我们的经验是,-20℃保存1年的冰冻人包皮切片作底物时,其抗原性无明显减弱,但时间过长,则要影响其滴度;冰冻切片后的皮肤暴露于室温(20℃±)3h即可完全破坏其抗原。
取天疱疮皮损周围皮肤作DIF,对天疱疮的诊断更有意义。如天疱疮的皮损广泛,也可取外观“正常”的皮肤,而不一定要取皮损边缘的皮肤,但皮损边缘的皮肤荧光抗体稀释度较“正常”皮肤者为高。
2.免疫荧光显示的部位在PV中,免疫球蛋白附着的部位一般在基底细胞上棘细胞下层;而在PF中,免疫球蛋白附着的部位在较上层的棘细胞间。与Pab结合的天疱疮抗原位于表皮细胞表面,其细胞间的荧光是细胞表面荧光的延伸。免疫电镜证明天疱疮抗原可能与桥粒列明显关系。
除用免疫荧光法可证明有Pab存在外,目前也用酶标法、ABC法等。
天疱疮抗体主要为IgG,也有部分为IgM和IgA。应用DIF检查时,也发现有C3沉积,但目前认为可能是继发于Ig的沉积。
3.天疱疮抗体与天疱疮的关系可由以下几方面来证明①DIF证明天疱疮病人皮损周围及“正常”皮肤处有IgG的沉积,且其荧光强度与病情的严重程度相平行;②血清中的Pab滴度与病情的严重程度相平行;③进行皮肤器官培养时,加入纯化的Pab可导致天疱疮样的棘层松解;④用血浆交换法去除Pab可导致天疱疮的缓解。
天疱疮抗体是针对表皮细胞膜多糖萼的抗体,其在体内与表皮细胞膜结合后可能使表皮细胞释放蛋白溶解酶如u –PA,u-PA在天疱疮发病机理中的作用:1)角朊细胞培养时加入Pab后,上清液中u-Pa ↑;2)抗u-PA抗体可阻止棘层松解发生;3)u-PA的抑制剂如α2-巨球蛋白、STBI以及合成抑制剂Foy、Foy-305、FUT-175、止血芳酸等均能在一定程度上抑制Pab导致棘层松解的产生。
4.天疱疮样抗体与血型抗体Ahmed及Workman检查1500份正常血清,发现14例有低滴度的抗表皮细胞间抗体,但无天疱疮的临床表现,其中9例用A、B型血型物质吸收后荧光消失,说明其可能为A、B血型抗体,A、B、H血型抗体存在于正常皮肤和口腔粘膜的棘层和颗粒层,但不存在于基底层和角化层,其分布同天疱疮抗原。药疹、烧伤等可有天疱疮样抗体,其与Pab的区别在于前者稀释度较低,荧光染色图形为粗颗粒状、不均一,且部分可用A、B血型物质吸收,而Pab的荧光图型为连续均一的线型,用A、B血型物质吸收后滴度不变。
三、HLA-DR抗原
人类有核细胞均存在MHC-I类抗原(HLA-A、B、C),表皮中下层亦有表达,但角质层阴性,其与皮肤病的关系有较多的报道。但本文只就角朊细胞表达HLA-DR抗原(在鼠为Ia抗原)作一简述。
人类MHC-II类基因位点主要有HLA-DR、DQ、DP三种抗原。HLA-DR抗原常存在于免疫活性细胞上,与抗原提呈给CD4+辅助T细胞有关。
1981年Lampert等首先报道在移植物抗宿主反应(GVHD)中角朊细胞有HLA-DR抗原存在。HLA-DR的图型为粗网状。后来人们发现,皮肤中有显著淋巴细胞浸润的疾病如GVHD、MF、湿疹、DLE、扁平苔藓时角朊细胞能表达HLA-DR抗原。白兆霞等对尖锐湿疣皮损组织进行免疫学检查,发现尖锐疣组织中HLA-DR(3/4)阳性,HLA-DQ(1/15)阳性,HLA-DP(3/14)阳性,而正常皮肤不表达HLA-DR抗原。
正是因为有了角朊细胞能表达HLA-DR抗原的证明(另一个证明是角朊细胞能产生一些细胞因子),现代皮肤病学家才不仅仅瓜皮肤作为一个单纯的物理屏障和湿度调节 器,皮肤免疫系统(Skin immune system, SIS)的概念才得以形成。SIS的细胞成份包括:角朊细胞、肥大细胞、树枝状抗原提呈细胞、组织中的巨噬细胞、粒细胞、肥大细胞、内皮细胞、T细胞等;体液成份包括:抗微生物多肽、补体、免疫球蛋白、细胞因子、纤溶素、花生四烯酸、神经肽等。
四、凝集素受体
随着表皮细胞分化从基底层进到角化层,基细胞表面的糖链亦有改变。在新生兔表皮中,rittonla simplictolia Isolectin1-B4(GSI-B4与α-D-galactopyranosyl 残基结合)与基底层结合较强,而与棘层结合较弱,不与粒层、角南层结合。UEA(与α-L-fucose残基结合)与棘层、粒层下部结合,但不与基底细胞层和角质层结合。Con-A:基底细胞荧光较棘层弱,用96%乙醇固定皮肤时,荧光大为减弱,10%福尔马林固定则使荧光完全消失,Con-A的免疫荧光图型同Pab,但Con-A也使基底膜带和真皮胶原着色,Pab与Con-A的荧光在角朊细胞时能相互阻滞,因而认为天疱疮抗原可能是表皮细胞膜上能与Con-A结合的一个多糖萼成分。PNA在猪表皮中使表皮各层活细胞(即角质层除外)着色,而在人组织则仅使基底层上活细胞着色。
表皮细胞癌变过程中,表面多糖类也发生改变:可表现为①正常寡糖基增加或丢失;②正常糖基分布改变;③出现一些未成熟的或新的寡糖基而成为与肿瘤相关的决定簇。我们的研究认为PNA、BSL、UEA在生殖器疣,尤其到PIn III/CIN III及生殖器癌阶段时染色显著增强,而LCA则无明显改变,DBA在PIn III/CIN III时阳性率最高,到癌变时又下降,其原因尚不清楚。
凝集素受体主要为细胞浆着色,但有部分可使细胞膜着色。
五、其它
用人工制备的抗桥斑、桥糖蛋白抗体,抗细胞粘附分子、转铁蛋白、表皮生长因子、糖皮质激素等抗体,也发现了皮肤角朊细胞上有这些物质的受体存在。应用免疫组化和相关的技术,将会进一步明确它们的作用及其与皮肤病之间的关系。
第二节 黑素细胞及其肿瘤
一、正常黑素细胞
人类黑素细胞主要分布于表皮基底层。表皮黑素细胞起源于神经嵴。HE染色的切片中,黑素细胞核小浓染,胞浆透明,约10个基底细胞中可见一个。能确定黑素细胞的方法有透射电镜观察及多巴染色。免疫细胞化学染色目前仅以抗S-100蛋白抗体着染有一定参考意义,根据其位于基底层一般可判断其系黑素细胞,但有时Langerhan氏细胞也可存在于基底层,而且我们在应用中还发现,不少皮内痣未累及表皮的黑素细胞作S-100蛋白染色时,表皮基底层未能显示阳性的黑素细胞。中间丝系列中,黑素细胞波形纤维蛋白阳性。此外,黑素细胞尚可表达黑素小体相关抗原(HMSA)、一些神经苷酯、P97等黑素瘤相关抗原,但极微弱。
二、色素痣
色素痣可表达与黑素细胞相同的抗原,且通常较强。1987年Nakanish等曾克隆出一析仅与色素痣而不与正常黑素细胞及黑素瘤细胞反应的单抗TNKH1,由于未见进一步的研究,尚不能认为色素痣中存在一种特异抗原。
三、恶性黑素瘤
恶性黑素瘤主要起源于表皮黑素细胞,少数起源于色素痣、真皮等。在黑素细胞及其肿瘤中,表皮黑素细胞最为成熟,除分化抗原外,表达的抗原少,色素痣特别是交界痣处于较低的增殖状态,表达的抗原较多,恶性黑素瘤分化最低,增生活跃,除能表达正常黑素细胞及痣细胞所表达的抗原外,尚能表达一些特殊的黑素瘤相关抗原,或表达强度远高于正常黑素细胞及痣细胞。
近10余年来,已克隆出许多株黑素瘤相关抗原的抗体,但至今尚未发现一种真正的黑素瘤特异抗原,有的单抗虽具有很高的特异性及敏感性,如两伯称2-139-1及6-26-3的单抗,黑素瘤阳性率26/26,呈强阳性或中度阳性,22例色素痣仅1列交界痣可疑阳性,然而近10年的文献跟踪未见进一步的深入研究。
在众多的黑素瘤相关抗原中,以P97、神经节 苷酯、HMB45研究得较深入。诊断应用中应用最多的是HMB45,Gown等以ABC法观察了60例恶性黑素瘤,仅2例阴性,交界部痣细胞阳性6例,皮内痣及30种168例非黑素细胞性肿瘤全部阴性。最近的免疫电镜观察显示,HMB45抗原定位于黑素化不完全的黑素小体或称异常黑素小体上。由于大样本量的电镜观察发现少数先天性痣的皮内痣中可以有异常黑素小体,另一方面少数黑素瘤中不一定存在异常黑素小体,所以应用HMB45时,除需注意交界部的阳性对黑素细胞肿瘤的良恶性鉴别无意义外,皮内损害中的阳性与阴性亦应结合HE切片进行分析。
神经节 苷酯(Ganglioside)是一类带唾液酸的鞘糖酯,按糖基中唾液酸的数目分为单、二、三、四唾液酸神经节 苷酯,分别简称GM、GD、GT和GQ,每种神经节 苷酯还可根据薄板层析迁移率Rf值的大小再分几个亚类,如GD1、GD2、GD3等。神经组织、黑素细胞等含很微量神经节 苷酯,细胞恶变过程中往往伴有神经节 苷酯的改变,其改变程度与肿瘤的恶性程度和转移有关。黑素瘤细胞表达大量GD3、GM3,25%原发和50%转移性黑素瘤还表达GD2。研究表明,恶性黑素瘤与正常黑素细胞所表达的神经节 苷酯的结构是相同的,一些神经节 酯的单抗只与黑素瘤结合,不与正常黑素细胞、神经组织结合,可能是由于含量的差异所致,另外可能与神经节 苷酯在细胞表面的暴露程度有关。GM3已被称为黑素瘤的跨种抗原,但GD3较GM3更具特异性,因两者在正常黑素细胞中的比值GM3:GD3为18:1,在黑素瘤中GM3:GD3为1:15。
目前针对神经节 苷酯的单抗有数10株,各株的抗原结合特性有一定差异,较早的一株名为R24的抗原为GD3,除与黑素瘤、星形细胞瘤反应外,与其它一些恶性肿瘤及少数正常组织亦有反应。国内引进的一株名为Mel3的杂交瘤所针对的抗原为GD2、GT3、GD3、GQ16,10例黑素瘤组织细胞100%强阳性或中度阳性,4/7例色素痣的部分细胞弱阳性或中度阳性,4/14例表皮黑素细胞呈极弱反应,胎肝以外的其它胚胎组织阴性。田芳等用该单抗所染结果与前述相类似。
P97抗原是一膜结合的转铁蛋白样分子,黑素瘤细胞膜上含量很高。现已克隆出P97分子cDNA并制备成分子疫苗,但应用前景尚不明。对P97的研究主要是应用放免法,很少应用免疫组化方法。
S-100蛋白、波形纤维蛋白虽不象一些黑素瘤相关抗原那样具有高特异性,但其应用范围广,易获得,所以此二种蛋白的抗体在黑素瘤鉴别诊断中应用最普遍。我们对68例病理确诊或疑诊的黑素瘤组织进行染色,结合抗角蛋白抗体标染,HE切片观察等,否定了11例的诊断,余57例S-100蛋白及波形纤维蛋白均阳性。根据此观察,笔者认为:在HE切片观察基础上,排除一些神经性肿瘤、组织细胞增生症X、色素痣,S-100蛋白及波形纤维蛋白均阳性,能肯定恶性黑素瘤诊断,两抗体均阴性能否定诊断。
NSE在黑素瘤中的表达率较低,染色弱,在黑素瘤鉴别诊断中实用意义不大。
第三节 Merkel细胞
一、免疫细胞化学在Merkel细胞起源和功能认识中的作用
Merkel细胞系1975年Merkel在真皮交界处发现的一种比周围基底细胞淡染的细胞,此种细胞与神经髓鞘接触,认为是触觉细胞,并发现其能促进所有特化的感觉功能所接受和传导,这种功能不需触觉小体或环状小体介导。后来在电镜下观察到Merkel细胞内含神经内分泌颗粒,组织化学和免疫组化观察到其含有与神经组织有关的酶如特异性乙酰胆硷酯酶三磷酸核苷酶、神经特异性烯醇化酶(NSE)等,出已将此种细胞归类于APUD细胞,但其它应具备的APUD细胞生物学特征Merkel细胞似乎还不具备,许多试图证明单胺代谢的努力均未获结果。
对Merkel细胞的起源,曾疑为源于神经嵴,认为系胚胎发生期伴随神经的伸展而移至皮肤。近年的研究发现,Merkel细胞能表达多种低分子量细胞角蛋白,如CAM5.2、CK5、AN3等及上皮膜抗原。发生时间上,胚胎等12周表皮开始出现单个CAM5.2、CK5、EKH5等低分子角蛋白阳性的细胞(表皮细胞不表达这些低分子量角蛋白),到15至23周,真皮浅层亦出现散在的低分子角蛋白阳性细胞,这些细胞NSE也呈阳性,以神经纤维蛋白标记显示,胚胎等第12周时,皮肤中的神经束位于真皮中部,第16周时向表皮延伸,第20周达表皮下并延至表皮[2]。这些研究及另外的工作表明,Merkel细胞系由角朊细胞分化而来,发生于小汗腺嵴。
对Merkel细胞的功能,免疫细胞化学研究结果给人们提出了新的思考:表皮Merkel细胞为什么要进入真皮?进入真皮后为什么又要数周内即消失?研究表明,真皮内的Merkel细胞表达的神经生长因子受体(NGF-R)强于表皮Merkel细胞,角蛋白的表达也有差异;Merkel细胞进入真皮的时间与皮肤的末梢神经形成的时间正好吻合,真皮内Merkel细胞减少消失的时间正好是真皮浅表神经未梢与表皮Merkel细胞形成接触的时间,提示真皮Merkel细胞起着引导形成末梢神经网的作用,当完成引导神经定位的功能后即逐渐消失,这一功能可能是先靠其表达的大量NGF-R完成的。小汗腺嵴中的Merkel细胞可能起着引导形成导管周分泌神经丛的作用,成人汗腺中不含Merkel细胞,可能是在完成神经丛的定位后消失。此外,立毛肌中的肾上腺能神经可能也是由毛盘外的Merkel细胞引导的。皮脂腺无神经支配,可能与皮脂腺胚芽中未出现过Merkel细胞有联系。
二、Merkel细胞癌的免疫细胞化学诊断
Merkel细胞癌的组织病理诊断较困难,虽然电镜下所见的神经内分泌颗粒对诊断颇有价值,但需事先留取标本。应用免疫细胞化学技术则可于HE切片鉴别有困难后再切片染色。低分子角蛋白如CAM5.2、CK5等及上皮膜抗原呈阳性,NSE、Synaphysin Chromogranin A等阳性表明系神经内分泌肿瘤。通常以CAM5.2及NSE两种抗体一起应用,阳性即可作出诊断。与其它大多数APUD肿瘤相同,S-100蛋白呈阴性。
第四节 郎格罕细胞
郎格罕细胞(Langerhans cell, LC)是起源于骨髓和脾脏的一种树枝状细胞。LC主要存在于表皮和毛囊上皮内,通常位于表皮基底层上方。但真皮内,口腔、扁桃体、咽部、食管和阴道的粘膜中以及淋巴结、脾脏和胸腺等部位也可见LC。表皮内LC可以游走、穿越其基底膜。皮肤移植时,移植物中大部分原有的LC可迅速被宿主LC所替换,只有一小部分LC能存在很久。
LC在超威结构上的特征性表现为Birbeck颗粒,亦称郎格罕颗粒。其断面呈网球拍状。LC内无张力细丝及黑色素小体。LC也无桥粒,其树枝状突起与黑素细胞、神经及其它LC也未见直接的联接。
LC在体表的分布密度因部位、性别与年龄而有一定差异。正常成人中,面颈最多,躯干、四肢及头顶为次,骶尾及掌跖较少。口腔粘膜的LC也较少。
根据LC的表面标记可识别LC,并进一步研究其功能特性。人LC的主要表面标记有FC-IgG受体、LKT6(Leu6,DAKo -6)抗原,S-100蛋白、M241抗原、T200抗原、Hle-1抗原、ATP酶、Vimentin、非特异性酯酶、Leu3(OKT4)抗原(微弱)。上述许多表面标记除LC有外,还可见于其它一些组织和细胞中。但人LC是正常皮肤内唯一能与OKT6结合的细胞,这为皮肤LC的研究提供了一个独特的标记。由上述表记可看出,LC的表面标记与巨噬细胞颇为相似。此外小鼠也是研究LC的一种常用实验动物,其LC的许多表面标记与人LC相似。
现今认为,皮肤是一个具有独特免疫功能的器官,与机体免疫系统密切相关。而LC有多种免疫功能。除上述与免疫相关的一些表面标记外,LC能摄取,提呈抗原,具有同种异基因刺激作用,还可分泌白介素1等细胞因子。LC在接触性变态反应和移植排斥过程中均起重要作用。
免疫细胞化学技术在与LC相关研究中的应用。
一、研究LC自身的表面标记
应用免疫细胞化学技术进一步研究LC表面受体或表面分子,以加深对LC功能特性的认识。通过单克隆体免疫细胞化学及RT-PCR(reverse transcriptase –ploymerase chain reaction ) 技术证实,新鲜分离的人LC能显示2种FcεRII:一种是膜相关型,可用单抗CD12检出;另一种为可溶性分泌型,可用RT-PCR证实。近年还报告,在异位性皮炎皮损中LC能显示高亲和力IgE受体(FcεRI)。
人LC还能表达β1整合素(β1integrin),后者能介导与板层素和纤维粘连蛋白的粘附。培养的LC还可表达白细胞功能相关抗原3型(leukocyte functio –associated antigen –3 ,LFA-3)和细胞间粘连分子-1型(intercellular adhesion molecule –1 ),而新鲜分离的LC则不能显示。
抗CD1单抗(如OKT6、Leu6)是显示LC最常用的。目前已知CD1可分为CD1a、CD1b、CD1c三种,正常表皮LC为CD1a(+)。在异性皮炎及蕈样肉芽肿的LC可异常显示CD1b及CD3b。组织细胞增生症X的LC尚可同时显示CD11b。
二、研究皮肤病中LC数量、密度及结构的改变
应用免疫酶和免疫电镜等技术检查LC数量、密度以及结构的变化,可探讨LC与皮肤病的关系以及外界因素对皮肤LC的影响。包括:
1.观察外界因素对LC的影响观察化学因素(如氮芥)、紫外线、X线及冷冻等因素对LC密度和结构的影响。
2.观察疾病情况下LC的数量和密度变化如蕈样肉芽肿、扁平苔藓、玫瑰糠疹、硬化萎缩性苔藓、疣状皮结核、白癜风和斑秃等皮肤病中LC增加。原发刺激性接触性皮炎中LC数量减少,而变应性接触性皮炎中LC数量增加。皮损内LC减少的疾病有:麻风、红斑狼疮、结节 病、AIDS、移植物抗宿主病,皮肤癣菌病等。此外,银屑病皮损处,LC分布不均,甚至聚集成群,治愈后可恢复有规则的分布。
免疫细胞化学技术将有助于进一步了解众多皮肤病中LC数量或密度的改变,同时也将加深对LC本身表面标记的全面认识,从而有助于全面认识LC的功能特点以及与淋巴细胞、角朊细胞及肥大细胞等细胞成分的相互影响。
第五节 真皮与表皮交界
真皮与表皮交界不平。真皮乳头与表皮的突起部分(即表皮突)互相镶接。
一、基底膜带
(一)基底膜带(basementmembrane zone, BMZ)的结构
基底膜带位于表皮真皮连结处,用PAS染色光学显微镜下所见为0.5~1μm厚的均匀一致的紫红色带,称为表皮下基底膜带。
1.BMZ的超威结构在电镜下观察,BMZ由表皮侧至真皮侧可分为四层结构:
(1)基底细胞的胞浆膜(plasmamembrane)及膜内侧的半桥粒(hemi – desmosome)。
(2)透明板(透明带,laminalucida),位于胞浆膜下方,约35~40nm厚,其中包括基底层下致密板,为7~9nm厚的电子致密片,距胞浆膜约10nm;锚丝(anchoring filament, 直径约5~7nm)从半桥粒穿过基层下致密板而固定于致密板上。
(3)致密板(laminadensa):厚约80~200nm,又分为三层:①内层,厚10~20nm,电子密度低;②中层,厚约50~150nm,电子密度高,即狭义的基板(basal lamina);③外层:厚10~20nm,电子密度低。
(4)基底膜下纤维带有:有3种纤维结构:①锚纤维(anchoring fibril),直径为20~60nm,从致密板伸向真皮;②微原纤维;③胶原纤维。
(二)病变部位于基底膜带的几种大疱性皮肤病
病变部位于基底膜带的几种大疱性皮肤病常见的有以下几种:①大疱性类天疱疮(Bullous Pemphigoid, BP);②疤痕性类天疱疮(Cicatrical pemphigoid, CP);③妊娠疱疹(Herpes Gestations, HG);④疱疹样皮炎(Dermatitis Herpetiformis);⑤成人线状IgA大疱性皮病(Linear IgA Bullous Dermatosis ofAdult, LADA);⑥儿童良性慢性大疱性皮病(BenignChronic Bullous Dermatosis of Childhood, BCBDC);⑦获得性大疱性表皮松解症(Epidermolysis Bullosa Acquisita, EBA)。
1.大疱性类天疱疮(BullousPemphigoid, BP)本病是一种慢性全身性表皮下大疱性皮肤病。直接免疫荧光(DIF)检查:90%以上患者的皮损及皮损周围正常皮肤基底膜带可见到IgG及C3呈线状排列,有时IgA亦为阳性。在远离皮损的正常皮肤及皮损已消退者亦可有IgG及C3沉积于基底膜带。免疫电镜定位IgG和C3沉积于基底细胞膜下方的透明板内。
70%左右患者IIF法可检出血清中有抗BMZ抗体,主要为IgG,其滴度水平与病情活动度无相关性。
BP抗原分子具有异质性,BP主要抗原为-230kD的蛋白质分子,少部分BP抗体尚能与其它一些不同分子量的蛋白质相结合。
2.疤痕性类天疱疮(CicatricialPemphigoid, CP)本病又称良性粘膜类天疱疮(Benign mu-cosal Pemphigoid),是一种好侵犯粘膜尤其是眼结合膜的慢性水疱性皮肤病,DIF检查皮肤和粘膜受损处的基底膜带有线状IgG和C3沉积,IIF可查得少数患者血清中有抗BMZ抗体。免疫电镜观察IgG和C3沉积在透明板和基底细胞膜下方,致密板真皮侧也有部分沉积。
3.妊娠疱疹(HerpesGestation, HG) 该病为妊娠期发生的痛痒性大疱性皮肤病。皮损及外观正常皮肤DIF检查基底膜带有C3和IgG呈线状沉积,病人血中也可查到抗BMZ抗体。免疫电镜发现IgG和C3沉积在整个透明板内。
4.疱疹样皮炎(DermatitisHerpetiformis, DH)DH是一种慢性良性复发性皮肤病。DIF检查显示皮损和正常皮肤真皮乳头有IgA呈颗粒状沉着。血清中IgA抗肌内膜循环抗体及抗谷胶蛋白抗体。国内患者作此诊断应慎重,确诊需作DIF检查。
免疫电镜发现紧贴在基底膜板下方有IgA沉着,并与锚原纤维、微原纤维结合,部分Ig可沉积在基底膜下透明板内。
5.成人线状IgA大疱性皮病(Linear IgA Bullous Dermatosis of Adult, LADA)该病临床表现和组织病理改变类似疱疹样皮炎或大疱性类天疱疮,现已确定是一独立的疾病。DIF检查示非皮损区基底膜带有线状IgA沉积,少数患者可查到循环BMz IgA抗体。免疫电镜观察IgA沉积于基板下区和/或透明板内。
6.儿童良性慢性大疱性皮病(BenignChronic Bullous Dermatosis of Childhood, BCBDC)
该病又称儿童型线状IgA大疱性皮肤病,其免疫病理变化与LADA相同,现倾向于认为BCBDC是LADA的儿童型,但尚有争论。
LADA与大疱性类开疱疮和疱疹样皮炎相鉴别见表17-1。
表17-1 LADA与DH、BP的鉴别
| DH | BP | LADA | |
| 免疫电镜(IEM) | IgA沉积于远离基板下真皮乳头区域 | IgG和C3沉积于透明板内,基底细胞半桥粒表面 | IgA沉积于基板下区和/或透明板内 |
| 皮损周围皮肤DIF | 真皮乳头颗粒状IgA沉积,BMZ颗粒状沉积 | BMZ为线状IgG、C3沉积 | BMZ均质线状IgA沉积,部分可有C3及其它型Ig沉积 |
| IIF | 无抗BMZ抗体 | 大部分有抗BMZ、IgG型抗体 | 部分有抗BMZ的IgA型抗体 |
7.获得性大疱性表皮松解症(Epidermolysisbullosa Acquisits, EBA)现认为该症可能系自身免疫性疾病。DIF检查BMA有IgG及C3呈线状沉积。IIF检查血循环中有抗BMZ抗体。EBA应注意与BP相鉴别,可用IM氯化钠液分离真表皮,以此作底物用IIF法检查EBA和BP病人的血清,EBA病人的BMZ抗体沉积于真皮侧,而BP病人的BMZ抗体沉积于表皮侧。此外EBA与BP的鉴别还可通过电镜、免疫电镜及抗原分子量分析等进行,二者的区别见表17-2。
表17-2 EBA与BP 的区别
| BP | EBA | |
| 电镜 | 水疱位于基底膜的透明板 | 水疱位于基底膜的透明板以下 |
| 免疫电镜(IEM) | 免疫球蛋白沉积在透明板及基底细胞浆膜的半桥粒 | IgG沉积于基底膜致密板及下方的锚状纤维 |
| IIF(1mol/l NaCl分离皮肤为底物) | 大部分病人循环BMZ抗体阳性,IgG位于表皮侧的基底膜 | 部分病人的循环BMZ抗体阳性,IgG沉积于真皮侧的基底膜 |
| 抗原蛋白的分子量 | BP主要抗原蛋白分子量为230kD,次要抗原为160kD,抗原存在于表皮浸出物中 | 抗原蛋白分子量为290kD,抗原存在于真皮浸出物中 |
用1mol/L NaCl分离皮肤的基底层,其分离部位位于基底板上方,即基底板留在真皮侧,透明板附着在表皮侧。
二、狼疮带试验(LupusBand Test, LBT)
狼疮带试验是检查系统性红斑狼疮(SLE)病人外观正常皮肤表皮真皮交界处免疫球蛋白沉积的一种试验,常用皮肤冰冻切片直接免疫荧光法检测。
1.
①必须要有免疫球蛋白沉积;②荧光图型规则:颗粒或线状;③荧光明亮。
2.特异性
(1)阳性率:如表17-3所示。此外,人体不同部位“正常”皮肤阳性率不同:肩、三角肌部位85%~90%,前臂和上臂伸侧60%~70%,背、臂50%~60%。我们检测重庆地区SLE病人上臂中段外侧LBT阳性率为75%左右。
表17-3 LBT阳性率
| 疾病 | 皮疹部 | “正常”皮肤 | |
| 暴露部位 | 隐蔽部位 | ||
| DLE | >90% | ||
| SLE | >90% | 70%~80% | 50% |
| 混合性结缔组织 | 78% | 50% | 33% |
(2)假阳性:较低,SLE病人亲属和配偶,密切接触者可阳性,常为IgM。
(3)假阴性:病程四个月以内者及治疗后(多为青年SLE病人)可阴性。
3.临床用途
(1)鉴别SLE和DLE(盘状红斑狼疮):DLE和LBT阴性。
(2)鉴别SLE和其它ANA阳性疾病:其它ANA阳性疾病LBT常阴性。
(3)有助于判断病情和预后:病情严重者不仅沉积的Ig类别多,而且荧光强,有IgG、IgA沉积者比仅有IgM沉积者病情重,Ig类别和荧光强度与肾病的关系尤为明显。
(4)可能有助于估价疗效。
第六节 免疫细胞化学技术在真皮纤维化性疾病研究中的应用
真皮结缔组织由数量不多的细胞和丰富的细胞外基质组成。细胞成分包括成纤维细胞、肥大细胞、巨噬细胞和少量淋巴细胞等。细胞外基质包括:①胶原:真皮中胶原纤维由I型和II型胶原构成,成熟真皮中I型胶原约占胶原的85%,越年幼的皮肤含III型胶原的比例越高。②弹性蛋白。③非胶原糖蛋白:如纤维粘连蛋白。④蛋白聚糖:为氨基聚糖(亦称糖胺聚糖)与核心蛋白质构成的共价化合物。其中氨基聚糖可分为透明质酸、硫酸软骨素、硫酸皮肤素、硫酸角质素、肝素和硫酸乙酰肝素等。
真皮纤维化是以胶原为主的细胞外基质成分在真皮中过度积聚的结果。它既见于硬皮病等皮肤病中,还见于皮肤创伤愈合过程中发生的肥厚性瘢痕和瘢痕疙瘩中。现将免疫细胞化学技术在上述常见的真皮纤维化性疾病研究中的应用简介如下:
一、确定细胞外基质成分在真皮的分布
利用各种细胞外基质的抗体,借助免疫细胞化学技术对细胞外基质在真皮中的分布进行定位,尚可经图像分析系统对染色强度等参数定量化,所获得数据经统计学处理能更准确地反映细胞外基质分布和含量上的量化差异程度。用ABC法显示,硬皮病真皮中III型胶原大量沉着,其分布方式与免疫电镜所见相符,即标记III型胶原抗体的细纤维大量聚积于真表皮交界处基底膜下;而在真皮深部,这种细纤维与标记I型胶原抗体的粗纤维相间分布,形成光镜下所见的粗大纤维束。纤维粘连蛋白也可大量沉积于硬皮病真皮深层胶原纤维束之间,但有些文献报道的结果并不一致。免疫荧光法显示,纤维粘连蛋白在肥厚性瘢痕和瘢痕疙瘩中量沉积,呈线状或卷曲排列,其分布符合组织学上所见结节 性结构的特点。近来用不同蛋白聚糖的单克隆抗体,借助APAAP法发现,肥厚性瘢痕组织中含有大量4-或6-硫酸软骨素,只有少量硫酸皮肤素。其中血管周围浸润的T淋巴细胞与4-硫酸软髓素密切相关。
二、研究纤维化皮损中细胞的表型特征和(或)功能状态
(一)成纤维细胞
1.合成功能活跃除了上述对已形成胶原的分布进行观察外,利用抗体I型前胶原氨基末端的单克隆抗体,可确定新合成未加工的I型前胶原。正常人皮肤显示了真表皮交界部I型前胶原的灶性沉着。而硬皮病皮损及其未受累皮肤中,真皮上部有连续广泛的I型胶原着色。这反映了硬皮病成纤维细胞活跃的合成功能。
2.HLA-II类抗原的表达正常皮肤及正常瘢痕的成纤维细胞并不表达HLA-II类抗原。但在硬皮病、瘢痕疙瘩和肥厚性瘢痕中,可见许多表达HLA-II类抗原的成纤维细胞。由于HLA-II类抗原为递呈特定抗原触发免疫应答所必需,推测在上述疾病中,表达HLA-II类抗原的成纤维细胞参与了局部免疫反应。
3.细胞间粘连分子1型(ICAM-1)的表达硬皮病炎症期皮损中可见一些成纤维细胞样细胞上有ICAM-1的表达。流式细胞仪检测发现,与正常成纤维细胞相比,体外培养的硬皮病成纤维细胞中高水平表达ICAM-1的细胞比例增ICAM-1与淋巴细胞功能相关抗原1型(LFA-1)是一对配体受体系统,它们可介导成纤维细胞与T细胞结合。高水平表达ICAM-1的成纤维细胞可促使拥有LFA-1的MHC-II类限制性T辅助细胞的活化。推测由此产生能促进成纤维细胞合成细胞外基质成分的细胞因子。
(二)肌纤维母细胞
在肥厚性瘢痕以及其它一些病理情况下,存着一种具有成纤维细胞和平滑肌细胞超微结构特征的细胞,即肌纤维母细胞。其起源尚不明确。利用不同细胞骨架蛋白(波形纤维蛋白、结蛋白、α-平滑肌及α-横纹肌肌动蛋白、非肌性及平滑肌肌球蛋白)的抗体,对肌纤维母细胞的表型特征进行了研究,证实了异质性纤维母细胞群的存在。其一部分显示成纤维细胞的特征,而其余的则显示有不同程度的平滑肌分化的特征。
(三)单一核浸润细胞
在硬皮病、瘢痕疙瘩及肥厚性瘢痕中,常有不同程度单一核浸润细胞增加,弥散分布或位于血管周围。应用淋巴细胞和单核细胞的单克隆抗体检测发现,主要为T淋巴细胞和巨噬细胞。这些细胞可能通过释放某些与纤维有关的细胞因子而参与真皮纤维化的发生。此外还发现,硬皮病皮损中血管周围浸润细胞处有ICAM-1和整合素(integin)β1和β2(细胞外基质在细胞表面的受体)的免疫染色强度增加。这些细胞粘连分子在淋巴细胞迁移、定位以及粘附在细胞外基质上起重要作用。
(四)内皮细胞和肥大细胞
硬皮病皮损中,内皮细胞上ICAM-1和内皮细胞白细胞连分子1型(ELAM-1)免疫染色阳性。这两种分子的表达是内皮细胞活化的表现,它们可能与淋巴细胞附着在活化的内皮细胞上有关。硬皮病、瘢痕疙瘩和肥厚性瘢痕中,肥大细胞与纤维化也有密切关系。肥大细胞(MC)根据它所含中性蛋白酶的组成和含量可分为两型,一种含类胰蛋白酶(tryptase),而胃促胰酶(chymase)含量极少,即MCT;另一种则含这两种酶,即MCTC。应用这两种酶的单克隆抗体,对硬皮病皮损区MC的数量、表型和分布进行研究,结果提示MC参与了该病的发生。
三、检测与纤维发生有关的细胞因子
转化生长因子β(TGF-β)和血小板衍生的生长因子(PDGF)与纤维化发生密切相关。用免疫细胞化学技术,在硬皮病皮损中检出了PDGF及其β型受体和TGF-β的存在,在瘢痕疙瘩皮损中也检出了TGF-β的存在。
四、其它
免疫荧光法是检测自身抗体的常用方法。系统性硬皮病患者血清中常存在多种自身抗体。在瘢痕疙瘩患者中也发现了抗成纤维细胞的抗核抗体。免疫荧光法还显示,瘢痕疙瘩和肥厚性瘢痕组织中IgM、IgG和IgA水平增高。瘢痕疙瘩与免疫的关系已引起注意并有待进一步研究。
第七节 真皮浸润细胞免疫表达
一、T淋巴细胞及其亚群的免疫表达
CD3(OKT3,Leu4)对T细胞特异,正常或肿瘤性B细胞不表达CD3;CD4RO(UCHL1)大多数T细胞和T细胞淋巴瘤呈阳性表达,能用于石蜡切片中。二者是常规筛选T细胞的良好标记物。成熟T细胞可分为表达CD4(OKT4、Leu3a)T辅助(TH/I)细胞、CD8(OKT8,Leu2a)T抑制(TS/C)细胞二种亚群。
在炎症性皮肤病中,红斑狼疮可能与T淋巴细胞介导的细胞免疫有关,红斑狼疮皮损浸润细胞大多为T细胞,最初报告TH、TS比率接近,有些报导浸润细胞多为TH;也有TS稍占优势者。大多数结果显示TS细胞较正常增加,TH和TS数较接近。因此TS细胞可能与皮损的发病机制方面有关。在扁平苔藓中浸润细胞主要是T淋巴细胞,早期TH细胞增加,而晚期,病程较长或未经治疗者TS细胞升高,TH/TS比率下降。在银屑病、尖镜湿疣、异位性皮炎皮损中,真皮浸润细胞多为T淋巴细胞,以TH为主,TS仅占少数,TH/TS比率显著增高。而银屑病、尖锐湿疣TS为主。
皮肤T细胞淋巴瘤(CTCL)具有特征性临床表现和病理变化,免疫标记显示肿瘤细胞特异性表达CD3,同时可表达CD4和CD8二种T细胞亚群标记。通常情况下肿瘤细胞以TH细胞表型为主,TS仅占少数,如蕈样肉芽肿,Sezary综合症等。由于病情的变化还可表现为TH和TS比率的改变呈TS表型为主;某种T细胞标记的缺失,如TS阴性;TH和TS标记在不成熟的T细胞中共存,呈双标记;出现不成熟的细胞标记和一种新的标记,如CD38;或不成熟细胞标记的肿瘤细胞数量增多。在诊断中T细胞标记物不能特异性区分正常和肿瘤性T细胞,在T或非T细胞性肿瘤中常出现许多反应性T细胞,而T细胞性肿瘤的组织形态可表现为多形性,在诊断阳性细胞是肿瘤性成为反应性T细胞会发生困难。由于T细胞性淋巴瘤有异常免疫表型,常缺失或不表达某一种T细胞亚群抗原,可用来鉴别肿瘤性与反应性T细胞亚群,但有时也不可能完全达到理想的诊断目的。
二、B淋巴细胞和免疫球蛋白的表达
CD19(B4)、CD20(B1)、CD22(Leu14):三种抗体能检测前B细胞和B细胞的表面抗原,但不能检测浆细胞;L26:与大多数B淋巴细胞反应,特异性强并能用于石蜡切片。B细胞在分化的大多数阶段表面有免疫球蛋白(SIg)分子,每个正常B细胞在分化的不同阶段或同一阶段上可产生几种不同类型的重链IgM(μ)、IgD(δ)、IgG(γ)、IgA(α),B细胞成熟为浆细胞则失去SIg出现胞浆内免疫球蛋白(CIg),但轻链都为同一型,κ或λ。SIg、CIg和κ、λ可作为进一步免疫表型分析。在正常B细胞群体中轻链κ和λ比例为2:1。在皮肤B细胞淋巴瘤(CBCL)中,不同的肿瘤细胞产生的SIg不同,每种B细胞可产生一种或两种重链,但只产生一种轻链,呈单克隆性。如在SIg中可见IgM和/或IgG,以其中一种阳性为主,但只有一种轻链κ或λ阳性出现,或占绝对优势。在淋巴组织反应性增生时各种B淋巴细胞都增生,呈多克隆性,可产生两种轻链和一组重链。因此,Ig能证实B细胞来源,并根据不同表达可作进一步分型。而用轻链的单一型标记可鉴别CBCL和淋巴组织反应性增生。
三、其它
CD11b(OKM1)、CD14(OKM2)、CD15(LeuM1):存在于单核细胞内;MAC387:能用于石蜡切片,单核巨噬细胞系统中许多细胞,如反应性组织细胞,上皮样细胞和巨细胞;肿瘤中浸润的巨噬细胞等均能表达MAC387,如组织细胞性淋巴瘤中瘤细胞阳性。溶菌酶:存在于单核-巨噬细胞和粒细胞中的溶酶体酶。不存在于B或T细胞。可作为真性组织细胞性淋巴瘤的标记物,但需注意在以上标记物中,肿瘤中反应增生的组织细胞可呈阳性反应,因此在判别阳性细胞是肿瘤性组织细胞还是反应性细胞,需结合形态和其它标记物予以鉴别。
第八节 汗腺及汗腺肿瘤的免疫细胞化学特点
目前已有多种PcAb和McAb用于汗腺及汗腺肿瘤的研究,这些不同的抗体对汗腺的不同部位有特异性反应,主要用于探讨汗腺肿瘤的组织发生,分化特点以及诊断及鉴别诊断。同时也可用于外科手术切除时,迅速判断肿瘤是否切除干净。现将不同的抗体分述如下。
1.癌胚抗原(CEA) 出已证明在大小汗腺的腺体及导管部均有CEA。在各种汗腺的良恶性肿瘤中也有不同的表达形式。CEA在汗腺肿瘤导管样腔隙内及其附近染色最强,汗管瘤及多形性汗腺瘤通常含有丰富的CEA,而实体性肿瘤,例如小汗腺孔瘤、螺旋腺瘤及圆柱瘤中则仅见稀疏灶状沉积,多种汗腺起源的恶性肿瘤中也见灶状CEA沉积,但CEA不能区别是起源于大汗腺或小汗腺。CEA染色不仅可研究肿瘤的发生,还可用于显微镜下的外科手术,用以快速判断肿瘤组织是否切除干净。因Paget细胞也含有CEA,因此也是鉴别Paget氏病的Paget细胞与皮肤原位癌中Paget样细胞以及恶性黑色素瘤中的Paget样瘤细胞的一种简单易行的方法。此外,CEA也存在于胎儿的小汗腺中,因此,可作为汗腺分化的最早标志。
2.S-100蛋白在皮肤病中,可用以检测Schwann氏细胞、皮肤神经黑色素细胞、痣细胞以及来源于这些细胞或组织的肿瘤。因此可用以区别梭形细胞恶性黑色素瘤与梭形细胞鳞状细胞癌以及恶性纤维组织胞瘤,用以鉴别神经来源的肿瘤与其他纤维性肿瘤,近来也有报告用S-100蛋白染早期麻风皮损中的神经组织,以了解神经的破坏,对麻风的早期诊断有一定的帮助。在小汗腺腺细胞及郎格罕氏细胞,S-100也为阳性,但小汗腺导管及大汗腺则无S-100。因此可以通过S-100染色了解汗腺肿瘤的起源,同时也有助于明确诊断。最近报告汗囊瘤中部分细胞S-100阳性,也说明这些肿瘤的组织发生与小汗腺中含有S-100蛋白的细胞有关。
3.角蛋白在大小汗腺的导管、腺体以及汗腺肿瘤中均有角蛋白存在。但对不同分子量的角蛋白则有不同的染色形式。近来报告,用识别分子量56kD的Dako-CKl及识别分子量39、43用50kD的Cam5.2二种抗体检测多种汗腺肿瘤,包括汗孔瘤、透明细胞汗腺瘤、螺旋腺瘤、皮肤混合瘤、圆柱瘤、生乳头汗管囊腺瘤及大小汗腺的汗囊瘤等,大多数肿瘤对这二种抗体呈阳性反应。也有用抗角蛋白抗体检测了多种小汗腺瘤的报告,结果所有的瘤均呈形式不同的呈阳性结果。但有些作者的结果表明汗管孔瘤、部分小汗腺孔瘤、螺旋腺瘤及大汗腺汗囊瘤等对抗角蛋白抗体EKH5呈阴性。
4.上皮膜抗原(EMA)文献报告大小汗腺的腺体部分在EMA抗原,而导管则无该抗原。某些汗腺来源的肿瘤对EMA也呈阳性反应,有报告90%的Paget氏病及乳腺导管癌EMA染色阳性。有人用EMA检测了多种小汗腺癌,包括小汗腺导管癌、透明细胞汗腺癌、乳头状汗腺癌、汗孔癌、腺样囊性癌、微囊性附件癌及小汗腺粘液腺癌等,结果均为阳性。
5.β2微球蛋白(β2MG)β2MG在多种良恶性汗腺肿瘤中可有程度不同的阳性反应。文献报告大汗腺囊瘤、乳头汗腺瘤、透明细胞汗腺瘤、真皮内导管瘤、汗管瘤、螺旋腺瘤及圆柱瘤均为阳性。部分小汗腺癌也含有这种蛋白。
6.巨囊病液体蛋白(GCDEP)GCDEP主要存在于大汗腺及大汗腺来源的多种肿瘤中,例如大汗腺汗囊瘤、乳头状汗腺瘤、生乳头汗管囊腺瘤、部分圆柱瘤及皮肤混合瘤中,也用于乳房及乳房外Paget氏病的检测。因此,GCDFP可以用于区别大小汗腺分化,有助于了解汗腺肿瘤的组织发生以及诊断及鉴别诊断。
7.表皮生长因子(EGF)EGF存在于汗腺的腺体及导管部。在某些汗腺肿瘤中也有不同的分布形式。可见于透明细胞汗腺瘤的管状上皮细胞、大汗腺混合瘤的管状及导管细胞的顶端部。
8.Peptidylarginine deiminase(PD)PD见天大小汗腺的腺体及肌上皮细胞浆中,也存在于乳房外Paget细胞内。认为该酶可作为汗腺肿瘤分类的新的标志。
9.碳酸酐酶(CA)存在于大小汗腺的腺体细胞及导管上皮细胞。可见于皮肤混合瘤的管状、导管样及囊状结构的管腔细胞。
10.锌α2糖蛋白(An2GP)An2GP主要存在于大汗腺体及导管部,部分见于小汗腺腺体,小汗腺导管则为阴性。在某些大汗腺肿瘤中多为阳性,例如大汗腺汗囊瘤及生乳头汗和囊腺瘤等。部分螺旋腺瘤及透明细胞汗腺瘤也含有这种蛋白。Zn2GP染色对于了解某些汗腺肿瘤的组织发生及分类有一定的帮助。
11.乳液脂肪球蛋白(MFG)MFG位于大小汗腺的腺体,而导管则无此蛋白,有报告90%的乳腺导管及乳房Paget氏病中MFG染色呈阳性反应,认为MFG染色有助于了解某些肿瘤的组织发生。
12.转铁蛋白(Ft )小汗腺导管外层细胞存在有FT,而末端汗管及小汗腺腺体则无此蛋白。在某些汗腺肿瘤中FT也有不同的分布形式,可见于汗管瘤细胞条索的外层细胞,在末端汗管瘤及某些汗腺癌中可呈弥漫性分布。
总之,可用于汗腺及汗腺肿瘤标记的分子很多,除上述之外,其他例如抗唾液腺酶、抗α—胰酶蛋白、抗大汗腺上皮抗原(AEA)等,对于了解汗腺肿瘤的起源及分类均有一定的帮助,但目前尚没有一种标记能区别良恶性肿瘤,或区别原发及转移性肿瘤,因此对于汗腺肿瘤的诊断,分类及组织发生,还要结合常规组织病理改变及临床特点等多方面因素进行综合考虑。
皮脂腺的免疫细胞化学特点。
目前可用于标记皮脂腺及皮脂腺肿瘤的抗体或酶有多种,包括角蛋白、EMA、MFG、CA及AEA等,但没有一种标记是皮脂腺所特有的。β2MG在皮脂腺痣、皮脂腺腺瘤及皮脂腺癌中也可呈阳性反应。近来报告皮脂腺癌中也存在OKMS抗原、虽然其性质仍不清楚,但OKMS染色有助于该病的诊断。
(孙建方 曾学思 刘季和)
参考文献
1.郭定九易凡,译.皮肤免疫病理学.1980年,长沙
2.SerreG, Viocent C , et al. Natural IgM and Igg autoantibodies to epidermal keratinsin normal human sera:I ELISA titration immunofluorecence study. J Invest Dermatol, 1987, 88:21~27
3.王刚,等.抗角蛋白自身抗体的研究进展.国外医学(皮肤病学分册),1982,18(2):74
4.聂祝湘,等.天疱疮抗体及其临床意义.临床皮肤病科杂志,1991,20(6):317~319
5. 聂祝湘,等.天疱疮治疗的某些进展.国外医学(皮肤病学分册),1991, 17(5):265~268
6.ThompsonC, et al. Expression of blood group antigen by cultured human epidermal cells.J Invest Dermatol, 1986, 86:394~398
7.jANdBos. sis . keratinocyte p 75, CTC Press, Inc . Florida AM, 1989
8. 白兆霞,等.尖锐湿疣病损的免疫组化研究.中华皮肤科杂志,1992, 25:247
9.赵玉铭,等.HLA抗原在正常皮肤中的分布.中华皮肤科杂志,1991, 23(6):402
10. VanLis JM , et al. Cin- Areaction with plasma membrane in human epidermsi. Am JClin Pathol, 1983, 779(1):143~4
11.Hashimoto K, etal. A Lectin – binding glyciprotein of Mr 135000 associated withbasal keratinocyte in pig epidermis. Biochem J, 1986,237(2):405~414
12.唐书谦,等.不同底物对大疱性皮肤病间接免疫荧光的评价评价.中华皮肤科杂志,1988,22(1):36
13. 刘荣卿,等.天疱疮及大疱性类天疱疮外观正常皮肤的免疫荧光检查.中华皮肤科杂志,1987,20:138
14. 聂祝湘,等.止血芳酸治疗天疱疮的实验观察.中华皮肤科杂志,1992, 25(4):256~258
15. WickMR and Scheithauer. Primary neuroendocrine carcinoma of the skin. In :Pathology oof Unsual MalignantCutaneous Tumors. Wick MR ed. Ne W Yorh. Marcel Dekker INC, 1985. 107
16.Narisawa Y, Hashimoto K, Bayless T, et al. Cytokeratin polypeptide Profile ofmerkel cells in human fetal and adult skin:difference of expression of cytokeratins inepidermal and dermal merkle cells. j Invest Dermatol, 1992, 98:171
17.Narisawa Y , Hashimoto K, Nihei Y, et al. Biological significance of dermalmerkle cells in development of cutaneous nerves in human fetal skin. J HistchemCytochem, 1992;40:65
18. 刘荣卿唐书谦徐洁芳,等.天疱疮及大疱性类天疱疮外观正常皮肤的免疫荧光检查.中华皮肤科杂志,1987,20(3):138~140
19. 刁庆春刘荣卿唐书谦.天疱疮、类天疱疮自身抗体检测的临床意义。中华皮肤科杂志,1988,21(5):283
20.朱学骏niimi YJ Bystryn JC.大疱性类天疱疮抗原分子异质性。中华皮肤科杂志,1990,23:291~293
21.靳培英是元甫。疱疹样皮炎在我国的发病情况及其诊断标准的商榷.中华皮肤科杂志,1991,24(4):232~235
22.Prost G, et al. Diagnosis of adultlinear IgA dermatosis by immuno ╟ electromicroscopy in 16 patients withlinear IgA deposits. J Invest Dermatol,1989, 92(1):39~45
23.wojnarowska F, Marsden RA, Bhogal B, et al. Chronic bullous disease ofchildhood, childhood cicatricial pemphigoif, and linear Iga disease of adults.A comparative study demonsrating clinical and immunopathologic overlap. J AmAcad Dermatol, 1988, 19(5):792~805
24. 朱学骏Niimi YJ Bystryn JC.抗基底膜带抗体阳性血清患者中获得性大疱性表皮松解症的发生率.临床皮肤科杂志,1990,19(4):170~173
25.Akutsu Y and Jimbow K. Immunoelectron microscopic demonstration of humanmelanosome associated antigens (HMSA) on melanoma cells:Comparison with tyrosinasedistribution. J Invest Dermatol, 1988, 90:179
26.NakanishiT and Hashimoto K. The differential reactive of benign and malignantnevomelanecytic lesions with mouse monoclonal antibody TNKH1. Cancer, 1987, 50:1340
27. ImamA, Mitchell MS, Modlin RL, et al. Human monoclonal antibodies that distinguishcutaneous malignant melanomas form benign nevi in fixed Tissue sections. JInvest Dermatol, 1986, 86:145
28. GownAM, Vogel AM, Hoak M , et al. Monoclonan antibodies specific for melanocytictumors distinguish subpopulations of melanocytes. Am j Pathol, 1986, 123:195
29.Schaumburg - Lever G, Metzler G, Kaiserling E.Ultrastructural localization ofHMB –45 binding sites. J Cutan Pathol, 1991,18:432
30. 天高文叶庆佾刘荣卿.异常黑素小体在恶性黑素瘤诊断中的意义.第三军医大学学报,1992,14(4):323
31.Furukawa K and Lloyd KO. Gangliosides in melanoma. IN:Human Melanoma. From Basicresearch to dinical application. Ferrone S ed. New York Springer –Verlag, 1990:15
32.Taniguchi M, Kuwabara I, Harada Y, et al. Cross ╟ species melanoma antigen. 1990.
33.Werkmeister JA, Triglia T, Mackay IR, et al. Fluctuations in the expression ofa glyolipid antigen assocted with differentiation of melanoma cells monitoredby a monoclonal antibody , Leo Me13. Cancer Res, 1987,47:225
34. 田芳金伯泉黄传书,等.抗人黑素瘤单克隆抗体免疫组化的研究.单克隆抗体通迅,1991,7:21
35. EstinCD, Plowman CD, Rose TM, et al. Characterization of P97, a humanmelanoma -associated antigen, and development of a recombinant vaccien formelanoma. In:Human Melanoma. From basic research to clinical application . FerroneSed. New York. Springer –Verlag, 1990.87
36.高天文刘荣卿叶庆佾.无色素性恶性黑素瘤免疫组化诊断研究.中华皮肤科杂志,1992, 25:222
37. 刘荣卿高天文.无色素性恶性黑素瘤的诊断探讨.实用肿瘤杂志,1992,7:152
38.NagataH, Ueki H, Moriguchi T, et al. Fibronectin,localization in normal human skin,granulation tissue, hypertropic scar, maure scar, progressive systemicsclerotic skin, and other fibrosing dermatoses. Arch Dermatol, 1985, 121(8):995~999
39.Linares HA. Protroglycan – lymphocyte association in the development ofhypertrophic scars. Burns, 1990, 16(1):21~24
40.Branchet MC, Boisnic S, Bletry O, et al. Exxpression of HLA class II antigensonskin fibroblasts in scleroderma. Br J Dermatol, 1992,12(5):431~435
41.CastagnoliC, Stella M, Magliacani G, et al. Anomalous expression of HLA class IImolecules on kerattinocytes and fibroblasts in hypdrtropgicscars consequent tothermal injury. Clin Exp Immunol, 1990, 82(2):350~354
42.Needleman BW, Increased expression of intercellular adhesion molecule 1 on thefibroblasts of scleroderma patientl. Arthritis Rheum,1990, 33(12):1847~1851
43.Skalli U, Schurch W, Seemayer T, et al. Myofibrollasts from diverse pathologicsetting are heterogeneous in their content of actin isoforms and intermediatefilament proteins. Lab Invest, 1989, 60(2):275
44.Sollberg S, Peltonen J, Uitto J, et al. Elevated expressoin of β2and β2integrins, intercellularadhesion molecule 1, and endothelial leukocyte adhesion molecule 1 in the skinof patients with sysytemic sclerosis of recent onset .Arthritis Rheum, 1992;35(3):290~298
45. GayS, Jones RE, Huang GQ, et al. Immunohistologic demonstration of platelet -derives growth factor and sis – oncogene expression in scleroderma. J InvestDermatol, 1989, 92(2):301~303
46.Klareskog L, Gustafsson R, Scheynius A, et al. Increased expression of platelet– derives growth factor type B receptors in the skin of patients with systemicsclerosis. Arthritis Rheum, 1990, 94(2):197~203
47.Gruschwitz M, Muller PU, Sepp N, et al. Transcription and expression oftransforming growth factor type beta in the skin of progressive systemicsclerosis:amediator of fibrosis? J Invest Dermatol, 1990, 94(2):197~203
48.Peltonen J, Hsiao LL, Jaakkola S, et al. Activation of collagengene expressionin keloids :colocalization of type I and IV collagen and transforming growth factor–β1mRNA.J Invest Dermatol, 1991;97(2):240~248
49.TraniAMA, Gruber BL, Kaufman LD, et al. Mast cell changes in scleroderma. ArthritisRheum, 1992;35(8):933~939
50.Hashimoto K, et al. Anti – keratin monoclonal antibodies :production, specificities andapplications. J Cutan Pathol, 1983;6(10):529~539
51.KallioinenM, et al. β-2-microglobulin in benign and malignant adnexal skin tumors andmetastasizing basocellular carcinoma. J Cutan Pathol, 1984;1(11):27~34
52.Penney NS. Immunohistochemistry of adnexal neoplasms. j Cutan Pathol , 1984;(11):357~364
53.SwansonPE, et al. Eccrine sweat gland carcarcinoma:an histologic and immunohistochemical studyof 32 cases. J Cutan Pathol,1987,2(4):65~86
54. NodaY, et al. Immunohistochemical study of carbonic anhydrase in mixed tumors andadenomas of sweat and sebaceous glands. J Cutan Pathol, 1987;5(14):285~290
55.NodaY,et al. Immunohistochemical localization by monoclonal antibody of humanepidermal growth factor in mixed tumors of the skin. J Cutan Pathol, 1987;6(14):337~342
56. ZukJA, et al. Immunohistochemistry staining patterns of sweat glands and theirneoplasms using two nomoclonal antibodies to keratieos. j Cutan Pathol, 1988;1(15):8~17
57.MazoujianG, et al. Immunohistochemistry of gross disease fluid protein (GCDFP-15) in 65benign sweat gland tumors of the skin. Am j Dermatopathol, 1988, 1(10):28~35
58. WoodWS, et al. Mammary Paget’s disease and intraductal carcinoma :histologic, histologic,histochemical and immunocytochemical comparison. Am j Dermatopathol, 1988,10(3):188
59.Mihara M. Chondroid syringoma associated with hidrocystoma – like changes :possible differentiation intoeccring gland:a histologic. immunohistochemical and electron microscopic study. JCutan Pathol, 1989, 5(16):281~286
60.Penneys NS, et al. Immunohistochemistry demonstration of ferritin in sweatgland and sweat gland neoplasms. J Cutan Pathol, 1990, 1(17):32~36
61. UranoY, et al. Immunohistochemistry demonstration of petidylarginine deiminase inhuman sweat glands. Am J Dermatopathol, 1990;12(3):249~255
62.Mazoujian G. Immunohistochemistry of GCDFP –24 and zinic alpha2 glycoprotein inbenign sweat gland tumors. Am J Dermatopathol,1990, 12(5):452~457
第十八章 核酸分子杂交技术概述
第一节 核酸的分子结构
一、核酸的化学组成
组成核酸的元素有C、H、O、N、P等,其中N含量约为15%~16%,磷含量为9%~10%。由于核酸分子中的磷含量比较恒定,因此,核酸定量测定的经典方法,是以测定磷含量代表核酸量。
核酸经水解可得到多核苷核,因此核苷酸是核酸的基本单位,核酸就是由很多单核苷酸聚合形成的多核苷酸,核苷酸可被水解产生核苷和磷酸,核苷还可进一步水解,产生戊糖和含氮碱。因此,核酸是由含氮碱、戊糖及磷酸三种成分组成。
含氮碱(简称碱基):核酸中的含氮碱简称碱基,是嘌呤碱(purine)与嘧啶碱(pyrimidine)的衍生物。RNA和DNA含有的共同碱基成分是腺嘌呤(adenine,A)、鸟嘌呤(guanine,G)和胞嘧啶(cytosine, C)。二者的区别是RNA含有尿嘧啶(uracil,U),而DNA含有胸腺嘧啶(thymine,T)。嘌呤和嘧啶都有酮-烯醇式互变异构现象,一般生理pH条件下呈酮式。它们的结构如下:

有些核酸中含有修饰碱基(或稀有碱基),这些碱基大多是在上述嘌呤或嘧啶碱的不同部位甲基化(methylation)或进行其它的化学修饰而形成的衍生物。例如有些DNA分子中含有5-甲基胞嘧啶(m5C),5-羟甲基胞嘧啶(hm5C)。某些RNA分子中含有1-甲基腺嘌呤(m1A)、2,2-二甲基鸟嘌呤(m22G)和5,6-二氢尿嘧啶(DHU)等。
嘌呤碱和嘧啶碱一般多不易溶于水,对250~280nm波长的紫外光有较强的吸收,但对260nm光波的吸收能力最大。由于碱基是核酸的基本组成成分,因此,所有的核酸(包括DNA和RNA)其共同特点是对260nm处的紫外光有最大的吸收值。
核酸分子中碱基的克分子数与磷的克原子数相等,所以可根据核酸溶液中的磷含量及紫外光的吸收值来测定核酸量。一般以每升核酸溶液中含1g磷原子为标准来计算核酸的吸光率,这称为克原子磷吸光率或克原子磷消光系数[ε(p)],ε(p)的计算式为:
ε(p)=A/Cl
A为吸光度(光密度),1为比色杯内径,通常为1.0cm;C为每升核酸溶液中磷的克原子数。
C= 每升溶液中磷重(wg)/30.98ε(p)=30.98A/wl
一般DNA的ε(p)=6000~8000;RNA为7000~10000
现将DNA和RNA的化学组成归纳如表18-1:
表18-1
| RNA | DNA | |
| 嘌呤碱 | 腺嘌呤鸟嘌呤 | 腺嘌呤鸟嘌呤 |
| 嘧啶碱 | 胞嘧啶尿嘧啶 | 胞嘧啶胸腺嘧啶(或5-甲基胞嘧啶) |
| 戊糖 | 核糖 | 脱氧核糖 |
| 磷酸 | 磷酸 | 磷酸 |
二、核酸的一级结构
核酸又称多核苷酸,组成DNA的脱氧核糖核苷酸主要为四种,即dAMP、dGMP、dCMP及dTMP;组成RNA的核糖核苷酸主要有AMP、GMP、CMP及UMP四种。对两种核酸的组成可简写如下:
DNA=(碱基-脱氧核糖-磷酸)n;RNA=(碱基-核糖-磷酸)n
核酸中核苷酸的连接方式为:一个核苷核C-3’上羟基与下一个核苷核酸C-5’连接在磷酸羟基脱水缩合成酯键,称酯键称3’5’磷酸二酯键,若干个核苷酸间依3’5’磷酸二酯键连接成长链的大分子即为核酸。此长链称多核苷酸链,在链的一核苷酸,其C-5’连接的磷酸只一个酯键,称此核苷酸为链的5’磷酸未端或5’。链的另一端核苷酸上C-3’上羟基是自由的,对此核苷酸称为3’羟基末端或3’端,链内的核苷酸在C-5’上磷酸已形成二酯键,C-3’上羟基也已参与二酯键的形成,故称核苷酸残基。
核酸的一级结构乃指其核苷酸链中核苷酸的排列顺序,由于核酸中核苷酸彼此之间的差别乃在于碱基部分,故核酸的一级结构即指核酸分子中碱基的排列顺序。
对核酸一级结构的描述为:将5’磷酸末端书于左侧,中间部分为核苷酸残基,3’羟基末端书于右侧。通常用竖线表示核糖,碱基标于竖线上端,竖线间有含P的斜线,代表3’,5’磷酸二酯键。此表示法及简化式如下:

三、核酸的高级结构
核酸的多核苷酸链在次级键的基础上,还可形成更为复杂的二级及三级的高级结构。
(一)DNA
1.二级结构1953年Watson 及Crick在化学分析及X光衍射法观察DNA结构的基础上提出了著名的DNA双螺旋结构模型(double helix model)此结构是在核酸一级结构基础上形成的更为复杂的高级结构,即DNA的二级结构,结构如图18-1。

图18-1 DNA的双螺旋结构
P:磷酸基;S:脱氧核糖;G:鸟嘌呤;
A:腺嘌呤;T:胸腺嘧啶C:胞嘧啶
DNA的二级结构即双螺旋结构,其内容可归纳为:
(1)DNA分子为二条多核苷酸链以一共同轴为中心,盘绕成右手双螺旋结构。螺旋直径2nm。螺旋盘绕形成链间的两种沟,即宽的大沟与狭窄的小沟。
(2)二条多核苷酸链的走向相反,通常取左侧链从上到下为5’→3’端,右则链从下向上为5’→3’端,这样二条链构成反平行排列的双螺旋。
(3)二条多核苷酸链借氢键而连系在一起。氢键乃一链碱基上-NH2的氢与另一链上碱基的氧或氮形成。碱基有二个氢键,G与C之间有三个氢键(图18-3)。这种相配关系称为碱基互补或碱基配对。配对的碱基处于同一平面,此平面与双螺旋的中心轴垂直,由于二条链中碱基互补,所以二链彼此又称为互补链。
(4)碱基对之间氢键的能量为3~7kcal/mol,由于氢键多,所以可维系DNA双链结构。另外碱基对彼此间距离为0.34nm,每一螺旋含10个碱基对,故螺距为3.4nm,相邻碱基对间彼此尚有范德瓦士(van der Waals)力作用(此力量为1~2kcal/mol,作用范围为0.5nm),能量虽弱但由于碱基对多,合力也就大。可见碱基对的氢键及碱基对之间的范德瓦士力是稳定DNA成双螺旋结构的主要能量。
上述DNA的双螺旋结构是溶液及活体中常见的形式,通称B型。当B型所处条件的湿度低于75%时,可转变为A型。A型的碱基对不垂直于双螺旋的轴、倾斜约20度,螺距降为2.8nm,每一螺旋含11个碱基对。B型与A型的水合程度不同,它们是DNA分子在天然条件下的两种基本形式。除A、B型外尚发出有C型双螺旋,似B型,螺距3.3nm,第一螺旋含9个碱基对。
DNA双螺旋结构阐明的量重要意义在于第一次提出了遗传信息是以DNA分子中核苷酸的排列顺序为储存方式,从而说明了天然遗传信息的复制过程。
2.三级结构已发现线粒体、叶绿体、细菌、质粒及一些病毒的DNA双螺旋分子尚可形成封闭环状,天然状态的环状DNA分子多扭曲成麻花状的超螺旋结构(superhelix),这些比螺旋更为复杂的结构即DNA分子的三级结构。
真核生理细胞核中的DNA具有一种超螺旋结构,即DNA双螺旋盘绕在组蛋白上形成核小体(nucleosome)。核小体是染色质(chromatin)的核心小粒,由有140个碱基对的双螺旋DNA缠绕于由组蛋白(H2A、H2B、H3及H4各二分子)组成的八聚体外面,这一DNA股由此形成直径为9nm的超螺旋1.75圈。此核小体又经60个碱基对的DNA双螺旋及组蛋白H1形成细丝(间隔区)与下一个核小体相连接。
核小体的DNA双螺旋为200个碱基对,长度应为0.34nm×200=68nm,但实际长度只10nm,说明DNA双螺旋链进一步螺旋化盘绕在组蛋白八聚体上,其长度压缩了7/8。每6个核小体又绕成一圈形成螺线管,外径为30nm,螺距为10nm。这样DNA分子长度被压缩了6/7。120个螺线管又盘绕成直径为400nm,高为30nm的超螺线管,DNA分子长度又被压缩了40/41,此超螺线管即染色体的单位纤维(unit fiber),长20~60nm。从单位纤维形成染色单体(chromatid),实际长度为2~10nm,DNA分子长度又被压缩了5/6~6/7。这样从许多核小体组成的串珠样纤维经多层次螺旋化结构到形成染色单体,DNA分子的长度已被压缩至近1/10000。
(二)RNA
RNA分子也是由核苷酸依3’,5’磷酸二酯键形成的多核苷酸链。RNA总是以单链的形式存在,也有5’磷末端及3’羟基末端。RNA单链的局部折叠成的某一片段的A及G分别与另一片段的U及C配对常形成发夹结构(hairpin structure)。在此结构内的碱基无需全部配对,而配对部位形成小的双螺旋区域,不能配对的碱基则连成小环从螺旋区中被圈出来。这种RNA单链局部小双螺旋结构即是RNA的二级结构。
四、基本组织
由于DNA分子中核苷酸序列分析以及一级结构与功能相关的研究,使得人们有可能进一步了解DNA一级结构与基因组织的关系。已经证实,自然界极大多数生物体遗传信息贮存在DNA的核苷酸排列顺序中,因此,基因是DNA的一个片段,只有少数病毒的遗传信息贮存在RNA分子中。DNA分子中不同区域有不同功能,有些区域可编码蛋白质(最终产物是蛋白质),有些区域可编码RNA(最终产物是tRNA和rRNA),有些序列则与调控有关。那么一个DNA分子能携带多少基因呢?如果以平均1000个碱基对可编码一个3kD的蛋白质计算,猴病毒(SV40)DNA分子量为3.0×105,有5000碱基对可编码5种蛋白质。人染色体DNA有2.3×109碱基对,可编码200万以上的基因,但实际上,最多可编码基因数为2~3万。这是由于真核细胞DNA分子除编码蛋白质和RNA等结构基因外,有相当部分DNA顺序属于非编码区,而原核细胞DNA由于分子较小,必需充分利用有限的核苷酸序列。各种生物体内DNA分子的大小见表18-2。
表18-2 各种生物体内DNA分子的大小
| 来源 | 分子量 | 碱基对数目 | 长度 |
| 噬菌体фX174 | 0.6μm | ||
| 腺病毒(SV40) | 1.6×106 | 4500 | 1.5μm |
| 鼠线粒体 | 3.0×106 | 14000 | 4.9μm |
| 噬菌体λ | 9.5×106 | 50000 | 17μm |
| 噬菌体T2或T4 | 3.3×107 | 200000 | 67μm |
| 大肠杆菌染色体 | 1.3×108 | 4500000 | 1.5μm |
| 人染色体 | 3.0×109 | 125000000 | 4.1μm |
1.真核生物的基因组织根据某一段核苷酸顺序在整个DNA分子中出现的频率不同可分为以下几种:
(1)单拷贝顺序(singlecopy sequence):在整个DNA分子中只出现一次或少数几次,主要是编码蛋白质的结构基因。除组蛋白、角蛋白和肌动蛋白以外,几乎所有的蛋白质基因都是单拷贝顺序,平均为1000碱基对。单拷贝基因在整个基因组织中所占比例最高。在人的细胞中约占DNA含量的一半。
(2)中等重复顺序(moderatelyrepetitive sequences):有些基因如核蛋白体RNA基因、tRNA基因、组蛋白基因等在DNA分子中可重复出现几十到几千次,约占人细胞DNA含量的30~40%。以rRNA为例,在大肠杆菌中重复频率为7而果蝇中可重复千次。可见真核细胞中重复顺序比原核细胞高得多。
(3)高重复顺序(highlyrepetitive sequences):可重复几百万次。往往是简单的重复顺序,如蟹的T-A-T-A-T-A-T。也有的较长如非洲绿猴DNA是以172个碱基对的顺序为基础重复几万次。高重复顺序一般位于异染色质上,多数不编码蛋白质或RNA,其功能还不太清楚,主要是起间隔作用,可能与调控有关。
在重复顺序中还有一种反转重复顺序(inverted repetitivesequences)。其特点是一段碱基呈现回文结构,即一条单链回折即可形成互补的双链,故称为回文结构(palindromicstructure)或发夹结构(hairpin structure)。这种结构对基因的复制与转录可能具有调节 控制功能。

真核细胞中单拷贝顺序和重复顺序常常是中间隔排列的。不仅如此,在一个基因内部往往被一个或几个额外的顺序分割成若干片段,这种插入到基因内部的顺序称为插入顺序或内含子(intron)。内含子是不编码的顺序,而编码的碱基顺序则称为外显子(exon)。插入顺序是真核细胞DNA最主要的特征。
真核生物由于存在着较多的重复顺序、特殊的插入顺序以及控制区和其它多余顺序,使得DNA总长度往往大于编码的结构基因,因此,实际基因数往往小于DNA分子。
2.原核生物的基因组织原核生物DNA分子较小,基因组织也较简单,一般具有以下特点:
(1)DNA分子绝大部分用于编码蛋白质,不编码部分(又称间隔区)通常包含控制基因表达的顺序。例如,噬菌体фX174中只有5%是非编码区。
(2)功能相关的基因常常串联在一起,并转录在同一个mRNA分子中,称为多顺序反子。这种现象在真核生物中是很少见的。
(3)基因重叠:例如фX174的E基因全部包括在D基因内,B基因则包括在查基因内。这种现象主要发现在病理DNA分子中,可能是由于DNA分子太小又要装入相当量的基因的缘故。
第二节 DNA的变性与复性
一、DNA变性
DNA变性是指双螺旋之间氢键断裂,双螺旋解开,形成单链无规则线团,因而发生性质改变(如粘度下降,沉降速度增加,浮力上升,紫外吸收增加等),称为DNA变性。加热、改变DNA溶液的pH、或受有机溶剂(如乙醇、尿素、甲酰胺及丙酰胺等)等理化因素的影响,均可使DNA变性。
通常,可利用DNA变性后波长260nm处紫外吸收的变化追踪变性过程。因为DNA在260nm处有最大吸收值这一特征是由于含有碱基组成的缘故,在DNA双螺旋结构模型中碱基藏于内侧,变性时由于双螺旋解开,于是碱基外露,260nm紫外吸收值因而增加,这一现象称为增色效应(hyperchromic effect)。见图18-2。

图18-2 DNA的增色反应
如果升高温度使DNA变性,以温度对紫外吸收作图,可得到一条曲线,称为溶解曲线(见图18-3),由图可见当温度升高到一定范围时,DNA溶液在260nm处的吸光度突然明显上升至最高值,随后即使温度继续升高,其吸光度也无明显变化。由此说明DNA变性是在一个很窄的温度范围内发生,增色效应是爆发式的。从而也说明当达到一定温度时,DNA双螺旋几乎是同时解开的。通常人们把50%DNA分子发生变性的温度称为变性温度(即熔解曲线中点对应的温度),由于这一现象和结晶的融解相类似,故又称融点或融解温度(melting temperature, Tm)。因此Tm是指消光值上升到最大消光值一半时的温度。

图18-3 DNA的Tm值
综上所述,Tm值和增色效应是目前描述DNA特性所常用的两个量。假定一个DNA大分子最初全部是双螺旋结构,在热变性后消光系数上升30%以上;如果DNA原先局部就处于单链状态(例如在分子末端),则变性后上升较少。增色效应的大小是DNA性质的一个简单指标,与分子量无关。Tm不是一个固定的数值,它与很多因素有关:pH、离子强度和DNA的碱基比例。随着溶剂内离子强度上升,Tm值也随着增大。在某一离子强度(~10-3M)以下,无需加热就使溶于其中的DNA出现不可逆变性。与A-T碱基配对比较,DNA双螺旋内的G-C配对更为牢固。在相同条件下,DNA内G-C配对含量高,其Tm值也高。
假定在一个双链DNA分子内某些片段含有较多G-C碱基对,根据它们局部Tm值差,用电子显微镜就可以观察和测量到这些片段,如在DNA某一片段内含有较多的A-T碱基对,在某一个温度时就可能出现双链解离的现象。但在同一温度下,含G-C对较多部分仍然保持双链结构。这是一种非常有用的技术。
DNA的Tm值与以下因素有关:
(1)DNA的均一性:均一DNA如病毒DNA,解链发生在很窄的范围内,而不均一的DNA如动物细胞NDA其Tm值的范围则较宽。
(2)DNA分子中(G+C)的含量:一定条件下DNA的Tm值,由G+C含量所决定,因为G+C之间有3个氢链,因此G+C含量较高的DNA,Tm值较高,二者的关系可用以下经验式表示:
%(G+C)=(Tm-63.0)×2.44
实验表明DNA分子中(G+C)克分子含量百分比的大小与Tm值的高低呈直线关系,见图18-4。

图18-4 DNA和Tm值与G-C含量的关系
(3)溶剂的性质:Tm不仅与DNA本身性质有关,而且与溶液的条件有关,通常溶液的离子强度较低时,Tm值较低,融点范围也较宽,离子强度增高时,Tm值长高,融点范围也变窄。因此,DNA制剂不应保存在离子强度过低的溶液中,一般保存在1mol/l NaCl溶液中较稳定。
二、复性
变性DNA只要消除变性条件,二条互补链还可以重新结合,恢复原来的双螺旋结构,这一过程称为复性(renaturation)。通常DNA热变性后,将温度缓慢冷却,并维持在比Tm低25~30℃左右时,变性后的单链DNA即可恢复双螺旋结构,因此,这一过程又叫做退火。复性后的DNA,理化性质都能得到恢复。倘若DNA热变后快速冷却,则不能复性(图18-5)。

图18-5 热变性过程和两种冷却过程示意图
影响复性速度的因素很多,同样条件下,DNA顺序简单的分子复性很快,如polyd[T]和polyd[A]由于彼此互补识别很快,故能迅速复性。但顺序较复杂的DNA分子复性则较慢。因此通过变性速率的研究,可以了解DNA顺序的复杂性。DNA片段的大小也影响变性的速率,因为DNA片段愈大,扩散速度愈低,使DNA片段线状单链互相发现互补的机会减少。因此,在复性实验中,有时将DNA切成小片段,再进行复性。同样条件下,同一种DNA浓度愈高,复性速度也愈快。溶液的离子强度对复性速度也有影响,通常盐浓度较高时,复性速度较快。
Doty研究小组是最早对DNA变性过程进行深入研究的。它们所获得的结果表明,在达到Tm值时,两条DNA单链分离开。如果在加热之后慢慢地冷却,则出现部分复性,即DNA的一部分回复到双螺旋结构。复性的程度取决于DNA浓度及信息含量的多少。病毒DNA(信息含量少)比哺乳动物DNA容易复性,而DNA浓度较高时,有利于复性,快速冷却使DNA仍然处于变性状态,这时自由单链成链线团结构。对这种情况,人们称之为螺旋-线团转化过程(helix-coil-transition)。快速冷却时消光系数固然有所下降,但比天然DNA的数值始终要大。
细胞核DNA复性的动力学研究指出,DNA内很少片段有重复的或很相似的碱基顺序(所谓重复DNA)。DNA复性的程度和过程与其信息含量的多少等有关;因而病毒DNA比细菌DNA复性得快。Britten发现一种测定和观察复性过程的方法。X轴表示变性DNA原始浓度(Co)和保温时间的乘积,纵轴表示DNA复性部分(重新作为双螺旋结构出现)。DNA比例可以用羟基磷灰石柱的办法加以确定,因为这种柱能够使单链和双链DNA分离开来。DNA复性曲线呈S形,随着信息含量增加,此形状相同曲线往往较高Co.t值处移动。奇怪的是,从细胞核来的DNA在复性时显示出完全不同的情形:这些DNA中的一部分异常快地复性,而另一些DNA只有在极高的Co.t值时才出现预期的复性。对快速复性可以作这样的解释,即在某一DNA之内同时有几个相同或很类似的顺序存在,因而找重复顺序比找DNA内唯一顺序要快得多。后者含有特殊的遗传信息,常被称为独特DNA。与之相反是重复DNA片段。
真核DNA自发复性的一种特殊途径是通过发夹结构。对单链而言,要生成这种发夹结构,要求一种特定的碱基顺序,这种顺序称作回文(正读反读都相同)结构。为了构成回文结构,DNA片段的碱基顺序必须在互补链内找到相反的顺序;在具有相反碱基顺序的两个DNA片段之间,显然常常出现短的中间片段由于存在这样的核苷酸顺序,在复性时就能形成发夹结构。
如果存在很多重复回文结构,在部分复性时就能通过形成DNA侧链而出现十字结构。DNA回文结构使DNA片段出现回旋对称性。这种结构常常出现在DNA和蛋白质之间相互作用的地方,特别是后者起控制作用时。
第三节 分子杂交
一、概述
前面已经介绍了核酸分子单链之间有互补的碱基顺序,通过碱基对之间非共价键(主要是氢键)的形成即出现稳定的双链区,这是核酸分子杂交的基础。杂交分子的形成并不要求两条单链的碱基顺序完全互补,所以不同来源的核酸单链只要彼此之间有一定程度的互补顺序(即某种程度的同源性)就可以形成杂交双链。分子杂交可在DNA与DNA、RNA与RNA或RNA与DNA的二条单链之间进行。由于DNA一般都以双链形式存在,因此在进行分子杂交时,应先将双链DNA分子解聚成为单链,这一过程称为变性,一般通过加热或提高pH值来实现。使单链聚合双链的过程称为退火或复性。用分子杂交进行定性或定量分析的最有效方法是将一种核酸单链用同位素或非同位素标记成为探针,再与另一种核酸单链进行分子杂交。
核酸杂交技术基本上是Hall等1961年的工作开始的,探针与靶序列在溶液中杂交,通过平衡密度梯度离心分离杂交体。该法很慢、费力且不精确,但它开拓了核酸杂交技术的研究。Bolton等1962年设计了第一种简单的固相杂交方法,称为DNA-琼脂技术。变性DNA固定在琼脂中,DNA不能复性,但能与其它互补核酸序列杂交。典型的反应是用放射性标记的短DAN或RNA分子与胶中DNA杂交过夜,然后将胶置于柱中进行漂洗,去除游离探针,在高温、低盐条件下将结合的探针洗脱,洗脱液的放射性与结合的探针量呈正比。该法尤其适用于过量探针的饱和杂交实验。60年代末,Britten等设计了另一种分析细胞基因组的方法。该法是研究液相中DNA的复性以比较不同来源核酸的复杂度,典型的方法是:从不同生物体(细菌、酵母、鱼和哺乳动物等)内分离DNA,用水压器剪切成长约450核苷酸(nt)的片段。剪切的DNA液(含0.12mol/L磷酸盐缓冲液或0.18mol/l Na+),经煮沸使dsDNA热变性成ssDNA。然后冷至约60℃,在此温度孵育过程中,测定溶液一定时间内的UV260nm的吸光度(减色效应)来监测互补链的复性程度。通常该实验可比较不同来源生物DNA的复性速率,并可建立序列复杂度与动力学复杂度间的关系。
60年代中期Nygaard 等的研究为应用标记DNA或RNA探针检测固定在硝酸纤维素(NC)膜上的DNA序列奠定了基础。如Brown等应用这一技术评估了爪蟾rRNA基因的拷贝数。RNA在代谢过程中被3H尿嘧啶标记,并在过量的情况下与膜上固定的基因组DNA杂交,继而用RNase处理,消化非特异性结合的RNA。漂洗后计数以测定杂交探针的量。通过计算与已知量DNA杂交的RNA量即可评估rRNA基因数。由于当时缺乏特异探针,这种方法不能用于研究其它特异基因的表达,这些早期过量探针膜杂交试验实际上是现代膜杂交实验的基础。
进入70年代早期,许多重要的发展促进了核酸杂交技术的进展。例如,对特异基因转录产物的分析和对动力学杂交实验又有兴趣。固相化的Poly U –Sepharose和寡(dT)-纤维素使人们能从总RNA中分离PolyA+ RNA。用mRNA的经纯化技术可从网织红细胞总RNA中制备α-和β-珠蛋白mRNA混合物。这些珠蛋白mRNA首次被用于合成特异的探针以分析珠蛋白基因的表达。由于制备cDNA探针很繁琐,所获得cDNA的长度和纯度也不稳定。所以寻求新的探针来源是使分子杂交技术进一步推广的基础。
70年代末期到80年代早期,分子生物学技术有了突破性进展,限制性内切酶的发展和应用使分子克隆成为可能。各种载体系统的诞生,尤其是质粒和噬菌体DAN载体的构建,使特异性DNA探针的来源变得十分丰富。人们可以从基因组DNA文库和cDNA文库中获得特定基因克隆,只需培养细菌,便可提取大量的探针DNA。迄今为止,已克隆和定性了许多特异DNA探针。
由于固相化学技术和核酸自动合成仪的诞生,现在可常规制备18~100个碱基的寡核苷酸探针。应用限制酶和Southern印迹技术,用数微克DNA就可分析特异基因。特异DNA或RNA序列的量和大小均可用Southern印迹和Northern印迹来测定,与以前的技术相比,大大提高了杂交水平和可信度。
尽管取得了上述重大进展,但分子杂交技术在临床实用中仍存在不少问题,必须提高检测单拷贝基因的敏感性,用非放射性物质代替放射性同位素标记探针以及简化实验操作和缩短杂交时间,这样,就需要在以下三方面着手研究:第一,完善非放射性标记探针;第二,靶序列和探针的扩增以及信号的放大;第三,发展简单的杂交方式,只有这样,才能使DNA探针实验做到简便、快速、低廉和安全。
二、探针-靶反应
从化学和生物学意义上理解,探针是一种分子,它带有供反应后检测的合适标记物,并仅与特异靶分子反应。抗原-抗体、外源凝集素-碳水化合物、亲和素-生物素、受体-配基(ligand)以及互补核酸间的杂交均属于探针-靶分子反应。蛋白质探针(如抗体)与特异靶分子是通过混合力(疏水、离子和氢键)的作用在少数特异位点上的结合,而核酸探针与互补链的反应则是根据杂交体的长短不同,通过氢键在几十、几百甚至上千个位点上的结合。因为有机溶液可降低杂交体的稳定性,所以,疏水反应对互补核酸链的结合也有一定的作用,但对其特异性影响甚微。
核苷酸经某一原子、功能基团或长侧链修饰后仍可能进行碱基配对,这取决于修饰的部位和修饰的性质。这一特性有助于理解非放射性核酸探针标记物的设计和125I与DNA探针的化学结合。能与核酸结合的单一原子有银、溴和碘等,这些元素可与嘧啶(胸腺嘧啶除外)环的C-5位或嘌呤环的C-8位反应而不影响氢键的形成。溴亦可与胸腺嘧啶的C-6位结合。而胞嘧啶的C-4和腺嘌呤的N-6就不能被修饰,否则会影响碱基配对,尽管C的N-4位和A的N-6位参与了氢键形成,但它们也是标记位点。这是因为标记的探针每1kb只掺入10~30个修饰碱基,即仅4%~12%的单个碱基被修饰的类似物取代了。尽管掺入位点处的碱基配对较弱或不存在,但对整个杂交分子的稳定性影响很小。防止氢键破坏的一种方法就是修饰探针,即探针克隆入M13载体中,只修饰载体区而不修饰插入片段。当用放射性同位素32P和35S标记核酸时,由于同位素是掺入核酸骨架的磷酸二脂键中,因此碱基未发生任何修饰。在5’端的磷酸基团上可进行化学修饰,这是标记寡核苷酸探针的有效方法。因为这种方法是在一个探针分子上标记一个检测的基团,所以,对长的克隆探针不适用。
此外,还可利用修饰的碱基来增加杂交的稳定性和特异性。2-氢基腺嘌呤可替代寡核苷酸探针中的腺嘌呤通过形成3个氢键以增加杂交体的稳定性。另外,在G-C丰富的RNA探针中,可用次黄嘌呤代替鸟嘌呤以获得特异的杂交。因为次黄嘌呤和鸟嘌呤间只形成2个氢键,有效地降低了杂交体的Tm值,这样,Tm值与杂交温度更接近,杂交的严格性就增加了,因此,也就增加了特异性。
很显然,结合位点的不同和可检测基团与检测系统的不同,可派生出很多核酸探针标记方法。这是由核酸的化学结构和性质所决定的。只有在对核酸分子的探针-靶反应的化学本质有了深入了解之后,才能更好地理解后面的章 节 内容。
三、核酸探针的种类
基因探针根据标记方法不同可粗分为放射性探针和非放射性探针两大类,根据探针的核酸性质不同又可分为DNA探针,RNA探针,cDNA探针,cRNA探针及寡核苷酸探针等几类,DNA探针还有单链和双链之分。下面分别介绍这几种探针。
(一)DNA探针
DNA探针是最常用的核酸探针,指长度在几百碱基对以上的双链DNA或单链DNA探针。现已获得DNA探针数量很多,有细菌、病毒、原虫、真菌、动物和人类细胞DNA探针。这类探针多为某一基因的全部或部分序列,或某一非编码序列。这些DNA片段须是特异的,如细菌的毒力因子基因探针和人类Alu探针。这些DNA探针的获得有赖于分子克隆技术的发展和应用。以细菌为例,目前分子杂交技术用于细菌的分类和菌种鉴定比之G+C百分比值要准确的多,是细菌分类学的一个发展方向。加之分子杂交技术的高敏感性,分子杂交在临床微生物诊断上具有广阔的前景。细菌的基因组大小约5×106bp,约含3000个基因。各种细菌之间绝大部分DNA是相同的,要获得某细菌特异的核酸探针,通常要采取建立细菌基因组DNA文库的办法,即将细菌DNA切成小片段后分别克隆得到包含基因组的全信息的克隆库。然后用多种其它菌种的DNA作探针来筛选,产生杂交信号的克隆被剔除,最后剩下的不与任何其它细菌杂交的克隆则可能含有该细菌特异性DNA片段。将此重组质粒标记后作探针进一步鉴定,亦可经DNA序列分析鉴定其基因来源和功能。因此要得到一种特异性DNA探针,常常是比较繁琐的。探针DNA克隆的筛选也可采用血清学方法,所不同的是所建DNA文库为可表达性,克隆菌落或噬斑经裂解后释放出表达抗原,然后用来源细菌的多克隆抗血清筛选阳性克隆,所得到多个阳性克隆再经其它细菌的抗血清筛选,最后只与本细菌抗血清反应的表达克隆即含有此细菌的特异性基因片段,它所编码的蛋白是该菌种所特有的。用这种表达文库筛选得到的显然只是特定基因探针。
对于基因探针的克隆尚有更快捷的途径。这也是许多重要蛋白质的编码基因的克隆方法。该方法的第一步是分离纯化蛋白质,然后测定该蛋白的氨基或羟基末端的部分氨基酸序列,然后根据这一序列合成一套寡核苷酸探针。用此探针在DNA文库中筛选,阳性克隆即是目标蛋白的编码基因。值得一提的是真核细胞和原核细胞DNA组织有所不同。真核基因中含有非编码的内含子序列,而原核则没有。因此,真核基因组DNA探针用于检测基因表达时杂交效率要明显低于cDNA探针。
DNA探针(包括cDNA探针)的主要优点有下面三点:①这类探针多克隆在质粒载体中,可以无限繁殖,取之不尽,制备方法简便。②DNA探针不易降解(相对RNA而言),一般能有效抑制DNA酶活性。③DNA探针的标记方法较成熟,有多种方法可供选择,如缺口平移,随机引物法,PCR标记法等,能用于同位素和非同位素标记。
(二)cDNA探针
cDNA(complementary DNA)是指互补于mRNA的DNA分子。cDNA是由RNA经一种称为逆转录酶(reverse transcriptase)的DNA聚合酶催化产生的,这种逆录酶是Temin等在70年代初研究致癌RNA病毒时发现的。该酶以RNA为模板,根据碱基配对原则,按照RNA的核苷酸顺序合成DNA(其中U与A配对)。这一途径与一般遗传信息流的方向相反,故称反向转录或逆转录。携带逆转录酶的病毒侵入宿主细胞后,病毒RNA在逆转录酶的催化下转化成双链cDNA,并进而整合人宿主细胞染色体DNA分子,随宿主细胞DNA复制同时复制。这种整合的病毒基因组称为原病毒。在静止状态下,可被复制多代,但不被表达,故无毒性。一旦因某种因素刺激而被活化,则该病毒大量复制,如其带有癌基因,还可能诱发细胞癌变,后来发现逆转录酶不仅普遍存在于RNA病毒中,而且哺乳动物的胚胎细胞和正在分裂的淋巴细胞也含有逆转录酶。逆转录酶的作用是以dNTP为底物,RNA为模板,tRNA(主要是色氨酸tRNA)为引物,在Trna3’-OH末端上,5’-3’方向,合成与RNA互补的DNA单链,称为互补DNA(cDNA),单链cDNA与模板RNA形成RNA-DNA杂交体。随后在逆转录酶的RNase H活性作用下,将RNA链水解成小片段。cDNA单链的3’末端回折形成一个小引物末端,逆转录酶又以第一条cDNA链为模板再合成第二第cDNA链,至此,完成逆转录全过程,合成双链cDNA。
逆转录现在已成为一项重要的分子生物学技术,广泛用于基因的克隆和表达。从逆转录病毒中提取的逆转录酶已商品化,最常用的有AMV逆转录酶。利用真核Mrna3’末端存在一段聚腺苷酸尾,可以合成一段寡聚胸苷酸(oligo(dT))用作引物,在逆转录酶催化下合成互补于mRNA的cRNA链,然后再用RNase H将mRNA消化掉,再加入大肠杆菌的DNA聚合酶I催化合成另一条DNA链,即完成了从mRNA到双链DNA的逆转录过程。
所得到的双链cDNA分子经S1核酸酶切平两端后接一个有限制酶切点的接头(linker),再经特定的限制酶消化产生粘性末端,即可与含互补末端的载体进行连接。常用的克隆载体是λ噬菌体DNA,如λgt,EMBL和Charon系列等。用这类载体可以得到包含104以上的转化子的文库,再经前面介绍的筛选方法筛选特定基因克隆。用这种技术获得的DNA探针不含有内含子序列。因此尤其适用于基因表达的检测。
(三)RNA探针
RNA探针是一类很有前途的核酸探针,由于RNA是单链分子,所以它与靶序列的杂交反应效率极高。早期采用的RNA探针是细胞mRNA探针和病毒RNA探针,这些RNA是在细胞基因转录或病毒复制过程中得到标记的,标记效率往往不高,且受到多种因素的制约。这类RNA探针主要用于研究目的,而不是用于检测。例如,在筛选逆转录病毒人类免疫缺陷病毒(HIV)的基因组DNA克隆时,因无DNA探针可利用,就利用HIV的全套标记mRNA作为探针,成功地筛选到多株HIV基因组DNA克隆。又如进行中的转录分析(nuclear run on transcrip-tion assay)时,在体外将细胞核分离出来,然后在α-32P-ATP的存在下进行转录,所合成mR-NA均掺入同位素而得到标记,此混合mRNA与固定于硝酸纤维素滤膜上的某一特定的基因的DNA进行杂交,便可反映出该基因的转录状态,这是一种反向探针实验技术。
近几年体外转录技术不断完善,已相继建立了单向和双向体外转录系统。该系统主要基于一类新型载体pSP和pGEM,这类载体在多克隆位点两侧分别带有SP6启动子和T7启动子,在SP6RNA聚合酶或T7RNA聚合酶作用下可以进行RNA转录,如果在多克隆位点接头中插入了外源DNA片段,则可以此DNA两条链中的一条为模板转录生成RNA。这种体外转录反应效率很高,在1h内可合成近10μg的RNA产生,只要在底物中加入适量的放射性或生物素标记的NTP,则所合成的RNA可得到高效标记。该方法能有效地控制探针的长度并可提高标记物的利用率。
值得一提的是,通过改变外源基因的插入方向或选用不同的RNA聚合酶,可以控制RNA的转录方向,即以哪条DNA链以模板转录RNA。这种可以得到同义RNA探针(与mRNA同序列)和反义RNA探针(与mRNA互补),反义RNA又称cRNA,除可用于反义核酸研究外,还可用于检测mRNA的表达水平。在这种情况下,因为探针和靶序列均为单链,所以杂交的效率要比DNA-DNA杂交高几个数量级。RNA探针除可用于检测DNA和mRNA外,还有一个重要用途,在研究基因表达时,常常需要观察该基因的转录状况。在原核表达系统中外源基因不仅进行正向转录,有时还存在反向转录(即生成反义RNA),这种现象往往是外源基因表达不高的重要原因。另外,在真核系统,某些基因也存在反向转录,产生反义RNA,参与自身表达的调控。在这些情况下,要准确测定正向和反向转录水平就不能用双链DNA探针,而只能用RNA探针或单链DNA探针。
综上所述,RNA探针和cRNA探针具有DNA探针所不能比拟的高杂交效率,但RNA探针也存在易于降解和标记方法复杂等缺点。
(四)寡核酸探针
前述三种探针均是可克隆的,一般情况下,只要有克隆的探针,就不用寡核苷酸探针。在DNA序列未知而必须首先进行克隆以便绘制酶谱和测序时,也常应用克隆。克隆探针一般较寡核苷酸探针特异性强,复杂度也高,从统计学角度而言,较长的序列随机碰撞互补序列的机会较短序列少,克隆探针的另一优点是,可获得较强的杂交信号,因为克隆探针较寡核苷酸探针掺入的可检测标记基因更多。但是,较长的探针对于靶序列变异的识别能力又有所降低。对于仅是单个碱基或少数碱基不同的两序列,克隆探针不能区分,往往杂交信号相当。这既是其优点,又是其缺点。优点是当用于检测病原微生物时,不会因病毒或细菌DNA的少许变异而漏诊,缺点则是不能用于点突变的检测。这种情况下,通常要采用化学合成的寡核苷酸探针。
合成的寡核苷酸探针具有一些独特的优点:①由于链短,其序列复杂度低,分子量小,所以和等量靶位点完全杂交的时间比克隆探针短,如20nt的寡核苷酸探针在浓度为100ng/ml,靶序列为1~100pg、1kb片段或3×10-18~3×10-16mol/L时,达到最大程度的杂交只需10min,而用2kb的克隆探针在同样条件下达到完全杂交则需16h。②寡核苷酸探针可识别靶序列内1个碱基的变化,因为短探针中碱基的错配能大幅度地降低杂交体的Tm值。③一次可大量合成寡核苷酸探针(1~10mg),使得这种探针价格低廉,与克隆探针一样,寡核苷酸探针能够用酶学或化学方法修饰以进行非放射性标记物的标记。尽管克隆探针较特异,但通过细心筛选序列和/或选择相对长的序列(>30nt)亦可设计出非常特异的寡核苷酸探针。最常用的寡核苷酸探针有18~40个碱基,目前的合成仪可有效地合成至少50个碱基的探针。下面是筛选寡核苷酸针的一些原则。
①长18~50nt,较长探针杂交时间较长,合成量低;较短探针特异性会差些。
②碱基成分:G+C含量为40%~60%,超出此范围则会增加非特异杂交。
③探针分子内不应存在互补区,否则会出现抑制探针杂交的“发夹”状结构。
④避免单一碱基的重复出现(不能多于4个),如-CCCCC-。
⑤一旦选定某一序更符合上述标准,最好将序列与核酸库中核酸序列比较,探针序列应与含靶序列的核酸杂交,而与非靶区域的同源性不能超过70%或有连续8个或更多的碱基的同源,否则,该探针不能用。
按上述原则选出的探针会增加成功的机会,选定后进行合成与标记,并摸索合适的杂交条件。方法是制备几张点有特异靶DNA和不相关DNA的膜,各膜分别在不同温度下与探针杂交,特异靶DNA杂交信号强而非特异DNA不产生任何杂交反应的就是最适杂交温度。在进行点突变检测杂交的反应时,洗膜条件和温度物选择往往更为重要。所选漂洗条件必需使野生型靶DNA与探针产生强的杂交信号而突变型靶DNA则不产生杂交信号,这可以通过逐渐提高洗膜温度来完成。
寡核苷酸探针还有一个重要用途。在用于检测单个碱基差异时尚可采用一种称为寡核苷酸限制(oligonucleotide restriction)的技术。该技术只有在突变点位于某一限制性内切酶识别位点时才有效。例如,镰刀状红细胞贫血是因β珠蛋白基因的第6个寡码子由GAG变成GTG,从而导致所编码氨基酸由酪氨酸变成缬氨酸。突变的β-珠蛋白功能异常,称作S珠蛋白,而野生型称为A珠蛋白,其基因型分别为βS和βA。恰好突变点A→T位于Del I的识别序列CT-NAG之内,这就为设计寡核苷酸限制实验创造了条件。方法是合成一个长40个碱基的寡核苷酸探针,其5’末端距突变碱基有11个碱基,该探针与βA基因的非编码链互补。将此探针的5’末端标记上32P。杂交方法采用液相杂交法,即在液相中将靶DNA变性解链,然后与探针退火,产生杂交体。如靶DNA为βA型,则两条链完全互补,并产生Dde I的酶切位点;如待检DNA为βS型,则所形成的杂交体中两条链在突变碱基处不配对,从而不能被Del I所识别。用Del I消化杂交DNA,显然βA会被切开而βS不被切开。βADNA杂交体被切开后,5’端探针序列因只有8个碱基,与杂交链结合不紧而解离,从而产生游离的5’端标记8核苷酸单链。不被切开的βS杂交体尚可被另一个限制酶Hinf I消化,该酶的识别位点紧靠Del I 识别位点上游。βS杂交DNA经Hinf I消化后,将释出探针DNA的5’末端3核苷酸小片段。βADNA杂交体因已无Hinf I识别序列,故而不能被Hinf I消化。这样βA和βSDNA经此寡核苷酸探针杂交和Del I及Hinf I消化后,分别产生游离的8核苷酸(8nt)和3核苷酸(3nt) 片段,它们可以经电泳分离后进行放射自显影而获证实。藉此策略,可轻易将各种β珠蛋白突变型鉴别开,如纯合野生型AA结果为仅有8nt片段,纯合突变型SS则仅可检出3nt片段,而杂合子AS型则两种片段均存在。
四、核酸探针的标记和检测(详见每十九章 )
分子杂交是核酸链间碱基配对规则的一种结合方式,是核酸的重要理化特性。利用分子杂交这一特性来对特定核酸序列进行检测,必须将杂交链中的一条用某种可以检测的分子进行标记,这条链就称为核酸探针。因此,核酸探针的制备是分子杂交技术的关键。最早采用的也是目前最常用的核酸探针标记方法是放射性同位素标记。常用的放射性同位素有32P和35S前者能量高,信号强,最常用。放射性同位素标记探针虽然敏感度高,但却存在辐射危害和半衰期限制(32P半衰期为14.3天,35S半衰期为87.1天,125I的半衰期为60天),3H的半衰期长达12.3年,但它所释放β放射线能量太低(0.018Mev),只能用于组织原位杂交。由于同位素标记的探针在使用过程中存在着上述缺点,近些年来,人们在寻找非航船性标记物方面取得了很大进展,国际上已有多家公司相继推出多种非放射性探针标记试剂盒,在国内也已具备生物素类标记物的生产能力,并有相应试剂出售。目前,非放射性标记物有下述几类:金属如Hg,荧光物质如FITC;半抗原如地高辛;生物素;酶类如辣根过氧化物酶(HRP)。半乳糖苷酶或碱性磷酸酶(AKP)等。不同的标记物,所标记探针的方法及检测方法也各异。下面仅就国际上较常用的,有实用价值或发展前景的几种核酸标记方法及其显示方法分两方面简述如下。
(一)核酸探针的常用酶促标记技术
1.缺口平移 该技术由Kelly等于1970年创立。其原理是首先用DNA酶在双链DNA探针分子的一条链上制造一些缺口(nick ),缺口处会形成3’—羟基末端,这时再在大肠杆菌DNA聚合酶I的催化下将核苷酸残基加在3’-羟基上,同时,根据大肠杆菌酶DNA聚合酶I的5’→3’核酸外切酶活性,此酶将缺口5’侧核苷酸依次切除。其结果是在缺口平移(nick tr-anslation)。根据这个原理,如果用高强度的放射性核苷酸(通常为α-32PdATP)置换先前存在的核苷酸,则可制备比活性高达108cpm(每分钟计数)/μg的32P标记DNA。用缺口平移法标记的DNA探针能满足大多数杂交要求。
2.DNA快速末端标记 大肠杆菌DNA聚合酶i 经枯草杆菌蛋白酶切割可得到两条多肽链,其中分子量为76kd的大片段称为Klenow片段。该酶具有完整聚合酶I的5’→3’聚合酶活性和3’→5’核酸外切酶活性,但缺乏5’→3’核酸外切酶活性。利用Klenow片段可以填补由限制酶消解DNA所产生的3’凹陷末端。因此,用这种方法可以标记双链DNA的凹陷3’末端。用Klenow片段标记末端一般只用一种[α-32P]dNTP,加入反应的[α-32P]dNTP取决于DNA末端延伸的5’末端序列,例如,用EcorI切割DNA所产生的末端用[α-32P]dNTP标记。标记反应可在一种限制酶消解DNA后立即进行,不需去除限制酶或使其失活,也不需更换缓冲液,具有3’延伸的DNA末端不能被Klenow片段有效在标记,欲标记这类分子可用T4DNA聚合酶。
选用这种标记方法是为了产生可用于凝胶电泳时作大小参照物的DNA片段。因为标记的DNA片段与其摩尔浓度成比例,而不与片段大小成比例,在限制酶消化物中,小的和大的片段都以相同程度被标记。因此,可使用放射自显影术确定不有被溴化乙锭染色所观察到的大小DNA带,尤其适用于Southern吸印杂交时分子量标志物的标记。通过选择相应标记的dNTP,该法还可以只标记DNA分子的一端。例如,若DNA片段的两个末端分别是Bam H I和Hind III 粘膜端,在反应中只加入[α-32P]dNTP或[α-32P]dGTP,使可选择性标记两末端之一。
3.用T4多核苷酸激酶标记DNa 5’末端 寡核苷酸探针或短的RNA和DNA探针可选用此法标记,寡核苷酸探针一般多用这种标记。T4多核苷酸激酶(polynucleotide kinase, PNK)是由T4噬菌体感染的大肠杆菌中提取的,此酶能催化ATP的γ-磷酸转移至DNA或RNA的5’-OH末端。在过量ADP存在时,也可促进磷酸交换反应,使PNK将DNA末端5’磷酸转移到ADP上生成ATP,然后催化[α-32P]dNTP上的标记磷酸转移至DNA的5’末端,从而使DNA重新磷酸化,并藉此得到标记。显然,PNK标记DNA末端需要[γ-32P]dNTP,这与前述酶促标记方法不同。通常,对于5’磷酸化的DNA探针,要先用碱性磷酸酶去掉磷酸基团,然后再用于PNK催化的5’末端标记,这样标记效率较高。
4.随机引物延伸 这是以单链DNA或RNA模板合成高比活性32P标记探针所选用的方法。原理是使长6~8nt的寡核苷酸片段与变性的DNA或RNA模板退火,在DNA聚合酶I或反转录酶的作用下,以每一个退火到模板上的寡核苷酸片段为引物引发DNA链的合成,在反应时将[α-32P]dNTP掺入合成链,即得到标记。变性处理后,新合成链(探针片段)与模板解离,即得到无数各种大小的探针DNA。因为所用寡核苷酸片段很短,在低温条件下可与模板DNA随机发生退火反应,因此被称为随机引物(random primer)。这种随机引物可用小牛胸腺DNA或鱼精DNA制备。
用随机引物法标记的DNA探针或cDNA探针比活性显著高于缺口平移法,且结果较为稳定。这种方法尤其适用于真核DNA探针,因为随机引物来自真核DNA,其与真核序列的退火率要高于原核序列。因此,对于克隆的DAN探针,常先将插入探针DNA切下来回收后再标记,而缺口平移法可直接用于全质粒的标记。
5.聚合酶链反应(详见第二十二章) 聚合酶链反应(polymerase chain reaction, PCR)是一种分子生物学新技术,由美国Cetus公司人类遗传学部的Kary.B. Mullis于1985年创立。该技术利用两个与相反链杂交并随着于靶DNA两侧的寡核苷酸引物经酶促合成特异的DNA片段,包括模板变性,引物退火和引物延伸三个步骤的反复循环,最终两引物所夹靶DNA得到千万倍以上的扩增。因此,PCR技术已成为一项极为有价值的技术并已迅速推广应用。
PCR技术有许多重要用途,其中之一便是可用来标记高比活性DNA探针。PCR技术具有很高的特异性,可在1~2h之内在量合成探针DNA片段,如果在底物中加入[α-32P]dNTP或其它标记的dNTP,则探针DNA合成过程中可得到很好的标记,标记物的掺入率可高达70%~80%。因此,PCR标记技术特别适用于大规模检测和非放射性标记。该法的缺点是要合成一对特异性PCR引物。使用从探针DNA上制备的小片段作引物也能取得较好的标记效果。
(二)核酸探针的非放射性标记技术
1.光敏生物素标记核酸 目前使用的光标生物素试剂有两种:光生物素(乙酸盐)和补骨脂素生物素。它们都是由一个光敏基团、一个连接臂和一个生物素基团组成。光生物素的光敏基团是-N3,它在光作用下可与核酸中的碱基结合。补骨脂素生物素中的光敏基团补骨脂素在光照(320~400μm)下,可与单链或双链核酸发生反应,反应主要在T上,C上也有一定程度的反应。光敏生物素的连接臂含6~12个碳原子,用以减少探针杂交时的空间位阻。光敏生物素标记核酸,方法简单,灵敏度也可达到pg水平,可用于外源基因的检测。最近出现了一种新的光敏活性DNA生物素试剂,即生物素-聚乙二醇-当归素(BPA)。BPA的DNA结合部分是一个活性糖香豆素衍生物,在长波UV下它可与DNA碱基共价键结合。BPA反应物与DNA结合比光敏生物素更特异,在可见光下它不与核酸反应,这个特性可使BPA只标记粗制细胞裂解物中的核酸,而不标记蛋白、多糖和其他细胞大分子。
2.酶促生物素标记核酸 以生物素化的脱氧核苷三磷酸(Bio-11-dUTP,Bio –7 – dATP、Bio-11-dCTP)等代替相应32P标记的脱氧核苷三磷酸,经DNA聚合酶作用掺入DNA。Bio-dUTP代替dTTP,Bio-dATP代替dATP,Bio- dCTP代替dCTP。Bio –11-dUTP的11是指生物素基团与脱氧核苷酸之间连接臂的碳链长度。常用的酶促生物素标记DNA的方法有缺口平移法和随机引物延伸法。
3.寡核苷酸的生物素末端标记 有5’-磷酸的化学标记法和3’-OH的酶促标记法。前者将寡核苷酸的5’-磷酸接上一个乙二胺,然后用琥珀酰亚胺生物素,将生物素基团连接在磷酸酰胺基上。后者是用末端转移将Bio-11–dUTP加于其3’-OH端(脱去一个焦磷酸)。
4.酶标DNA 标记试剂是辣根过氧化酶(HRP)或碱性磷酸酶(AP)。通过对苯醌(PBQ)与聚乙烯亚胺(PEI)连接而成(HRP-PBQ-PEI+),此试剂在戊二醛的作用下与变性的DNA结合,使HRP与DNA连接在一起,组成HRP标记的DNA探针。
5.酶标寡核苷酸 包括核苷酸5’末端标记HRP法和内部标记AP法。前者是在HRP中产生一个-HS反应基团,在寡核苷酸合成终了加在5’端,带一个C6的-HS基,与活化的HRP反应生成5’-HRP寡核苷酸。后者是在全成寡核苷酸过程中将一个5’带连接臂及CF3基团的尿苷3’亚磷酰亚胺合成在寡核苷酸链中,合成后此活化的寡核苷酸与AP反应即得到AP标记的寡核苷酸。
6.DNA半抗原标记 其原理与Bio-11-dTUP相同,只是用毛地黄甙代替生物素形成Dig –11- dUTP,酶促掺入DNA分子。用抗毛地黄甙抗体检测标记在DNA上的半抗原分子Digoxigenin(地高辛)
(三)非放射性探针的显示体系
1.AP显色体系

BCI –OH+NBT→紫色↓
ASO:等位基因特异的寡核苷酸,BCIP:5溴-4氯-3吲哚磷酸,NBT:四氮唑蓝,Pi:磷酸。
2.HRP显色体系
HRP + H2O2[HRP·H2O2]
ODA –NH2 +[HRP ·H2O2]枣→ODA-N = ODA/棕色↓+HRP +H2O
ODA:邻-联茴香胺。
3.ABC显色体系
DNA –B+ SA – AP→DNa – B – SA或DNa – B +SA - BAP→DNa –B –SA –BAP
经上述两反应,把AP连接在DNA上以后,再进行AP酶显色。这里SA为Streptavidin(链酶亲合素),BAP为生物素化的磷酸酶,B为生物素(biotin),ABC为Avidin – Biotin - Enzyme com-plex, 即亲合素- 生物素-酶复合物。
以上反应AP亦可用HRP代替。
表18-3曱核酸探针的标记分子
| 标记物性质 | 标记分子 | 标记方法 | 杂交体的检测法 |
| 放射性分子 | [α-32P]dNTP | NT、PCR、RPI | 放射自显影或计数 |
| [γ-32P]dNTP | TL | 放射自显影或计数 | |
| 125I | 碘化 | 放射自显影或计数 | |
| 35S | NT | 放射自显影或计数 | |
| 3H | NT | 放射自显影或计数 | |
| 非放射性分子 | |||
| 生物素 | Bio-11-dUTP | NT、TL、PCR | 酶标亲合素或酶标抗生物素抗体显色 |
| 光敏生物素 | 600W 可见光照 | 同上 | |
| 生物素化补骨脂素 | 365nm紫外线照 | 同上 | |
| 生物素酰-e-氨基乙酸 | 化学合成法 | 同上 | |
| N-羟基丁二酰亚胺脂 | 酶标亲合素或酶标抗生物素抗体显色 | ||
| 生物素肼 | 化学合成法 | 酶标亲合素或酶标抗生物素抗体显色 | |
| 酶 | 微过氧化物酶 | 直接法或合成法 | 直接底物显色或用酶标抗体+ 底物显色 |
| 碱性磷酸酯酶 | 直接法或合成法 | 同上 | |
| 荧光素 | 罗丹明和FITC | 合成法 | 直接荧光显微镜观察或酶标抗体+ 底物显色 |
| 化学发光标记物 | 化学发光测量或自显影 | ||
| 抗双链单抗 | 酶标或荧光标记单抗 | 化学法 | 直接底物显色 |
| 稀有金属 | Eu3- | 化学法 | 时间分辨荧光 |
| 重金属 | Ag | 化学法 | |
| Hg | 化学法 | ||
| 半抗原 | 磺酸胞嘧啶 | 化学法 | 酶标单抗 + 底物显色 |
| 地高辛 | RPL | 酶标抗体 + 底物显色 |
* :NT:缺口平移; PCR:聚合酶链反应;RPL: 随机引物标记; TL:末端标记
4.非放射发光自显影若将AP或HRP的显色底物根据光化学原理换成一种酶解后产生光子的化合物,可用自显影技术暴光X线片显示。
(1)HRP发光自显影:氨基苯-甲酰肼在HRP与H2O2的作用下氧化为氨基苯二甲酸,同时放出N2及发光(波长428nm)。发光时加入某些酚的衍生物时可增强发光上千倍。反应如下图:
(2)AP的发光自显影:AP的发光底物是金刚烷二氧丁环磷酸盐(AMPPD),它含有磷酸酯键在AP的作用下水解下一个磷酸,进而由分子内过氧键提供能源分解产生金刚酮和激发态的甲基间-氧苯甲酸阴离子,当此阴离子恢复到基态时发出光子。可用波拉黑白片(621型)直接暴光显影。显影信号强度比BCIP/NBP显色法强两上数量级。是很前景的显示体系。
其发光反应的原理如下:
HRP的发光原理:
![]()
AP的发光原理:
![]()
五、核酸分子杂交的类型
随着基因工程研究技术的迅猛发展,新的核酸分子杂交类型和方法在不断涌现和完善。核酸分子杂交可按作用环境大致分为固相杂交和液相杂交两种类型。固相杂交是将参加反应的一条核酸链先固定在固体支持物上,一条反应核酸游离在溶液中。固体支持物有硝酸纤维素滤膜、尼龙膜、乳胶颗粒、磁珠和微孔板等。液相杂交所参加反应的两条核酸链都游离在溶液中。
由于固相杂交后,未杂交的游离片段可容易地漂洗除去,膜上留下的杂交物容易检测和能防止靶DNA自我复性等优点,故该法最为常用。常用的固相杂交类型有:菌落原位杂交、斑点杂交、狭缝杂交、Southern印迹杂交、Northern印迹杂交、组织原位杂交和夹心杂交等。
液相杂交是一种研究最早且操作复合的杂交类型,在过去的30年里虽有时被应用,但总不如固相杂交那样普遍。其主要原因是杂交后过量的未杂交探针在溶液中除去较为困难和误差较高。近几年由于杂交检测技术的不断改进,商业性基因探针诊断盒的实际应用,推动了液相杂交技术的迅速发展。下面对固相杂交和液相杂交分别进行介绍。
(一)固相膜核酸分子杂交方法
固相核酸杂交多是在膜上进行,因此,以下主要介绍固相膜的核酸分子杂交方法:
1.DNA的变性 DNA变性解链是杂交成功的关键。Southern印迹杂交时DNA在凝胶中变性,变性方法是将凝胶浸在数倍体积的1.5mol/l NaCl和0.5mol/l NaOH中1h然后用数倍体积的1mol/l Tris –HCl(Ph8.0)和1.5mol/l NaCl溶液中和1h。DNA受酸、碱、热等处理均能发生变性,但强酸会使核酸降解。一般认为碱变性较好,可避免DNA降解。热变性在要低DNA浓度(100μg/ml)和低盐浓度(0.1mol/l SSC 含15mmol/l NaCl - 1.5mmol/L柠檬酸三钠,pH7.0)下进行。用SSC稀释DNA溶液为50μg/ml,加10mol/l NaOH使最终浓度为0.1mol/L(pH约12.8),室温变性10min,很快置冰盐水中,用10min/l HCl或5mol/l NaH2PO4调pH到7~8[亦可用碱变性后,调至中性,再加热100。c 10min],DNA变怀可用OD260增加(约30%~40%)来检测,变性DNA醇沉淀呈雪样,完全失去纤维状沉淀。变性后加入等量冷的12×SSC,冰浴保存。
2.变性DNA在硝酸纤维素膜上的固定 硝酸纤维素滤膜(孔径0.45μm)先在蒸馏水中充分浸泡,再用6×SSC浸泡30min~2h,凉干。DNA样品转移或加至硝酸纤维素膜上后,先室温干燥4h,然后在80。C真空干燥2h。
3.预杂交 湿润的滤膜放入可加热封口的塑料袋中,按每平方厘米滤膜加0.2ml预热至60。C的预杂交液(6×SSC,0.5%,SDS,5×Denhardt液,100μg/ml鲑鱼精DNA)。鲑鱼精DNA需经过剪切和DNA酶消化处理,然后酒精沉淀纯化,调浓度至10mg/ml,用前放100。C水浴中煮沸变性10min,冰水骤冷。尽可能将袋中气泡赶尽,可封口器将袋口封住。将杂交袋浸入68。C水浴保温3~12h。当预杂交液温度升至68。C时,在滤膜表面常会形成小气泡。轻轻晃动袋中液体即可除去这些小气泡,这一点对于保证滤膜表面充分浸润预杂交液很重要。
4.杂交 从水浴中取出塑料袋,用剪刀剪开一角,尽可能挤净预杂交液。用吸管或大枪头将杂交液加入袋中,用恰好是足量的液体保持滤膜湿润(50μl/cm2)。溶液的组成是6×SSC,0.01mol/l EDTA, 变性的标记核酸探针,5×Denhardt液,0.5%SDS, 100μg/ml变性的鲑鱼精DNA。尽可能赶尽气泡后,将塑料袋严密封口,杂交反应在68℃水浴中进行,所需时间视探针和检测靶DNA的性质及探针的比活性等情况而定,一般4~20h。
5.洗膜 取出塑料袋,用剪刀剪开,小心取出滤膜,立即浸入盛有2×SSC和0.5%SDS溶液的盘中,室温下漂洗5min。再将滤膜移入2×SSC和0.1%SDS溶液中,室温下洗涤15min(轻轻摇动)。然后将滤膜移入0.1×SSC和0.5%SDS溶液中;68℃轻轻摇动保温2h,更换缓冲液后继续保温30min。
洗膜的温度一般应控制在低于Tm值12℃以上。(Tm = 69.3 + 0.41x(G +C) %)。双链DNA的Tm值随错配碱基对数每增加1%而递减1℃。
6.结果显示 非放射性检测方法前已述及,此处主要介绍放射性测定方法。固相膜的放射性杂交结果显示有两种方式,一是放射性自显影法,另一种是液闪计数法。前一种方法比较简单,只需将杂交膜与X光片在暗盒中曝光数小时至数天,再显影、定影即可。对于杂交信号较弱的固相膜,用一块增感屏可显著增强曝光强度。此外,为了减弱32P的散射,曝光通常在-20℃或-80℃下进行。液闪计数法主要用于打点和狭缝杂交及为了比较两个杂交信号的强弱等情形。方法是将完成杂交的膜在漂洗结束后剪成小块(每份样品1块),80℃真空干燥后装闪烁瓶。加入2~5ml闪烁液,剪2~3块无样品膜块作为本底对照。在液体闪烁计数器上自动计数。液体计数测定放射性强度也可在放射自显影之后进行。
(二)固相核酸分子杂交类型
1.菌落原位杂交(Colonyin situ hybridization) 菌落原位杂交是将细菌从培养平板转移到硝酸纤维素滤膜上,然后将滤膜上的菌落裂菌以释出DNA。将NDA烘干固定于膜上与32P标记的探针杂交,放射自显影检测菌落杂交信号,并与平板上的菌落对位。
实验步骤如下:
①将硝酸纤维素滤膜置于含抗生素的平皿琼脂培养基上,用无菌牙签挑取单菌落种于滤膜和主琼脂平板上,排列成方格栅,膜和板上菌落位置相同。
②培养细菌至产生1~2mm大小的菌落。
③在一块平皿中置4张滤纸,用10%SDS浸透,倒掉多余液体。将带有菌落的滤膜取下,轻轻置于滤纸上,菌落面上在,注意防止在滤膜底面存有气泡。
④5min后,将滤膜转至用变性溶液(0.5mol/l NaCl , 0.5mol/L Tris·NaCl)浸湿的滤纸上,放置10min。
⑤将滤膜转至中和溶液(1.5mol/lNaCl , 0.5mol/L Tris·HCl ,pH8.0)浸湿的滤纸上,放置10min。重复中和1次。
⑥将滤膜移至用2×SSPE溶液浸过的滤纸上,放置10min。SSPE配成20×贮备液:3.6mol/l NaCl, 0.2mol/L NaH2PO4(PH7.4), 20mmol/L EDTA(pH7.4)。
⑦将滤膜用滤纸吸干,80℃真空烘干2h。
以下操作参考前述。
2.斑点杂交(Dot blot)斑点杂交法是将被检标本点到膜上,烘烤固定。这种方法耗时短,可做半定量分析,一张膜上可同时检测多个样品。为使点样准确方便,市售有多种多管吸印仪(manifolds),如Minifold I和II、Bio-Dot (Bio –Rad )和Hybri –Dot,它们有许多孔,样品加到孔中,在负压下就会流到膜上呈斑点状或狭缝状,反复冲洗进样孔,取出膜烤干或紫外线照射以固定标本,这时的膜就可以进行杂交。
(1)DAN斑点杂交
①先将膜在水中浸湿,再放到15×SSC中。
②将DNA样品溶于水或TE,煮沸5min,冰中速冷。
③用铅笔在滤膜上标好位置,将DNA点样于膜上。每个样品一般点50μl(2~10μg DNA)。
④将膜烘干,密封保存备用。
(2)RNA斑点杂交:与上法类似,每个样品至多加10μg总RNA(经酚/氯仿或异硫氰酸胍提取纯化)。方法是将RNA溶于5μlDEPC水,加15μl甲醛/SSC缓冲液(10×SSC中含0.15mol/l甲醛)使RNA变性。然后取5~8μl点样于处理好的滤膜上,烘干。
培养细胞,标本处理技术可以简化,不用提取和纯化RNA。方法是用含0.5%Nonidet P40的低渗缓冲液对多种动物细胞作简单处理,离心去掉细胞核和细胞碎片,就得到基本不带DNA而富含RNA的细胞质提取物,这一粗RNA在高盐下用甲醛变性,不需加工直接点到硝酸纤维素膜上。本法可以快速检测大量标本,而只需极少量的细胞(5×104)或组织。
整个RNA实验中,要防止激活内源性RNase,有许多种预防措施,有一种是在样品中加入核糖核苷氧矾基复合物(RVC)。
(3)完整细胞斑点杂交:应用类似检测细菌菌落的方法,可以对细胞培养物的特异序列进行快速检测。将整个细胞点到膜上,经NaOH处理,使DNA暴露、变性和固定,再按常规方法进行杂交与检测。有人曾用此法从105个培养细胞中检测到少至5pg 的Epstein– Barr病毒DNA。完整细胞斑点印迹法可以用于筛选大量标本,因为它是使细胞直接在膜上溶解,所以DNA含量甚至比常用的提取法还高,又不影响与32P标记的探针杂交。但它不适于非放射性标记探针,因为DNA纯度不够,会产生高本底。
3.Southern印迹杂交(southern blot )Southern blot 是研究DNA图谱的基本技术,在遗传诊断DNA图谱分析及PCR产物分析等方面有重要价值。Southern印迹杂交基本方法是将DNA标本用限制性内切酶消化后,经琼脂糖凝胶电泳分离各酶解片段,然后经碱变性,Tris缓冲液中和,高盐下通过毛吸作用将DNA从凝胶中转印至硝酸纤维素滤膜上,烘干固定后即可用于杂交。凝胶中DNA片段的相对位置在DNA片段转移到滤膜的过程中继续保持着。附着在滤膜上的DNA与32P标记的探针杂交,利用放射自显影术确定探针互补的每条DNA带的位置,从而可以确定在众多酶解产物中含某一特定序列的DNA片段的位置和大小。
(1)琼脂糖凝胶电泳:利用琼脂糖凝胶电泳可以很容易地将DNA限制酶消化片段(0.3~25kb)分离开。分离大分子DNA片段(800~12000bp)用低浓度琼脂糖(0.7%),分离小分子片段(500~1000bp)用高浓度琼脂糖(1.0%),300~5000bp的片段则用1.3%的琼脂糖凝胶,根据分离样品量、分离速度和分辨率要求的不同,可选用不同规格的电泳槽。
电泳时,同时将标记物加到旁边孔中,便于确定样品DNA的分子量。20伏恒压电泳过夜。电泳毕,将胶浸到含0.5μg/ml EB的TBE缓冲液中染色30min,也可将EB直接加到电泳缓冲液中或在配胶前加入胶中,在254nm短波透射灯下拍照,加橙黄色滤色镜,使用高速一次成像胶片,光圈f4.5,曝光20~40s。
(2)硝酸纤维素滤膜吸印。
①将胶切成合适大小,切去右上角作为记号。
②将胶放进盛有变性缓冲液(1.5mol/lNaCl, 0.5mol/L NaOH)的盘中轻摇动15min。
③换到中和缓冲液(1mol/LTris·HCl , pH8.0, 1.5mol/L NaCl)中轻摇动30min。
④裁一张硝酸纤维素膜,2~4张3MM滤纸和一些吸印纸(可用卫生纸),都与胶的大小相同(硝酸纤维素膜和吸印纸不能比胶大,否则易形成旁路),先将硝酸纤维素膜浸到水中,再放入10×SSC中,接触胶和硝酸纤维素膜时都要戴橡胶手套操作。
⑤平盘上放一块比胶大的平板(盛胶槽翻过来即可),上面铺一张3MM滤纸,起灯芯作用,盘中加少量10×SSC缓冲液(2.5cm厚),不能没过平板,使3MM滤纸充分饱和。
⑥将胶倒扣到3MM滤纸上。
⑦浸湿的硝酸纤维素铺在胶上,对齐,铺膜时从一边逐渐放下,防止产生气泡,有气泡时,可用吸管赶出,不能让膜与胶下的滤纸直接接触。
⑧膜上放一张3MM滤纸,不能与胶接触。
⑨上面加吸印纸及重物(500g左右)。
⑩通过滤纸的灶芯作用,平盘中的缓冲液就会通过胶上移,从而将DNA吸印到膜上,及时更换浸湿的吸印纸。在室温下转印过夜。
⑾去除上面的东西,用镊了将膜取出,在6×SSC中洗一下(也可不洗)。
⑿自然干燥,80℃烤2h。
⒀这时的膜就可进行杂交,或室温密封保存。
4.Northern印迹杂交(Northern blot) 这是一种将RNA从琼脂糖凝胶中转印到硝酸纤维素膜上的方法。DNA印迹技术由Southern于1975年创建,称为Southern印迹技术。RNA印迹技术正好与DNA相对应,故被趣称为Northern印迹杂交,与此原理相似的蛋白质印迹技术则被称为western blot。Northern印迹杂交的RNA吸印与Southern印迹杂交的DNA吸印方法类似,只是在进样前用甲基氧化汞、乙二醛或甲醛使RNA变性,而不用NaOH,因为它会水解RNA的2’-羟基基团。RNA变性后有利于在转印过程中与硝酸纤维素膜结合,它同样可在高盐中进行转印,但在烘烤前与膜结合得并不牢固,所以在转印后不能用低盐缓冲液洗膜,否则RNA会被洗脱。在胶中不能加EB,因它为影响RNA与硝酸纤维素膜的结合,为测定片段大小,可在同一块胶上加标记物一同电泳,之后将标记物胶切下,上色、照像。样品胶则进行Northern转印,标记物胶上色的方法是在暗室中将其浸在含5μg/ml EB的0.1mol/L 醋酸铵中10min,在水中就可脱色。在紫外光下用一次成像相机拍照时,上色的RNA胶要尽可能少接触紫外光,若接触太多或白炽灯下暴露过久,会使RNA信号降低。从琼脂糖凝胶中分离功能完整的mR-NA时,甲基氢氧化汞是一种强力、可逆变性剂,但是有毒,因而许多人喜用甲醛作为变性剂。所有操作均应避免RNase的污染。
下面介绍RNA甲醛凝胶电泳和吸印方法:
(1)试剂
10×MSE缓冲液:0.2mol/L 吗啉代丙烷磺酸(MOPS),pH7.0, 50mmol/L 醋酸钠,1mmol/l EDTA, pH8.0。
5×样品缓冲液:50%甘油,1mmol/l EDTA, 0.4%溴酚蓝。
甲醛:用水配成37%浓度(12.3mol/L)。应在通风柜中操作,pH高于4.0。
去离子甲酰胺。
50mmol/L NaOH(含10mmol/l NaCl)。
0.1mol/L Tris·HCl,Ph7.5。
(2)步骤
①40ml水中加7g琼脂糖,煮沸溶解,冷却到60℃,加7ml 10×MSE缓冲液、11.5ml甲醛,加水定容 至70ml,混匀后 倒入盛胶槽。
②等胶凝固后,去掉梳子和胶布,将盛胶槽放入1×MSE缓冲液的电泳槽。
③使RNA变性(最多20μg):RNa 4.5μl,10×MSE缓冲液2.0μl,甲醛3.5μl,去离子甲酰胺10.0μl。
④55℃加热15min,冰浴冷却。
⑤加2μl 5×载样缓冲液。
⑥上样,同时加RNA标记物。
⑦60伏电泳过夜。
⑧取出凝胶,水中浸泡2次,每次5min。
⑨室温下将胶浸到50mmol/LNaOH和10mmol/l NaCl中45min,水解高分子RNA,以增强转印。
⑩室温下将胶浸到0.1mol/LTris·HCl (Ph7.5)中45min,使胶中和。
⑾20×SSC洗胶1h。
⑿20×SSC中过夜,转印到硝酸纤维素膜上。
⒀取出硝酸纤维膜,80℃真空烘烤2h。
5.组织原位杂交(Tissuein situ hybridization) 组织原位杂交简称原位杂交,指组织或细胞的原位杂交,它与菌落的原位杂交不同。菌落原位杂交需裂解细菌释出DNA,然后进行杂交。而原位杂交是经适当处理后,使细胞通透性增加,让探针进入细胞内与DNA或RNA杂交。因此原位杂交可以确定探针的互补序列在胞内的空间位置,这一点具有重要的生物学和病理学意义。例如,对致密染色体DNA的原位杂交可用于显示特定的序列的位置;对分裂期间核DNA的杂交可研究特定序列在染色质内的功能排布;与细胞RNA的杂交可精确分析任何一种RNA在细胞中和组织中的分布。此外,原位杂交还是显示细胞亚群分布和动向及病原微生物存在方式和部位的一种重要技术。
用于原位杂交的探针可以是单链或双链DNA,也可以是RNA探针。通常探针的长度以100~400nt为宜,过长则杂交效率减低。最近研究结果表明,寡核苷酸探针(16~30nt)能自由出入细菌和组织细胞壁,杂交效率明显高于长探针。因此,寡核苷酸探针和不对称PCR标记的小DNA探针或体外转录标记的RNA探针是组织原位杂交的优选探针。
探针的标记物可以是放射性同位素,也可以是非放射性生物素和半抗原等。放射性同位素中,3H和35S最为常用。3H标记的探针半衰期长,成像分辨率高,便于定位,缺点是能量低。35S标记探针活性较高,影像分辨率也较好。而32P能量过高,致使产生的影像模糊,不利于确定杂交位点。
原位杂交中,标本的固定条件是影响杂交效率的重要因素,标本组织蛋白质的消化程度对探针进入细胞极为重要。去除蛋白的方法是,用0.2mol/l HCl处理载玻片,用蛋白酶K消化,然后用不同浓度的乙醇脱水,原位杂交还是一种新技术,发展很快,在敏感性、特异性和稳定性上还需要进一步完善和提高(详见二十章 )。
6.固相夹心杂交Dunn等最早介绍了夹心杂交类型,Ranki等又作了进一步的改进。夹心杂交法比直接滤膜杂交法有两个主要的优点:①样品不需要固定,对粗制样品能做出可靠的检测;②用夹心杂交法比直接滤膜杂交法特异性强,因为只有两个杂交物都杂交才能产生可检测的信号。
固相夹心杂交需要两个靠近而不互相重叠的探针,一个作固相吸附探针,另一个作标记检测探针。样品基因组内核酸只有使这两个探针紧密相连才能形成夹心结构。需注意的是两个探针必须分别亚克隆进入两个分离的非同源载体内,以避免产生高的本底信号(如一个克隆人Puc19,另一克隆人pBR322)。
夹心杂交法可用滤膜和小珠固定吸附探针,使用小珠可更好地进行标准化试验和更容易对小量样品进行操作。Dahlen 等利用微孔板进行夹心杂交,可同时进行大量样品检测,他们先吸取DNA探针加到凹板中,然后用紫外线照射使其固定到塑料板上。用微孔板进行夹心杂交还可直接用于PCR技术。应用光敏生物标记探针检测PCR产物的敏感性和用32P标记探针(3×108cpm/μg)作16h放射自显影的Southern杂交的敏感性一样。用微孔板杂交的其它优点还包括同时做多份样品,加样、漂洗和读结果等步骤可以自动化。
7.其它杂交类型
(1)固化探针杂交:该法较少使用,原理是使未标记固化探针通过杂交与靶RNA或DNA结合,漂洗后,用酶标抗DNA:RNA抗体或抗DNA:DNA抗体与杂交物结合。将乳胶颗粒收集,吸附到膜上后漂洗,加入底物显色并进行测定。探针浓度2μg/ml,80℃杂交,可在10~15min完成,检测的敏感性为5×108靶序列。
(2)反向杂交:这个杂交类型是用标记的样品核酸与未标记的固化探针DNA杂交,故称为“反向杂交”。这种杂交方法的优点是在一次杂交反应中,可同时检测样品中几种核酸。这种杂交方式主要用于进行中的核酸转录试验和多种病原微生物的检测。前者是在转录过程中标记RNA探针,后者可用光敏生物素制剂BPA标记样品核酸。
(三)固相膜核酸杂交的几点说明
1.杂交膜的选用杂交膜是一种多孔、表面积很大的固相载体,核酸一旦固定在上面,就可用杂交法进行检测。最常使用的膜是硝酸纤维素膜,用于放射性和非放射笥标记探针都很方便,产生的本底浅,与核酸结合的化学性质不是很清楚,推测为非共价键结合。经80℃烤干2h和杂交处理后,核酸仍不会脱落。硝酸纤维素膜的另一特点是只与蛋白有微弱非特异结合,这在使用非同位素探针中尤为有用。硝酸纤维素膜的缺点是结合核酸能力的大小取决于转印条件和高浓度盐(>10×SSC),与小片段核酸(<200bp)结合不牢,质地脆,不易操作。
尼龙膜在某些方面比硝酸纤维素膜好,它的强度大、耐用,可与小至10bp的片段共价结合。在低离子浓度缓冲液等多种条件下,它们都可与DNA单链或RNA紧密结合,且多数膜不需烧烤。尼龙膜韧性好,可反复处理与杂交,而不丢失被检标本。它通过疏水键和离子键与核酸结合,结合力为350~500μg/cm2,比硝酸纤维素膜(80~100μg/cm2)强许多。尼龙膜的缺点是对蛋白有高亲合力,不宜使用非同位素探针。
2.“噪音”的排除“噪音”(noise)是固相膜杂交方法常遇到的问题,指标记DNA结合到空白膜上的放射性计数,即本底。这个问题的克服一是使用高纯度的核酸制品和充分严格的杂交条件:二是选择合适的杂交反应液和对膜进行处理。研究发现,随着离子强度的增加,空白膜(未固定DNA对照膜)上的“噪音”水平增加,而在50%甲酚胺6×SSC的杂交反应液中充分封闭膜上的多余非特异结合位点。
(四)液相核酸分子杂交类型
1.
(1)HAP吸附杂交:羟基磷灰石(HAP)层析或吸附是液相杂交中最早使用的方法。在液相中杂交后,DNA:DNA杂交双链在低盐条件可特异地吸附到HAP上。通过离心使吸附有核酸双链的HAP沉淀,再用缓冲液离心漂洗几次HAP,然后将HAP置于计数器上进行放射性计数。
(2)亲合吸附杂交:生物素标记DNA探针与溶液中过量的靶RNA杂交,杂交物吸附到酰化亲合素包被的固相支持物(如小球)上,用特异性抗DNA:RNA杂交物的酶标单克隆抗体与固相支持物上的杂交物反应,加入酶显色底物,这个系统可快速(2h)检测RNA。
(3)磁珠吸附杂交:Gen– probe公司最近应用吖啶翁酯(acridinium ester)标记DNA探针,这种试剂可用更敏感的化学发光来检测。探针和靶杂交后,杂交物可特异地吸附在磁化的有孔小珠(阳离子磁化微球体上)。溶液中的磁性小珠可用磁铁吸出,经过简单的漂洗步骤,吸附探针的小珠可用化学发光测定。
2.发光液相杂交
(1)能量传递法:Heller等设计用两个紧接的探针,一个探针的一端用化学发光基团(供体)标记,另一个探针的一端用荧光物质标记,并且这两个探针靠得很近。两个靠得很近的探针用不同的物质标记(标记光发射),当探针与特异的靶杂交后,这些标记物靠得很近。一种标记物发射的光被另一种标记物吸收,并重新发出不同波长的光,调节 检测器使自动记录第二次发射光的波长。只有在两个探针分子靠得近时,才能产生受激发光,因此这种方法具有较好的特异性。
(2)吖啶翁酯标记法:吖啶翁酯标记探针与靶核酸杂交后,未杂交的标记探针分子上的吖啶翁酯可以用专门的方法选择性除去,所以杂交探针的化学发光是与靶核酸的量成比例的。该法的缺点是检测的敏感度低(约1ng的靶核酸),仅适用于检测扩增的靶序列,如rRNA或PCR扩增产物。
3.液相夹心杂交
(1)亲合杂交:在靶核酸存在下,两个探针与靶杂交,形成夹心结构,杂交完成后,杂交物可移到新的管或凹孔中,在其中杂交物上的吸附探针可结合到固相支持物上,而杂交物上的检测探针可产生检测信号。用生物素标记吸附探针,用125I标记检测探针,这个系统的敏感性可检测出4×106靶分子。该试验保持了固相夹心杂交的高度特异性。
(2)采用多组合成探针和化学发光检测:第一类探针是未标记的检测探针和液相吸附探针,它们有50个碱基长,其中含有30个细菌特异序列碱基和20个碱基的单链长尾;第二类探针是固相吸附探针,它可吸附在小珠或微孔板上。未标记检测探针的单链长尾用于结合扩增多个标记探针,液相吸附探针和靶杂交物从溶液中分离并固定在小珠或微板上,典型的试验可用25个不同的检测探针和10个不同的吸附探针。第一个标记检测探针上附着很多酶(碱性磷酸酶或过氧化物酶)可实现未标记检测探针的扩增。使用化学发光酶的底物比用显色反应酶的底物更敏感。这个杂交方法已用于乙肝病毒、沙眼衣原体、淋球菌以及质粒抗性的检测,敏感性达到能检测5×104双链DNA分子。
4.复性速率液相分子杂交这个方法的原理是细菌等原核生物的基因组DNA通常不包含重复顺序。它们在液相中复性(杂交)时,同源DNA比异源DNA的复性速度要快。同源程度越高,复性速率和杂交率越快。利用这个特点,可以通过分光光度计直接测定变性DNA在一定条件下的复性速率,进而用理论推导的数学公式来计算DNA-DNA之间的杂交(结合)度。
六、核酸分子杂交实验因素的优化
(一)探针的选择
根据不同的杂交实验要求,应选择不同的核酸探针。在大多数情况下,可以选择克隆的DNA或cDNA双链探针。但是在有些情况下,必须选用其它类型的探针如寡核苷酸探针和RNA探针。例如,在检测靶序列上的单个碱基改变时应选用寡核苷酸探针,在检测单链靶序列时应选用与其互补的DNA单链探针(通过克隆人M13噬菌体DNA获得)或RNA探针,寡核苷酸探针也可。长的双链DNA探针特异性较强,适宜检测复杂的靶核苷酸序列和病原体,但不适宜于组织原位杂交,因为它不易透过细胞膜进入胞内或核内。在这种情况下,寡核苷酸探针和短的PCR标记探针(80~150bp)具有较大的优越性。
在选用探针时经常会受到可利用探针种类的限制。如在建立DNA文库时,手头没有筛选特定基因的克隆探针,这时就可用寡核苷酸探针来代替。但必须首先纯化该基因的编码蛋白,并测定6个以上的末端氨基酸序列,通过反推的核苷酸序列合成一套寡核苷酸探针。如果已有其它动物的同种基因克隆,因为人类和动物间在同一基因的核苷酸顺序上存在较高的同源性,因此可利用已鉴定的动物基因作探针来筛选人类基因克隆。对于基因核苷酸序列背景清楚而无法获得克隆探针时,可采用PCR方法扩增某段基因序列,并克隆人合适的质粒载体中,即可得到自己的探针。这种方法十分简便,无论基因组DNA探针还是cDNA探针都可以容易地获得,而且,可以建立PCR的基因检测方法,与探针杂交方法可作对比,可谓一举两得。
(二)探针的标记方法
在选择探针类型的同时,还需要选择标记方法。探针的标记方法很多,选择什么标记方法主要视个人的习惯和可利用条件而定。但在选择标记方法时,还应考虑实验的要求,如灵敏度和显示方法等。一般认为放射性探针比非放射性探针的灵敏度高。放射性探针的实际灵敏度不依赖于所采用的标记方法,如随机引物延伸法往往得到比缺口平移法更高的比活性。在检测单拷贝基因序列时,应选用标记效率高、显示灵敏的探针标记方法。在对灵敏要求不高时,可采用保存时间长的生物素探针技术和比较稳定的碱性磷酸酶显示系统。
(三)探针的浓度
总的来说,随探针浓度增加,杂交率也增加。另外,在较窄的范围内,随探针浓度增加,敏感性增加。依我们的经验,要获得较满意的敏感性,膜杂交中32P标记探针与非放射性标记探针的用量分别为5~10ng/ml和25~1000ng/ml,而原位杂交中,无论应用何种标记探针,其用量均为0.5~5.0μg/ml。探针的任何内在物理特性均不影响其使用浓度,但受不同类型标记物的固相支持物的非特异结合特性的影响。
(四)杂交率
传统杂交率分析主要用于DNA复性研究,在这种情况下,探针和靶链在溶液中的浓度相同。现代杂交实验无论在液相杂交还是固相杂交均在探针过剩的条件下进行,此外,固相杂交中靶序列不在液相,故其浓度不能精确计算。因此,本文不讨论通常用于杂交反应的传统二级速率公式,而叙述一级动力学公式。
在探针过量的条件下,杂交率主要依赖于探针长度(复杂度)和探针浓度。下面列出的公式适用于过剩单链探针对靶序列杂交的情形,双链探针开始时(1~4h),杂交动力学相同,但长时间杂交后,由于探针本身的复性,可用于杂交的探针浓度会逐渐降低。公式(1)可用于估计半数探针与固定靶序列杂交所需的时间。
t1/2=ln2/kc
t=保温(杂交)时间(s);k =形成杂交体的速率常数[mol/(Lxntxs)];c =溶液中的探针浓度(mol/L)。速率常数K决定于探针长度(L)、探针复杂度(N)、温度、离子强度、粘度和pH。不含重复序列的探针,l =N。例如,对一个含两个20nt序列的40mer探针而言,l=40,N=20。K与这些变量的关系为:
Kn= 3.5×105K=KnL0.5/N (2)
Kn是缔结常数,Kn =3.5×105。Na+浓度为0.4~1.0mol/L, Ph5~9和杂交温度低于探针-靶序列杂交体Tm值2.5℃时,公式(1)和(2)可合并为(3),用于计算半数探针与靶序列的杂交率(以秒计)。

对一个长500个碱基的探针而言,此值为:
![]()
长500个碱基的探针杂交时间很长(20h),应用短探针和使用杂交促进剂有其优越性。由于实际应用的探针长度变化较大(对>1kb的探针,因扩散与粘度效应不可能使因素L得到合适的补偿)。另外,固靶序列也不可能都用于杂交,所以,由公式预计的随探针长度增加的杂交率不一定总是正确的。
(五)杂交最适温度
杂交技术最重要的因素之一是选择最适的杂交反应温度。若反应温度低于Tm 10~15℃,碱基顺序高度同源的互补链可形成稳定的双链,错配对减少。若反应温度再低(Tm-30℃),虽然互补链之间也可形成稳定的双链,但互补碱基配对减少,错配对增多、氢键结合的更弱。如两个同源性在50%左右或更低些的DNA,调整杂交温度可使它们之间的杂交率变化10倍,因此在实验前必须首先确定杂交温度。通常有三种温度可供试验,即最适复性温度、苛刻复性温度及非苛刻复性温度。温度的选择及温度对杂交的影响见表18-3。最适复性温度(Optimunm renaturationtemperature, TOR):Tor =Tm –25℃
苛刻复性温度:Ts = Tm – (10或15℃)
非苛刻复性温度:Tns =Tm – (30或35℃)
在2×SSC反应液中,可以根据下列公式计算最适复性温度:TOr =0.51 (G+C%)+47℃。
表18-4 DNA—DNA杂交温度的选择范围(2×SSC)
| DNA中G+C mol% | 杂交反应温度(℃) | ||
| TOR | Ts | Tns | |
| 30 | 62.3 | 73.3 | 52.3 |
| 35 | 64.9 | 74.9 | 54.9 |
| 40 | 67.4 | 77.4 | 57.4 |
| 45 | 70.0 | 80.0 | 60.0 |
| 50 | 72.5 | 82.5 | 62.5 |
| 55 | 75.1 | 85.1 | 65.1 |
| 60 | 77.6 | 87.6 | 67.6 |
| 65 | 80.2 | 90.2 | 70.2 |
| 70 | 82.7 | 92.2 | 72.7 |
| 75 | 85.3 | 95.3 | 75.3 |
可以看出DNA复性和DNa–RNA, DNA-DNA杂交通常要在高温反应条件下进行,其反应的最大速度是在低于Tm值约25℃。然而对于那些反应时间需要延长,或对生物活性必须保护的复杂生物的核酸研究(如哺乳动物),核酸长时间处于高温下很显然是不利的。这会引起核酸链的断裂、胶嘌呤的作用,结合到膜上的DNA脱落也会增多。这个问题可以通过使用高浓度盐溶液(如6.2mol/l NaCl),或使用某些有机溶剂的水溶液降低反应温度来解决。常使用的有机溶剂有两类,甲酰胺和二甲亚砜(DMSO)。在杂交液中加入30%二甲亚砜可使T2噬菌体DNA的Tm值比原先降低14℃,而使用酰胺甚至可使DNA在室温下变性和复性。Mc-Conaughy等发现,反应液中每增加1%的甲酰胺浓度,Tm值可降低0.72℃。
现在认为,适当选择甲酰胺和盐水浓度及合适的反应温度,可使DNA复性和DNA-RNA杂交获得高特异性和更快的反应速度。
(六)杂交的严格性
影响杂交体稳定性的因素决定着杂交条件的严格性。一般认为在低于杂交体Tm值25℃时杂交最佳,所以首先要根据公式(4)计算杂交体Tm 值。由此式可见,通过调节 盐浓度、甲酰胺浓度和杂交温度来控制所需的严格性。对用20个碱基以上的探针做DNA:DNA杂交的Tm值计算如下:
![]()
n =杂交体中最短链的长度,因此,对一个G+C为42%的500个碱基探针于5×SSC(0.75mol/l Na+)和50%甲酰胺杂交的Tm 值为:
T=81.5 +(-2.07)+ 17.22 –1 –(30.5)=65℃
T杂交 =65℃–25℃=40℃
影响TM值的其它因素:
(1)对克隆或合成探针而言,同源性每下降1%,Tm值就降低1.5℃,15~50个碱基的寡核苷酸探针的这种作用更明显。
(2)RNA:DNA杂交体的Tm值较同样的DNA:DNA杂交体的高10~15℃。
(3)RNA:RNA杂交体的Tm值较同样的DNA:DNA杂交体的高20~25℃。
显然,当用RNA为靶序列时,要使用甲酰胺来降低Tm 值以保证合适的杂交温度。当以克隆的探针进行膜杂交时,在最后的漂洗步骤中应达到最严格的条件。对一个500个碱基探针而言,典型最终漂洗条件点0.1×SSC(0.015mol/l Na+),55℃。代入公式(4)可得:
Tm =81.5 (-30.3) +17.22 –1-0 =67℃
67℃-55℃=12℃
因此,较Tm低12℃的漂洗条件比Tm 低25℃的杂交相比条件更严格了。
对寡核苷核探针而言,杂交温度往往低于Tm5℃,因此,对一个G+C为50%的30nt寡核苷酸探针来说,Tm 值为:

T杂交=55℃-5℃=50℃
下面一个经典的公式适用于14-20个碱基的寡核苷酸探针:
Tm =4℃(g + C) +2℃(a + T)
在实际应用中,寡核苷酸探针的最佳杂交温度必须精确确定。最方便的一种方法是制备一张含不同稀释度靶DNA和非特异靶DNA(如鱼精或大肠杆菌DNA)的膜。在不同温度下使膜与探针杂交,特异靶序列结合探针信号很强,而非特异靶序列与探针无任何反应的温度就是最适温度,在某些条件下,可用二甲亚砜(DMSO)代替甲酰胺来降低Tm值。
用一个以上的探针的(如夹心杂交)杂交系统中,估计Tm值更加复杂。可用上述公式估计每一探针的Tm 值。然后求其均值作为杂交温度。
(七)杂交反应时间
在条件都得到满足的情况下,杂交的成败就取决于保温时间。时间短了,杂交反应不完成;时间长了也无益,会引起非特异结合增多。一般杂交反应要进行20h左右。1966年Britten和Kohne推荐用Cot =值来计算杂交反应时间。Cot 值实际上是杂交液中单链起始浓度(Co)和反应时间(t)的乘积。实验表明Cot =100时,杂交反应基本完成。Cot=0,基本上没有 杂交。例如在液相杂交中未标记的DNa 400μg/ml(按单股DNA每微克 紫外吸收值为0.024计算,总的吸收值为9.6),如果反应时间为21h,那么对于未标记的DNA来说,Cot =9.6/21 =100.8, 杂交完成了。对标记Dn A(浓度为0.1μg/ml)来说Cot值为0.05,这就充分排除了标记DNA的自我复性。
(八)杂交促进剂
惰性多聚体可用来促进250个碱基以上的探针的杂交率。对单链探针可增加3倍,而对双链探针、随机剪切或随机引物标记的探针可增加高达100倍。而短探针不需用促进剂,因其复杂度低和分子量小,短探针本身的杂交率就高。
硫酸葡聚糖是一种广泛用于较长双链探针杂交的促进剂。这是一种多聚胺,平均分子量为500000。另一种常见的促进剂是聚乙二醇(PEG),PEG分子量小(6000~8000)、粘度低、价格低廉,但它不能完成取代硫酸葡聚糖。在某些条件下5%~10%硫酸葡聚糖效果较好,若用5%~10%PEG则可产生很高的本底。因此,使用促进剂时有必要优化条件。另一种多聚体促进剂是聚丙烯酸,用其钠盐,浓度为2%~4%。与硫酸葡聚糖相比,其优点是价格低廉,粘度低(MW=90000)。
小分子化学试剂酚和硫氰酸胍也能促进杂交,它们可能是通过增加水的疏水性和降低双链和单链DNA间的能量差异而发挥作用。酚作为杂交促进剂,只能在低DNA浓度的液相杂交中观察到,该方法曾被称为酚乳化复性技术,该法不能用于固相杂交,因酚可引起核酸与膜的非特异吸附作用,即使在液相杂交中的应用也是有限的。而硫氰酸胍可通过降低双链DNA的Tm值而起作用。此外,该分子还可以促进RNA的杂交,有裂解细胞而抑制RNase的作用。总之,硫酸葡聚糖和聚乙二醇因能用于固相杂交是目前最常用的杂交促进剂。
第四节 石蜡包埋组织的DNA提取及其应用
近10年来,现代分子生物学技术越来越广泛地被用于人类疾病研究的诸领域,为了解病理状态下基因组DNA的变化积累了新资料。目前认为,人类基因组并非人们想象的那样稳定,诸如基因重排、扩增、缺失,突变和DNA甲基化类型改变等时有发生,这些改变对于基因表达和调控,以及疾病过程的发展与转归等方面均具有重要意义。
医院病理科档案中积存的大量石蜡包埋组织,是一个可靠的分子生物学研究的材料来源。在石蜡切片上进行原位杂交或原位PCR分析的分子生物学方法,是免疫细胞化学技术的重要延伸。通过对DNA或mRNA分析亦可直接证实或补充免疫细胞化学的发现。这些对形态学家较为熟悉的原位分子生物学技术,本节 不再赘述。Goelz(1985)和Dubeau 等(1986)成功地从蜡块中提取出高质量的DNA,完全可以满足某些肿瘤分子生物学研究的需要,结束了DNA研究依赖于新鲜或冰冻组织和细胞的历史,而且可以广泛地应用于大宗病例的回顾性研究,对肿瘤发生的分子机制的探讨,诊断与鉴别诊断研究和患者预后评估等方面均具有重要价值。本节 重点讨论石蜡包埋组织DNA提取的方法学及其潜在的应用前景。
一、石蜡包埋组织DNA提取的基本方法
从石蜡包埋组织中提取DNA的基本步骤,是在常规DNA提取方法的基础上改良和演变而来。Goelz等(1985)最先提出的石蜡包埋组织DNA提取技术(表18-5),是用机械的方法破碎组织,切除多余的石蜡,直接进入含SDS和高浓度蛋白酶K(1mg/ml)的提取缓冲液加温孵育,然后进行苯酚和氯仿抽提。所得DNA虽不完整,但可被限制性内切酶切割,因而适于点杂交,印迹杂交等多种分子生物学实验。Dubeau等(1986)在上述方法上作了改进。首先通过组织切片用二甲苯脱蜡,保证了组织的完全破碎,使细胞与消化液充分接触,使DNA释放和蛋白去除更加完全;其次通过两步消化的方法,将不适于做分子杂交的降解的DNA小片段去除,仅保留那些可螺旋化的完整的DNA大分子,从而提高了DNA质量,适于做Southern印迹杂交分析。Moerkerk等(1990)对上述两种方法进行了比较,发现两种方法所取得DNA之点杂交结果一致,非螺旋化DNA亦不影响杂交分析。
表18-5 Gpelz氏DNA提取方法的主要步骤
| 1.切除多余石蜡,暴露组织 |
| 2.将组织切碎(最大径<0.5mm),称重; |
| 3.溶于TE9提取液(组织<50mg/5ml,50~500mg/10ml),高速混悬2~3min;于48℃放置24h,其制备见表18-6; |
| 4.再次混悬组织,加入蛋白酶K至终浓度1mg/ml,SDS至2%,孵育40h; |
| 5.用等体积酚-氯仿溶液抽提3次; |
| 6.2.5倍体积乙醇沉淀DNA |
| 7.-70℃放置2~4h |
| 8.9000×g离心1h |
| 9.沉淀物用70%乙醇洗1次 |
| 10.干燥,TE(pH7.2)溶解。 |
表18-6 TE9 DNA提取液的制备
| 500mmol/L | Tris |
| 20mmol/L | EDTA |
| 10mmoo/L | NaCl |
| 1% | SDS |
| 500μg/ml | 蛋白酶K |
| PH8.0 |
5μm组织切片
↓
常规脱蜡、水化
↓
第一次溶液A孵育(去上清)
↓
第二次溶液A孵育(留上清)
↓
氯仿-异戊醇抽提
↓
RNA酶和蛋白酶消化
↓
酚抽提
↓
沉淀
↓
(却除未螺旋化DNA)↓
透析
图18-6 石蜡包埋组织DNA提取流程(Drbeau等,1986)
溶液A
| 2×SSC |
| 100μg 蛋白酶K/ml |
| 1% SDS |
不同类型的基因分析所要求的DNA质量长数量不同。Southern印迹杂交分析需要10~15μg大片段DNA(>20kb),因为杂交前要进行相应的限制性内切酶消化和凝胶分离不同片段长度的DNA。故DNA提取要求高,小片段DNA存在会直接影响杂交信号。与之相反,多聚酶链反应(PCR)则可在相对粗制的小片段DNA样本上进行,分析所需的DNA很少,0.5μg甚至更少即可。PCR的模板DNA制备方法很多,除上述两种方法外,还有更简便的直接水煮法(Sle-bos,et al, 1990;Smit, et al. 1988)、蛋白酶消化法(Impraim et al. 1987;Brice, et al. 1989)。这些方法不经过酚-氯仿-异戊醇抽提、DNA纯化等步骤,直接将组织放在去离子水中煮沸10min或在蛋白酶K缓冲液中消化4h,DNA即可释放出来。此提取物可直接用作模板,进行PCR扩增,但是,我们发现直接水煮法和蛋白酶消化法提取的DNA,扩增率较低,且重复性不好。这可能是由于DNA附着的蛋白质去除不净而影响DNA变性和引物的结合,亦可能是由于标本中残留的固定剂等成分对Taq DNA多聚酶的抑制所致。
二、影响DNA提取质量的因素
1.固定剂对DNA的影响固定剂的类型直接影响提取DNA的质量。目前大多数实验室常用的中性缓冲福尔马林固定的标本,DNA保存完好,可以获得高分子量DNA。Warford等(1988)对甲醛固定过程中DNA变化进行了观察,发现核酸对甲醛反应性可分为两个阶段:①早期出现碱基快速可逆性羟甲基化;②数天后碱基对间核酸与蛋白间缓慢地形成亚甲基交联。DNA提取过程中的蛋白酶K消化,酚/氯仿抽提和纯化等步骤,可以消除由于固定所造成的DNA某些理化性质改变。
bramwell等(1988)发现,甲醛和戊二醛固定可使得DNA产量降低,醋酸甲醇(MAA)可导致DNA明显降解。Michel’s运输保存液或PBS存放组织虽提取DNA纯度高,但产量明显降低。Dubeau等也观察到含苦味酸(Bouin氏液)和含氯化汞的固定液(Zenker,Bs)处理标本不能获得完整的DNA。
乙醇被认为是保存核酸的最佳固定剂。Wu等(1990)用无水乙醇固定标本48h,最长达2年,均可得到中量的高分子DNA。每mm3乙醇固定标本平均DNA产量为26.6μg,高于新鲜标本(19.4μg/mm3)。经限制性内切酶消化后,乙醇固定组织DNA均显示由于重复DNA序列存在所产生的特征性卫星带,说明DNA被完成消化。Southern印迹杂交结果与冰冻组织一致。
Sato 等(1990)用AMex方法处理组织,既可保存许多抗原成分,亦可使大分子量DNA完好无损。其基本方法为:将组织放至4℃丙酮浸透,移至-20℃过夜。然而再用丙酮分别在4℃和室温脱水各15min,苯甲酸透明两次,每次15min,最后60℃真空浸蜡2~3h,石蜡包埋。结果显示,每10mg AMex法处理的湿重组织提高分子量DNA71.4±14.53μg,与新鲜组织产量相当(70.4±13.76μg)。酶切、电泳和杂交反应亦相同于新鲜组织。提示AMex法是一种多用途组织处理技术,可以克服由于DNA降解、高分子量DNA减少和内切酶不完全消化所产生的电泳类型改变,是一种理想的DNA保存方法,特别适用于对形态学、免疫表型和基因改变的相关性分析。
2.固定时间对DNA的影响固定过程中所发生的组织反应至今尚未被完全更理解,虽然理论上讲室温下福尔马林与DNA几乎不发生反应,但已发现碱基与组蛋白之间的甲基交联。这种福尔马林介导的甲基化直接影响DNA提取的效率。如果事实果真如此,那么固定的时间是一个重要的变异因素。然而,Goelz等没有发现固定时间对DNA提取质量的明显影响。Dubeau等认为组织固定时间太短或太长均会导致DNA的降解。该作者对固定12h到5天不同时间间隔标本的DNA提取显示,随着固定时间的延长,可螺旋化(Spoolable)的高分子量DNA明显减少。固定5天后可螺旋化DNA提取率仅有8%。Warford等也发现单细胞悬液经30min福尔马林固定后,DNA产量减少到30%,由此可见,不同标本对不同固定剂所需的最佳固定时间应摸索选定。根据Dubeau等经验,常规组织固定应在12h以上至110之内。
3.固定温度等其他因素对DNA的影响核酸与固定剂的反应由反应成分、浓度、酸硷度以及温度等因素的调节 ,其中温度效应显得特别重要。室温下DNA双股螺旋链表现为两条由氢键连接在互补多聚核苷酸;加热到65℃时,氢键开始断裂;约90℃时,产生两条单链分子。在此变性状态下,甲醛与酸反应很快,通过羟甲基化作用可抑制DNA冷却后的再复性。
最近,Koshiba等发现福尔马林固定过程中的DNA降解,是由于固定温度高,pH低以及甲酸的存在所致。通过应用缓冲福尔马林和低温下固定(4℃),可以明显改善DNA保存。
酸性环境中DNA的降解已有过深入的研究。一般认为,强酸可导致DNA的完全解聚,而弱酸也能引起一些结构的改变。当pH达到2.5以下时,几乎所有的碱基之间氢键解离,使DNA双链断裂而产生不可逆的变性;随后出现N-糖苷键水解,使嘌呤残基游离;最后,多聚核苷之磷酯键缓慢水解,仅残留具有完整嘧啶的多聚脱氧核糖短臂。上述改变亦受温度或离子强度的影响。加入盐或降低温度可稳定氢键,因而可防止酸性条件下的DNA变性。然而,即使福尔马林被氢氧化钠中和,在室温下DNA亦发生降解,提示福尔马林本身即可降解DNA。福尔马林中DNA降解的机理及其预防有待于进一步研究。
4.组织处理过程对DNA的影响我们发现,从常规组织处理的蜡块中提取的DNA,其大部分分子量在100bp~1000bp之间,主要分布于100~1500bp,仅约1/3的组织所提取DNA>20kb。这除与固定剂、固定时间等因素有关外,可能的原因还有:①组织从外科切除到固定之间的时间长短不一。当组织未固定或固定不充分时,核酸酶可自由作用;②不同肿瘤中核酸酶的水平不一,其在固定前或固定后均不发挥作用;③蜡块贮存的时间长短不一。虽然从不同贮存时间的蜡块中提取的DNA大小无绝对区别,但新近的蜡块比贮存10年以上的标本所获得的DNA分子量大。可能蜡块中仍存在导致DNA降解的因素。
组织的浸蜡和包埋温度过高或时间过长,均可导致DNA变性,而产生单链DNA片段。单链DNA不能被限制性内切酶所消化,可导致电泳时泳动速率变慢。
三、提高DNA提取质量的方法
1.蜡块的选择从福尔马林固定的组织标本中未能提出完整的高分子量DNA的重要原因之一,是应用了固定不充分的组织。因此,在DNA提取前应检查组织切片。如果有自溶、退变或组织结构不清,大片出血等改变的蜡块不能用;若有明显坏死存在的蜡块,最好不用或将坏死部分切去后再用。尽可能地选用新近标本,缓冲福尔马林、丙酮和乙醇固定者最佳。
2.DNA提取方法学的改善为了提高石蜡包埋组织DNA提取的质量和效益,人们从不同方面进行了探索。其中在DNA提取液的改良,蛋白酶的消化时间和DNA纯化等问题上取得了进展。①DNA提取液主要含SDS和蛋白酶K的TE缓冲液。固定和包埋组织由于化学修饰作用,使得DAN与蛋白质不易分离。因此,必须增加SDS和蛋白酶K的浓度和作用时间:SDS可增至1%~2%,蛋白酶K200~500μg/ml,最高可达1mg/ml;作用时间一般为2~4天,最长可达7天。蛋白酶K可分次加入,并注意不时震摇,使酶与组织充分接触。Koshiba等发现,利用Goelz等和Dubeau等提出的DNA提取方法,不能够得到令人满意的完整DNA。尿素和胍(guanidine)是DNA自然和人工交联最有力的剥脱剂,2-巯基乙醇可干扰二硫键,促进蛋白变性。作者对DNA提取液进行了改良,加入高浓度(4mol/L)尿素和2-巯基乙醇。应用此缓冲液,有效地从包埋组织中获得高质量DNA。②DNA释放率对于不同的组织类型是有差异的,取决于组织细胞密度和细胞外间质的多少。对于细胞丰富、含有很少间质的组织(例如脾脏),通过24h孵育80%以上DNA可释放出来;相同量的DNA释放对于富含致密间质的子宫肌瘤则需要6天时间;转移性畸胎瘤含中等细胞密度和疏松的间质,DNA释放率亦为中等。由此可见,对不同类型的组织DNA提取,蛋白酶K的孵育时间可作适当调整,以求最大量地获取大分子DNA。此外,对于Dubeau等提出的DNA提取过程中分次消化步骤的必要性,也有人提出异议。因为低、中分子量的核酸存在对限制性内切酶的消化和杂交不起作用。③Dubeau等发现,不适于进行酶切反应和杂交研究的化学修饰的DNA,可通过搅起完整的DNA而被动除去,因而强调了螺旋化(spooling)在DNA纯化中的重要性。该作者还发现延长组织固定时间的影响之一就是减少了可螺旋化DNA的量,杂交分析显示,螺旋化DNA杂交信号强,而未螺旋化DNA信号减弱。因此,增加DNA螺旋化可提高提取DNA质量和杂交效率。但是,Moerkert 等认为未螺旋化DNA不影响进行点杂交分析。
3.避免DNA机械性损伤福尔马林固定和石蜡包埋使组织变得坚韧,很难达到匀浆的效果。经常的做法是将组织切成3~5μm薄片,使每一细胞都被切开。但是,我们认为切片太薄,容易过多地将DNA切断,影响高分子量DNA的获得率。最好是采用15~20μm的厚切片。高浓度蛋白酶K消化2~4天,使能达到细胞充分破碎、蛋白充分消化的目的。并尽可能避免机械性匀浆过程造成的DNA剪切。
此外,在NDA释放出来以后的提取过程中,应尽可能轻柔操作,避免过多地移管。若必需移管时应选用大口吸管。尽可能避免人为的DNA剪切。纯化DNA用TE(pH8.0)溶解放4℃保存即可,若短期不用时应-20℃冻存,但切忌反复冻融,以免DNA降解。
四、石蜡包埋组织DNA分析的方法学
由于DNA提取方法的改善和DNA质量的提高,几乎所有基因分析的技术均可用于石蜡包埋组织,但目前分子病理学研究的常用方法是点杂交、Southern印迹杂交和多聚酶链反应(PCR)。
1.点杂交鉴于包埋组织DNA有一定程度的降解,因而点杂交被认为是一种简便、快速和实用的方法,特别适用于较大样本的筛选。Dyall – smith等(1988)采用未经抽提的蛋白酶消化产物直接点膜,进行点杂交分析,在3周内对200多病例进行筛选,对阳性病例和很难解释的弱阳性斑点,再进行原位杂交等方法作进一步证实。
2.Southern印迹杂交Southern印迹杂交是经典的基因分析技术,已被广泛地用于基因突变,扩增、重排和丢失等许多方面的研究。石蜡包埋组织的Southern印迹杂交分析有以下几个方面值得注意:
(1)当所分析的酶切片段长为300~500bp时,包埋组织DNA杂交信号强度只有相同量标准DNA的10%~85%。信号强度与原始DNA大小呈正相关,最小片段DNA产生最弱的信号。
(2)包埋组织DNA所致的非特异性背景杂交比标准DNA为明显。这种背景杂交的产生可能是由于不包含到分析基因中两个限制性内切酶识别位点的小片段DNA存在。
(3)由于背景杂交明显使得信号模糊,信/噪比缩小。根据Goelz的经验,约有25%石蜡包埋组织不适于作Southern印迹杂交。
(4)某些限制性酶切片段的电泳速度比标准DNA稍迟缓。可能的原因是DNA直接或间接的化学改变使某些限制性酶切位点失活和/或单链DNA存在。
(5)由于小片段DNA的存在,故用作杂交分析的DNA量应适当增加,以增强杂交信号。
3.PCR分析PCR技术是近年来分子生物学技术的典范,已被广泛地用于分子病理学的各个领域。此技术不但特异性好和敏感性高,而且简便、快速、模板DNA要求不高,特别适于石蜡包埋DNA的分析。
用于PCR扩增的DNA提取比较简单,既使少量DNA样品亦能产生大量特异性DNA拷贝。已被成功地用于各代木乃伊DNA的分析,小至1mm2的HE染色切片提取的DNA亦可获得满意的扩增,并可用于诊断。但是,为了提高PCR的敏感性和可重复性,模板DNA应尽可能地纯化,除去提取物中某些抑制PCR反应的成份。
此外,切片过程中要注意防止污染,以免出现假阳性。
最近,Davis等(1993)对PCR产物进行单链构型多态性(SSCP)分析,可以提高PCR敏感性5倍以上。SSCP分析是应用单链DNA在非变性聚丙酰胺凝胶上电泳,根据序列的不同所产生的构型差异来分析PCr 产物。此分析能检测出小到一个碱基的差异,因而可被广泛地用于研究点突变和基因多态性。
此外,在包埋组织的DNA提取中往往发现有RNA的存在。这些未加任何保护而免受降解的RNA,不可能是完整的序列。然而,此发现提示用福尔马林固定的组织亦可作为Northern印迹杂交分析的可能材料来源。
五、分子病理学研究中的应用
1.基因重排分析与淋巴瘤的诊断分子生物学技术在肿瘤诊断中的应用,目前仅限于淋巴瘤/白血病。淋巴瘤以具有特异性抗原受体基因重排的单一性细胞增殖为特征。因此,克隆性免疫球蛋白(Ig)和T-细胞受体(TCR)基因重排的检出可作为淋巴瘤诊断的重要指标,这在国外许多实验室已成为常规诊断技术。
Southern印迹杂交和PCR都已被成功地用于基因重排分析。此技术在下列病变的诊断和鉴别诊断中特别有意义:①恶性淋巴瘤与反应性淋巴组织增生的鉴别。后者为多克隆性细胞增生,不能检出或扩增出克隆性基因重排序列;②T和B细胞性肿瘤的区分:PCRβ基因重排支持T细胞源性,而Ig重链基因则为B细胞源性。然而,一部分病例显示Ig和TCR基因双重排。在这种情况下,要结合其他基因分析。若同时伴有Ig轻链(K或人)基因重排则支持B细胞肿瘤;同时伴有TCRr或TCRs基因重排则为T细胞肿瘤。另外,也可结合免疫分型。双基因重排的肿瘤往往一种基因为不完全重排、不伴有相应的抗原受体表达,故免疫表型上往往是单一的。③T细胞性淋巴瘤的诊断,T细胞肿瘤形态变化多端、免疫表型上无克隆性标记,故对此类淋巴瘤均有必要进行基因分型。④T细胞优势性B细胞淋巴瘤。这种肿瘤在形态和免疫表型上很难建立诊断。⑤残留病变监测和复发的早期诊断。此技术还可用于识别骨髓的累及、治疗或骨髓移植后残余病变的检测,以及形态学上不能察觉的早期复发的诊断。
某些淋巴瘤/白血病所伴有的特异性染色体易位是另一种类型的基因重排标记。例如滤泡型淋巴瘤中常出现的t(14:18)易位,Burkitt氏淋巴瘤的t(8:14)、t(8:2)和t(8:22)易位,以及慢粒或急淋白血病中常见的t(9:33)易位。因上述基因重排在淋巴瘤中出现频率不高,故诊断应用价值不大。
2.癌基因与抗癌基因的研究分子生物学在肿瘤病理学中另一热点是癌基因和抗癌基因的研究。自从1981年Weinberg 等首先报道人癌基因分离成功以来,至今已有50多种癌基因被发现,这些基因普遍存在于各种生物细胞中,对于细胞的生长和分化起着重要作用。在正常情况下,其表达受到严格调控;病理状态下,癌基因活化,表达失控,使细胞原有的正常生物学性状发生改变,从而导致细胞癌变。据报道,癌基因的结构和功能改变见于造血系统、乳腺、粘膜鳞状上皮、前列腺、肺、肾、消化道、膀胱、卵巢、消化腺、神经系统和软组织等肿瘤。
另一类基因称抗癌基因或抑癌基因,现已发现的有p53、Rb、DCC、WT1和NF1等。其蛋白产物的功能是阻滞癌基因所编码多肽的活性。因此,如果抗癌基因发生突变或功能丧失,异常的癌基因产物表达失控,而诱发细胞转化为肿瘤。此现象为见于视网膜母细胞瘤、子宫内膜、结肠、食管等各部位的肿瘤。
目前,对人类肿瘤中癌基因和抗癌基因的检测,已经在肿瘤的分类、发病机理、肿瘤生物学行为和预后的关系等方面与肿瘤临床密切结合起来,并正在逐渐地应用于肿瘤的诊断、鉴别诊断和治疗。
(1)癌变机理的研究:癌基因活化和抗癌基因失活在人类肿瘤的发生发展过程中起重要作用。已有大量证据表明,至少需要两种以上的癌基因活化的协同作用才能使正常细胞发生恶性转化。目前研究发现绝大多数肿瘤有一种以上的癌基因过度表达,一种癌基因对靶细胞的永生化起重要作用,而另一种则促进细胞的永生化。
(2)肿瘤生物学待业和预后的研究:某些癌基因突变及其产物的过度表达与癌细胞的分化和恶性程度有关。目前研究最多的是c –erbB –2与乳腺癌的关系。许良中等(1992)发现,浸润性导管癌中c – erbB –2阳性表达率达67%以上,单纯癌阳性率为26.5%,而全部乳癌良性病变皆阴性。我们的研究发现,c –erbB –2 过度表达的乳腺癌预后不良,Schimmelpenning等(1992)也报告伴有c –erbB –2 扩增的导管内癌易于发生周围浸润。此外,ras P21在乳腺癌中的表达也有上述趋势。
(3)辅助诊断和鉴别诊断:bc1-2基因已被用于滤泡型淋巴瘤与反应性滤泡增生的鉴别诊断,前者阳性表达率在80%以上,而后者几乎为阴性;ras癌基因突变或过度表达有助于甲状腺乳头状癌、乳腺导管癌、结肠腺癌等肿瘤的诊断;小细胞肺癌常伴有n –myc突变。
(4)癌细胞的组织发生:paget氏病可分乳腺外(EPD)和乳腺内(MPD)两种。有关paget细胞的起源问题仍有争议。许良中(1993)观察了c –erbB –2和p53在77例EPD和10例MPD中的表达,认为MPD中的paget细胞是来源于腺癌细胞而不是表皮的角质层细胞。EPP中的paget细胞也来源于腺癌细胞,但这种腺癌细胞与MPD中的腺癌细胞不同,因为两者基因表达不同。
3.遗传病的基因诊断遗传病的回顾性家族调查,可通过石蜡包埋组织完成。Mueller等描述1例怀疑囊性纤维化(CF)的死婴,石蜡包埋组织是唯一的材料来源。应用CF基因标记引物,对患儿和其父母的DNA分别进行PCR扩增。扩增产物用相应内切酶消化并检测限制性片段多态性。结果显示父母和患儿在同一位点上有意义,表明患儿遗传有突变型CF基因,最后证实了CF的诊断。
另一种常见的遗传病–肌营养不良症(DMD),是由Dystrophin基因的DNA序列畸变引起。Forstboefel等用该基因的已知编码DNA序列,从一死婴尸检组织中得到的DNA进行选择性PCR扩增。结果发现DMD基因的一关键部分缺失,进而证实了DMD的诊断。同样可通过亲代DNA分析,区分遗传性或散发性缺失。
4.病理微生物的检测核酸杂交和PCR技术对病原微生物的检测亦具有独到之处,除其特异性和敏感性极高外,还可适用于石蜡切片等多种材料,且可避免因培养造成的病原扩散。特别是一些原位杂交和PCR诊断性试剂盒的问世,使此项检测更加简便易行。因此,分子生物学将是传染病实验室诊断技术的发展方向。这方面的应用已有很多报道,本节 不再赘述。
5.组织来源的鉴定PCR可用于选择性扩增一部分HLa–DQa 基因,这部分是人类基因组中高度多肽性的位点。DNA序列微小的个体差异,可被特异性cDNA探针区分。此基因在人群中的正常变异是有图谱的,故可将其用作“基因指纹”来验证组织来源。在日常工作中偶尔遇到标本的标记错误,当观察组织切片,发现与临床资料不匹配时才被发现。Shibata等通过分析石蜡标本DNA中HLa–DQa位点解决了这一难题。另一高度多肽性的基因-低密度脂蛋白受体基因,亦可同样用于标本的鉴定。
Dubeau等发现提取DNA的甲基化类型是恒定的,包埋组织仍保留其原有的特异性甲基化特征,籍此可有助于识别某些肿瘤的起源组织。
综上所述,石蜡包埋组织DNA的提取扩展了分子生物学技术在临床上的应用范围。虽然现在回顾性DNA分析仅用于确定少数特异性诊断,但随着越来越多的感染性病原基因、特异性肿瘤基因和遗传病基因的识别和克隆,相信不远的将来基因诊断的应用范围会进一步拓宽,分子杂交等基因分析技术将会在病理学诊断和研究中发挥越来越重要的作用。
(张建中)
参考文献
1.吉昌华.特异单引物法标记高活性DNA探针.第四军医大学学报.1991:12:62~85
2.Sambrokk J, Fritch EF, ManiatisT.Molecular Cloning –a laboratory Manual. 2nd. ed , Cold Spring HarbourLabortory Press, 1989
3. Cox KH, Deleon DV, Angeres LM,et al. Detection of mRNAs in sea urchin embryosby in situ hybridization usingasymmetric RNA probes. Dev Biol, 1984;101:485~489
4. Herrin DL, Schmidt GW. Rapidreversible staining of northern blots prior to hybridization. Biotechniques.1989;6:196~201
5. Khandjian EW. Optimizedhybridization of DNA blotted and fixed to nitrocellulose and nylon memdranes.Bio/Technology. 1987;5:164~170.
6.White BA, Bancroft FC.Cytoplasmic dot hybridization.Simple analysis of relative mRNA levels inmutiple small cell or tissue samples . J. Biol Chem. 1982;257:8569
7. Williams DL, Newman TC,Shelness CS, et al. Measurement of apolipoprotein mRNA by DNA –excess solutionhybridization with single –stranded probes. Methods Enzymol. 1986;128 :671
8. 侯云德,主编.病毒基因工程原理与方法.P159~166.人民卫生出版社,1985;第1版,北京
9. Schleif RF & Wensink PC.Practical methods in molecualr biology. Springer –Verlag. 1981
10.林万明,主编.医学分子微生物学进展.第一集(上,下册).中国科学技术出版社,1991,北京
11.Mallet F. Enzyme –linkedoligosorbent assay for detection of immumodeficiency virus type 1. J ClinMicrobiol. 1993;31 :1444~1449
12. Hall GS. Probe technology forthe clinical microbiology laboratory. Arch Pathol Lab Med 1993;117:578~83
13.林万明,主编,核酸探针杂交实验技术.中国科技出版社,1991;北京
14. Hajra A. Detection of humanDNA mutations with nonradioactive, allelespecifc oligonucleotide probes.Pharmacogenetics, 1992;2:78~439
15.Ogilvie AD. In situhybridization . Ann Rheum Dis. 1990;49:434~439
16. Levenson C, Watson R, SheldonEL. Biotinylated psoralen derivative for labeling nucleic acid hybridizationprobes. Methods Enzymol, 1990;184:577~583
17. Tenover FC. DNA hybridizationtechniques and their application to the diagnosis of infectious disease. InfectDis Clin North Am 1993;7:171~181
18. Landry ML. Nucleic acidhybridization in virol diagnosis.Clin Biochem 1990;23 :267~277
19. Jackson P, Dockey DA, LewisFA, et al. Application of lnm gold probes on paraffin wax sections for in situhybridization histochemistry. j Clin Pathol 1990;43:810~812
20. Guesdon JL. Immunoenzymatictechiques applied to the specific detection of nucleic acids. A review. JImmunol Methods. 1992;150~49
21. Bush CE, Nichele LJ, PetersonWR, et al. Solid –phase time – resolved fluorescence detection of humanimmunodeficency virus polymerase chain reaction amplified products. AnalBiochem 1992;202:146~151
22.Cano RJ, Torres MJ, Klem RE,et al. DNA hybridization assay using ATTO PHOS, a fluorescent substrate foralkaline phosphatase.Biotechniques. 1992;12 :264~269
23. Kallioniemi A, Goldstein F,Smith AR, et al. Comparative genomic hybridization for molecular cytogeneticanalysis of soid tumors.Science. 1992;258 :(5083):818~821
24. Terouanne B, Chung J –L,Williams S, et al.Quantitative and qualitative annalysis of amplified DNAsequences by a competitive hybridization assay. Anal Biochem. 1992;205 :193~199
25. Marechal D. A subtractivehybridization method to isolate tissues – pecific transcripts application tothe selection of new brain ╟ specific products. Anal Biochem 1993;208:330~333
26.Goelz SE, Hamilton SR,Vogelstein B. Purification of DNa from formaldehyde fixed and paraffin embeddedhuman tissue. Biochem Biophys Res Commun. 1985;130 :118
27. Debeau L, Chandler LA, GralowJR, et al. Sorthern blot analysis of DNA extracted from formalin – fixedpathology specimens. Cancer Res. 1986;46 :2964
28. Mies C, Houldsworth J,Chaganti RSK. Extraction of DNa from paraffin blocks for Southern blotanalysis. Am J Surg Pathol, 1991, 15 :169
29. Sato Y, Mukai K, Matsuno Y,et al. The AMeX method:a multipurpose tissue – processingand paraffinembedding method. II.Extraction of spooled DNA and its applicationto southern blot hybridization to southern blot hybridization analysis. Am JPathol. 1990;136 :267
30. Mu AM, Ben –Bzra J, WinbergC, et al. Analysis of antigen receptor gene rearrangements in ethanol and formaldehyde– fixed,paraffin embeded specimens, Lab Invest . 1990;63 :107
31.Mies C. Molecular pathology ofparaffin – embedded tissue:currentclinical applications. Diagn Mol Pathol. 1992;1:206
32. Koshiba M, Ogawa K, Ogawa O,et al. The effect of formalin fixation on DNA and the extraction of high –molecular weight DNa from fixed and embedded tissues. Path REs Pract . 1993;189 :66
33.Bramwell NH, Burn BF. theeffects of fixative type and fixation time on the quantity and quality ofextractive DNA for hybridization studies on lymphoid tissue. Exp Hematol. 1988;16 :730
34. 张建中晏良遂白炎,等.基因重排分析在淋巴瘤诊断中的应用.中华医学杂志,1988;16 :730
35. Davis TH, Yockey CE, Balk SP.Detection of clonal immunoglobulin gene rearrangements by polymerase chainreaction amplification and sinle – strand comformational polymorphism analysis.Am J Pathol, 1993,142 :184
36. Wick MR. Oncogene analysis indiagnostic pathology :a current perspective. Am J ClinPathol, 1992;97 :S1
37. Furcht LT, McGlennen RC. Theemerging role of molecular diagnositics in surgical pathology, 1992;23:1197
38. Sukpanichnant S, Vnencak–Jones CL, McCurley TL.Detection of clonal immunoglobulin heavy chain generearrangements by polymease chain reaction in scrapings from archival H –Estained histologic section.Diagn Mol Pathol, 1993;2:168
39. 张建中.分子杂交技术在淋巴瘤诊断中的应用,国外医学肿瘤学分册,1988;15 :97
40.桂开林张建中. 甲状腺肿瘤的rasp 21表达的免疫组化观察.中华医学杂志,1990, 70:140
41. Wang Boyun (王伯沄),Li Yunsong (李云松),et al.Genetic identification for routine diagnosis of HBV by Dot – blot hybridization.Chinese Med J, 1993;106 (7):550~551
第十九章 核酸(基因)分子探针
第一节 概述
从化学和生物学的意义上理解,探针是一种已知特异性的分子,它带有合适的标记物供反应后检测。探针和靶的相互反应如抗原-抗体、血凝素-碳水化合物、亲合素-生物素、受体和配体,以及核酸与其互补核酸间的杂交等反应均属此类。用核酸探针与待检标本中核酸杂交,形成杂交体,再用呈色反应显示。此方法用于疾病的诊断,称为分子杂交基因诊断。此法开始用于遗传性疾病的诊断如血红蛋白病的诊断、先天性遗传病的产前诊断。近来,已发展为诊断外源性病原体如病毒、细菌、原虫等的方法;内源性病变基因研究如癌基因检测、基因突变、基因缺失或变异引起的疾病的基因诊断;人类基因识别及其生理功能和衰老有关研究;在法医检测中有关性别鉴别和DNA指纹谱的鉴定。基因探针的研究引起了人们高度重视,在探针的制备技术上有重大突破。可将核酸分子探针检测比喻为在柴草堆中去找一根针的神奇技术。据美国华尔街分析家预言:“在生物技术市场中,下一个突破和具有吸引力的是基因探针”。它的巨大的开发潜力和经济效益,已引起人们的重视。
目前基因检测方法中以同位素标记(32P、35S等)DNA探针灵敏度最高,但由于放射性污染、半衰期短、需要特别的安全防护条件等,限制了同位素标记探针的广泛应用。因此,非同位素标记探针的研制引起重视,自Langer等(1981)合成了生物素化dUTP和NTP类似物以来,开创了用非同位素标记的新领域,用生物素标记核酸探针检测和识别特定的核酸序列,已广泛应用于临床检验和科学研究。Leary等(1983)用缺口平移法标记的生物素DNA探针成功地用于Southern印迹杂交技术。Forst等(1985)发表了光敏生物素直接标记核酸的简便方法,使核酸和蛋白质的生物素标记探针技术前进一大步。Renz 等(1984)、Thorpe 等(1985)和Pollars 、Knight等(1990)用化学法直接把辣根过氧化物酶接到DNA上,运用发光显影法提高了敏感性。Muh-legger等(1990)用地高辛(Digoxigenin)标记DNA,再用地高辛抗体连接碱性磷酸酶,催化发光底物金刚烷脱磷并发光,灵敏度与32P标记探针相同,而且32P、标记的DNA探针杂交膜需要在-70℃件下曝光4~7天于X光片上显影,碱性磷酸酶发光法只需10~30min,十分快速、简便。
基因诊断的被检测基因或目的基因存在于样品中,先将样品中核酸提取出来,或在原位,或将样品点在硝酸纤维素滤膜上,再经蛋白酶处理,或酶切成较小的片段,经变性处理(热或碱变性)成单链。另一方面制备已知核酸序列标记的核酸分子探针,也经变性成单链。根据核酸链之间碱基配对的原理,将此核酸探针与样品中核酸单链结合成双链核酸,即称分子杂交。被检样品形成杂交双链,显示阳性结果。如样品无与探针互补的序列,则不发生分子杂交,结果为阴性。这种技术用于诊断要依靠基因探针,可见基因探针是基因诊断中的关键性试剂。
核酸探针传统的标记物是用放射性同位素,多用32PdNTP、3HdNTp 、35SdNTP等。用放射性同位素标记核酸有以下优点:
(1)灵敏性高:一般可达到0.5~5pg或更低浓度核酸的检测水平,可以检测极少量或拷贝数少的基因组(可延长曝光时间或增敏屏增敏)。
(2)特异性高:用放射自显影法,样品中存在的无关核酸或非核酸成分不会干扰检测结果,准确率高,假阳性率低。
(3)方法简便。所以,放射性同位素标记核酸探针在一些有条件的单位,作为主要的标记方法仍在使用。
放射性同位素标记技术也存在以下缺点:
①半衰期短,必须经常标记探针:如32P、半衰期只有14.3天,放射强度逐日变化。35S的半衰期可达88天,但衰变能量只有32P的1/10,灵敏度较低,只能用于多拷贝基因的检测。3H的半衰期虽长达12.26年,但衰变能低,灵敏度太低。
②费用高:α-32P标记的dATP(400Ci/mmol),需要进口试剂,价格高。
③检测时间长:用放射自显影需要较长的曝光时间(1~15天)。
④放射性同位素对人体有害,实验室和环境易被污染,放射性废物处理困难。因此,推广使用受到限制。
所以研究非放射性标记核酸探针及其检测显示方法、为推广应用基因诊断创造有利的条件,已成为80年代以来各国十分重视的研究目标。这项技术属生物高技术中发展很快、前景很大的项目。美国科学家于1981年首先合成了生物素标记的脱氧尿嘧啶核苷三磷酸,他们采用缺口平移制成生物素化核酸探针,成功地用于探测一系列基因。随后美国的BRL和Enzo biochem 生产了这种生物素标记探针及分子杂交成套试剂盒。1985年澳大利亚合成了光敏生物素,用于直接标记核酸,这是Adelaide大学Forest等学者的重大成功。该大学的Bresatec 公司和美国的Vector实验室,先后完成了配套试剂盒。1988年西德Boehring – Mannheim公司研制成功地高辛(半抗原)-抗体-酶法基因探针试剂盒。1989年我国军事医学科学院马立人教授等合成光敏生物素并研制成功光敏生物素核酸探针标记和检测试剂盒。至今,在国内外市场上已有多种商品化非放射性标记核酸探针试剂盒供应。
利用核酸探针杂交技术比用免疫学抗原抗体技术有更高的特异性和敏感性等优点,已显示出巨大的发展潜力。许多核酸(基因)探针已直接用于基因检测,疾病诊断和病因研究。正在迅速发展的基因诊断更需要制作各种基因探针。因此,学习和研究制备核酸探针技术象制备各种单克隆抗体探针一样已成为90年代大力发展的高技术,也是分子医学发展的热点之一。
核酸探针制备技术包括目的基因的制备,放射性同位素标记或非放射性标记,标记核酸的纯化、鉴定、分装、贮存等。本文介绍常用核酸探针的制备技术,供初学者参考,更详细的了解请参考有关专著。这项技术正在发展中,新方法不断出现,要密切注视文献进展。
第二节 核酸(基因)探针目的核酸的制备技术
一、特异性目的核酸(或基因)的制备
核酸分子探针的制备首先需要获得所要的特异性核酸或其片段。可用以下方法制备:
(1)直接分离基因核酸:即从基因组上直接用内切酶切下所需基因。
(2)化学合成基因核酸:即以单核苷酸为原料,以固相磷酸三酯法合成某一结构完全清楚,分子量较小的寡核苷核。
(3)酶促合成核酸:在真核细胞中获得特异的结构基因。常用方法是以mRNA为模板,利用逆转录酶合成单链cDNA,再以大肠杆菌DNA聚合酶I合成双链的结构基因。
(4)RNA探针。
二、目的核酸的扩增
在获得特异的目的基因后,可用以下方法大量扩增制备:①用体外DNA重组技术与载体DNA相连,转化至大肠杆菌中进行无性繁殖。以氯化铯超速离心纯化重组质粒DNA,并以合适限制性内切酶消化,经凝胶电泳制备回收特异的目的核酸片段。②聚合酶链式反应(Poly-merase chain reaction, PCR)扩增技术:利用这种先进技术能简便快速制备大量特异性目的核酸片段。PCR技术的基本原理是利用DNA聚合酶依赖于DNA模板的特征,在体外用一对和欲扩增DNA片段的两侧序列互补的引物诱发聚合反应,即双链DNA先高温变性,然后在低温下与引物退火,再在中等温度进行链延伸反应。上述在三种不同温度下的变性、退火和延伸为一个循环反应,重复这种循环反应可使DNA获得指数性倍增,例如经过35个循环反应,DNA可扩增1×108倍以上。
第三节 放射性同位素标记核酸探针
最常用的同位素是α-32PdNTP,3HdNTP,及35SdNTP,多用缺品平移法、末端标记法,随机引物延伸法和反转录标记法。在以mRNA制备cDNA时,同时掺入标记的脱氧核苷酸,制出cD-NA标记探针。
一、缺口平移法
在适当的浓度的DNase I作用下在一双链DNA上制造一些缺口,再利用大肠杆菌DNA聚合酶I 的5’—3’外切酶活性依次切除缺口下游的核酸序列,同时将四种脱氧三磷酸核苷(其中一种用放射性标记)利用该酶5’—3’聚合活性补人缺口,使缺口逐个平称并在平移过程中形成标记的新生核酸链。此法也适用于探针的非放射性标记。如32P标记DNA探针(缺口平移法):反应体积为25μl,内含0.3μgDNA片段,4μl 0.2μmol/L dNTP, 1.1×106Bq [α-32P]dATP,1μl2万倍稀释的DNA酶和2μl DNA聚合酶I,6μl缓冲液[为50mmol/l Tris·HCl(PH7.2)、10mmol/l MgSO4、1mmol/L二硫苏糖醇(DTT)和50μg/ml BSA],反应在14℃进行3h。标记DNA经Sephadex (G-50)柱层析回收。
二、末端标记法
在大肠杆菌T4噬菌体多聚核苷酸激酶(T4PNK)的催化下,将γ-32P-ATP上的磷酸连接到寡核苷酸的5’末端上。要求标记的寡核苷酸5’端必须带羟基。反应式为:

此法适用于标记合成的寡核苷酸探针。如将底物改为Bio –11 –dUTP,也可以在3’端标记上一个生物素。
寡核苷酸35S的3’—末端标记法:将下列液体依次加入Eppendorf管中。
寡核苷酸(1 pmol)1μl
10×Tailingbuffer 2μl
[α-35S]2μl
双蒸馏水14μl
末端脱氧核苷酸酶1μl(10Unit)
混合后,置于37℃水浴中1.5h。取出反应管放入冰水中5min。加入下列液体:
TRNA(25mg/ml)3μl
1×TE(pH8.0)180μl
酚100μl
CTAa100μl
充分混合2min。离心15000r/min 5min。将上清液(约200μl)移入新的Eppendorf 管中,然后加入下列液体:
4mol/L醋酸胺100μl
100%酒精800μl
混匀,置冰浴中,15min。再15000r/min离心10min,在管底可见一白色沉淀块(含tRNA及寡核苷酸)。吸去管中液体,然后加入1000μl80%酒精,混合1~2min同上离心,吸除酒精(勿破坏沉淀块),将管置于40℃温箱中5min。加入适量的1×TE(pH8.0)及0.5mol/l DTT溶解沉淀。标记探针的最终浓度是0.5ng/μl,DTT的最终浓度为20mmol/μl。取出1μl标记探针测定比放射性,应在1.0×10dpm/μg以上。保存在-80℃中1~2个月。再次使用时应考虑到放射性同位素的衰减量。
三、应用特异单引物法标记DNA探针
应用探针DNA上的一个片段作为DNA引物,以环化探针DNA的重组质粒DNA为模板,在DNA聚合酶的作用下,通过变性,退火和延伸过程,使探针DNA得到标记。反应在0.5ml离心管内进行,总体积为25μl,内含50mmol/l Tris—HCl pH7.5, 10mmol/L MgCl2、BSa 5mmol/L、80ng引物DNA和0.1μg连接的DNA或0.1μg质粒。反应管在95℃变性5min,取出,稍离心,立即放入37℃C水浴保温2min使DNA退火,加入1UE.coli DNA聚合酶I,在37℃进行延伸反应。对环化基因,延伸18min,对质粒DNA延伸35min重复上述变性、退火和延伸过程1次。
四、双引物法标记DNA探针法
反应在0.5ml管内进行,反应体积为50μl,内含50mmol/l Tris(pH7.5)、10mmol/l Mg-Cl2、10mmol/L β-巯基乙醇和500μg BSA/ml,引物片段1和2各90ng,模板DNA0.1μg,[α-32P]dCTp 1.5×106Bq,dATp 、dGTP和dTTP各200μmol/L。标记反应包括3个步骤:
(1)变性:反应管在95℃水浴5min,然后离心;
(2)退火:37℃水浴2min;
(3)延伸:加入DNA聚合酶i 1u,37℃水浴18min。重复上述变性、退火、延伸过程1~2次,分别进行其标记率测定:取0.5μl反应液分别点于两张滤纸片上,烤干。一张经0.6mol/L三氯醋酸(TCA)、0.3mol/l TCA依次洗涤,每次10min,然后再用无水乙醇,醇醚混合液和乙醚洗涤各5min。两张滤纸分别放入闪烁瓶内,测定cpm值,达到108cpm/μg DNA以上。
五、聚合酶链反应(PCR)标记高活性DNA探针
在0.5ml离心管内进行,反应总体积为50μl,内含模板DNA350ng,DNA引物各50pmol/L,dGTP、dCTP和dTTP各200μmol/L,[α-32P]dATp 1.1×106Bq,反应缓冲液为67mmol/l Tris—HCl pH8.8含2.5mmol/l MgCl2、6.7mmol/L(NH4)2SO4、10mmol/l β-巯基乙醇、170mg/l BSA、6.7μmol/l EDTA和40μl/ml二甲亚砜。将反应管置于95℃水浴变性5min取出,加入Taq DNA聚合酶0.5~2u,在旋涡混合器上混匀简单离心一下,加入35μl石蜡油。放入65℃水浴2min,取出,立即进入PCR循环:91℃变性30s,51。C退火1min,68℃延伸2min。重复上述过程15次。最后将反应管置65℃水浴5min。反应完成,加入酵母tRNA10μg。分别测定参入和游离放射性计数,参入率为97.4%。标记DNA探针经醋酸钠酒精沉淀回收。将沉淀溶于10mmol/l Tris—HCl 、EDTA(pH8.0)100μl。用PCR方法标记的DNA探针特异性高,敏感性好,可测出的最低靶DNA量为10fg,利用PCR还可以作DNA探针的非放射性标记。
第四节 非放射性标记的核酸探针
放射性标记核酸探针在使用中的限制,促使非放射性标记核酸探针的研制迅速发展,在许多方面已代替放射性标记,推动分子杂交技术的广泛应用。目前已形成两大类非放射标记核酸技术,即酶促反应标记法和化学修饰标记法。
酶促反应标记探针是用缺口平移法,随机引物法或末端加尾法等把修饰的核苷酸如生物素-11-dUTP掺入到探针DNA中,制成标记探针,敏感度高于化学修饰法,但操作程序复杂,产量低,成本高。
化学修饰法是将不同标记物用化学方法连接到DNA分子上,方法简单,成本低,适用于大量制备(>50μg)如光敏生物素标记核酸方法,不需昂贵的酶,只在光照10~20min,生物素就结合在DNA或RNA分子上。
非放射性标记核酸探针方法很多,现介绍常用的几种方法如下:
一、生物素标记核酸探针方法
生物素标记的核苷酸是最广泛使用的一种,如生物素-11-dUTP,可用缺口平移或末端加尾标记法。实验发现生物素可共价连接在嘧啶环的5位上,合成TTP或UTP的类似物。在离体条件下,这种生物素化dUTP可作为大肠杆菌多聚酶I(DNA酶I)的底物掺入带有缺口的DNA或RNA,得到生物素标记的核酸探针。这种标记方法称为缺口平移法。用标记在DNA上的生物素与链霉亲合素-酶(过氧化物酶或碱性磷酸酶)标记物进行检测。
缺口平移法标记生物素DNA探针:在硅化Eppendorf管(放入冰浴中)加下列反应液:
待标记DNA 0.1μg/μl 5μl
10×NTB 1μl
DNase I2pg/μl 1μl
消毒三蒸水 3μl 总体积达10μl
混匀,37℃,15min。离心10000r/min 1min后,放入冰浴中,继续加入下列反应液:
dNTP(ACG)0.5μg/ml2μl
Bio –11–dUTP 0.5μg/ml2μl
10×NTb 4μl
消毒三蒸水 31μl
混匀,短暂离心后,加入
DNA聚合酶I(5u/μl)1μl总体积50μl
混匀,14℃过夜(10h以上),加入
终止液 2μl
经Sephadex –G –50柱分离,回收生物素标记DNA。
10×NTB配法:500mmol/l Tris –HCl, Ph7.5;100mol/L MgCl2;80mmol/L β-巯基乙醇,500μg/ml BSA。
终止液:0.25mol/L EDTA, 10mg/ml tRNA和10mmol/l Tris –HCl (pH7.5)。
缺口平移法标记探针少量多次标记效果较好,即每次标记DNA不超过1μ.Bio –11-dUTP要浓贮,分装,-20。C保存,反复冻融常会降解失活。Bio –11- dUTP贮存液:10mmol/L即100μg Bio-11-dUTP中加入11.6μl Bio-11 –dUTP稀释液,分装成3μl/支,-20℃保存。
地高辛-dUTP标记DNA也可按此法进行。
乙醇沉淀分离回收标记DNA比较方便,即加入5μl4mmol/l LiCl,125μl冷乙醇,混匀,-20℃放置30min,12000r/min离心5min,去上清,用70%乙醇和无水乙醇洗沉淀物,倒置离心管,晾干,用消毒三蒸水5μl溶解沉淀物(0.1μg/μl)-20。C保存。用LiCl 可较好地分离DNA和可溶性核苷酸,因为dNTPS的锂盐在乙醇中比钠盐溶解性更大。
二、光敏生物素标记核酸探针
光敏生物素有一个连接臂,一端连接生物素,另一端有芳基叠氮化合物。在可见光照射下,芳基叠氮化合物可能变成活化芳基硝基苯,很易与DNA或RNA的腺嘌呤N—7位置特异结合,大约每50个碱基结合一个生物素,所以只用于标记大于200个核苷酸的片段。光敏生物素的醋酸盐很易溶于水,与核酸形成的共价结合很稳定。此法有以下优点:方法简便易行,快速省时,不需昂贵的酶和dUTP等;只需光照,探针稳定,-20℃可保存12个月以上。适用于DNA和RNA,抗体和酶等的标记。在原位分子杂交,斑点杂交和Southern印迹杂交中应用,其特异性和灵敏性较高,价廉易购,国内已有试剂盒供应,军事医学科学院放射医学研究所马立人教授等研制和生产的光敏生物素核酸探针和检测试剂盒使用良好。
方法步骤:在一灭菌Eppendorf管中加待标记DNa 5μg/10μl,在暗室中加入5μg/5μl光敏生物素,充分混匀,插入冰浴中,置特制光源下10cm处照射20min。加入100mmol/l Tris –HCl pH9.0, 1.0mmol/L EDTA10μl混匀。再加入等体积仲丁醇,混匀。离心1min(10000r/min)吸去上层仲丁醇,弃去。再加入仲丁醇25μl,重复提取游离的光敏生物素。吸去上层无色仲丁醇后,加入5μl 3mol/L醋酸钠,充分混匀,加入冷无水酒精100μl充分混匀,沉淀标记DNA,置-20℃过夜(或-70℃15min)15000r/min离心20min,沉淀物再用70%乙醇洗一次,离心,抽干,溶于0.1mmol/l EDTA或TE中,测定探针浓度,分装,保存于-20℃。
三、生物素-补骨脂素(Biotin -psoralen)标记法
生物素-补骨脂素是另一种生物素光敏物质,在长波长紫外线照射下与嘧啶碱基发生光化学反应,加成到DNA中,去除小分子后,得到生物素标记核酸探针。此法可标记单链或双链DNA或RNA,及寡核苷酸。灵敏度与放射性探针相当。标记方法:取DNA或片段0.5μg加50μlTE(pH8.0)缓冲液中,再加入5μlg生物素-补骨脂素,溶解后,置365nm紫外光下直接照射20min,距离5cm,加等体积TE,移入用TE平衡的Sephadex G—50 柱(高1.0cm),离心法过柱,收集液体即为Bio –DNA探针。
四、生物素-α-氨基乙酸-N-羟基琥珀标记化学修饰的DNA法
此法是在亚硫酸盐催化下,生物素酰肼可置换寡核苷酸探针中胞嘧啶上的氨基,使生物素结合到DNA分子上而制成生物素化DNA探针。此法优点是采用通用试剂和技术,检出敏感。Vicied 等人指出DNA和RNA中胞嘧啶N-4位置在亚硫酸氢盐存在下可用乙二胺连接臂修饰,此过程也可能介导C-6位的磺酸盐组分。在合适的条件下,可有3%~4%的碱基被修饰。新鲜配制亚硫酸氢钠-乙二胺混合液,两者混合液含量分别为1mol/L和3mol/l (pH6.0),加入对苯二酚,使终浓度为1mg/ml。将DNA用超声打成500~800bp长度的片段,煮沸法变性,取1份DNA与9份上述混合液混合,42℃水浴3.5h。用5mmol/L磷酸钠缓冲液(pH8.5)在40℃下充分透析,浓缩DNA,再溶于200μl 0.1mol/L磷酸钠缓冲液(pH8.5),再加入4mmol/L生物素-ε-氨基乙酸-N-羟基琥珀酰亚胺脂,室温反应2h,用含150mmol/l NaCl、1mmol/l EDTA的10mmol/L磷酸钠缓冲液(pH7.0)在40℃下充分透析,纯化,-20℃保存。
五、缺口平移法标记生物素DNA探针(二步法)
取HBV质粒DNA0.5μg,DNase I(SABC)2pg, 10×NBTμl,三蒸水补足体积至10μl,37℃,15min;加5mmol/l dATP dGTP dCTP Bio –11- dUTP各2μl,10×NBt 4μl,三蒸水补足体积至10μl,37℃,15min;三蒸水补足体积至49μl,DNA聚合酶i 5u,混匀,14℃过夜,加0.5mmol/l ED-TA(Ph8.0)1μl终止反应。
已标记探针的提纯:10mg/ml tRNA 2μl,10mmol/L Tris –HCl (pH7.5)150μl,2.5倍体积的95%乙醇,置液氮中15min或-20℃过夜。15000r/min,离心10min,真空干燥后,溶于适量三蒸水中,即为纯化的探针,-20℃备用。
使用闭环或线性双链质粒DNA,或分离的双链DNA片段均可进行此法标记,全质粒标记敏感性较高,因为标记物可同时掺入载体DNA。
此法也可用于放射性同位素和地辛标记DNA法。
六、生物素随机引物标记探针方法
以HBV DNA为例。取HBv DNA质粒0.5μg,随机引物(Pharmacia)2μg,用TE(pH8.0)补足体积至10μl;100℃,热变性5min,骤冷10min。加10×缓冲液(500mmol/l Tris –HCl (Ph6.6),100mmol/L MgCl2,10mmol/L β巯基乙醇),BSa 500μg/ml 5μl,5mmol/l dATP/dGTP dCTP各1μl,按不同比例加入Bio –11-Dutp,和dTTP,用三蒸水补足体积至48μl,加DNA聚合酶(SABC)8u,混匀,37℃,2h,加0.5mol/l EDTA(Ph8.0)2μl,终止反应。
在随机引物标记体系中,加入不同梯度浓度比值的Bio-11-dUTP/dTTP(%),发现二者比值明显影响探针标记率和显色灵敏度。Bio-11-Dutp/dTTP(%)比值为35%时,其标记率最高,显色灵敏度达0.2pg,杂交灵敏度为1~2pg。二步法缺口平移标记HBv DNA探针,其灵敏度低于随机引物标记。Mackeg等(Focus,1992;14:21)证实了用随机引物标记探针具有放大的效应。随机引物中加入一定比例的dTTP,能增加HBv DNA探针的标记率和灵敏度。其灵敏度接近同位素标记探针的灵敏度。
七、异羟基洋地黄毒甙(Digoxigenin)标记核酸探针
1988年德国Boehringer Manheims公司推出了一种地高辛标记DNA检测试剂盒。先将地高辛甙元通过一手臂联接至dUTP上,用随机引物法标记DNA制成探针。平均每20~25个核苷酸中标记一个地高辛甙元,然后用抗地高辛抗体的Fab片段与碱性磷酸酶的复合物和NBt – BCIP底物显色检测,灵敏度达0.1pg DNA,因此可做1μg哺乳动物DNA中单拷贝基因分析。此种探针有高度的灵敏性和特异性,安全稳定,操作简便,可避免内源性干扰,是一种很有推广价值的非放射性标记探针。
标记方法步骤:(1)取一小离心管(0.5ml)插入冰浴中,加入待标记DNa 1μg/5μl,95℃变性10min,迅速移入盐冰中3min。加入六核苷酸引物2μl,Dig-dNTP标记物2μl和消毒双蒸水10μl、大肠杆菌DNA聚合酶i Klenow片段1μl(单位)。(2)短时离心,37℃孵育至少60min(20h以内)。(3)加入2μl 0.2mol/L EDTA溶液中止反应。再加入2.5μl 4mol/L LiCl和75μl预冷的乙醇(-20℃),放入-70℃至少30min或-20℃过夜。(4)离心(12000g)10min,弃上清,再加入70%乙醇(冷)40μl洗一次,离心,抽干,再溶于50μl TE溶液(pH8.0)中,分装,-20℃存放备用。
八、光敏2,4-二硝基苯(光敏DNP)标记DNA法
光敏DNP由一连接臂组成,一端是2,4-二硝基苯,另一端有芳基叠氮化合物。此法适用于含氨基检测基团。其敏感性和光敏生物素标记探针相同,检测时需要抗DNP抗体和免疫化学显色。标记方法:(1)DNA不心变性,必须溶于水中,取2~10μg10μl,加入二甲亚砜25μl,每微克DNA加入光敏DNp 2μg(在避光条件下),混匀。(2)置入冰浴中,在特制灯10cm下照射10min。(3)加入水165μl,4mol/L醋酸钠20μl和异丙醇50μl,混匀。(4)用705和无水乙醇沉淀各一次,晾干,按50μg/ml溶于200μl水中,如探针不溶时,可在60℃水溶中加热10min,离心5min,除去不溶性杂质,分装,-20℃可保存1~2年。此法简便,不仅适用于核酸标记,也适用于蛋白质标记。
九、三硝基苯磺酸(TNBS)标记核酸探针
在温和的条件下,TNBS将核酸的胞嘧啶转化为N-甲氧基-5,6-二氢嘧啶-6-磺酸盐衍生物,对胞嘧啶残基进行磺化修饰制成磺化半抗原探针。此法十分简便,也可用于蛋白质的标记。标记方法:取变性单链的DNA5μg,溶于0.02mol/L硼酸钠缓冲液(pH8.6)中,加入TNBS5μg溶解,在室温中反应1h。移入冰浴中,加入无水乙醇和70%乙醇各洗1次,晾干,用50μl消毒双蒸水溶解,分装,-20℃保存备用。
十、生物素化的RNA探针标记
RNA探针比cDNA探针的敏感性提高10倍以上,在许多优点。它们是单链,不需变性,也没有互补链的干扰,与靶基因杂交比DNA探针更稳定。Bio-11-dUTP可通过Sp6、T3和T7RNA聚合酶掺入到RNA转录子中。标记方法:其下列反应体积为50μl:40mmol/l Tris HCl pH8.0、8mmol/l MgCl2、2mmol/L亚精胺、25mmol/l NaCl, 1mmol/L每一ATP、GTP、GTP,1mmol/L生物素Bio-11-Dutp,500ng模板,45u T3RNA聚合酶。混合,37℃反应1h。加入10%SDS终止反应。凝胶过滤分离标记RNA探针。
十一、辣根过氧化物酶标记核酸探针法
此法标记原理如下图所示:

标记的HRP部分催化底物化学发光反应:氨基苯二甲酰肼 氨基苯二甲酸
氨基苯二甲酸
+N2+光→X-光片上感光10~20min显定影。
光亮子在酚、萘及胺类等增强剂促进下,而使光亮增强。
这种方法就是利用特殊的酶底物,氧化后把产生的能量转变为光能放出,称为化学发光。杂交后与探针结合的酶催化相应的发光剂,经增强剂将光能放大,在X光片上显示杂交信号。此方法灵敏度与同位素标记水平相当,简便快速,安全,是一种特异性好的检测手段,具有广泛的应用前景。
HBV-DNA的HRP标记方法:质粒中插入HBV全基因组DNA,长3.2kb,载体为PBR322质粒,4.3kb。将质粒DNA用三蒸水稀释成10ng/μl,取20μl放入EP管,100℃变性5min,加入20u HRP标记试剂,混匀,加入戊二醛20μl混匀,37℃10min,此时可立即使用,或放在冰浴中10~15min内使用,或加入50%去离子甘油-20℃保存供分子杂交用,可存放6个月。
十二、用聚合酶链反应标记高活性DNA探针
聚合酶链反应(PCR)或称体外基因倍增技术,它利用一对位于待扩增的DNA序列两端的取向相对的DNA引物,在DNA聚合酶的介导下,经过多次变性,退火和延伸过程的重复性循环,大量合成靶DNA序列。在标记dNTP存在时,经PCR反应产生的靶DNA片段均参入了标记物,用此法标记的探针标记率高达97.4%。此法重复性好,简便、快速、特异、不要求模板DNA的纯度,可以大量制备。此法有普遍应用价值。
标记方法如下:待标DNA模板1ng,50mmol/L KCl, 10mmol/L Tris-HCl(pH8.4),2.5mmol/LMgCl2dATP、dCTP、dGTP各200μmol/l dTTP150μmol/Ll,Bio-11-dUTP 50μmol./L, 引物各1μmol/L,明胶200μg/ml,2u Taq DAN聚合酶,总反应体积为100μl。混匀后,加石蜡油封顶,94℃和55℃各2min,72℃3min,经25个循环后,可产生5~10μg标记探针,需时仅4h。乙醇沉淀扩增的产物后,溶于100μl TE中,分装-20℃。
第五节 寡核苷酸探针的制备
利用寡核苷酸自动合成仪,可很简单地合成制备寡核苷酸探针(如15~50bp),这类探针具有以下优点:①短的探针比长探针杂交速度快,特异性强。②可以在短时间内大量制备。③在合成中进行标记制成探针。④可合成单链探针,避免了用双链DNA探针在杂交中自我复性,提高杂交效率。⑤寡核苷酸探针可以检测小DNA片段,在严格的杂交条件下,可用于检测在序列中单碱基对的错配。
因此,寡核苷酸探针的研究,对于提高核酸杂交技术的特异性和敏感性,扩大应用范围有重要意义。
常用的寡核苷酸探针有3种:①特定序列的单一寡核苷酸探针;②较短的简并性较高的成套寡核苷酸探针;③较长而简并性较低的成套寡核苷酸探针。多用32P标记寡核苷酸探针,如:1)通过T4噬菌体多核苷酸激酶催化的磷酸化反应标记合成的寡核苷酸探针,在合成寡核苷酸时期5’端缺少一个磷酸基,因而易用T4噬菌体多核苷酸激酶进行磷酸化反应,而将α-32P从[γ-32P]ATP转移至其5’端。这种磷酸化反应最多能使每一寡核苷酸分子中掺入一个32P原子。2)用大肠杆菌DNA聚合酶i Klenow片段标记合成的寡核苷酸探针,其比活性更高,每一寡核苷酸分子可带有若干个放射性原子,放射性比活度可高达2×1010计数/(min·mg)。

附图 DNA聚合酶i Klenow片段标记合成寡核苷酸探针
寡核苷酸探针的非放射性标记时,可用以下几种方法:
1.酶延伸法合成与探针目的基因的3’-端一段互补的寡核苷核序列,此序列的5’-端多加一个A,与目的基因片段退火,再用Klenow酶延伸,使bio –dUTP掺入探针的3’末端。
2.5’磷酸末端标记法带5’-磷酸的寡核苷酸探针,在咪唑缓冲液中用水溶性碳二亚胺(EDC)处理,可生成活性的磷酸咪唑中间体,与过量的乙二胺作用,就可以引入一个带氨基的接臂。用活化生物素标记就可以得到5’-磷酸标记的寡核苷酸探针。
3.酶标探针法用双功能联接剂如辛二酸双羟基琥珀亚胺酯联接寡核苷酸和碱磷酶,可以生成1:1的酶标寡核苷酸探针。此法省略了生物素-亲合素中间步骤,可减少非特异性反应。
4.生物素酰肼胞嘧啶修饰法在亚硫酸盐催化下,生物素酰肼可置换寡核苷酸探针中胞嘧啶上的氨基而得生物素化寡核苷酸探针。
5.寡核苷酸的酶促加尾标记法在末端转移酶的作用下,用非放射性物质修饰的核苷酸(生物素dATP;生物素-dUTP;地高辛-dUTP)可加到DNA的3’末端,每个探针DNA可加上10~20个修饰碱基。
(1)取-0.5ml硅化塑料离心管,插入冰浴中,加入寡核苷酸(3pmol)×μl,5×加尾缓冲液20μl,5.0mmol/l dUTP 4μl(终浓度200μmol/L),修饰的dNTP(生物素-dUTP;生物素-dATP;地高辛-dUTP)×μl(终浓度100μmol/L),加入至100μl,混匀后加入末端转移酶5u。37℃反应1h。
(2)探针纯化:乙醇沉淀法:加入50μg tRNA,15ul 4mol/L醋酸钠和375μl无水乙醇,混匀,-20℃1h,高速离心10min,弃上清,用70%乙醇和无水乙醇再反复洗沉淀,晾干,再溶于水中,浓度为500ng/ml。
常用试剂配制方法[见附录二“(四)关于探针的标记”部分]。
参考文献
1.Forst AC, et al. Non- radioactivehybridization probes prepared by chemical labeling of DNA and RNA with a novelreagent, photobition. Nucl Acids Res, 1985;3:745~761
2.LawrenceJB, Singer RH. Quantitive analysis of in situ hybridization methods for thedetection of actin gene expression. Nucl Acid Res, 1985;13:1777
3.WangBoyun (王伯沄),et al. Photobiotin HBV- DNAprobe for routine diagnosis of hepatitis B virus in dot blots. Interantionalsymposium on Viral hepatitis and Aids, 1991;1:14~18,Proceedings A038, Beijing.
4.PeterSD, et al. Fale -positive results with hepatitis B virus DNA dot –hybridizationin hepatitis B surface antigen – negative specimens. J Ciln Microbiol, 1986;23:297
5.白薇 静国忠. 应用点杂交技术对乙型肝炎病毒基因组进行定量分析.中华微生物学和免疫学杂志,1990;10:174
6.马立人刘耀清.光敏生物素核酸探针标记和检测试剂盒使用说明.军事医学科学院放射医学研究所,1989:6
7.马风林.生物素标记核酸探针技术.生物化学与生物物理进展,1989;16(27):15~17
8.王伯沄,李玉松.核酸探针标记和检测技术的进展.中华流行病学杂志,1997;18(3A):37~42
9.张立农,等.半抗原Digoxingenin 标记HBv DNA探针的制备及临床应用.中国人兽共患病杂志,1990;6(3):9~12
10.AmoldusEPJ, et al. Feasibiligy of in situ hybridization with chromosome specific DNAprobes on paraffin wax embedded tissue. J Clin Path, 1991;44:990~904
11.蒋三亮张思仲.用地高辛配基标记DNA探针检测人类基因单拷贝序列.遗传与疾病,1991;8(17):4~6
12. 吴玉涛方勤.核酸分子探针制备技术新进展.国外医学:分子生物学分册,1989;3:101
13. 刘钟镔.应用免疫学方法的核酸探针-抗杂交体和半抗原核酸探针.国外医学:免疫分册,1989;5:29
14.NoveGJ, et al. Detection of human papilloma virus DNAin Formalin –fixed tissues byin situ hybridization after amplification by PCR. AM J Pathol, 1991;139:847
15.王伯沄,等.生物素标记HBV-DNA探针的研制和应用.中华流行病学杂志,1992;13(特2):193
16.林万明,主编.核酸探针杂交实验技术.北京:中国科学技术出版社,1991:33~82
17.JSambroor FF. Fritch T Maniatis:Molecular Cloning. A Laboratory Manual 2nd .金冬雁,等译:分子克隆实验指南.北京:科学出版社,1992:495~569
18. 王伯沄.原位PCR标记检测技术.中华流行病学杂志,1997;18(3A):1~4
19.吉昌华.应用特异性双引物法标记DNA探针.第四军医大学学报,1991;12(1):66
20.吉昌华.应用聚合酶链反应标记高活性DNA探针.第四军医大学学报,1990;11(4):316
21. WangBo –yun(王伯沄)et al. Genetic identification for routine diagnosis of HBV DNA by Dot–blot hybridization. Chin Med J , 1992;106(7):550~551
第二十章 原位杂交组织化学
原位杂交组织化学(In situ hybridization histochemistry, ISHH)是应用已知碱基顺序并带有标记物的核酸探针与组织、细胞中待测的核酸按碱基配对的原则进行特异性结合,形成杂交体,然后再应用与标记物相应的检测系统,通过组织化学或免疫组织化学方法在核酸原有的位置进行细胞定位。这一技术为研究单一细胞中编码各处蛋白质、多肽的相应mRNA的定位提供了手段,使从分子水平研究细胞内基因表达及有关因素的调控提供了有效的工具。可视为组织化学或免疫细胞化学中革合性的突破。
第一节 原位杂交组织化学概述
一、核酸分子杂交技术
1961年Hall开拓了液相核酸杂交技术的研究,其基本原理是利用核酸分子单链之间有互补的碱基顺序,通过碱基对之间非共价键的形成,出现稳定的双链区,形成杂交的双链。自此以后,由于分子生物学技术的迅猛发展,特别是70年代末到80年代初,分子克隆、质粒和噬菌体DNA的构建成功,核酸自动合成仪的诞生,大大丰富了核酸探针的来源,新的核酸分子杂交类型和方法不断涌现。按其作用方式可大致分为固相杂交和液相杂交两种:液相杂交是指参加反应的两条核酸链都游离在溶液中,而固相杂交是将参加反应的一条核酸链固定在固体的支持物上(常用的有硝酸纤维素滤膜,其它如尼龙膜、乳胶颗粒和微孔板等),另一条参加反应的核酸链游离在溶液中。固相杂交有菌落原位杂交(colony in situ hybridization)、斑点杂交法(Dot blot)、Southern印迹杂交(Southern blot)、Northern印迹杂交(Northern blot)和组织原位杂交(Tissue in situ hybridization),即原位杂交组织化学技术和原位杂交免疫细胞化学技术。液相分子杂交技术包括吸附杂交、发光液相杂交、液相夹心杂交和复性速率液相分子杂交等(详见第十八章 )。
二、原位杂交组织化学技术的由来及发展
原位杂交组织(或细胞)化学技术简称原位杂交(In situhybridization),如上所述,属于固相核酸分子杂交的范畴。但它区别于固相核酸分子杂交中的任何一种核酸分子杂交技术。菌落杂交系细菌裂解释放出DNA,然后进行杂交。Southern印迹杂交法是以鉴定DNA中某一特定的基因片段,而Norhtern印迹杂交法是用以检测某一特定的RNA片段的。它们都只能证明该病原体、细胞或组织中是否存在待测的核酸而不能证明该核酸分子在细胞或组织中存在的部位。1969年美国耶鲁大学Gall 和Pardue首先用爪蟾核糖体基因探针与其卵母细胞杂交,确定该基因定位于卵母细胞的核仁中。与此同时,Buongiorno – Nardelli和Amaldi,John及其同事等相继利用同位素标记核酸探针进行了细胞或组织的基因定位,从而创造了原位杂交细胞或组织化学技术。Orth(1970)应用3H标记的兔乳头状瘤病毒cRNA探针与兔乳头状瘤组织的冰冻切片进行杂交,首次用原位杂交检测了病毒DNA在细胞中的定位,但当时的工作多采用冰冻组织切片或培养细胞,探针均采用同位素标记。
由于同位素标记探针具有放射性既污染环境,又对人体有害,且受半衰期限制等缺点,科学工作者们开始探索用非放射性的标记物标记核酸探针进行原位杂交。Bauman(1981)等首先应用荧光素标记cRNA探针做原位杂交,然后用荧光显微镜观察获得成功。Shroyer(1982)报道用2,4二硝基苯甲醛(DNP)标记DNA探针,使该DNA探针具有抗原性,然后用兔抗DNP的抗体来识别杂交后的探针,最后经免疫过氧化物酶的方法来定位杂交探针。这两种方法至今仍有采用,但因敏感度不够高,应用不够普遍。
Pezzella(1987)创建了用磺基化DNA探针来做细胞或组织原位杂交的方法,其基本原理是使DNA探针的胞嘧啶碱基磺基化,利用单克隆抗体识别磺基化探针,再通过免疫组化方法显示结合的单克隆抗体,从而对杂交结合的探针进行定位。本法的优点是磺基化DAN探针标记简便,不需作缺口平移标记,敏感度也较高。但自生物素和高辛标记探针技术建立后,已有取而代之的趋势。生物素标记探针技术是Brigat(1983)首先建立的,它利用生物素标记的探针在组织切片上检测了病毒DNA,通过生物素与抗生物素结合,过氧化物酶-抗过氧化物酶显示系统显示病毒DNA在细胞中的定位。生物素标记探针技术目前已被广泛应用,特别是在病毒学和病理学的临床诊断中。这种生物素标记技术又叫酶促生物素标记技术。另一种叫光促生物素标记核酸技术,该技术是用光敏生物素(Photobiotin)标记核酸。目前应用的光敏生物素有乙酸盐和补骨脂素生物素,它们都是由三个部分组成:光敏基团、连结臂和生物素(图20-1)。在强光下,不需酶反应,光敏生物素的光敏基团即可与核酸中的碱基相结合。光敏生物素标记核酸,方法简单,灵敏度也不低,但标记效率不高,每100~150个碱基才能标记一个生物素,对于短的基因探针特别是寡核苷酸探针不宜使用,以免因标记数过少而影响灵敏度(Forster et al 1985)。

图20-1 光敏生物素结构图
近年来,地高辛(Digoxigonin)标记技术引起科技工作者的极大兴趣。Boeringer Mannhem Bio-chemisca于1987年将地高辛标记的有关试剂及药盒投放市场。和其它非放射性标记物一样,地高辛较放射性标记系统安全,方便、省时间。同时在敏感性和质量控制方面比生物素标记技术要优越,可以检测出人基因组DNA中的单拷贝基因。地高辛标记法显示的颜色为紫蓝色(标记碱性磷酸酶-抗碱性磷酸酶显色系统),有较好的反差背景。
核酸探针根据标记方法的不同可粗略分为放射性探针和非放射性探针两类。根据探针的核酸性质不同可分为DNA探针、RNA探针、cDNA探针、cRNA探针和寡核苷酸探针等。DNA探针还有单链DNA(Single stranded, ssDNA)和双链DNA(Double stranded, dsDNA)之分(详见十九章 )。早期应用的主要是DNA探针,继之Temin在70年代研究致癌RNA病毒时制备了cDNA探针(complementaryDNA),其基本原理是以RNA为模板,经逆转录酶(reversetranscriptase)又称为RNA指导的DNA聚合酶催化产生的。该酶以RNA为模板,按照RNA的核苷酸顺序合成DNA,这一途径与一般遗传信息流的方向相反,故称逆转录。CDNA是指互补于mRNA的DNA分子。RNA探针是将特异性的cDNA片段插入含有相当的RNA聚合酶启动子的转录性载体。这类载体包括pSP64和pSP65,它们具有不同的启动子在多克隆位点的各侧。Psp64和pSP65在sP6启动子的多克隆位点的方向是不同的。通过改变外源基因的插入方向或选用不同的RNA聚合酶,可以控制RNA的转录方向,即以哪条DNA链为模反转录RNA。从而可以得到与mRNA同序列的同义RNA探针(Sense probe)和与mRNA互补的反义RNA探针(antisense probe),又称互补RNA探针(complementary RNA probe , cRNA)。通常用同义RNA探针做为反义RNA探针的阴性对照。由于RNA探针是单链分子,所以它与靶序列的杂交反应极高。有报告认为其杂交率高于DNA探针的8倍。
DNA合成仪的诞生使制造寡核苷酸探针成为可能,与上述探针不同的是寡核苷酸探针不是克隆性DNA探针,它是由DNA合成仪依照所需杂交的靶核苷酸序列合成的。具有制造方便,价格低廉的优点,也可进行放射性与非放射性标记,但其特异性不如克隆性探针强,亦不如其杂交信号高。
原位杂交组织化学技术在近20年的发展可以说是飞跃的,其突出的特点是由分子遗传学研究提供的探针大量增加,探针生产的可靠性和速率大大发展了,更重要的是非放射性标记物的发展使原位杂交组织化学技术在不久的将来将和现今的免疫细胞化学技术一样成为实验室的常规技术和临床日常应用的诊断技术。新的非放射性标记技术正在继续不断涌现。Coulton(1991)建议将非放射性标记技术更名为亲合复合物标记技术(Affinity – Complex Labelled Probes, ACLP )。因为“非(non)“在英文里是一个否定的名词,而且根据非放射性标记技术的原理是将一个标记物利用其亲合性,应用直接或间接的方法结合在核苷酸分子上。
原位杂交组织化学技术在生命科学的研究中可视为一项革命性的技术。它使它们的研究从器官、组织和细胞水平走向分子水平。为各个学科的研究带来突破性的进展。其中特别突出的是细胞或组织的基因表达、染色体分析、病毒诊断和发育生物学。我们在下节 将详加叙述。
三、原位杂交组织化学技术的基本方法
如前所述,由于核酸探针的种类和标记物的不同,在具体应用的技术方法上也各有差异,但其基本方法和应用原则大致相同。大致可分为:①杂交前准备,包括固定、取材、玻片和组织的处理,如何增强核酸探针的穿透性、减低背景染色等;②杂交;③杂交后处理;④显示(visual-ization):包括放射性自显影和非放射性标记的显色。
(一)固定
原位杂交组织化学技术(In Situ HybridizationHistochemistry, ISHH)在固定剂的应用和选择上应兼顾到三个方面:保持细胞结构,最大限度地保持细胞内DNA或RNA的水平;使探针易于进入细胞或组织。DNA是比较稳定的,mRNA是相对稳定的但易为酶合成和降解。RNA却绝然不同,非常容易被降解。因此,对于DNA的定位来说,固定剂的种类和浓度并不十分重要。相反,在RNA的定位上,如果要使RNA的降解减少到最低限度,那么,不仅固定剂的种类浓度和固定的时间十分重要,而且取材后应尽快予以冷冻或固定。在解释ISHH的结果时应考虑到取材至进入固定剂或冰冻这段时间对RNA保存所带来的影响,因组织中mRNA的降解是很快的。在固定剂中,最常用的是多聚甲醛。和其它的固定剂(如戊二醛)不同,多聚甲醛不会与蛋白质产生广泛的交叉连接,因而不会影响探针穿透入细胞或组织。其它如醋酸-酒精的混合液和Bouin’s固定剂也能获得较满意的效果。对于mRNA的定位,我们常采用的方法是将组织固定于4%多聚甲醛磷酸缓冲液中1~2h,在冷冻前浸入15%蔗糖溶液中,置4℃冰箱过夜,次日切片或保存在液氮中待恒冷箱切片机或振荡切片机切片。组织也可在取材后直接置入液氮冷冻,切片后才将其浸入4%多聚甲醛约10min,空气干燥后保存在-70℃。如冰箱温度恒定,在-70℃可保存数月之久不会影响杂交结果。在病理学活检取材多用福尔马林固定和石蜡包埋,这种标本对检测DNA和mRNA有时也可获得杂交信号,但石蜡包埋切片由于与蛋白质交叉连接的增加,影响核酸探针的穿透,因而杂交信号常低于冰冻切片。同时,在包埋的过程中可减低mRNA的含量。其它固定剂如应用多聚甲醛蒸汽固定干燥后的冷冻切片也可获得满意效果。各种固定剂均有各自优缺点,如沉淀性(Precipitating)固定剂:酒精/醋酸混合液、Bouin’s液、Carnoy’s液等能为增加核酸探针的穿透性提供最佳条件,但它们不能最大限度地保存RNA,而且对组织结构有损伤。戊二醛能较好地保存RNA和组织形态结构,但由于和蛋白质产生广泛的交叉连接,从而大大地影响了核酸探针的穿透性。至今,多聚甲醛仍被公认为ISHH较为理想的固定剂。
(二)玻片和组织切片的处理
1.玻片的处理玻片包括盖片和载片应用热肥皂刷洗,自来水清洗干净后,置于清洁液中浸泡24h,清水洗净烘干,95%酒精中浸泡24h后蒸馏水冲洗、烘干,烘箱温度最好在150℃或以上过夜以去除任何RNA酶。盖玻片在有条件时最好用硅化处理,锡箔纸包裹无尘存放(硅化方法见附录)。
由于ISHH的实验周期长,实验程序繁杂,因此,要应用粘附剂预先涂抹在玻片上,干燥后待切片时应用,以保证在整个实验过程中切片不致脱落。常用的粘附剂有铬矾-明胶液,其优点是价廉易得,但在长周期实验过程中,粘附效果不够理想。多聚赖氨酸液具有较好的粘附效果,但价格昂贵,需进口。近年Vector Lab (U.S.A.)推出一种新的粘附剂叫VectorbandReagent,每一单位包装可制备500~700张载玻片,粘附效果极佳,价格较多聚赖氨酸便宜,制片后可长期保存应用。目前国内尚无生产,需国外进口(配方见附录2)。
2.增强组织的通透性和核酸探针的穿透性此步骤根据应用固定剂的种类、组织的种类、切片的厚度和核酸探针的长度而定。比如用戊二醛固定的组织由于其与蛋白质产生广泛的交叉连接就需要应用较强的增强组织通透性的试剂。增强组织通透性常用的方法如应用稀释的酸洗涤、去垢剂(detergent)或称清洗剂Triton X-100、酒精或某些消化酶如胃蛋白酶、胰蛋白酶、胶原蛋白酶和淀粉酶(diastase)等。这种广泛的去蛋白作用无疑可增强组织的通透性和核酸探针的穿透性,提高杂交信号,但同时也会减低RNA的保存最和影响组织结构的形态,因此,在用量及孵育时间上应慎为掌握。
蛋白酶K(ProteinaseK)的消化作用在ISHH中是应用于蛋白消化的关键步骤,其浓度及孵育时间视组织种类、应用固定剂种类、切片的厚薄而定。一般应用酶k 1μg/ml(于0.1mol/l Tris/50mmol/LEDTA, pH8.0缓冲液中),37℃孵育15~20min,以达到充分的蛋白消化作用而不致影响组织的形态为目的。蛋白酶K还具有消化包围着靶DNA的蛋白质的作用,从而提高杂交信号。在蛋白酶K消化后,应用0.1mol/L的甘氨酸溶液(在PBS中)清洗以终止蛋白酶K的消化作用,甘氨酸是蛋白酶K的抑制剂。为保持组织结构,通常用4%多聚甲醛再固定。Burns等(1987)报告应用胃蛋白酶(Pepsin)20~100μg/ml(用0.1n HCl 配)37℃、30min进行消化,所获实验结果优于蛋白酶K。
不少实验工作者在多聚甲醛固定后,浸入乙酸酐(aceticanhydride)和三乙醇胺(tri-ethanolamine)中以减低静电效应,减少探针对组织的非特异性背景染色。有的作者除在室温下浸于上述溶液10min外,还在预热37℃的50%甲酰胺/2×SSC液中预杂交15min,然后用2×SSC,0.30mol/lNaAc/0.030mol/L枸橼酸钠液中浸15min。但Heinz、Hofer等一些著名学者却对此持有异议,根据他们的实验和经验证明,乙酸酐和三乙醇胺液的处理并不能起到减低背景的目的,不能改善ISHH的信/噪比例。
3.减低背景染色和免疫细胞化学染色一样ISHH实验程序中,如何减低背景染色是一个重要的问题。ISHH中背景染色的形成是诸多因素构成的。杂交后(Posthybridization )的酶处理和杂交后的洗涤均有助于减低背景染色。
预杂交(Prehybridization)是减低背景染色的一种有效手段。预杂交液和杂交液的区别在于前者不含探针和硫酸葡聚糖(Dextransulphate)。将组织切片浸入预杂交液中可达到封闭非特异性杂交点的目的,从而减低背景染色。
有的实验室在杂交后洗涤中采用低浓度的RNA酶溶液(20μg/ml)洗涤一次,以减低残留的和内源性的RNA酶,减低背景染色。
4.防止RNA酶的污染由于在手指皮肤及实验用玻璃器皿上均可能含有RNA酶,为防止其污染影响实验结果,在整个杂交前处理过程都需戴消毒手套。所有实验用玻璃器皿及镊子都应于实验前一日置高温(240℃)烘烤以达到消除RNA酶的目的。要破坏RNA酶,其最低温度必须在150℃左右。有条件的国外实验室在消毒的玻璃器皿外包以锡箔纸以利于标记和防止取出时空气污染。在无高温消毒的烤箱时,亦可用国内出产的卫生蒸汽消毒锅(山东新华医疗器材厂生产)。杂交前及杂交时所应用的溶液均需经高压消毒处理。
(三)杂交(Hybridisation)
在ISHH,整个实验周期是比较长的,实验程序也比较繁杂,而杂交在ISHH整个实验中可被认为是“短兵相接”的一步。杂交前的一切准备工作如增加组织通透性都是为了在杂交这一步骤中核酸探针能进入细胞或组织与其内的靶核苷酸相结合。因此,杂交是ISHH中关键的而且是最重要的一个环节 。
杂交是将杂交液滴于切片组织上,加盖硅化的盖玻片。国内向正华等采用无菌的蜡膜代替硅化的盖玻片也可获得满意的实验结果。加盖片的目的是防止孵育过程中的高温(50℃左右)导致杂交液的蒸发。因此,也有为稳妥起见,在盖玻片周围加液体石蜡封固的,但作者认为这并不十分必要,因封固的石蜡在高温下融解反易导致杂交液的污染,必要时可加橡皮泥封固盖片四周。硅化的盖玻片的优点是清洁无杂质,光滑不会产生气泡和影响组织切片与杂交液的接触,盖玻片自身有一定重量能与有限的杂交液吸附达到覆盖和防止蒸发的作用。在孵育时间较长时,为保证杂交所需的湿润环境,可将复有硅化盖玻片进行杂交的载片放在盛有少量5×SSC或2×SSC(standardsaline citrate, SSC)溶液的硬塑料盒(要能防止高温破坏)中进行孵育。杂交液的成分和预杂交液基本相同,所不同的是加入了标记的核酸探针和硫酸葡聚糖(配方见附录)。
如前所述,杂交前的准备只是为杂交的成功奠定基础,要获得满意的实验结果,在杂交这一实验过程中还须注意以下的环节 。
1.探针的浓度很难事先确定每一种实验探针的浓度,但要掌握一个原则,即探针浓度必须给予该实验最大的信/噪比值。背景染色的高低也与探针浓度有关。根据国内外实验工作者的经验,认为最佳原则应是应用最低探针浓度以达到与靶核苷酸的最大饱和结合度为目的。这和我们在免疫细胞化学试验中选择抗血清的最佳工作浓度的原则一样。
探针浓度依其种类和实验需要略有不同,根据笔者的经验及所查阅文献,在原位杂交细胞化学中,探针浓度为0.5~5.0μg/ml(即0.5~5.0ng/μl)。根据Heinz 、Hofelt实验室经验,对放射性标记的dsDNA或cRNA探针,其浓度在2~5ng/μl。Conlton认为生物素标记探针,其最佳浓度在0.5~5ng/μl。作者在英皇家研究生院Polak教授实验室应用于放射性标记cRNA探针的浓度为0.5ng/μl,而在非放射性标记(生物素或地高辛)cRNA探针浓度为2.5ng/μl,放射性标记DNA探针浓度为1.0ng/μl。向正华等应用地高辛标记生长抑素cRNA探针获得满意结果,其探针浓度为0.5ng/μl。
必须强调的是,国内外实验室都证明加杂交液的量要适当,以10~20μl/每张切片为宜。杂交液过多不仅造成浪费,而且液量过多常易致盖玻片滑动脱落,影响杂交效果,过量的杂交液含核酸探针浓度过高,反易导致高背景染色等不良后果。
2.探针的长度一般应用于ISHH探针的最佳长度应在50~100个碱基之间。探针短易进入细胞,杂交率高,杂交时间短。据报告,长500个碱基的探针,其杂交时间约需20h左右。200~500个碱基的探针仍可应用,如超过500个碱基的探针则在杂交前最好用碱或水解酶进行水解,使其变成短的片段,达到实验所需求的碱基数。
附:核酸探针水解法(以放射性标记探针为例)
(1)按下列比例混合
探针溶解于水160μl无菌蒸馏水加入含标记探针沉淀物的Eppendrof管中
0.4mol/L NaHCO320μl
0.6mol/L Na2CO320μl
混合后孵育于60℃水浴,其孵育时间由下式推算:
孵育时间= LO–Lf/K×LO–Lf
LO:核酸探针原长度(Kb)
Lf:核酸探水解后所需长度(Kb)
K:是一常数0.11Kb/min
(2)在室温中加入下列配方以终止水解
3mol/L 醋酸钠 6.6μl(最终浓度0.1mol/L)
醋酸1.3μl(最终浓度0.5%)
(3)加下列配方沉淀探针
7mol/L 醋酸铵100μl
100%乙醇750μl
tRNA(10mg/ml) 2μl
置于—20℃2h后回暖至室温,在14000rpm离心30min。
(4)小心将乙醇轻轻倾出,待试管内干燥后再用无菌蒸馏水稀释到10ng/μl浓度。
(5)应用放射性标记测定法测定其放射比活性(详见第十九章 ),然后调到5ng/μl浓度。
3.杂交的温度和时间杂交的温度也是杂交成功与否的一个重要环节 。在第十八章 概述中曾提到DNA或RNA需加热或变性、解链后才能进行杂交。能使50%的核苷酸变性解链所需的温度,叫解链温度或融解温度(melting temperature, 简称Tm)。原位杂交中,多数DNA探针需要的Tm是90℃,而RNA则需要95℃。这种高温对保存组织形态完整和保持组织切片粘附在载玻片上是不可能的。因此,在杂交的程序中常规的加入30%~50%甲酰胺(for-mamide)于杂交液中。McConaughy报告,反应液中每增加1%的甲酰胺浓度,Tm值可降低0.72℃。因此,可用调节 盐浓度的办法来调节 Tm。Tm的计算公式在第十九章 有介绍,由公式的列出也表明了它与盐的浓度、探针的长度、甲酰胺的百分比等诸多因素有关。由于盐和甲酰胺浓度的调节 等因素,实际采用的原位杂交的温度在Tm-25℃左右,即比Tm减低25℃,大约在30~60℃之间,根据探针的种类不同,温度略有差异,RNA和cRNA探针一般在37~42℃左右,而DNA探针或细胞内靶核苷酸为DNA的,则必须在80~95℃加热使其变性,时间5~15min,(有作用报告在105℃微波炉加热使之变性),然后在冰上搁置1min,使之迅速冷却,以防复性,再置入盛有2×SSC的温盒内,在37~42℃孵育杂交过夜。
杂交的时间如过短会造成杂交不完全,而过长则会增加非特异性染色。从理论上讲,核苷酸杂交的有效反应时间在3h左右。Barns等(1987)报告用DNA探针杂交,其反应完成时间为2~4h。但为稳妥起见,一般将杂交反应时间定为16~20h,或为简便起见杂交孵育过夜,从现有文献报告看无不良结果。当然,杂交反应的时间与核酸探针长度与组织通透性有关,在确定杂交反应时间应予考虑,并经反复实验确定。
有作者主张杂交反应的孵育应在黑暗环境中进行,因为光线会促进甲酰胺的电离作用。
4.杂交严格度(Hybridizationstringency)杂交条件的严格度(stringency)表示通过杂交及冲洗条件的选择对完全配对及不完全配对杂交体的鉴别程度。错配对(mismatch)杂交的稳定性较完全配对杂交体差,因此,通过控制杂交温度、盐浓度等,可减弱非特异性杂交体的形成,提高杂交的特异性。所以,杂交的条件愈高,特异性愈强,但敏感性降低,反应亦然。一般来说,低严格度(lowstringency)杂交及冲洗条件在Tm -35℃至Tm –40℃之间,高盐或低甲酰胺浓度。在这种条件下,大约有70%~90%的同源性核苷酸序列被结合,其结果是导致非特异性杂交信号的产生。中严格度,Tm -20℃至Tm-30℃的范围。高严格度(high stringency)为Tm-10℃至Tm-15℃,低盐和高甲酰胺浓度。在这种条件下,只有具有高同源性的核苷酸序列才能形成稳定的结合。麦跃行装用地高辛标记原位杂交技术检测尖锐湿疣中人乳头瘤病毒DNA型别,结果发现在严格条件下(Tm-12℃)各型病毒DNA的检出率和阳性率明显低于非严格条件下(Tm-35℃),其相差非常明显(P<0.001)。因为,在严格条件下只有同源性很强的DNA才被检出,而在非严格条件下同源性较低的DNA序列也被检出。因此,他建议对病毒DNA分型需在高严格条件下进行,而低严格条件则可用于对病毒感染进行筛选。
由于原位杂交技术多数是在Tm-25℃进行的,不属于高严格范围,无疑会产生非特异性结合导致信/噪比减低。在这种情况下,可用加强杂交后处理洗涤的严格度使非特异性的杂交体减少。由于RNA杂交的稳定性,应用cRNA探针进行细胞或组织的原位杂交时的杂交温度比其它核酸探针要高10~15℃。实验证明,cRNA产生的信号比双链cDNA要强。单链的RNA探针其杂交信号大于双链的cDNA的约8倍。
5.硫酸葡聚糖(Dextransulphate)和甲酰胺(formamide)硫酸葡聚糖是核酸杂交液中仅次于甲酰胺的一种组成成份。在杂交液中,甲酰胺占50%左右,而硫酸葡聚糖占10%左右。它是一种大分子的多聚胺化合物,具有极强的水合(hydrate)作用,因而能大大增加杂交液的粘稠度。硫酸葡聚糖的主要作用是促进杂交率,特别是对双链核酸探针。这是应用硫酸葡聚糖于杂交液中的主要目的。
甲酰胺的主要作用在上节 已提及,在调节 杂交反应温度方面,甲酰胺起了极为重要的作用,从而有助于保持组织的形态结构。甲酰胺还可防止在低温时非同源性片段的结合,但甲酰胺具有破坏氢键的作用从而具有一种不稳定的作用。
(四)杂交后处理(posthybridisation treatment)
杂交后处理包括系列不同浓度,不同温度的盐溶液的漂洗。在原位杂交组织化学的实验程序中,这也是一个重要的环节 。特别因为大多数的原位杂交实验是在低严格度条件下进行的,非特异性的探针片段粘附在组织切片上,从而增强了背景染色。RNA探针杂交时产生的背景染色特别高,但能通过杂交后的洗涤有效地减低背景染色,获得较好的反差效果。在杂交后漂洗中的RNA酶液洗涤能将组织切片中非碱基配对RNA除去。洗涤的条件如盐溶液的浓度、温度、洗涤次数和时间因核酸探针的类型和标记的种类不同而略有差异,一般遵循的共同原则是盐溶液浓度由高到低而温度由低到高。必须注意的是在漂洗的过程中,切勿使切片干燥。干燥的切片即使大量的溶液漂洗也很难减少非特异性结合,从而增强了背景染色。放射性标记探针杂交后漂洗过程中可用底片曝光的方法检测背景染色(非特异性标记的多少)作为改善漂洗程序的指针。在35S标记的核酸探针在漂洗液中须加入14mmol/L的β-巯基乙醇(β-mercaptoethanol)或硫代硫酸盐(thiosulphate),以防止35S标记的核酸探针被氧化。总之,如何控制漂洗的严格度从而达到理想的信/噪比无既定方案可循,必须从反复的实践中取得经验。
(五)显示(Visualization)
显示又可称为检测系统(Detectionsystem)。根据核酸探针标记物的种类分别进行放射自显影或利用酶检测系统进行不同显色处理(详见本章 第二节 )。
细胞或组织的原位杂交切片在显示后均可进行半定量的测定,如放射自显影可利用人工或计算机辅助的图象分析检测仪(computer –assisted image analysis)检测银粒的数量和分布的差异。非放射性核酸探针杂交的细胞或组织可利用酶检测系统显色,然后利用显微分光光度计或图像分析仪对不同类型和数量的核酸的显色强度进行检测。但利用ISHH做半定量测定必须注意严格控制实验的同一条件,切片的厚度和核酸的保存量如取材固定的间隔时间等。如为放射自显影,核乳胶膜的厚度与稀释度等必须保持一致。
(六)对照实验和ISHH结果的判断
和其它实验方法一样,并非ISHH的任何阳性信号都是特异性的,故必须同时有对照试验以证明其特异性。对照试验的设置须根据核酸探针和靶核苷酸的种类和现有的可能条件去选定,常用的对照试验有下列几种(表20-1)。
表20-1 ISHH对照试验一览表
| 核乳胶或非放射性检测系统对照试验 |
| Northern 或Southern印迹杂交法* |
| ISHH与免疫细胞化学结合* |
| 应用多种不同的核苷酸探针与同一靶核酸进行杂交 |
| 将cDNA或cRNA探针进行预杂交(吸收试验)* |
| 与非特异性(载体)序列和不相关探针杂交(置换试验) |
| 将切片应用RNA酶或DNA酶进行预处理后杂交* |
| 应用同义RNA探针(Sense probe)进行杂交* |
| 以不加核酸探针杂交液进行杂交(空白试验) |
| 组织对照用已知确定为阳性或阴性组织进行ISHH对照 |
| 应用未标记探针做ISHH,进行对照 |
从理论上讲,对照试验设置愈多其靶核苷酸特异性确定愈可靠,但现实是不可能的。因此,在上述对照试验中应任选设至少3~4种用以证实ISHH结果的可靠性。在上述试验中,标明*者为比较可靠的对照试验。①Northern 和Southern印迹杂交法证明的方式和用Western印迹法检测抗体(蛋白质)的特异性一样,是比较可靠的。②如果具备相当的免疫组化抗血清,可用结合的免疫组织化学和ISHH法从蛋白质(或多肽)水平和转录水平在相邻切片或同一切片中证明同一种多肽和相应mRNA共存于同一细胞中。③预先将切片用DNA酶或RNA酶消化,然后用ISHH技术证明丢失的是DNA或RNA。如同免疫组化的吸收试验一样,事先与特异性的cRNA或cDNA进行杂交。再进行ISHH,其结果应为阴性。④由于同义RNA探针和组织内mRNA序列顺序是相同的,应用其进行ISHH,结果应为阴性。检测系统的对照如乳胶或酶显色系统也应在无标记探针的情况下进行。
ISHH的最大优点是它的高度特异性,它可测定组织、培养的单个细胞或细胞提取物中的核苷酸含量。应用高敏感度的放射性标记cRNA探针在理想的ISHH的实验条件下检测mR-NA,其敏感度可达到20个mRNA拷贝/每个细胞。由于双链DNA的稳定性,在用ISHH定位DNA时很少发生丢失,降解。在靶核苷酸序列比较伸展的情况如染色体铺片,长于2kb的探针可以应用。因此,其敏感性高到能够出在染色体铺片上,有时甚至在组织切片上的单个基因拷贝。正因为如此,对ISHH结果的解释应持慎重态度,特别是前人未报告过的新发现。因为如前所述,影响ISHH实验结果的因素太多,比如在外科或实验取材后未及时的固定或冷冻可由于组织中mRNA的降解而导致假阴性结果。另外,在各种类型核酸探针进入细胞、组织和各种器官的能力,又叫可接近性(acessiblity)各异。这些诸多因素都将影响ISHH的实验结果。
第二节 cRNA探针在原位杂交组织化学(ISHH)中的应用
Angerer及其同事们首先应用RNA探针于原位杂交(见Cox et al 1984),核酸探针为单链的RNA分子,产生自具有质粒逆转录系统的cDNA克隆(图20-2)。由于它是单链的,不像双链的DNA探针,在溶液中不会再退火(reanneal),因此,较大百分比的探针可参与杂交反应,较cDNA探针的信号强。除此之外,在溶液中产生的cRNA-mRNA杂交体比相应的cDNA-mRNA杂交体稳定,但在原位杂交中是否如此尚未证明。cRNA探针不足之处在于有时比DNA探针粘性强(stickier)。可与组织产生较高的非特异性结合,但此缺陷可在杂交后漂洗液中加用酶漂洗来解决。最近,Wolf等(1987)建议插入确定长度的寡核苷酸至载体内产生cRNA分子,这种cRBA分子称为“寡核苷酸核酸探针”(oligoribo-probes)已被成功的用于原位杂交实验。

图20-2 示cDNA转录为cRNA,可标记以不同的标记物,然后与细胞中的mRNA相结合。Biotin(生物素),Au(金),digo-(地高辛)
一、同位素标记cRNA探针在ISHH中的应用
(一)组织切片的原位杂交细胞化学方法
(1)组织准备:大鼠以10%水合氯醛(0.3ml/100g 体重),或1%戊巴比妥钠约1ml(3~4mg/100g体重)腹腔内注射麻醉,用100ml生理盐水冲洗和150ml 4%多聚甲醛主动脉灌注固定。固定半小时后,取出组织块,置入4%多聚甲醛液中后固定4~6h,4℃。
如要取脑组织,可于灌注后置4℃冰箱内过夜,次晨取脑组织,后固定4℃4h左右。
(2)组织切片/培养细胞在经过处理,抹以粘附剂的载片上,在43℃烤箱过夜。
(3)在PBS(0.1mol/l Ph7.2)中浸5~10min。
(4)浸于0.1mol/L甘氨酸—PBs 液内5min。
(5)为增强组织通透性,将载片置于0.3%Triton X-100(在PBS内)10~15min。
(6)PBS洗3×5min。
(7)在蛋白激酶K(1μg/ml)溶于Tris –HCl (0.1mol/L, pH8.0)和EDTA(50mmol/L,pH8)中37℃20min。也有用蛋白激酶K溶液,不加EDTA的。
(8)浸入新鲜配制的4%多聚甲醛(在PBS0.1mokl/L,pH7.2)3min以终止消化作用和再固定。
(9)浸入新鲜配制的含0.25%(V/V)三乙醇胺(0.1mol/l pH8.0)中,10min以达乙酰化(acetylate)的目的。
(10)预杂交:在50%(V/V)甲酰胺溶于4×SSC预热37℃15~45min 。
(11)杂交:将载片上过量的甲酰胺液倾去,加20μl杂交混合液(含放射性同位素标记的探针量为5×103~106cpm/每张载片)。覆以硅化的盖玻片,置于盛有少量5×SSC的硬塑料盒内以保持湿度,42℃孵育12~18h。为使载片不致于浸泡于SSC溶液内,通常以二根玻管(或棒)扎成担架状,载片置于玻棒上,与盐液不接触,但可保持盒内空气湿润。
(12)杂交后漂洗
①以小烧杯盛适量4×SSC溶液,将载片一端斜插入溶液内,轻轻抖动以移除盖玻片。
②将载片置于有刻度的染色用小方玻缸内,加入42℃(预热)4×SSC,3×20min。在漂洗过程中宜不断振动,以增强漂洗效果。如设有调整钮的振动台更为理想。
③加20μlRNA酶溶液(20μg/ml)在NaCl(0.5mol/L)、Tris –HCl (pH8.0)和EDTA(1mmol/L,pH8.0)消化未杂交探针,42℃30min(也有不加EDTA的)。
④以递减梯度盐溶液SSC漂洗载片:2×SSC,0.1×SSC和0.05×SSC各30min 42℃。
⑤梯度酒精脱水:70%,90%,2×100%酒精含0.3mol/L乙酰胺,室温,每次10min,空气干燥后待进行放射自显影。
(13)放射自显影和复染
①在暗室中预热水浴至45℃,将分装的核乳胶溶液小瓶置水浴中浸泡至少1h,同时预热一电热板至45℃。将杂交后漂洗过完全干燥的载片依次排列于玻片架上,有组织切片一面面向实验者。在实验的载玻片前放1~2张无切片的干净玻片,作为测定核乳胶溶解度与浸片高度等的空白对照片。浸泡(Dipping)过核乳胶膜的载片放入暗盒内,事先最好将暗盒准备好,为保持干燥,放入一包变色硅胶干燥剂(无水干燥剂为小块蓝色晶体,吸水后呈粉红色,置烤箱中烘干待转成蓝色后可重复应用),预先备好封固暗盒用的胶带备用。
②核乳胶液,国外产品为ILFord K5乳胶液,国内核乳胶产品可自原子能研究所订购。不论国产或进口乳胶,事先应(按说明需要浓度)稀释分装在10ml小瓶内,密封于暗盒内,4℃备用。反复的冷冻和融解核乳胶会增加背景染色。每一小瓶供一次性实验应用。
为节 省核乳胶,切片宜贴附在靠近载片的一端。这样,在浸泡时少量乳胶便可充分覆盖切片。
③浸核乳胶(Dipping):当一切准备工作就绪后,在暗室中(只留完全灯)先将载片置于电热板上预热1~2min。以空白载片浸入核乳胶液,取出后检查核乳胶是否充分溶解,玻片上有无气泡。然后正式进行切片浸入。浸核乳胶膜是一项需反复操练的技术。以拇、食指夹住玻片一端,以垂直方向进入乳胶,进入的提出均应采取中速度,且速度应保持稳定,提出后可将玻片一端滴下的乳胶轻沾于吸水纸上,掌握好该技术,浸入形成的核乳胶膜厚度适当,均匀一致。依序放在预热45℃的电热板,倾斜度应一致。在45℃电热板上干燥至少1~2h,在此期间应严格控制在黑暗中。
④装入暗盒曝光:将载片架上已干燥覆有核乳胶的载片放入暗盒内,周围用胶带封固,以标签写明:样品种类,实验者姓名,曝光日期等放在4℃冷房或冰箱内。曝光时间依同位素种类而异,32P大约需5~7日,3H需4周,但还要参考细胞内mRNA的含量而定,含量高者曝光时间宜短,反之宜适当延长。可根据不同曝光时间的实验结果予以调整。曝光时间长可增加信号,但也增加背景,反之,信号减弱,但背景亦低。
⑤显影:取出切片中暗盒(注意:切勿启封),放在室温至少1h,使其回升到室温。然后在暗室内(只留安全灯),将载片置入Kodax D19显影液(预调温至18~20℃)3min。水冲片刻后入Kodax F24固定剂内3min。上述溶液及水温最好都保持在18~20℃。突然改变溶液温度会损坏精细的核乳胶膜。另外,在显影和定影过程中不要振荡溶液,因为,这时的乳胶还是处于胶状结构,溶液振荡的冲击可使乳胶膜产生划痕。
⑥冲洗,脱水和复染:用自来水(水冲力勿过猛)冲洗载片20min,如需要可用1%苏木精复染,复染后自来水冲洗分化2min,梯度酒精脱水(70%,90%,100%)每次3min,二甲苯透明,DPX封片。
(二)培养细胞的原位杂交细胞化学方法
(1)固定:通常将细胞培养在盖玻片或塑料薄膜上,可将盖玻片取出,倾去培养液,用4%多聚甲醛液固定2~4h后,依组织切片处理法进行ISHH实验。也有在4%多聚甲醛室温固定20min后,由低浓度30%,50%,70%酒精各3min ,保留在新鲜配制的70%酒精中,4℃,备用。
(2)重回到水:50%,30%酒精3min,无菌重蒸水2×3min,然后置入PBS含5mmol/l MgCl210min,室温(配制法:200ml PBS, 1ml MgCl2)。
(3)0.1mol/L甘氨酸/Tris pH7.4:室温10min(0.1mol/L 甘氨酸,0.2mol/l Tris(配制法:1.5mg甘氨酸和20ml Tris,应用重蒸水制成200ml)。
以后步骤同(一)组织切片法。
二、生物素标记cRNA探针在原位杂交组织化学中的应用
(一)光敏生物素标记cRNA探针的应用
以线性质粒DNA为模板合成未加标记物的cRNA探针,使其最终浓度为0.5~1.0μg/μl(500~1000ng/μl),再与等体积的光敏生物素(1μg/μl)混合。在150瓦卤素灯下,距离光源20cm处照射30min。用仲丁醇抽提游离生物素,再用丁醇沉淀回收光敏生物素cRNA探针,将其溶于适量的灭菌双蒸水,用紫外分光亮度计测探针的光密度(详第十九章 ),其最佳工作浓度为2μg/ml。
切片的制作、预处理、预杂交、杂交和杂交后冲洗的方法同概述中基本方法一节 。
光敏生物素核酸探针原位杂交组化程序:
(1)石蜡切片脱蜡入水后,置0.1mol/l PBS pH7.2冲洗5min;冰冻切片直接入PBS冲洗5min。
(2)0.1mol/l 甘氨酸PBS冲洗5min。
(3)0.4%Trition X-100 PBS 冲洗15min。
(4)蛋白酶K1μg/ml(0.1mol/l Tris –HCl pH8.0, 50mmol/L EDTA配)37℃保温30min。
(5)4%多聚甲醛PBS固定5min。
(6)0.1mol/l PBS冲洗2×3min。
(7)0.25%乙酸酐(0.1mol/l 三乙醇胺配制)10min。
(8)2×SSC冲洗10min(1×SSC:0.15mol/l NaCl, 0.015mol/L 柠檬酸钠)。
(9)取10μl含相应探针的杂交液滴于标本上,如果是cDNA探针则用前将探针于95℃水浴中保温10min,马上放入冰浴中冷却,然后再用。
(10)盖上22×22mm的硅化盖片或合适大小的蜡膜,入温盒43℃保温12~16h。
(11)4×SSC洗脱盖片,并在同一液中37℃漂洗10~30min。
(12)2×SSC(含20μg/mlRNaseA, 适于RNA探针)冲洗30min,37℃。
(13)1×SSC,0.1×SSC,37℃各漂洗10~30min。
(14)0.05mol/l PBS 冲洗4×5min。
(15)3%BSA(0.4%Triton X-100 PBS配)37℃保温30min。
(16)Avidin –AKP(碱性磷酸酶)(1:500~1:100,0.4%Triton X-100 PBS配)室温1~3h。
(17)0.05mol/l PBS冲洗4×5min。
(18)TSM1冲洗2×5min。
(19)TSM2冲洗2×5min。
(20)硝基四氮唑蓝(NBT)0.4%mg/ml 和5-溴-4-氯-3-吲哚基-磷酸(BCIP)0.2mg/ml混合液显色,室温,暗处3h。
(21)20mmol/l EDTA,pH8.0终止显色。
(22)甘油明胶直接封片。
结果:杂交阳性部位着蓝黑色。
组织处理及预杂交所用器皿需高温消毒,实验者需戴手套。
(三)酶促生物素标记cRNA探针的应用
基本方法和放射性标记cRNA探针同,所不同的是探针浓度为2.5μg/μl。显示探针反应步骤如下。
(1)用PBS冲洗粘附有切片的载片2×3min。根据情况也可用漂洗法。
(2)将载片浸入0.3%H2O2在PBS或甲醇内30min以封闭内源性过氧化物酶。
(3)PBS冲洗2×3min,用吸水纸拭干切片周围的水份,加入小鼠抗生物素血清1:100和PBS含正常羊血清(1:30),室温1h,或4℃过夜。
(4)PBS彻底冲洗。
(5)载片加生物素化抗小鼠IgG(1:100)30min室温。
(6)PBS彻底冲洗。
(7)应用ABC复合物与等量的1%牛血清白蛋白-PBS液混合孵育1h,室温。
(8)PBS彻底冲洗。
(9)将切片覆以新鲜配制的0.025%DAB溶液,0.02%H2O2,孵育3~15min。
(10)水洗,复染,脱水,透明和以甘油/PBS或DPX封固。如需要可用银染,多层ABC或PAP法加强染色效果。
三、地高辛标记cRNA探针的应用
(一)基本原理
地高辛(Digoxigenin 简写Digo-)又称异羟基洋地黄毒甙配基,这种类固醇半抗原仅限于洋地黄类植物,其抗体与其它任何固醇类似物如人体中的性激素等无交叉反应,地高辛配基标记于脱氧尿嘧啶三磷酸核苷(dUTP)上形成digoxigenin –11-dUTP(图20-3)。通过随机引物或缺口翻译法(多用随机引物法),将dig-11-dUTP与探针的核酸分子相连,构成Dig-配基标记的核酸探针。将这种标记的探针与组织、细胞或染色体原位核酸分子之间的同源序列在一定条件下互补杂交,然后用偶联有酶或荧光素的羊抗高地辛抗体Tab(抗原结合片段)结合物作为酶标或荧光标记,再分别用显色底物使杂交部位显色或产生荧光以达到检测目的,其反应过程见图20-3。

图20-3 地高辛标记的探针检测酶联免疫反应
常用的免疫酶学检测方法有两类:一是Dig –HRP(辣根过氧化物酶)检测体系,以DAB(四氢氯化二氨基联苯胺)/H2O2为底物,结果为棕色;或以4-氯-1-萘酚/H2O2为底物,结果为蓝色。另一是Dig –AKP检测体系:以BCIP/NBT为底物,结果为蓝紫色沉淀。与免疫细胞化学方法相似,如应用酶促反应会较单一信号的标记物如荧光素具有更高的灵敏度。同样是酶促化学反应,AKP灵敏度和分辨率较HRP高约10倍左右,但HRP的优点为价廉、稳定。
应用地高辛标记的核酸探针也较稳定,据报告在-20℃贮存可达2年,随时要取用,不像放射性标记探针有半衰期所致的时间限制。但在现实应用中,仍喜欢采用新鲜的地高辛配基标记3~6个月以内的核酸探针。为节 省核酸探针的用量,凡使用过的含有探针的杂交液也可反复多次使用,特别是对于已知的重复性实验。对于细胞或组织内未知mRNA的检测,仍宜采用未使用过的探针杂交液为佳。
与放射性标记相比,地高辛标记探针具有非放射性探针的优点,对人体无害,不受半衰期限制,探针可长期保存。与生物素标记探针相比,地高辛探针不受组织、细胞中内源性生物素的干扰,敏感性高。由于地高辛具有灵敏度及分辨率高,反应产物颜色鲜艳,反差好,背景染色低,制备探针可较长期保存,对人体无害等优点,已日益显示出它的优越性和广泛的应用前景。它不仅可应用于原位杂交细胞化学,还可应用于Southern印迹杂交法检测特定基因组序列,进行RFLP分析用于基因诊断,菌落原位杂交,噬菌斑原位杂交,固定细胞及中期染色体原位杂交以及生物体液中,组织中病毒DNA序列的检测。这一技术还被应用于检测DNA标记物及测序,对人类染色体连锁图谱进行构建和基因图谱分析。
(二)基本操作步骤
组织处理及预杂交等步骤与本章 中叙述的放射性同位素标记cRNA探针相同,但由于地高辛标记cRNA探针在原位杂交细胞化学中已愈来愈得到广泛的应用,我们在基本方法中仍较详细的叙述其操作过程。
1.组织前处理在组织制片中以冷冻切片(厚10~30μm)最佳。切片贴在预先清洁,高温处理并涂以粘附剂载玻片上,先在37℃预干燥4h,然后置于37℃烤箱中过夜。经过上述处理的切片如在-20℃可保存2~3周,在-70℃可保存数月之久,有报告可保存数年之久的。但仍以新鲜制片为好。如为石蜡包埋切片,应脱蜡经梯度酒精入水。一般不提倡浸入二甲苯溶液。但在细胞内mRNA含量高时应用二甲苯脱蜡后仍能显示。经水洗后入37℃烤箱4h或过夜,然后进行杂交前处理。
在烘烤及低温保存时,为防尘埃及空气中RNA酶的污染,宜用锡箔纸(foilpaper)包被,内加少许干燥剂(变色硅胶)。
下列步骤所需玻璃器皿均需消毒,操作者需戴手套。
(1)PBS洗2×3min。
(2)选择少数几张切片作为“RNA酶对照片”。
其它切片暂放于PBs 内。
RNA酶对照片处理方法:加RNA酶(100μg/ml)在预热37℃的溶液内。放在潮湿的盛有少许2×SSC塑料盒或蒸发皿内。在每张切片上覆以过量的RNA酶溶液,在37℃孵育30min后用2×SSC冲洗,2×3min,然后与其它保存在PBS的切片一起进行下列处理。
(3)蛋白酶K消化:将组织切片放在0.1mol/l Tris/50mmo/L EDTA pH8.0,内含蛋白酶K1μg/ml,孵育15~20min。消化时间应根据组织的种类,厚度反复试验调整。时间过短探针不易进入,过长影响细胞或组织的形态结构。
(4)0.1mol/L甘氨酸/PBs 5min终止蛋白激酶K反应。0.25%乙酸酐(0.1mol/l 三乙醇胺配制)10min。
(5)在4%多聚甲醛/PBS3min。
(6)以PBs 漂洗2×3min。
(7)浸入新鲜配制的0.25%乙酸酐(0.1mol/L三乙醇胺配制)10min,以封闭非特异性结合部位。
(8)2×SSC漂洗15min。
2.杂交以含cRNA探针(0.5ng/ml)的杂交液,按每张切片10~2μl的量覆盖切片。地高辛配基标记的cRNA核酸探针保存浓度为2.5ng/ml,用前稀释备用。覆以硅化盖玻片或塑料蜡膜,置于盛有少量2×SSC温盒内在42℃,16~18h或过夜。
3.显示
(1)用缓冲液1冲洗杂交后的载片2×3min。
(2)在缓冲液1中10min,室温以封闭非特异性结合部位。
(3)拭干切片周围的载片,注意保持切片湿润。加数滴抗地高辛抗血清(工作浓度1:500,以缓冲液1稀释),孵育2h,室温。
(4)缓冲液1漂洗3×3min。
(5)浸入缓冲液210min室温。
(6)浸入底物中孵育10~30min(或更长时间,视需要而定),底物内含显色BCIP/NBT,室温。最好用锡箔纸包裹反应盒,使显色在黑暗中进行。定期取出切片在显微镜下检测反应强度。根据反应强度决定延长或终止反应。反应颜色为紫蓝色。
(7)将切片浸入缓冲液3以终止反应。
(8)复染,可用1%伊红、1%苏木精、1%亮绿或5%的焦宁(又称派咯宁丫)(pyronin 丫)10~30s。
(9)流水洗5~10min,直至水无色为止。
(10)在切片未干前,以PBS/甘油封固切片,如要永久保存,可以用DPX在盖片四周封固。为去除水份,在封固前可进行梯度酒精脱水,透明,DPX封固,但每步时间仅需几秒钟,时间过长易致褪色。
几点说明
①缓冲液1,2,3配制法见附录。缓冲液1中BSA用量大,价贵,如无法负担可略去。
②切片处理过程可采取漂浮法或载片染色法,载片染色适用于切片数数量较少时,可用液体覆盖于切片表面进行孵育,漂洗在烧杯内进行。如切片多,可将载片置于方形的染色缸(staining jar)内,将冲洗液加入缸内,如有振荡器在漂洗中稍加震荡更有助于减低背景染色。漂浮法适用于切片数量大量,将切片置于凹形碟内,或染色缸内。漂浮法的优点是节 约试剂用量,切片两面均可接触反应液,有利于信号的增强。
③在底物中孵育时间过长会产生弱强的非特异性染色,有时甚至误为阳性反应。解决方法一是设置对照片,二是对非特异性染色加以区别。非特异性染色与特异性染色的主要区别点在于后者有结构性定位,而前者系无结构性定位,常在切片边缘或细胞密集处呈现较强的颜色反应。
④在组织前处理中应严格注意控制RNA酶的污染,包括戴手套、器皿消毒等。另外,和免疫细胞化学一样,自始至终应保持切片的湿润,勿令其干燥。
第三节 DNA及寡核苷酸探针在原位杂交组织化学中的应用
一、DNA探针的应用
虽然一般认为DNA探针敏感度不如cRNA探针,但在病毒的检测等领域中DNA探针仍得到广泛的应用。
在原位杂交细胞化学的操作步骤方面与cRNA探针基本相同,所不同的是:(1)杂交时需先在高温80~95℃短时处理,使DNA探针及细胞内靶DNA变性,解离成单链,迅置于冰上冷却。然后置于37℃~42℃杂交过夜。(2)RNA酶的溶液的冲洗不能减低背景,因此,在操作步骤中省略此步。
(一)地高辛-碱性磷酸酶(Dig -AKP)标记DNA探针在石蜡包埋切片检测病毒DNA中的应用
1.组织前处理
(1)固定:组织以10%中性福尔马林液或Bouins液固定,常规石蜡包埋,切片厚4~6μm,粘附于涂有粘附剂的玻片上,入烤箱60~80℃6~8h,使切片更紧贴玻片。
(2)脱蜡:二甲苯10min×2,自100%乙醇,90%,70%,50%,30%各5min。入PBS(含5mmol/lMgCl2,pH7.3~7.4)10min×2。入0.2n HCl 20min以进一步去除蛋白。
(3)50℃2×SSC,含5mmol/l EDTA溶液中30min。
(4)蛋白酶K(1μg/ml溶于0.1mol/l PBS中,)37℃20~25min。
(5)0.2mol/l 甘氨酸液:室温10min,中止蛋白酶反应。
(6)4%多聚甲醛(PBS新鲜配制):室温20min。
(7)PBS/5mmol/lMgCl2漂洗10min×2。
(8)脱水,自低浓度到高浓度,无水乙醇各3min,空气干燥。
2.预杂交封闭非特异性杂交位点,20μl/每张切片,42℃水浴半小时。
3.杂交10~20μl/每张切片,加盖硅化盖玻片,将切片置于95℃min,使探针及病毒DNA变性,然后迅速置于冰上1min(也有报告用乙醇使之冷却的),然后将切片置于盛有2×SSC湿盒内,42℃过夜(16~18h)。
4.杂交后漂洗
(1)2×SSC液内振动移除盖片。
(2)2×SSc55℃10min×2。
(3)0.5×SSc55℃5min×2。
(4)缓冲液II(含0.5%封阻试剂,用缓冲液I溶解)37℃30min。
(5)缓冲液I(10mmol/l Tris –HCl, 15.0mmol/L NaCl pH7.5)15min,室温。
(6)酶标地高辛抗体(1:5000,应用缓冲液I稀释)37℃30min。
(7)缓冲液i15min×2室温。
(8)缓冲液III(100mmol/l Tris -HCl, 100mmol/L NaCl, 50mmol/L MgCl2,pH9.5)室温2min。
5.显色
(1)显色液配制:缓冲液III:1ml中加入4.5μl四氮唑蓝(NBT),3.5μl X-磷酸盐(5-溴-4-氯-3吲哚磷酸盐(BCIP配成))。30μl/每张切片,置暗处显色30min到2h。定时抽查切片,镜检其显色情况。
(2)缓冲IV(10mmol/l Tris –HCl, 1mmol/L EDTA, pH8.0)10min终止反应,甲绿复染5min,二甲苯透明,DPX封固,镜检。
(二)荧光标记DNA探针的应用
1.概述在原位杂交细胞化学中荧光标记DNA探针(Fluorescence in situ DNA hybridisa-tion , FISH)的应用在细胞培养和染色体铺片(见二十一章 )中较为广泛。FISH属于非放射性标记,其优点在于简便,快速,其敏感性可与放射性同位素标记核酸探针相等。不少实验室报告应用FISH(2~5kbp探针)可成功地达到单个拷贝(copy)的特异性定位。
2.荧光标记DNA探针应用于ISHH中的基本原则(Barbara Traok和Dan Pinkel 1990)
(1)首先应使组织或染色体中靶核苷酸高温加热变性解离为单链DNA,化学性标记的DNA探针除外。
(2)杂交:一般在37℃进行,探针稀释浓度在2ng/μl,染色体铺片探针浓度在0.4ng/μl,杂交液2~3μl/每cm2盖片,每张盖片大约1.8cm2,约需10μl杂交液。有实验室报告,如每张盖片(温度为室温)加入杂交液将会降低杂交温度所需要的37℃,因此,建议对盖片应用前在37℃进行预热。
(3)用免疫细胞化学或组织化学方法显示荧光标记。自80年代以来,荧光素标记检测系统日益增加。包括:①生物素标记探针与荧光素标记的抗生物素(avidin)或抗生物素抗体。②氨乙酰基荧光(aminoacetylfluroence,AAF)-改良探针(modified probe),与抗AAF抗血清。③磺酸(sulfonatc)改良探针,以抗磺酸抗血清检测(Organic Ltd, Yavene, Israel和TMc BioproductsRockland ME可提供此药盒)。④汞标记探针(mercuratedprobe),以硫氢基(sulf hydryl)与荧光标记物或-半抗原相结合,再以抗半抗原抗血清检测。⑤地高辛标记探针,以地高辛抗血清检测(Boehringer – ManubeimInc, Mannhein, FRG可提供此药盒)。在上述各例中,为简便可采用直接法(图20-4A),为提高敏感度可采用间接法(图20-4B)。

图20-4 生物素标记核酸探针荧光免疫反应图解
生物素和地高辛用缺口平移法或随机引物法进行标记,以用后者为多。氨乙酰荧光素,磺酸和汞的核苷酸探针标记利用简单的化学反应。产生荧光的物质各有不同,常用的有异硫氰酸荧光素(FITC),也有应用德克萨斯红(texaored)获得满意效果的。但藻红素(Phycoerythrin)应用效果较差,可能由于分子大的缘故。可同时应用AAF和生物素标记系统及汞与生物素系统分别应用不同的荧光素去标记两条DNA进行双重染色。
3.基本操作方法
(1)玻片准备:细胞用甲醇:醋酸(3:1)固定,滴在玻片上可保存在-20℃,如将此载片烘烤于65℃数小时,将会导致样品的人工老化。应用相差显微镜在低倍下定位最佳区域,或用嘴轻吹气的方法可以看见浮动的细胞。在玻片背面圈出盖片应覆盖的区域。
(2)RNA酶处理:加50μlRNA酶溶液,盖以盖玻片,放在湿盒内(2×SSC)37℃1h。应用2×SSC漂洗2×3min,室温,梯度酒精脱水(70%,90%,100%),在空气中干燥。
(3)蛋白酶K和多聚甲醛处理:对单个拷贝杂交,蛋白酶K溶液(0.3~0.6μg/ml,在20mmol/l Tris –HCl, pH7.5, 2mmol/L CaCl2)在37℃孵育2h。此法对甲醇-醋酸固定的淋巴细胞效果特佳,但这种浓度的蛋白酶K溶液对未事先经多聚甲醛固定的染色体制片可在靶DNA变性步骤中完全破坏。因此,需根据细胞类型调整溶液的浓度和孵育时间。蛋白酶K消化后,以2×SSC,在室温漂洗2min×3,再固定于4%多聚甲醛溶液中,室温10min。2×SSC洗2min×3。
(4)靶DNA变性:将载片浸入70℃变性溶液(70%甲酰胺,2×SSC)2min。新鲜的变性溶液需每周配制,贮存于4℃冰箱中备用。一张处于室温的载片放入50ml的染色缸(coplin jar)内,将会使溶液温度减低约1℃,因此,每次应加入少量玻片,以免影响溶液的温度致变性不完全。冷却变性处理后的载片可放在冰上或浸入70%酒精溶液1min。漂洗加震动以终止反应和彻底去除变性溶液。然后经梯度酒精脱水(80%,90%,100%),空气干燥。
(5)杂交液的准备
MM1甲酰胺5.0ml
硫酸葡聚糖1.0g
20×SSC 1.0ml
(或50%硫酸葡聚糖)2.0ml
MM2甲酰胺 5.5ml
硫酸葡聚糖1 .0gm
20×SSC 0.5ml
首先将溶液在70℃加温,以溶解硫酸葡聚糖,冷却后调整pH至7.0,容量加至70ml。这容量是最后应用的杂交混合液的70%,其余的30%为核酸探针和水(如果需要的话)。MM1给预杂交混合液是:50%甲酰胺,10%硫酸葡聚糖2×SSC。Trask发现MM2效果较MM1好,DNA的Tm比MM1低-8℃。在2×2cm区域杂交混合液应为:MM17μl,DNA探针(保存液为500μg~10mg/ml)1μl,加探针混合液2μl,总量为10μl。
(6)杂交:每张盖玻片加10μl杂交混合液,注意移除气泡,可在盖片四周加橡皮泥封固,在37℃湿盒中过夜。
(7)漂洗:从温箱中取出后,以镊子移除橡皮泥,从现在起注意勿使载片干燥。否则盐的晶体将产生非特异性背景染色,漂洗应用2×SSC(pH7)在45℃3min×3。不时震动以助彻底漂洗,盖玻片将在漂洗中自然移除。然后再在2×SSC,45℃,2min×3。保存载片于PBS溶液内。
(8)荧光显示:
①生物素标记DNA探针的荧光显示。
1)应用PBS含5%无脂干奶(5μl每张盖片),也可用1%牛血清白蛋白(BSA)-PBS覆盖孵育5min室温,以封闭非特异性结合部位。
2)移除多余液体,加抗生素-FITC(5μg/ml在PBS含5%奶粉或1%BSA,5μl/cm2)。在湿盒中,室温孵育20min。抗生物素-FITC在此应用是过量的,因此,可回收贮存4℃再次应用,其保存时间可达数周。反应见图20-4A直接法。
3)漂洗:PBs 2min×3,45℃。
4)如需放大(amplification),即提高其敏感度,可按图20-4B间接法加生物素化羊抗抗生物素抗血清(biotinylated goat – antivaidin antibody)30min室温。倾去加另一层抗生物素-FITC抗血清孵育20min,重复上述1)~3)。
②AAF标记核酸探针的荧光显示
1)封闭非特异性结合部位:从PBS中取出载片,吸干多余液体,加PBS-0.1%吐温(Tween)含2%正常羊血清(NGS)(5μl/每cm2盖玻片)。使载片停留在室温5min。
2)倾去多余液体,加抗-AAF抗血清1:750,PBS-Tween –NGS溶液(如上i)5μl/cm2盖玻片。室温37℃。孵育30min.
3)漂洗:PBS-0.1%Tween室温5min×3,间歇性振荡。
4)羊抗小鼠IgG-FITC孵育,1:300~1:1000在PBS-0.1%Tween含2%NGS,37℃孵育30min,如3)应用PBS-0.1%Tween 漂洗5min×3。
4.荧光标记DNA探针在细胞核混悬液杂交中的应用
(1)细胞核的分离:将培养的细胞制成细胞混悬液,或以胰蛋白酶消化法于培养盖上收集培养细胞。应用MgSO4染色分离方法分离细胞核(Van den Engh etal 1986, 在Traok和Van Den Engh 34章 )。细胞混悬液浓度为5×106/ml。利用RNA酶消化后,使核从细胞分离,细胞核混悬液浓度为4~5×106细胞核/ml。
(2)细胞固定和酸的处理:在5ml试管内加冷的100%酒精不断旋转以达到满意的固定。在冰上停留10min。在4℃离心(×150g)10min。重复加三次冷的100%酒精入试管内,离心,倾去。置于冰上10min,再离心。然后加入相当核悬液1/2量的0.1n HCl , 0.5% Triton X-100。室温停留10min。加入IBM-0.25%Triton X-100(IBM配方:50mmol/l KCl, 10mmol/L MgSO4, 5mmol/L HEPES pH8.0)。再离心,重复IBM漂洗(这时细胞核可在不染色情况下,以荧光显微镜观察)后,以2×SSC-0.1%Tween漂洗1×3min,继之加入等量2%的多聚甲醛在1×PBS-5mmol/l MgSO4。在室温静置站立10min。倾去上清液,加IBm -Triton X-100漂洗,离心,使细胞核混悬液最终浓度为108/ml,(可用IBM-Triton X-100稀释约50倍,在血球计数器计数),混悬液镜检应含单个,完整的细胞核。
(3)细胞核混悬液杂交
①配制杂交混合液:甲酰胺5份,20×SSC1份,50%硫酸葡聚糖2份,pH调至7.0。此原液(stocksolution)可贮存在4℃冰箱内。应用时加1份10mg/ml鲱鱼精子DNA(herringsperm DNA)。
②混合1μl的细胞核混悬液(108/ml)与18μl的杂交混合液,充分混匀。将此19μl混合液移入1.5ml容积的Eppendorf管中(核含量约为105)。
③加入100ng/每管的AAF标记DNA探针(如为生物素标记DNA探针浓度为20~40ng/每管)。
④置70℃10min使DNA探针和核DNA变性。
⑤和组织切片与DNA探针杂交方法相较,不同的是在加热变性后切勿置冰上迅速冷却以终止反应,而应迅速转入37℃孵育过夜。
(4)杂交后漂洗
①在每管中加入1.25ml 50%甲酰胺-2×SSC(pH7.0),在42℃静置10~15min。偶尔旋转以助混匀。冷却至室温。加100μl经dimethylsuberimidate(DEMS)处理的血细胞(107/ml)混匀,离心,室温,10min,轻弹试管使沉淀的小块散开,加入1.25ml 2×SSC(pH7.0),42℃,继之,静置于室温10~15min,如前离心,再加1.25mlIBM-Triton X-100,室温静置5min,离心。
注:DEMS处理红细胞方法:经漂洗并离心去除白细胞和血清的红细胞在盐液如PBS中,细胞含量为108/ml,以K2CO3和DEMS溶液处理3次,第1次:K2CO3为20mmol/L,DEMS为3mmol/L,以后2次:K2CO3依然为20mmol/L,而DEMS为10mmol/L。在应用前将K2CO3和DEMS液混合加入红细胞混悬液中。在最后2次漂洗液中,应用100mmol/l K2CO3将pH调至9~10。在25℃,15min后,加入50μl,100mmol/l 的柠檬酸(citric acid)/每ml细胞混悬液的浓度以达固定红细胞的目的。固定的红细胞离心倾去上清液后,用2×SSC稀释到108/ml,加0.1%叠氮钠可在4℃保存至少1年。
(5)AFF标记的荧光显示:加200μl的PBS含0.05%Tween和2%正常血清(NGS),轻轻振荡混匀,室温静置10min,加20μl 1:100的单克隆抗AFF抗体,37℃孵育45min,加1.25ml的PBS-Tween,室温静置10min,加20间歇性振荡,离心,倾去上清液,加200μlPBS含0.05%Tween –2%NGS,振荡,室温静置10min,加20μl的羊抗小鼠–FITC荧光标记抗血清,稀释度1:100~1:300。孵育于37℃45min,加1.25mlPBS –Tween,室温静置10min,离心,倾去上清液。
(6)生物素标记探针的荧光显示:加200μl 4×SSC含0.1%Trion X-100 和5%BSA。室温静置10min后,加20μl抗生物素标记FITC抗血清15μg/ml,孵育在37℃30min,以1.5ml 4×SSc –0.1% Trion X-100洗1次,加入1.25ml IBm –Triton X-100,室温静置10~15min,间歇振荡、离心。
(7)荧光显微镜观察:将细胞核混悬液稀释于250μl的IBM-Trion X-100中,轻加振荡混匀。为抗荧光褪色可加等量的抗褪色溶液至载片上的细胞核涂片上,选择适当的激发波长观察。
(8)流式细胞计:将750μl的细胞核混悬液通过流式细胞仪(Flow cytometry, FCM),DEMS处理过的红细胞作为对照(Df 530/30nm, Omega ·Optical Inc, Brattleboro, VT)。详细操作见第十章 。
二、寡核苷酸探针的应用
寡核苷酸探针的优点在于它能根据需要人工用DNA合成仪合成,其长度及分子大小比较一致,可以控制。其长度一般较克隆的DNA片段短。目前,寡核苷酸探针已能成功的为放射性同位素、荧光素、生物素和地高辛所标记,并成功地运用于培养细胞、组织切片和染色体铺片等的原位杂交中。虽然有些科技工作者认为其敏感度不如来自质粒扩增的cRNA或DNA探针,但由于探针制备简便再加之于近年非放射性标记的成功,寡核苷酸探针在生物基础医学及临床学科领域中得到较为广泛的应用。
在原位杂交组织化学中应用寡核苷酸探针,其基本操作要点是相同的,如杂交温度在Tm-25℃,杂交孵育时间以过夜(16h左右)为佳。应用寡核苷酸探针在原位杂交组织化学技术中的成功与否主要决定于探针的设计,使有效配对率增加而错配(mismatch)减少。
(一)地高辛标记寡核苷酸探针的应用
1.组织处理
(1)冷冻切片:厚10~20μm,贴于事先经清洁处理及涂有粘附剂的切片上。切片保存于-80℃,在应用于杂交实验前,使迅速回升到室温,干燥,固定于3%多聚甲醛-PBS溶液中,pH7.4。PBS漂洗5min×3,孵育在2×SSc10min。
(2)石蜡包埋切片:浸入二甲苯10min移除石蜡,以100%乙醇10min×2,空气干燥10min,从高到低梯度乙醇(95%,80%,70%)1min/每个浓度。PBs 5min×3,孵育在2×SSc 10min。
(3)离心细胞涂片:将细胞先以4%多聚甲醛固定,应用离心沉淀法,将沉淀物涂于有粘附剂的载片上,应用PBS(含5mmol/l MgCl2)5min×3漂洗。在0.1mol/L三乙醇胺含0.25%(V/V)乙酸酐10min。在0.2mol/l Tris –HCl 含(0.1mol/L甘氨酸)pH7.410min。孵育在2×SSc 10min。
2.探针准备35pmol的寡核苷酸(oligo -)探针,3’ 终末标记以地高辛-11–dUTP。
3.预杂交和杂交加约300μl预杂交液(配制法见附录)在每张载片上,室温孵育1h。如为鲱鱼精子DNA,在应用前须在沸水浴中加热10min,而对酵母tRNA可不用加热变性。
(1)应用预杂交液稀释地高辛标记的Oligo-探针,探针理想工作浓度根据于待测核苷酸含量和实践的结果。如对于检测大鼠垂体的前促黑激素(proopiomelanocortin,POMC)mRNA的Oligo –探针,其理想工作浓度为342ng/ml(0.342ng/μl)。
(2)预杂交后以2×SSC漂洗,以吸水纸拭干切片周围水份,加30μl杂交液在切片上,加硅化盖玻片,在37℃过夜。如探针大于36碱基则杂交温度为42℃。次日室温2×SSC液漂洗切片1h,1×SSC漂洗切片1h(室温),0.5×SSc 37℃漂洗半小时,0.5×SSC室温漂洗半小时。
4.地高辛显示(同前)。
(二)同位素标记寡核苷酸探针的应用
1.组织处理大鼠应用1%戊巴比妥钠腹腔注射麻醉,经心脏灌注4%多聚甲醛-磷酸缓冲液中,约2h后(也可置于4℃冰箱过夜)取脑浸于同样固定液中加10%蔗糖溶液过夜,4℃。次日恒冷箱切片(-14℃),厚14μm左右,贴于有粘附剂的载片上,37℃或室温干燥以增加切片的粘附性。
2.杂交前处理同本章 第二节 放射性标记cRNA探针一节 。
3.杂交37℃过夜,余细胞同前。
4.杂交后漂洗2×SSc5min×3,1×SSc 1min室温,0.5×SSc55℃15min×2,室温漂洗于0.5×SSc 3min×2。梯度酒精脱水,切片室温干燥。
5.浸核乳胶切片浸入核乳胶,黑盒封闭,在4℃曝光2~3周(视同位素种类),显影,复染,观察。
(第二、三节 中所用试剂配制见附录)。
第四节 原位杂交组织化学与免疫细胞化学结合法
原位杂交组化(ISHH)与免疫组织化学(IHC)结合法是先后用ISHH和IHC在同一切片或两个相邻切片进行染色,这样就可以同一细胞中显示出某种mRNA和相应的蛋白、多肽或其它抗原,从而可更好地了解某一基因的转录和蛋白、多肽合成的动力学。ISHH与IHC结合法可以在相邻切片上分别进行ISHH和IHC染色,也可先后在同一切片上进行ISHH和IHC染色。前者可使ISHH和IHC染色都获得理想的结果,易成功,但易产生空间误差和样本误差。在同一切片上进行结合法可克服这些误差,但第一次染色总要或多或少地影响第二次染色,使第二次染色不十分理想。由于m RNA易被染色过程中污染有少量RNase的液体所降解,因而在实践中往往首先进行原位杂交组化染色,这种次序使结合法易成功。但在操作方法中应注意减少生物活性肽或蛋白的丢失,如在杂交后冲洗中适当减低漂洗温度。
一、同位素原位杂交组化与免疫组化PAP法的联合程序
(1)切片入PBS冲洗5min,最好是将切片漂洗于灭菌器皿中。
(2)0.1mol/L 甘氨酸PBs 5min。
(3)0.4%Triton X-100 PBS 15min。
(4)1μg/ml蛋白酶K,37℃保温30min。
(5)4%多聚甲醛PBS固定5min 。
(6)PBS冲洗2×3min。
(7)0.25%乙酸酐(0.1mol/L 三乙醇胺配)10min。
(8)2×SSC冲洗10min。
(9)杂交:如是cDNA探针用前需进行变性处理,载片法时将切片在空气中晾干,加含探针的杂交液10μl于切片上,盖上22×22mm的硅化盖片或相当大小看蜡膜,3H标记探针每10μl杂交液含1×105cpm探针,32P或35S标记探针每10μl杂交液含5×105cpm探针;如是漂浮切片,则用灭菌吸水纸将切片水份尽量吸干,然后入杂交液,探针浓度和载片法一样。入杂交液后43℃保温12~16h。
(10)4×SSc 37℃冲洗10~30min。
(11)2×SSC(如为RNA探针则含20μg/ml RNase)37℃冲洗30min。
(12)1×SSC和0.1×SSc 37℃分别冲洗30min。
(13)PBS冲洗2×5min。(转录ISHH)
(14)0.5%H2O2PBS室温30min。
(15)1%BSA 37℃,30min 。
(16)第一抗体,4℃孵育16~24h。
(17)PBS冲洗4×5min。
(18)第二抗体37℃,1h。
(19)PBS冲洗3×5min。
(20)兔PAp 37℃,1h 。
(21)PBS冲洗3×5min。
(22)DAB显色液5~10min(DAB显色液:0.05%DAB + 0.03% H2O2PBS液配)。
(23)PBS冲洗3×5min。如是漂浮切片则将其贴于涂有粘附剂的载片上,晾干。
(24)切片入70%,85%,95%和2个100%酒精脱水,空气干燥。
(25)在暗室涂布乳胶(乳胶配制:乳胶原液:0.6mol/L醋酸胺=1:1),晾干,装入自显影暗盒。
(26)4℃曝光:3H标记探针4~8周,35S标记探针1~4周,32P标记探针7~10天。
(27)D196显影液,20℃显影5~10min。
(28)自来水冲洗数秒。
(29)F5坚膜定影液10min。
(30)自来水冲洗15min。
(31)切片温箱烤干,脱水,透明,封片。
结果:蛋白或多肽免疫反应阳性细胞为棕色胞质,而其相应mRNA为黑色银颗粒聚集。
二、非同位素原位杂交组化与免疫组化联合法
非同位素标记物很多例如:生物素(biotin),地高辛(Digoxigenin),汞(mercury),溴(bromine)和碱性磷酸酶等,其中目前应用最多的是生物素和地高辛。将此法与免疫组化PAP法或ABC法联合使用,能成功地显示一些神经肽mRNA和神经肽的共存与共同分布。向正华等发现碱性磷酸酶抗地高辛抗体是经木瓜蛋白酶处理的,只有抗体的Fab段没有Fc段,而免疫细胞化学(Immunocytochemistry,ICC)所应用的抗体既有Fab段,又有Fc段。由于抗体的这一特性可在ISHH和ICC抗体孵育时将检测核酸的抗地高辛抗体Fab段与检测蛋白、多肽的兔抗血清混合在一起,一同孵育切片,这样可明显缩短ISHH和ICC结合法的实验周期,同时还可以减少实验过程中对ICC检测的蛋白、多肽的损害,使结合法易成功。为什么两种抗体可同时混合孵育切片,这是因为抗地高辛抗体只有Fab段,而没有Fc段。我们知道抗体的抗原决定簇在Fc段,因此第二抗体与第一抗体的结合是第二抗体的Fab与第一抗体的Fc,所以第一抗体如果只有Fab段没有Fc段,那么第二抗体就无法与一抗结合。因此实验中将二种抗体混合孵育切片而不会产生交叉结合。以下为此法的原理图(图20-5)。

图20-5 原位杂交细胞化学与免疫细胞化学结合法
此种ISHH与ICC联合法稳定,实验周期短,蓝色与棕色反差强,是目前较好的ISHH与ICC结合法。详细程序如下:
(1)将切片漂浮于能经受高压灭菌的器皿中。0.1mol/l PBS pH7.2冲洗3×5min。
(2)0.1mol/L甘氨酸PBS冲洗5min。
(3)0.4% Triton X-100 PBS 15min。
(4)1μg./ml蛋白酶K(0.1mol/l Tris –HCl pH8.0, 50mmol/L EDTA 配),37℃保温30min。
(5)4%多聚甲醛PBs 5min。
(6)PBS冲洗2×min。
(7)0.25%乙酸酐(0.1mol/L三乙醇胺配)10min。
(8)2×SSC冲洗10min。
(9)将切片用灭菌吸水纸吸干,然后入杂交液。核酸探针浓度为0.25~0.5μg./ml。每一正常成年大鼠脑冠状切片15μl杂交液足够。43℃保温12~16h。
(10)4×SSc 37℃冲洗30min。
(11)2×SSC(含RNasea 20μg/ml)37℃保温30min。
(12)1×SSC和0.5×SSc 37℃分别冲洗30min。
(13)0.05mol/l PBS冲洗3×5min。
(14)0.5%H2O2PBS室温20min。
(15)0.05mol/l PBS 冲洗2×5min。
(16)碱性磷酸酶标记抗地高辛抗体(Fab)与抗蛋白或多肽等抗体混合液,前者一般1:1000稀释,后者则因抗体而异。稀释液:1%BSA,0.4%Triton X-100 ,0.05mol/L PBSpH7.2,4℃孵育24h。
(17)0.05mol/l PBS冲洗4×5min。
(18)二抗(1:100~1:200)37℃保温1h。
(19)0.05mol/l PBS冲洗3×5min。
(20)PAP(1:200~1:400)37℃保温1h。
(21)0.05mol/l PBS冲洗3×5min。
(22)DAB显色液(0.05%DAB + 0.03% H2O2,0.05mol/L PBS pH7.2配)显色5~10min。
(23)0.05mol/l PBS冲洗3×5min。
(24)TSM,冲洗2×5min(TSM1:0.1mol/l Tris – HCl pH8.0,0.1mol/LNaCl,0.01mol/L MgCl2).
(25)硝基四氮唑蓝(400μg/ml)和5-溴-4-3-吲哚磷酸(200μg/ml)混合液(TSM2配显色混合液)显色1~3h,避光。
(26)20mmol/l EDTA终止显色。
(27)将切片贴于涂有铬矾明胶的载片上,空气干燥。
(28)梯度酒精脱水,透明、封片。
结果:ISHH阳性细胞的胞质呈紫蓝色,胞核不着色,示该细胞含XmRNA。ICC阳性细胞的胞质呈棕色,胞核不着色示该细胞含X多肽。双标记细胞的胞质为蓝棕混合色,示多肽与mR-NA共存于该细胞内。
第五节 原位杂交免疫细胞化学技术的未来与展望
自1969年以来,我们高兴的看到原位杂交免疫细胞化学技术已从分子生物学的一个分支发展成为生命科学的有效的研究方法。在原位杂交免疫细胞化学发展过程中两个关键性的突破是核酸探针制备的标记物的改进。核酸探针由克隆的核酸探针发展到无克隆的合成的寡核苷酸探针;从放射性同位素标记到非放射性标记。令人可喜的是,这一技术还处于不断的改进和更新的过程中。
一、PCR与原位杂交细胞化学结合法
自1988年以来On等科学家相继在研究对导致人类免疫缺陷的HIV-1/AIDS病毒DNA进行细胞内定位,以期提高对患者的阳性检出率。在系列研究的基础上,Bagasra及其同事在1990~1993年成功的报告了原位杂交及聚合酶链反应结合法,简称为原位杂交PCR(PCr in situ, PCRIS)。在本书二十二章 中曾介绍了PCR技术,它是一种对特定的DNA片段在体外进行快速扩增的无细胞克隆技术,基本步骤包括高温变性,低温退火适温延伸三个步骤的反复热循环,其效率可使几个拷贝的模板序列甚至一个DNA分子扩增107~109倍。大大提高了DNA的检测率。此法不足之外,在于其不能达到细胞或组织的定位。PCRIS技术的基本的原理是首先利用PCR技术将靶DNA片段扩增,然后用原位杂交细胞或免疫细胞化学技术通过标记的核酸探针与扩增了的DNA进行杂交显示和定位,其敏感性可达到显示单个拷贝基因的信号的程度。Bagasra及其同事们利用这一方法,应用32P和生物素标记的核酸探针分别对导致人体免疫缺陷的HIV-1/AIDS病毒DNA的单个拷贝基因经PCR扩增后在外周血单核细胞内显示成功。就算此法对HIV-1感染患者外周血单核细胞检测的阳性率明显高于用单纯原位杂交技术的检出率,说明其敏感度大于单纯的原位杂交免疫细胞化学技术。其主要实验步骤为将离心沉淀的细胞滴入覆有聚四氟乙烯(teflon coated)的设有三个凹孔的特制玻片(CellLine Associ-ates,Newfield, NJ ,Cat No 10~ 12,12~14mm的孔)的凹孔内,加热105℃90s,然后以2%多聚甲醛-磷酸缓冲液,pH7.4,固定1h,PBS漂洗3min×3。如用生物素标记核酸探针,应用0.3%的H2O2孵育37℃过夜,然后以蛋白酶K溶液(5μg/ml PBS)55℃孵育2h(孵育时间应根据细胞的种类而定),将孵育的载片置于96℃热板上2min,最终以蒸馏水漂洗,空气干燥。在溶液中按PCR技术的需要加入20PM一对应的引物(Primer),15μg PCR混合液含10μmol/l dATP、dCTP、dGTP和dTTP、50mmol/l KCl,10mmol/L Tris(pH8.3),2.5mmol/LMgCl2和10μl Taq多聚酶(lu/μl,Gene Amp Cetuo)。把上述溶液加入左侧二孔中,留一孔加入无引物的PCR混合液作为对照。将载片以22×66mm盖片覆盖,片周以无色指甲油封闭,放入自动的热循环仪(M.J.Re-seasCH,Boston MA)。可改良用铝锡箔纸覆盖于热循环仪表面再放置载片。按94℃/45℃/72℃每个温度1min,30个循环。这温度也可根据引物的GC比例加以调整以求得理想的扩增。也可根据下列公式计算引物的Tm值(Muller & Wold,1989)。
引物Tm=81.5 + 16.6(logM) + 0.41(%GC)–500/n
n=引物的长度,mol/L=缓冲液中盐的摩尔数,一般是0.047mol./L
按扩增后,将切片放入100%乙醇3~5min,以锐利刀片移除盖片,将载片放在90℃热板上30s,应用2×SSC漂洗,然后用生物素标记核酸探针进行杂交。载片在95℃热板上5min,然后移入温盒,48℃孵育4h或过夜。次日PBS漂洗,以抗生物素标记FITC抗血清(100μg/ml PBS pH7.2)37℃孵育1h,PBS冲洗,以甘油/PBS溶液封片,荧光显微镜观察。如生物素标记核酸探针的显示系统为过氧化物酶,则应用DAB/H2O2溶液显色,常规光镜观察。这一技术不仅提高了病毒HIV-1的侦检率,而且可用以确定细胞内携带的特殊基因,遗传片段,病毒和肿瘤的侵犯(load)等,是一项颇具广阔应用前景的实验技术。
二、快速原位杂交细胞化学技术
原位杂交免疫细胞化学技术存在的难点之一是实验手续繁琐,实验周期长。国外Liesi等(1986)和国内学者何彬等应用光敏生物素-链亲合素(Biotin-streptavidin)胶体金系统进行原位杂交,得到了快速满意的结果,全部实验可在数小时内完成。
作用把含某种多肽或蛋白的cDNA片段的质粒,按照第十九章 在光照下标记光敏生物素,然后经DNA酶消化1h,得到大量100~500bp长度的混合片段,变性后用于原位杂交。
如为培养细胞或细胞涂片,用95%乙醇、5%乙醇固定5min,PBS冲去固定液,加含探针的杂交液覆盖(光敏生物素标记探针浓度为2.5ng/μl),在温盒中50℃孵育1~2h,取出后直接加入胶体金标记链亲合素(1mg/ml)室温孵育15min,然后在室温或37℃下用大容量(200ml/每片)洗脱液(2×SSC,0.1%Triton X-100)分别冲洗5~10min,以银显影液放大金颗粒显示原位杂交结果,可用1%伊红复染,脱水,透明,封片,镜检。
如为冰冻切片(cryostat section 10~15μm),应经新鲜配制4%多聚甲醛室温固定15min,PBS冲去固定液,吸干后滴加蛋白酶K(25μg/ml,Sigma)37℃15min,再用4%多聚甲醛室温固定20min,PBS冲去多聚甲醛,晾干后按上述方法进行原位杂交和杂交后冲洗。
三、原位启动标记法
原位启动标记法(Primed in situ labelling,PRINS),又叫寡核苷酸启动法(Oligonucleotide-priming method)是Koch(1987)首先提出的,其基本原理是将未标记的寡核苷酸探针与细胞或组织中的靶DNA或RNA进行杂交,然后该寡核苷酸探针充当引物的作用,在Kelow多聚合酶的催化作用下,将生物素(或地高辛、荧光素)标记的核苷酸编入,以达到原位显示的目的。PRINS技术具有3个方面的优点:首先由于探针在杂交时是未标记的,仅在杂交之后才进行标记,因此背景染色很低。至少,从理论上讲,背景染色几乎是零。其次是有效地缩短了实验的时间,由于探针未经标记,无增加背景染色的顾虑。因此,可增加探针尝试,缩短反应时间。杂交反应时间只需1h。实验反应时间的缩短可有效的保持细胞或组织结构的完整性。第三个优点是能提高或增加信号的强度。Koch等曾成功的将此方法应用于染色体制片、单层细胞涂片和组织切片。它们还将此法与流式细胞计相结合以达到检测群体离散细胞的目的。
在染色体或单层细胞涂片,载片在70℃的溶液中变性(70%甲酰胺,2×SSC)2min,立即在系统酒精中脱水(70%,80%,90%,95%,100%,V/V),用吹风机吹干。预孵育在37℃~53℃20~30min,孵育时间加盖玻片,孵育液含2~4pmol寡核苷酸探针,dATP,dCTP,dGTP各10mmol,5mmol生物素-11-dUTP在25μl×NT缓冲液中(1×NT缓冲液含50mmol/l Tris –HCl,pH7.2,10mmol/L MgSO4,100μM二硫苏糖醇(dithio threitol),50μg/ml牛血清白蛋白),在预孵育时加入1μl的Klenow多聚酶。应用100ml 50mmol/L EDTA, 50mmol/L NaCl在65℃洗1min 以终止反应,然后放入100ml×BN缓冲液(100mmol/l NaHCO3,Ph8.0,0.01%Nanidet P-40)40℃,进行检测系统的显示如荧光-亲合素标记,过氧化物酶-亲合素标记等。
总之,自Gall 和Pardue 1969年建立杂交免疫细胞化学以来的20余年中,已有不少新的改良的方法出现,但基本原则仍为Gall和Pardue所建立的相仿。作者个人体会是任何方法需在本人的实验实践中加以体验和改良。比如目前对乙酰基化作用,即浸入醋酸酐和三乙醇胺是否能减低背景染色的问题有作者对此提出异议。在科技工作者认为在原位杂交实验的所有应用溶液中加入0.1%~0.2%的二乙基焦碳酸乙酯(diethyl pyrocarbonate, DEPC)能有效的减低背景染色,但有些作者对此持怀疑态度。蛋白酶K的消化作用曾被认为是增加细胞或组织渗透性的关键步骤,但有作用在自身的实验室实践中体会除结构较致密的组织如脑、脊髓等外,对培养或涂片的单层细胞、蛋白酶K的消化及预杂交均是可以省略的。本文列举各作者的操作步骤略有不同,可能是基于这个原因。
目前,原位杂交技术主要应用于基因组图(Gene mapping),基因表达定位(localization of gene expression),核DNA和RNA的排列,mRNA的排列和运输(arrangement and transport of mRNA),复制(replication)和细胞的分类(sorting of cells)。临床研究应用在细胞遗传学(Cytogenetics),生前诊断(Prenatal diagnosis),肿瘤和传染性疾病的诊断,生物学剂量测定(biological dosimetry)和病毒学的病原学诊断等。随着核酸探针的制备,标记方法和基本操作方法的不断改进,新的技术不断涌现,相信在不久的将来,原位杂交化学技术将会更广泛的被应用于各个学科,并不断为生命科学提供新的资料,开拓新的领域。
参考文献
1. Gall G& pardue ML.Formation and detection of RNA ╟ DNA hybrid molecules in cytologicalpreparations. Proc Nat Acad Science.U.S.A,1969,63:378~ 381
2.Glaid,etal. The use of complementary RNA probes for the identification and localisationof peptide messenger RNA in diffuse neuroen-docrine system. In : in situ hybridisation,Application to developmental biology and medicine Eds:N1 Narris and D.GWilkinson, Combridge University press, 1990,43~68
3.CoultonG.Non – radiosotopic labele for in situ hybridization histochemstry: ahistochemist’s view. In: in situ hybridization,application to developmentalbiology and medicine. Eds: N1 Narris and Dg wilkinson, Combridge universityPress, 1990:PP1~32
4.PlakJM,Mcgee JOD(Eds).In situ hybridisation principles and practice. New York:Oxford Oxford University Press, 1991
5.ForsterAC, et al. Non-radioactive hybridisation probes prepared by chemical labellingof DNA and RNA with a novel reagent photobitio.Nuci Acids Res, 1985;3:745 ~761
6.BagasraO, et al. Polymerase Chain Reaction in situ:intracellular amplificaton anddetection of HIV –1 proviral DNA and other specific genes. J. ImmunologicalMethods, 1993;158~145
7.BehringerMan heim, Biochemica. Neuradioactive in situ hybridisation application Manoal,1992
8.Cai WQ(蔡文琴),et al. In situ hybridisation ofatrial natriuretic peptide mRNA in the endothelial cells of human umbilicalvessels. Histo-chemistry, 1993;100:277 ~ 283
9.Koch J,et al. Oligonucleotide – priming methods for the chromosome – specificlabelling of alpha satellite DNA in situ. Chromosoma,1989;98:259~ 265
10.Barbara T, Pinkel D. Fluorescence in situ hybridisation with DNA probes. In :Flow cytometry (Eds zbigniew Darzynkiewice and Harry A.Crissman ) Academinpress Inc, 1990;383~400
11. LiesiP, et al. Specific detection of neuronal cell bodies in situ hybridisation witha biotin – labelled neurofilament cDNA probe J. His-tochem Cytochem, 1986July;34(7):923~926
12. 正向华,蔡文琴,等.用光敏生物素反意生长抑素(SS)cRNA探针显示组织切片中ss mRNA。解剖学杂志,1992,15(4):312~313
13.正向华,张俐.应用反意生长抑素cRNA探针原位杂交显示大鼠下丘脑生长抑素mRNA.解剖学杂志,1990,13(4):307
14.何彬,等.一种快速敏感的原位杂交方法.解剖学杂志,1992;15(4):312~313
15.向正华,蔡文琴,等.原位杂交组织化学与免疫组织化学结合法的研究.解剖学杂志,1993,16:451~454
第二十一章 原位杂交技术在染色体和电镜水平的应用
原位杂交免疫细胞化学技术的应用除在培养的离散细胞涂片和各种组织制片如恒冷箱冷冻切片、石蜡包埋切片外,又进一步扩展到染色体铺片和电镜水平。现分别予以介绍。
第一节 原位杂交技术在染色体铺片的应用
近年,不少科技工作者将原位杂交组织细胞化学技术(ISHH)应用于细胞分裂中期(Metaphase)和分裂间期(Interphase)的染色体铺片上,利用标记的核苷酸探针与之进行杂交,可在光镜或电镜水平检测到不同的特异性的标记物。目前,原位杂交组织化学在染色体铺片的应用主要在三个方面:染色体的基因分配或基因图(Gene assignment)的研究、癌细胞或癌前组织的染色体异常的间期细胞遗传学分析研究和性染色体对胚胎的生前诊断。在依次介绍这些方法的应用以前,我们先简要介绍一个有关染色体的基本的知识和染色体铺片的制作方法。
一、有关染色体的基本知识及制片
(一)染色体的形态结构
体细胞的染色体是46个,23个,其中22对是常染色体,一对是性染色体。男性一对XY,女性为XX。染色体的形态随着细胞周期的不同而有所改变,在光学显微镜下所看到的染色体是细胞分裂中期染色体(metaphase chromsome)。
每个染色体含有两条染色单体,呈赤道状彼此分离,只有着丝粒处相连。根据着丝粒的位置分为三种类型,中部着丝粒型,亚中部着丝粒和端着丝粒型(图21-1)。

图21-1 正常人体细胞的三种染色体
1.中部着丝点染色体;2.近中部着丝点染色体;3.近端部着丝点染色体
1.非显带染色体特征分为七组
A组(1~3):为最大的具中部着丝粒染色体,这组染色体相互间很易区别。第1号和第2号染色体大小相似,唯第2号染色体为近中部着丝粒染色法。第3号染色体较1、2号染色体小,为中部着丝粒染色体。
B组(4~5):为大的具中部着丝粒染色体。2对染色体之间在形态和长度上较难区别。
C组(6~12号和X):为中等大小的具中部或近中部着丝粒染色体。这组染色体较难区分,其中第6、7、11号和X染色体为中部着丝粒染色体,第8、9、10和12号染色体为近中部着丝粒染色体。女性为2个X染色体。男性只有1个X染色体。
D组(13~15号):为中等大小的具近端着丝粒染色体。在其短臂上有随体。与他组染色体有明显区别。但3对染色体之间较难区别。
E组(16~18号):为小的具中部或近中部着丝粒染色体。第16号染色体为中部着丝粒染色体,第17号和18号染色体为近中部着丝粒染色体。不过,着丝粒位置第18号较第17号染色体更近端部。
F组(19~20号):为更小的中部着丝粒染色体。2对染色体之间,形态上很难区别。
G组(21~22号和Y):为最小的近端着丝粒染色体。第21号和22号染色体大小相似,且短臂上常连有随体。Y染色体常比第21和22号染色体大、染色深。且无随体。Y染色体长臂2个染色单体比较靠拢,长臂末端也较模糊。
2.G带染色体的特征
第1号染色体:识别并不困难,但初学者易把长短臂颠倒。短臂的近侧1/2处有2个深带。远侧有一半几乎为浅染区;短臂共分3区。界标为近侧的深带(2区1带)和中段的深带(3区1带)。长臂近侧为一窄的浅带。中段和远侧段各有2条深带;长臂共分4区,界标为次缢痕远侧的浅带(2区1带)、中段的深带(3区1带)和远侧的深带(4区1带)。
第2号染色体:短臂可见4条深带。中段的2条深带常互相靠近,表现为1条深带;短臂共分2区,界标为1浅带(2区1带)。长臂可见4~7带,近侧着色甚浅,中段及远侧着色较深;长臂共分3区,界标为2个浅带(2区1带和3区1带)。
第3号染色体:短臂近侧可见2条深带;远侧可见3条深带,其中远端的1条带较窄,染色浅;短臂分为2区,界标为1浅带(2区1带),长臂近侧和远侧各有1条较宽的深带:好的标本近侧深带可分为2条深带,远侧深带可分为3~4条深带;长臂分为2区,界标为1浅带(2区1带)。长臂深带宽度略大于短臂深带。
第4号染色体:短臂有1~2条深带,只1区。长臂有均匀分布的4条深带;长臂分3区;界标为2浅带(2区1带和3区1带)。
第5号染色体:短臂有1条深带,只1区。长臂有5条深带,中段的3条深带常靠近;长臂分3区,界标有1深带(2区1带)和1浅带(3区1带)。
第6号染色体:短臂近侧有1宽的浅带,远侧为1深带;短臂分2区,界标为1浅带(2区1带)。
第7号染色体:短臂有2~3条深带,近末端带着色很深;短臂分2区,界标为1深带(2区1带)长臂有3条深带,近侧和中部的2条带较深;长臂分3区,界标为2深带(2区1带和3区1带)。
第8号染色体:短臂有2条深带,远侧深带较近侧深带着色深;短臂分2区,界标为1浅带(2区1带)。长臂有3~4条深带,远中的深带着色较深;长臂分2区,界标为1深带(2区1带)。
第9号染色体:短臂有1~2条深带;短臂分2区,界标为1深带(2区1带)。长臂2条深带。长臂分3区,界标为2深带(2区1带和3区1带)。
第10号染色体:短臂有2条深带,近侧较近侧深带着色浅;短臂只1区。长臂有3条深带,近侧深带着色更深;长臂分2区,界标为1深带(2区1带)。
第11号染色体:短臂有1~2条深带;短臂只1区。长臂有2条深带,在近侧深带与着丝粒之间有1宽的浅带;长臂为2区,界标为1浅带(2区1带)。
第12号染色体:短臂有1条深带;短臂只1区。长臂有3条深带,中间的1条深带宽,近侧深带与着丝粒的距离较第11号染色体近;长臂分2区,界标为1深带(2区1带)。
第13号染色体:长臂有4条深带,中间2条深带宽;长臂分3区,界标为中间的2条深带(2区1带及3区1带)。
第14号染色体:长臂有45条深带,近侧的第2条带和远侧的带着色更深;长臂分3区,界标为2条深带(2区1带和3区1带)。
第15号染色体:长臂有4条深带,近侧的第2条带较宽;长臂分2区,界标为1深带(2区1带)。
第16号染色体:短臂有1~2条深带,短臂只1区。长臂有2条深带,近中部深带明显;长臂分2区,界标为1深带(2区1带)。
第17号染色体:短臂有1深带;只1区。长臂1~2深带,远侧深带较宽,在深带与着丝粒之间有1宽的浅带;分2区,界标为浅带(2区1带)。
第18号染色体:短臂为1浅带区。长臂有2条深带;为2区,界标是1浅带(2区1带)。
第19号染色体:着色最浅。着丝粒周围为深带。短臂和长臂均为1区。
第20号染色体:短臂有1深带,较宽;短臂和长臂均为1区。长臂有1深带,较宽。
第21号染色体:最小的1个染色体。长臂紧按着丝粒处有1深带,较宽;长臂为2区,界标为1深带(2区1带)。
第22号染色体:较21号色体长,长臂紧接着丝粒处有1深带,较窄。短臂和长臂均为1区。
X染色体:短臂中部有1条深带;分2区,界标是深带(2区1带)。长臂有4条深带,其中近槽深带最宽;分2区,界标是近侧深带(2区1带)。
Y染色体:长臂远侧半色着深,为1深带;短臂和长臂均为1区。
现在国内流行一种辨认G带每个染色体的口诀,稍加修改如下:
一秃二蛇三蝶飘,四象鞭炮五黑腰;
六号短空小白脸,七上八下九苗条;
十号长臂近带好,十一低来十二高;
十三十四十五号,三个长臂一二一;
十六长臂缢痕大,十七长臂带脚镣;
十八人小肚皮大,十九中间一黑腰;
二十头重脚脚底轻,二十一带宽身体小;
二十二带小身体大,Y长一宽近末端;
X短臂一、长臂三,中间象个工字般。
(二)染色体G显带技术
1.原理染色体的化学成份是核酸和蛋白质两部分。核酸以DNA为主,蛋白质有组蛋白和非组蛋白两种。因此染色体经蛋白水解酶类物质处理后,蛋白质已被水解而使DNA分子中碱基暴露,由于碱基中G/C和A/T组合的比例不同,对染料结合的程度不一,如这一段A/T碱基的成份多,则Giemsa染料易与它结合成深染;另一段G/C碱基的成份多,则Giemsa染料不易与其结合,结果成淡染,由于整条染色体上A/T和G/C的分布不匀,这样在染色体上呈现出深浅不一的条纹或者称带纹,该技术用Giemsa染色,故其带型称为G带。
2.操作过程
(1)按常规染色体技术制片。
(2)制好的染色体玻片,在80℃烘箱中,烘烤2h,置于室温。
(3)4℃冰箱PBS液5min。
(4)4℃冰箱PBS缓冲液含胰蛋白酶终浓度0.025%,消化10min。
(5)蒸馏水洗净胰酶。
(6)Giemsa染色20min。
(7)蒸馏水洗净染色液,晾干镜检。
4℃低温胰酶处理片子,其优点是:时间较长,易掌握。配制1次试剂可用1~2个月。
(三)高分辨染色体G带技术
1.原理常规的G带显带技术,在人类染色体中仅观察到320~450条带纹,对于一些染色体细微结构异常的识别是不够的。
氨甲碟呤抑制二氢叶酸还原酶,阻止叶酸转变为四氢叶酸,从而干扰了脱氧胸腺嘧啶核苷酸的合成,阻止了DNA的复制,使细胞被阻止在S期内。胸腺嘧啶核苷解除氨甲喋呤的作用,让被阻滞的细胞同时开始进行DNA复制,进而同步分裂;放线菌素D可增加染色体的长度,能显示更多的亚带。放线菌素D与核酸相互作用:①插入脱氧鸟嘌呤核苷酸和脱氧胞啶核苷酸之间,使DNA变长;②能与染色体缩短有关的特殊蛋白和DNA结合,因此,抑制了染色体正常的收缩过程。秋水仙胺抑制纺垂丝的形成,可以得到较多的晚前期、前中期、早中期的分裂相。这样染色体带纹可增加到500和850条,甚至可达1200~2000条之多。这一步对于研究较细小的染色体缺陷的基因定位,具有很大的意义。
2.材料和方法
(1)4ml培养液(为从日本进口的RPMi 1640或从美国进口的F10液)虽自制的小牛血清1ml。每ml加青、链霉素各100单位,pH=7.2。
(2)每瓶培养液内,另加自制的PHA或重庆产的PHA2.5mg。
(3)取外周血2ml,分别装入含培养液的4个培养瓶内。
(4)37℃孵育箱内培养72h。
(5)加入氨甲喋呤,最终浓度10-7mol/L,继续培养17h。
(6)用不含血清的培养液冲洗两次后,将上清液吸出,再加入含胸腺嘧啶核苷(最终浓度为10-5mol/L)的培养液,继续培养3h。
(7)再加入放线菌素D,最终浓度为3μg/ml,培养2h。
(8)加秋水仙胺,最终浓度为0.03μg/ml,培养2h。
(9)按常规染色体技术制片。
(10)按一般常用的G带显带技术,显示带纹。
3.注意事项
(1)高分辨染色体,重叠多,应增加固定次数和固定时间,可置于4℃冰箱存放24h后制片,用高距离滴片,以使染色体分散开。
(2)细胞培养液同步化后,如果用5-溴-2脱氧尿核苷(5-bromodeoxyuridine,BrdU),则需加黑物包装进行暗培养。
(四)外周血培养及染色体制片技术
1.国内应用的外周血培养染色体技术
(1)原理:外周血染色体制备是目前应用最广泛的细胞遗传学诊断技术,亦是基本的实验技术,由于取材容易,培养过程比较简单,短期内可以得到结果,所以其实用价值很高。
血液中含有红、白两类细胞,它们均是处于未分裂的间期细胞。红细胞没有核,无分裂能力;白细胞类虽有细胞核存在,但是外周血中处于休止期。植物血球凝集素(简称PHA)能促使淋巴细胞和单核细胞转化为具有分裂作用的母细胞。染色体只有在细胞分裂中期时最典型。秋水仙素类药的药物能抑制纺锤丝的形成,使细胞分裂停止于中期,低渗处理使细胞膨胀,细胞膜破裂,染色体分散,这样就可便于分析。
简意流程图:

(2)操作过程
①采血:无菌干针筒从静脉取血1~2ml,用肝素抗凝(约每毫升全血内含肝素100单位)。
②培养液配制:RPMI 1640 4ml
小牛血清 1ml
1%PHA(自制)0.2ml
调节 pH为7.4后置于-20℃冰箱
③标本接种:每5ml培养液加入抗凝全血0.5ml。
④培养细胞:将接种好的培养瓶置于37℃恒温箱中培养72h。
⑤阻止分裂:培养至68h,加秋水仙素,最终浓度0.02μl/ml,摇匀后置于37℃恒温箱中继续培养4h。
⑥收获:培养物混合后,置于10ml离心管内,离心10min(1000转/min),去上清液。留下培养物。
⑦低渗处理:低渗液可用0.56%的KCl(或0.075mol/l KCl)5~7ml,用吸管打散沉淀物,置于37℃水浴箱中保温20min,然后加入固定液(3份甲醇:1份冰乙酸)1ml用吸管打匀,预固定1~2min。
⑧离心:1000转/min离心10min。
⑨固定:吸去上清液,留下沉淀加上述固定液6~8ml,用吸管将沉淀物打散,固定30min后离心,1000转/min离心10min,取出吸去上清液留下沉淀。
⑩重复上述固定离心1次。
⑾标本制作:最后1次固定、离心后吸去上清液,留下沉淀再加少量新鲜固定液约0.3ml打散细胞悬浮液即可进行制片。制片之前先将载玻片经清洁液洗净处理后,置于冰箱内制成冰片。取冰片1张滴上2~3滴细胞悬液。利用冰片的表面张力关系使液体迅速向玻片四周散开,与此同时用嘴轻轻吹向滴片处,以助其更快散开,然后在酒精灯火上通过7~8次后,自然干燥或烤干均可。
⑿染色:Giemsa染液1份和pH7.4磷酸缓冲液9份,混合后,染色20min,蒸馏水洗去余下染液,晾干,镜检观察。
(3)注意事项
①无菌操作是关键。培养液不得污染。
②所用药品不得失效,特别是PHA,既要使淋巴细胞转化,又不能过量。
③小牛血清优质、无菌。
④秋水仙清素低浓度4~6h效果最佳,过量则染色体易收缩。
⑤固定液和Giemsa染液要求新鲜配用。
⑥培养时间72h较好。
(4)各种物品清洗与消毒
①玻璃器皿用后,立即用自来水冲洗,再用洗衣粉刷洗,然后用自来水冲洗。待干,泡入清洁液24~48h,取出,自来水冲洗,再用双蒸水冲洗,干后备用。
②接触洗液时,带上橡皮手套,围裙等防护品。
常用清洁液配制:
重铬酸钾25g
水200ml
浓硫酸1000ml
③先将重铬酸钾在水中溶解,然后慢慢加入浓硫酸,边加边搅拌,防止过度发热。使用3~6月后检查,若变绿表示失效。
④G5、G6漏斗的处理:水洗净、晾干,于浓硫酸泡(或洗液中泡)24h,再用蒸馏水冲洗至加入1%BaCl2滴无白色沉淀为止。包装消毒,15磅20min。
(5)橡皮塞的处理
新的橡皮塞洗后,先用0.5N NaOH煮沸15min,再用0.5n HCl煮沸15min,流水冲洗10min,用双蒸水泡24h,双蒸水冲洗,晾干,15磅20min高压灭菌。
(6)金属器械清洗
先用纱布或纸擦去防锈油,然后用洗涤液清洗,再用清水或蒸馏水洗净,擦干或烘干备用。
2.外周血细胞培养法(Bhatt B and McGee JOD,1990)
(1)收集静脉血(无菌),加肝素抗凝(20单位/ml);
(2)加0.8ml全血入每个培养瓶(含10ml培养液),37℃培养72h;
培养液配制:RPMI 76ml(Gibco,Cat.No.041-1875M)
小牛血清 20ml
PHA 2.0ml
(3)加100μl Brdu于培养瓶中,37℃再孵育16~17h;
(4)离心(1200rpm)8min,弃去上清液,沉淀中加入10ml RPMI 1640培养液,混匀;
(5)重复步骤(4);
(6)沉淀中加入10ml新配制的完全培养液(含2.5μg/ml胸腺嘧啶),重新置于37℃孵育6~7h;
(7)在收获培养细胞前15~30min,可加Colcemid,但当同时应用BrdU时这就并非十分必要。因为BrdU是胸腺嘧啶核苷的类似物,能使染色体在富含异染色质处断裂分解,从而使显带明显;
(8)1200rpm离心培养细胞,弃去上清液,加入1ml 0.56% KCl(事先预热至37℃),继续加入0.56%KCl使总容量达到10ml,在37℃孵育10min;
(9)如上述离心,弃去上清液,在沉淀的细胞内加入新鲜的冷固定剂,(甲醇:冰醋酸=3:1,新鲜配制,保存在冰上),置冰上至少20min;
(10)重复步骤(9)3~4次,直至细胞悬液清洁无色;
(11)可较长期保存在冰的固定剂内(-20℃)或再离心后加入0.5~1.0ml新鲜固定剂,置于冰上;
(12)玻璃载片放在Decon(清洁液)或其它的清洁液内过夜,次日用自来水冲洗,继之蒸馏水漂洗,在60~75℃干燥,然后把载片孵育在2%丙酮液内,室温,60min。自来水冲洗,再在60~75℃干燥;
(13)每张载片上加10μl的细胞混悬液,空气干燥,在24h后可应用于杂交实验,也可保存在-4℃达8周之久(试剂配制法见附录四)。
二、应用ISHH技术对染色体制片、基因分配(Chromosomalassignment of genes)的研究
(一)基本原理
染色体上基因位置分配的研究,又叫染色体图的研究,包括基因名称、基因在染色体的位置及与相邻基因的距离及其核酸序列的研究。研究基因图的方法包括家系的连锁分析法、体细胞杂交法、重组DNA技术和原位杂交法。果蝇的线形基因图和大肠杆菌、T4噬菌体两者的环状基因图都已绘成,目前正致力于人类基因图的绘制。人类基因约有5万~10万个,根据第八次国际人类基因定位工作会议,已定位的人类基因总数达1479个。
ISHH技术对染色体基因图的研究,是用同位素或生物素、地高辛标记的核酸探针,直接同中期的染色体铺片行杂交。早期的研究是用于重复序列DNA的定位,如编码核糖体的基因18S和28S核糖体RNA定位于第13~15号染色体和第21~22号染色体短臂次缢痕区。5S核糖体RNA定位于第1号染色体上长臂的远侧Iq42~Iq43。近年已能进行单拷贝基因的定位,如胰岛素基因定位于IIp 15上、C-mos原癌基因定位于Sq22上、N-ras原癌基因定位于IPI34。在染色体11的短臂上,利用ISHH技术证明4个基因依次排列,从短臂的远端依次为胰岛素、β-球蛋白、HRASI和PTH。
(二)操作步骤(Bhatt and MCGee, 1990)
在前面已介绍了制备血培养染色体铺片的方法。下面介绍的是在染色体制片上用免疫金银染色法进行原位杂交的基因定位显示、结合Giemsa染色显带技术的操作步骤。
1.移除内源性RNA
(1)加100μl RNA酶溶液,覆以盖玻片,放在有少许2×SSC溶液的湿盒内孵育,37℃,60min。
(2)在2×SSC溶液内移除盖玻片,以2×SSC洗2×3min。
(3)等级酒精系列脱水,10%,50%,70%,90%和100%,各1min,各1min。空气干燥。
2.探针标记和纯化用缺口平移法将生物素11-dUTP标记在DNA核酸探针上。
3.变性与杂交
加20~100ng生物素标记探针到杂交液中,加入5μl 20mg/ml人或鲱鱼精子DNA,总容量为30~40μl,离心5s,混匀后,滴于染色体铺片,覆以盖玻片,盖片四周以橡皮泥封固。放入盛2×SSC溶液温盒内75℃7~8min,使之变性,继之于37℃孵育16h。
4.杂交后漂洗2×SSC溶液内移除盖玻片,将载片浸入含50%甲酰胺的2×SSC溶液内,pH7.2,20min,42℃。然后作下列程序漂洗
溶液 漂洗时间温度
2×SSc 20min42℃
1×SSC20min 室温
0.1×SSc 20min 室温
5.免疫细胞化学显示
(1)孵育载片于PBt 15min,将片缘及背面擦干,加100μl一抗于载片(兔抗生物素抗血清1:100,以PBT稀释),孵育于37℃40~60min。
(2)快速用PBT冲洗,擦干片缘及背面,加100μl二抗抗血清(羊抗兔IgG结合10~20nm金粒,以PBT1:50稀释)于载片染色体铺片部位,37℃孵育45~60min。
(3)PBS洗3×5min。
(4)蒸馏水洗3×5min。
(5)加数滴银溶液于载片上,在光镜下监测,大约需5~18min可见在染色体上出现银斑点。
(6)蒸馏水洗。PBT配制见附录3。
6.显带复制(Replication banding)
(1)应用5μg/ml Hoechst 33258在2×SSC溶液内,暗室中染载片20min。
(2)蒸馏水洗,以2×SSC封固,覆以盖玻片,盖片四周封以橡皮泥。
(3)紫外光照射1~16h。
(4)蒸馏水洗和以10%Giemsa(磷酸缓冲液稀释,pH6.8~7.2)染色10min。
(5)蒸馏水冲洗,空气干燥,以DPX封固。
(6)光镜下观察,可见棕色的银斑点在染色体上的定位,并显示其与染色体分带的关系。
三、利用ISHH技术对肿瘤或癌前组织的细胞间期染色体铺片进行研究
(一)基本原理
在恶性的或癌前病变的组织,染色体组含量与结构的畸变在部分病例中与疾病的预后相一致。由于染色体基因的变化可能导致肿瘤的发生与进展,利用一些技术预测这些遗传物质的变化可为恶性肿瘤的检测及了解其进展和预后提供资料。流式细胞计(FCM)和染色体组型,即核型分析(karyothping analyses)等技术曾被用于这个领域的研究。FCM可测定肿瘤细胞DNA的含量,但它不能显示特异性染色体的结构异常,而且对微量的DNA含量改变难以检测。核型分析可以显示染色体结构和含量的变化,但要分析肿瘤细胞的核型只有在细胞培养以后。细胞培养时细胞的高度分裂指数和细胞的生长会导致染色体物质的丢失,而且核型分析不能显示特异性DNA探针的原位杂交技术,能够检测在细胞分裂间期细胞核内染色体数量和结构的异常变化。因此,这项技术又被称为“间期细胞遗传学分析法(Interphase Cytogenetics Analysis, ICA)。间期细胞遗传学的基本原理是利用合成的特异性DNA探针,标记以同位素、生物素、地高辛或荧光素,对外周血、肿瘤细胞或癌前组织的离散培养细胞的染色体铺片或切片进行DNA-DNA原位杂交,其杂交定位以荧光法、放射自显影或免疫组化法显示。目前ICA已广泛应用于生前诊断、肿瘤组织活检材料的诊断和基因异常的诊断。在肿瘤细胞方面,在乳腺癌,神经系统肿瘤、睾丸肿瘤,妇科肿瘤和膀胱肿瘤等均有实验报告。现已能提供的DNA探针有染色体1,7,8,9,10,15,16,17,18和性染色体X、Y,以及识别一些染色体特征性部位如着丝点(centromeric region)、染色体端极区(telomere region)的特异性重复靶核苷序列和随体的DNA探针,多数为合成的寡核苷酸探针,在应用上采取ISHH和FCM以及免疫组化相结合(有时还结合核型分析)的综合研究法(图21-2),也可用多种标记物显示不同颜色或不同标记在一张切片上同时显示多个染色体的结构或DNA含量异常,如异硫氰酸荧光素(FITC)和罗丹明200结合,前者显示黄绿色,后者显示红色,ABC-DAB显示法与地高辛-碱性磷酸酶系统相结合,前者反应物为棕色,后者为紫蓝色。这种联合应用法又叫多靶点原位杂交法(multiple-target ISH)。

图21-2 肿瘤组织处理流程图
(二)基本操作方法
1.玻片与组织前处理
(1)肿瘤细胞混悬液的制备:新鲜的从活检或外科手术或尸检获得的材料建议按图21-2的流程处理进行综合研究。用以制作细胞混悬液的组织在处理前可保存于液氮内。组织块在玻皿中切碎或用细胞打碎机打碎,用100μm孔直径的尼龙网过滤器滤过,固定在70%乙醇,-20℃,如保存于-39℃可保存数月至数年。
(2)分离的细胞由于表面有细胞质的覆盖,在荧光显微镜下会显示强烈的自动荧光,从而掩盖了ISHH的信号。可采取下列两种方法移除覆盖的细胞质;
①乙醇固定后的细胞,应用以前在新鲜制备的甲醇/醋酸(3:1)固定液内0℃,5min。滴2~3滴固定后的细胞混悬液于涂有粘附剂的载片上,空气干燥,然后快速浸入70%醋酸内10~60s。应用蒸馏水洗,在100%乙醇内脱水,空气干燥。
②应用胃蛋白酶蛋白水解作用。加5μl细胞混悬液于载片上,空气干燥30min或在80℃烤箱中干燥。胃蛋白酶(2500~3500单位/mg蛋白质,Sigma,USA)应用0.01mol/L HCl稀释至50~400μg/ml,10min 37℃;再用0.03% H2O2和PBS漂洗,以4%多聚甲醛固定,0℃,5min;载片脱水,空气干燥,在80℃加热变性30min。这个方法较①更好,能移除蛋白质、暴露核DNA和有助于探针的穿透,最重要的能较好的保持形态学的结构,以利于ISHH的荧光信号的显示。应用①法,细胞经常呈扁盘状,而且细胞质的自动荧光未完全消失,影响ISHH荧光信号的显示,但实验表明,必须严格掌握胃蛋白酶的浓度,过低,由于细胞质的覆盖,基因拷贝数会减低,而过高浓度的胃蛋白酶会导致过度消化影响细胞的形态结构。
(3)组织切片处理
①冷冻切片:切片厚5μm,放置有粘附剂的载片上,空气干燥,固定在4%多聚甲醛-PBS溶液,0℃,15min。固定后以PBS和0.01n HCl漂洗,以胃蛋白酶(20~100μg/ml,用0.01N HCl配制),37℃,30min,PBS漂洗2×5min,在4%多聚甲醛内固定15min(0℃),PBS洗2×5min,系列等级乙醇脱水,空气干燥。杂交前,在80℃加热30min使之变性。
②石蜡切片:切片厚5μm,漂洗在40℃温水中,捞片于有粘附剂的载片上,空气干燥,56℃加热1~16h,二甲苯脱蜡2×3min甲醇冲洗2×5min。应用1%H2O2(用甲醇配)溶液封闭内源性过氧化物酶活性。以甲醇冲洗,空气干燥,以胃蛋白酶(4mg/ml,用0.2n HCl配)37℃ 30min。消化后,载片以PBS冲洗。在杂交前,载片孵育于1%甘氨酸溶液-PBS中15min,以PBS冲洗和系列酒精脱水,空气干燥。载片在80℃孵育30min使之变性。
2.杂交本实验的杂交液略区别于其它实验,否则染色体1号和18号的DNA探针不仅结合1号和18号染色体,还会同时结合染色体9,6,13,21。杂交液配方:
甲酰胺 60%(V/V,2×SSC配,pH5.0)
鲱鱼精子DNA 1μg/μl
余与一般杂交液配制相同
对多靶点ISHH,须另加入1mmol/L KCN入杂交液,每张载片加5μl的含特异性DNA探针(2.5ng/μl)的杂交液,以盖片覆盖,四周用橡皮泥封固,先在80℃热板上5~10min使DNA变性,细胞混悬液制片变性时间只需2.5min,然后在37℃杂交,孵育过夜。
3.杂交后漂洗同本节 (二)杂交后漂洗步骤。
4.显示步骤根据标记物的种类(同位素、荧光素、生物素或地高辛)分别进行显示(与第二十章 中叙述相同)。
5.结果在光镜下可见染色体结构的改变,如在膀胱肿瘤细胞,其DNA含量经FCM显示高于正常组织1倍,在双靶ISHH显示载片上,可见肿瘤细胞间期核内,1号染色体为3倍体,而18号染色体为2倍体。在肿瘤细胞内应用双重靶点或多重靶点ISHH技术可见细胞间期核内多个染色体的众多畸变相。
ISHH技术作为一项快速与敏感的侦检细胞间期细胞核内染色体畸变的新技术,可结合病理材料的常规组织切片、免疫组化染色和FCM等对病检材料做出早期的、准确的诊断,并对肿瘤的预后与进展等有所了解。本技术成功的关键在于具有特异性的DNA探针和ISHH的侦检程序,比如染色体的拷贝数与肿瘤细胞前处理的方法有关,如移除蛋白质不彻底,就会使侦检到的染色体拷贝数减少。又如在切片上进行细胞间期染色体的ISHH时,常见到一些细胞核碎片呈不同形状的斑点状(在涂片上不会出现此种图像)。对ISHH所获得资料的分析,须经过反复的实践,比如模糊的或分裂的斑点可以是非整倍体(aneuoploidy)的假阳性反应,产生于细胞周期的G2期。
四、利用性染色体特异性DNA探针的ISHH技术
(一)基本原理
利用性染色体X或Y的特异性DNA探针的ISHH技术进行胎儿生前(Prenatal)性别的诊断,样品取自于羊水、绒毛或胎儿的血液。近年,科技工作者又成功地进行了胚前(pre-embry-o)或植入前(preimplantation)的ISHH诊断。所谓胚前诊断是在受精卵植入子宫内膜前的4~6细胞期,以显微操纵器(micromanipulator)或微型吸管穿破透明带,将分裂球或其中的部分细胞吸出放入培养液内,应用ISHH技术进行性染色体的分析,如有染色体畸形,可及早移除,避免以后进行人工流产术。本技术可还用于鉴别精子是带X或Y染色体。如果1个妇女遗传性基因是与X染色体相联系的,那么可给予人工授精只带X染色体的精子以避免其子代有遗传疾病的危险。当然带X染色体的精子的分离技术还有待于研究和建立。目前这还是一种实验性设想。羊水可在16~20周妊娠期吸取。在18~19周时,20ml的羊水内大约含100万个细胞,含大约7μgDNA。绒毛膜的绒毛可在3~6月取,每次可获5~50mg的组织。应注意在应用前清除母体细胞。胎血0.2~0.7ml可在17~40周采取,在15~21周,胎血中含2×109白细胞/L和类似数量的有核红细胞(Miller et al, 1985)。在32~34周,有核红细胞的比例数降至0~50/每100个白细胞。这种以性染色体为探针的ISHH技术,可应用于分裂中期的染色体铺片上,也可以应用于间期细胞核制片。性染色体ISHH技术在下列场合特别有用,如(1)当无足够的分裂细胞供可靠的细胞遗传学分析时;(2)当胎儿面临性染色体连锁遗传性疾病的危险而需做迅速的性别确定时;(3)协助鉴别45,X/46,XY镶嵌和其它异常染色体的镶嵌类型;(4)当一雌性具有一Y染色体的杂交时,应检查其父母的血样品,因为在正常情况下有部分的雄性具有2个Y染色体。这里只叙述了性染色体在ISHH技术的应用,如用同样技术标记其它染色体也可能对其它遗传性疾病进行诊断,如Julien等(1986)曾应用染色体21号DNA探针于间期细胞核,出现3倍体,为常见遗传性疾病Down氏综合征的诊断特征(发病率为1/700出生者),同样,在Edward氏综合症(遗传性疾病出现率1/3000出生者)显示18号染色体为3倍体。West实验室进行了大量的性染色体的ISHH实验,并比较了各种标记物的优缺点,他经反复实验后承认非放射性同位素标记物如生物素、地高辛具有许多优点,但在性染色体的ISHH显示,他认为至少在他的实验室同位素3H的标记优于其它的标记物。
(二)基本操作方法
1.Y染色体3H标记DNA探针原位杂交技术
(1)探针标记,以3H标记Y染色体DNA探针(详见第19章 )。
(2)原位杂交
①RNA酶的前处理:取1ml RNA酶保存液(10mg/ml)于250ml 2×SSC内,预热于37℃水浴中。选具有适量的细胞分布的载片孵育于稀释的RNA酶溶液中,37℃,1h。系列等级乙醇脱水,70%,90%,100%乙醇各2min,空气干燥。
②相当250ml的预杂交液(含70%甲酰胺,0.6×SSC配),70℃水浴。置载片于此预杂交液内2min以使靶DNA变性,如(1)经系列等级乙醇脱水,空气干燥。
③DNA探针准备与变性
杂交液:10×SSC20%
tRNA 10%
甲酰胺 50%
硫酸葡聚糖 20%
DNA探针-3H 20%
均匀混合,70℃水浴5min使探针变性,然后迅速置冰上冷却。
10×SSC:1.2mmol/L NaCl
0.15mmol/L醋酸钠
0.2mol/L NaPO4
tRNA(SigmaR1759)4mg/ml(用TE缓冲液配),-4℃保存。
TE缓冲液:10mmol/L Tris,1mmol/L EDTA,Ph7.5。
每张载片加20μl含探针的杂交液,覆以盖玻片,四周用橡皮泥封固,于37℃孵育过夜。可测定3H的放射比性,以了解每张载片的探针含量。
④杂交后漂洗,次日移除盖玻片,用缓冲液39℃漂洗
50%甲酰胺1×SSC 4×5min
1×SSC 39℃ 4×5min
⑤系列等级乙醇脱水,70%,90%,100%各2min,空气干燥。
(3)放射自显影(详见二十章 第一节 ):浸入核乳胶,暗盒于冷室或4℃冰箱储存,显影,定影,复染,封固和观察。应用3H标记pHY2.1DNA探针,其曝光时间大约为6~7日。
2.杂交前精子的处理
(1)取1ml用缓冲液清洗过的精子,加1ml 6mmol/L EDIT(60μl 0.2mol/L EDTA加1940μl的BWW培养基)。留置于室温5~10min,离心(1000rpm(175×g)5min。
(2)弃上清液,沉淀的精子内加1ml 2mmol/L DTT(dithiothretiol, DTT,二硫苏糖醇),配法:154μl的DTT加1846μl(4g/ml)BWW培养基(Gibbers et al, 1971),置室温45min,再离心1000rpm 5min。
(3)弃上清液,用BWW培养基再稀释、离心。
(4)加新鲜配制固定剂(甲醇:醋本以=3:1),反复混匀或置于漩涡式的混匀器上混匀,室温30~60min,离心。
(5)加数滴新鲜固定剂于离心管中,如上再混匀。迅速从混匀液中取2~3滴精液滴于载玻片上,空气干燥,以相差显微镜检查确有精子存在,保存在清洁的干盒中备用。
(6)在ISHH以前,取出载片,加数滴0.05% SDS(20μl 0.05% SDS/每2ml BWW培养基),静置5min,倾去SDS(十二烷基磺酸钠,配制法见附录2),以2×SSC漂洗,系列等级乙醇脱水,70%,90%,100%各2min,空气干燥。
(7)杂交步骤同上,杂交后以0.5%伊红黄(Eosin yellow)复染,自来水冲洗,空气干燥,DPX封固。
本节 简要介绍了ISHH技术在染色体铺片应用的三个方面,并摘要介绍了它们的应用及操作方法。由于这一技术在国际上也处于刚起步阶段,其发展主要在近10年,国内尚未开展,因此,此一技术的应用还有待于不断的摸索与完善。必须说明的是ISHH在染色体制片的应用也需设置对照实验组(详见第二十章 第一节)。
第二节 原位分子杂交技术在电镜水平的应用
自Gall和Pardue建立了原位杂交技术以来近20余年内,这一技术为基因的定位和表达、基因进化、发育生物学、肿瘤学、微生物学、病毒学、医学遗传学和遗传分析等领域研究提供了极其宝贵的资料,发挥了其它技术难以取代的作用。近年来,此一技术的应用领域逐渐扩大并在两个主要进行了技术法的改进。一方面是应用一系列放大手段增强检测的灵敏度(详见二十二章 ),另一方面是提高其分辨率,即向电镜水平发展。Jacob(1971)首先用3H标记的核酸RNA探针与DNA杂交并在电镜水平显示获得成功,继后不少科技工作者在这方面做了大量的工作(Manning et al 1975,Steinert et al1976,Hutchison et al 1982)。但所应用的均是同位素标记核酸探针,直到1986年Binder首先用生物素标记的rDNA及UI探针,在蜂蝇(Drosophila)卵巢,应用Lowicryl-K4M低温包埋的切片上进行原位分子杂交,以蛋白A和胶体金复合物作为显示系统,较好的保存了组织的形态学结构和较高的信噪比例。Webster等人(1986)应用生物素标记探针显示了细胞内mRNA的分布。Singer等(1989)成功的用双标记原位杂交技术,一方面检测整装抽提细胞内与骨架结合的mRNA,同时显示了该mRNA所表达的蛋白质。新近Fischer等利用地高辛标记rRNA探针在Lowicryl-K4M包埋的切片进行杂交,然后以抗地高辛等抗体结合胶体金颗粒进行显示,以银显示法加强获得极为满意的定位。总之,电镜水平的原位分子杂交技术在国外还处在不断提高和改进的阶段,在国内此一技术还刚起步。焦仁杰等(1992)报告了以生物素标记腺病毒的基因组探针与整装抽提的细胞进行电镜原位杂交技术,成功地证明了腺病毒DNA与核骨架的紧密结合关系,胶体金颗粒呈簇状与串珠状结合在核骨架上。向正华等(1994)应用地高辛标记探针结合HRP的包埋前染色法显示了POMc mRNA定位于神经元的粗面内质网上。下面列举几种代表性的电镜原位杂交技术。
一、应用同位素标记cRNA探针电镜原位杂交技术于染色体制片(Hutchison et al,1982)
(1)将整封染色体铺片放置于金网上,在70%的酒精蒸汽固定4~15h,空气干燥。
(2)以强碱使DNA变性,将金网置于2×SSC内(应用0.1n NaOH调整至pH12),室温,2min。
(3)脱水,以70%和95%酒精各冲洗3次,空气干燥。
(4)杂交,金网覆于平面玻璃皿( Petri dish)内的杂交液滴上,每滴约10~15μl,将此小碟置于盛于杂交缓冲的大塑料盒内,保持湿润,在60~65℃孵育4~24h。
杂交液的配制:6×SSC或6×TNS(1×TNs =0.1mol/L NaCl,0.01mol/L Tris,Ph6.8,含30000~50000cpm/10μl3h cRNA)。
(5)杂交后冲洗,金网自杂交液中取出后立即用大量的2×SSC冲洗多次。RNA酶溶液(20μg/ml)室温冲洗,然后再用2×SSC室温冲洗,冲洗后梯度酒精脱水(70%,95%)空气干燥。
(6)浸入乳胶膜,应用L-4核乳胶液,水稀释4倍。浸膜后的金网,用胶带固定在载玻片上放在密封的黑色塑料盒内,4℃,时间根据同位素种类和靶mRNA含量而定,也可选择不同时间曝光,根据显影强弱确定最终显影的时间。
(7)显影。暗盒自冷房或冰箱中取出后,在室渐中回暖至少30min,以防核乳胶膜皱缩。然后在显影液(Kodax Microdol X)显影3~5min,温度18~24℃。水冲,在15% Kodax快速定影液定影5min,然后在空气中干燥。
所有溶液应尽可能新鲜配制。
(8)电镜观察。
二、应用生物素标记DNA探针电镜原位杂交技术
(一)基本原理
应用DNA探针缺口翻译(nick translation)方法,通过碱基配对以一条DNA链为模板,将生物素标记的某一种脱氧三磷酸核苷酸如Bio-dUTP渗入有缺口的DNA链。将生物素标记的DNA探针与细胞或组织进行原位杂交。显示方法有二种:一种是用HRP显示,类似免疫电镜技术中采取的包埋前染色法,利用地高辛-过氧化物酶HRP显色法进行光镜水平的厚片原位杂交免疫细胞化学染色,其步骤与第二十章 叙述的原位杂交免疫细胞化学基本方法相同,只是为了减少细胞微细结构的损伤,在包埋过程中减少H2O2和Triton X-10等易损伤细胞与组织结构的试剂用量(向正华等1993)。在显色完毕后,取反应阳性部位按常规电镜操作程序进行锇酸后固定,脱水,包埋,切片和观察。此法利用HRP免疫反应产物具有极高电子反应密度体积大小不一,加之非特异性反应产物常掩盖微细结构的背景,不易达到准确的定位。现在比较广泛应用的是生物素-蛋白A(PA)胶体金(gold)标记技术。用于原位杂交的电镜定位,取得较为满意的效果。其基本原理是利用生物素标记探针与细胞或组织进行原位杂交后,利用抗生物素抗体-结合蛋白A-金标记杂交体的超微结构定位,类似免疫电镜中的包埋后染色。在包埋剂应用方面,有报告应用环氧树脂包埋获得成功的。但大多数较满意的结果均获自低温亲水性包埋剂——Lowicryl-K4M,也有应用LR-white作为包埋剂的(详见第七章 )。
(二)应用生物素标记DNA探针-PA-gold电镜杂交技术(Binder et al,1986)
1.固定现认为应用4%多聚甲醛加0.1%戊二醛在磷酸缓冲液中(pH7.4),为较理想的固定剂,也有主张单纯用4%多聚甲醛的,因经实验证明如应用高浓度4%的戊二醛比用多聚甲醛样品其杂交率减低60%。但作者认为应用少量戊二醛可较好的保持细胞的微细结构。也有报告用酒精/醋酸混合液的。多聚甲醛-戊二醛固定时间在15min至1h。然后放入Ringer氏液或PBS,在4℃含7%蔗糖的0.15mol/L磷酸缓冲液中储存过夜。
2.脱水次日,用0.15mol/L磷酸缓冲液(pH7.4)冲洗30min,然后进行脱水,①65%乙二醇,0℃,60min;②80%乙醇-35℃,120min;③100%K4M:80%乙醇 =1:1,-35℃,120min;④100%K4M:80%乙醇=2:1,-35℃,60min;⑤100%K4M -35℃,过夜。
3.包埋 按照Roth et al(1981),组织块包埋于盛有K4M的胶囊中,在-35℃紫外线灯(波长360nm)照射聚合24~48h。取出后置室温,用紫外线灯继续照射24h,使变硬易于进行超薄切片。胶囊短期可保存于室温,如需长期保存,宜置于-70℃冰箱中,可保存近1年。
K4M配制(中等硬度)
交联接剂(cross-linker)2.7mg
单体(monomer)17.3mg
引发剂(initiator)0.10mg
可根据硬度需要调整各化合物比例。增加交联剂的量,组织块的硬度增加。
4.切片超薄切片50~60nm,捞于有覆有Formavar和碳膜的镍网上。
5.组织前处理和预杂交用含0.2mol/l Tris缓冲液的0.1mol/L甘氨酸(Ph7.4)冲洗15min,以除去醛类固定剂对杂交和检测的影响,然后2×SSC冲洗15min,再用变性液(70%去离子甲酰胺,2×SSC)在65℃处理样品5~10min,以达到变性的目的。变化后的样品在预杂交液中(50%去离子甲酰胺,0.5mol/l NaCl, 10mmol/L Tris,1mmol/LEDTA,pH7.5)37℃预处理15min。
6.杂交镍网载有切片面覆盖于杂交液滴(约20μl)上,置于湿盒内37℃,1~2h。杂交液成份与光镜原位杂交免疫细胞化学相同(详见第二十章 ),如为DNA探针须在沸水中先煮2~3min,以使之变性,然后迅速移至冰浴。
整个杂交过程须注意防止镍网上的杂交液干掉。
7.杂交后漂洗
含50%甲酰胺的2×SSC液37℃30min
含50%甲酰胺的1×SSC液室温30min
无甲酰胺的1×SSC液室温20min
样品置1×SSc 4℃过夜
0.01mol/LPBS(pH7.2) 室温10min
4%BSA 封闭 15min
8.羊抗生物素IgG抗体(sigma)1:100(稀释用PBS液:2%NaCl, 0.05% KCl, 0.05% KH2PO4,0.278% Na2HPO4,另加300mmol/L NaCl, 0.5% Triton X-100)室温反应2h。
9.含0.1% BSA的PBS液洗3×30min。
10.兔抗羊IgG的IgG相连10nm胶体金(Sigma)1:100(稀释用1%BSA缓冲液:20mmol/l Tris –HCl, pH8.2,0.9% NaCl,0.02mol/L叠氮钠,0.5%Triton X-100),室温反应1h。
11.1%BSA缓冲液3×30min,PBS(pH7.2)15min,蒸馏水洗5min,空气干燥。
12.醋酸双氧铀染色20min,柠檬酸铅染色15min,空气干燥后电镜观察。
应用本法标记有如下优点:(1)可获迅速的信号检测;(2)形态学保存较好;(3)与放射性同位素原位分子电镜杂交技术的信/噪比例相近。是目前公认在电镜水平应用同位素标记原位杂交技术较为理想的方法。胶体金颗粒电子密度高,明显地区别于非特异性染色与污染,能达到较为满意的超微结构定位。本技术的难点在于:①实验周期长;②亲水性低温包埋剂制作切片,由于亲水性强,捞取比较困难,切片易于破裂;③探针的纯度与杂交后彻底的漂洗,这是本实验成功的关系,而彻底的漂洗又易导致镍网切片的破裂,作用推荐应用大量漂洗液或漂洗中设置多个漂洗杯,勤换漂洗液,或用软塑料瓶加笔状喷头,增加水压等方法,但不论漂洗或喷水冲洗都必须注意水流与网面平行而不能垂直,否则更易导致切片的破裂。④杂交时间:Binder等证明杂交1h即可出现特异性,到5h之内不断增加。Lawrence和Singer(1985)实验也表明杂交后3~4h杂交时特异性就可达到最大值,虽然此后杂交仍继续进行,杂交率并不再增加。焦仁杰等(1992)对整装细胞的试验也与上述实验相同,他们发现杂交4h和杂交20h相当,但前者的结构保存要好得多。他们实验表明,切片标本的杂交时间大约需9~10h。因此,选择最短而又最有效的杂交时间对有效地保持形态学结构是十分重要的。Binder认为生物素PA-Gold电镜杂交技术所需理想杂交时间为1~2h。⑤应用含甲酰胺(formamide)的缓冲液漂洗易导致金粒聚集的非特异性背景,因此Binder在实验后建议试用以PBS缓冲液漂洗5×10min代替含甲酰胺的盐液,经证明可避免或减少这种非特异性染色;⑥多数作者发现应用K4M包埋剂在电镜杂交技术是最理想的,其结果可与无包埋剂的培养细胞涂片、染色体铺片等的信/噪比值相等。
虽然生物素-PA-Gold电镜杂交技术在K4M包埋切片获得了较为满意的结果,但Lawarence和singer(1985)在比较了三种检测系统的信/噪(signal/Noise,S/N)得到的结果是32P标记为70、3H标记为20、而生物素标记的S/N值最低,为10。Webster等(1987)同时比较了生物素标记P-HRP糖蛋白cDNA探针(包埋前染色)和生物素标记P-糖蛋白cDNA探针-蛋白A-胶体金(包埋后染色)电镜杂交技术,观察15天大鼠三叉神经节 雪旺氏细胞髓鞘的标记,固定剂应用PLA溶液(4%多聚甲,15%(V/V)饱和苦味酸)和0.08%戊二醛(用磷酸缓冲液配),二者均获显示,但作者仍认为应用PA-Gold电镜杂交技术在K4M包埋切片上进行载网杂交的显示结果以及形态保存更为理想。
三、应用地高辛标记rRNA探针的电镜原位杂交技术
(一)基本原理
在地高辛标记核酸探针广泛用于光镜水平的原位杂交试验并获极为满意的结果后,科学工作者试图将其应用于电镜水平。其基本原理和生物素标记核酸探针-PA-Gold电镜杂交技术的基本原理相似,首先利用地高辛修饰核酸探针,与细胞或组织进行杂交,再用抗地高辛抗血清相连胶体金与之结合,进行细胞或组织特异核苷酸的超威结构定位。为增强金的显示效应,可用银加强法增强金粒的显示效应。
(二)基本操作方法(Fischer D et al, 1992)
1.组织处理
(1)固定:固定剂采用4%多聚甲醛(PFA,用PBS配制)加0.5%戊二醛(GA),保存在4℃。作者采取浸入法,即取大鼠肝脏放入冷固定剂中(4%PFA,不含GA),切成1mm3左右的小方块。修整好的组织块移入另一玻皿中,内盛有4%PFA和0.5%GA,固定2h。
(2)PBS(4℃)漂洗3~5min。
(3)脱水
时间乙醇浓度温度
2×15min 30%4℃
30min 30%4℃
30min 50% -20℃
2×30min 70%,90%,96%,100% -20℃
注意勿使酒精挥发致使组织干燥。
(4)浸透和包埋(Carlemalarm et al, 1989):由于K4M包埋剂有挥发性,因此,此步操作者必须带手套,在通风柜中进行,注意K4M包埋剂不要靠近O2,一切在低温下进行,最好设有恒低温的冷柜。
①Lowcryl K4M配方
1)交联剂A 2g
2)单体B 13g
3)引发剂0.075g
混合1),2)后,再加“3)”轻搅匀,混匀后置于-20℃。
②浸透(infiltration),在-20℃进行
时间液体
1h100%乙醇:K4M(1:1,V/V)
2×1h K4M
过夜 K4M
2×3h K4M
③包埋: 先将胶囊冷却,滴入几滴K4M,然后每个胶囊内放入一个组织块,以K4M充满胶囊,在室温放置30min,使包埋剂中气泡逸出。然后置于0℃-40℃之间,利用紫外线灯360nm波长照射5天,温度必须保存恒定。然后移至室温使温度回升,胶囊变硬。
④切片:由于胶囊是透明的,包埋在内的肝组织很容易识别。修块后进行切片,由于K4M是亲水性的,在切片过程中注意组织块表面一定不要让水浸湿,用200个网眼的镍网覆以For-mvar膜和碳膜捞取切片,空气干燥备用于杂交。
2.探针准备rRNA探针以Dig-UTP标记,注意探针不宜过长,否则影响对组织的穿透性。如过长,可事先用第二十章 介绍的探针水解法处理。
3.杂交本步骤均在湿盒内进行,将杂交液滴滴于蜡膜上,将镍网载有切片面覆于液滴上,在65℃杂交至少3h。杂交液含:5×SSC,0.1mg/ml tRNA,Dig-UTP反意探针10ng/μl(et 1×SSC配,含150mmol/L NaCl, 15mmol/L醋酸钠)。
4.杂交后漂洗在室温用2×SSC漂洗3×5min,然后用PBST(PBS,0.1%Tween)漂洗2×10min。
5.显示
①以PBST加BT封闭(BT配方:PBST,1%BSA)孵育15min。
②应用抗地高辛抗体结合直径1mm的金粒,以PBST加BG稀释为1:30,室温孵育1h。
③以PBST漂洗3×5min。
④以带笔尖嘴软塑料壶冲洗6×15min。
⑤以银增强法,在暗室中孵育于显影液:促进液(Enhancer)1:1,4~20min。
⑥重复④。
⑦以2%醋酸铀(4min),枸缘酸铅1min染色,漂洗,空气干燥。
⑧电镜观察。
四、结语
原位分子杂交技术在电镜水平的应用,或简称为电镜原位分子杂交技术是基因表达在超威结构定位的一项极有前景的新兴技术。但要使之完善,还需要做许多工作。必须说明的是电镜原位杂交技术和光镜原位杂交技术一样必须设置对照实验组,对显示的结果的解释应持审慎的态度。一般应在重复多次实验的基础上才能得出对本实验的结论,不能只凭一次实验或一张电镜照片就勿忙结论。因原位杂交技术是高度敏感、高度特异性技术,影响因素很多。电镜原位杂交技术的影响和干扰因素更多。相信在不久的将来,随着电镜原位杂交技术的广泛应用,科技工作者将从实践中对本技术的实验流程不断完善并有更多的新的电镜原位杂交技术方法涌现。
参考文献
1.Bhatt Band MeGee JOD. Chromsomal assignment of gene. In:In situ hybridization, Principles andpractice (Eds:Polak JM and McGee JOD)OxFord Science Publication, 1991:149~164
2.HopmanAHN et al.Interphase cytogenetics of solid tumors. In:In situ hybridisation, principlesand practice (Eds:Polak JM and McGee JOD)OxFord Science Pulication, 1991:165~186
3.WestJD.Sexing the human conceptus by in situ hybridization. In:In situ hybridisation, applicationto developmental biology and medicine (Eds:Harris N and Wilkinson DG).CombridgeUniversity Press, 1990:205~240
4.KochJ,et al. Oligonucleotide –priming methods for the chromosome –specificlabelling of alpha satellite DNA in situ.Chromosome, 1989, 98:259~265
5.EvaniViegas –Pequignot et al.Mapping of single – copy DNA sequences on humanchromsomes by in situ hybridisation with biotinylated probes:Enhancement of detectionsensitivity by intensifield - fluorescence digital –image mieroscopy. Proc NatlAcad Sci USA. 1989,86:582~586
6.MclarenA. Prenatal diagnosis before implantation:opportunities and problems. PrenatalDiagnosis, 1985;5:85~90
7.JulenJC, et al. Rapid prenatal diagnosis of Down’s syndrome with in situhybridisation of fluorescent DNA probe. Lancet , Ⅲ:863~864
8.MillarDS, ET AL. Normal blood cell values in the early and –trimester fetus:Prenatal Diagnosis, 1985, 5:367~373
9.BuggersJD, et al. The culture of mouse embryos in vitro. In :Methods in mammalian Embryology,(Eds:Daniel JC Jr)San Francisco:Free man , 1971:86~116
10.HutchisonN et al. In situ hybridisation at the electron microscope level:Hybrid detection byautoradiography and colloidal gold, The J Cell Biology, 1982, 95:609~618
11. BinderM, et al. In situ hybridisation of the eletron microscope level:Localization of transcripts onultrathin sections of Lowicryl K4M-embedded tissue using biotinylated probesand Protein A-Gold Complexes. J. Cell Biology, 1986, 102:1646~1653
12.RothJM, et al. Enhancement of structural preservation and immunocytochemicalstaining in low temperature embedded pancreatic tissue. j Histochem. Cytochem,1981,29:663~667
13.LawrenceLB and Singer RH.Quantitative analysis of in situ hybridisation methods for thedetection of actin gene expression ,Nucleic Acids Res, 1985, 13:1777~1799
14.WeketerH deF,et al. Use of a biotinylated probe and in situ hybridisation for lightand electron microscopic localization of PmRNAin myelin –formingSchwann cells, Histochemistry, 1987, 86:441~444
15.CarlsmalarmE and Villger W. Low temperature embedding. In:Tehcniques in immunocytochemistry (EdsBullock GR and Petruoz P),Acad Press, 1989,4:29~44
16.焦仁杰,等.应用电镜原位分子杂交技术对腺病毒DNA在宿主细胞内进行定位.电子显微学报,1992,2:81~84
第二十二章 聚合酶链反应(PCR)技术的发展和应用
第一节 概述
聚合酶链反应或多聚酶链反应(Polymerase Chain Reaction, PCR),又称无细胞克隆技术(“free bacteria”cloning technique),是一种对特定的DNA片段在体外进行快速扩增的新方法。该方法一改传统分子克隆技术的模式,不通过活细胞,操作简便,在数小时内可使几个拷贝的模板序列甚至一个DNA分子扩增107~108倍,大大提高了DNA的得率。因此,现已广泛应用到分子生物学研究的各个领域。
PCR技术最早由美国Cetus公司人类遗传研究室Kary Mullis及同事于1985年发现并研制成功的;最早的应用报道是Saiki等1985年将PCR技术应用于β-珠蛋白基因扩增和镰刀状红细胞贫血的产前诊断。随后使用了1976年Chien等分离的热稳定性Taq DNA聚合酶,使PCR操作大为简化,并使PCR自动化成为可能;1987年Kary Mullis等完成了自动化操作装置,使PCR技术进行实用阶段。
国内复旦大学1988年起开始研制耐热性多聚酶,军事医学科学院马立人教授等在1989年研制成功了PCR自动装置,并且不断推陈出新,最近研制的PTC-51A/B型DNA热循环仪体积小,造型美观,价格适宜,操作简单,尤为适宜国内应用。
PCR发明不到10年,却已获得广泛应用。目前,每年都有上千篇文章 发表。1991年,期刊“PCR方法与应用”(PCr Methods and Application)在美国创刊,使有关学者有了自己的论坛和参考的专业期刊。PCR技术作为一种方法学革命,必将大大推动分子生物学各有关学科的研究,使其达到一个新的高度。
1993年度诺贝尔化学将已于10月13日揭晓,Kary Mullis因发明了“聚合酶链式反应”而获得此殊荣。现在世界各地都在使用PCR检测病人血液中的微量遗传物质,这一成就为精确诊断艾滋病及其它病症铺平了道路。瑞典皇家科学院说:“PCR方法已经广泛应用于生物医学中。该方法同DNA测序法结合起来很可能将成为研究动植物分类学的一种革新工具。”一名加拿大籍英国科学家Michael Smith因开创了“寡核苷酸基因定点诱变”的方法而与Mullis同享此荣。
第二节 PCR技术的原理
PCR是体外酶促合成特异DNA片段的新方法,主要由高温变性、低温退火和适温延伸三个步骤反复的热循环构成:即在高温(95℃)下,待扩增的靶DNA双链受热变性成为两条单链DNA模板;而后在低温(37~55℃)情况下,两条人工合成的寡核苷酸引物与互补的单链DNA模板结合,形成部分双链;在Taq酶的最适温度(72℃)下,以引物3’端为合成的起点,以单核苷酸为原料,沿模板以5’→3’方向延伸,合成DNA新链。这样,每一双链的DNA模板,经过一次解链、退火、延伸三个步骤的热循环后就成了两条双链DNA分子。如此反复进行,每一次循环所产生的DNA均能成为下一次循环的模板,每一次循环都使两条人工合成的引物间的DNA特异区拷贝数扩增一倍,PCR产物得以2n的批数形式迅速扩增,经过25~30个循环后,理论上可使基因扩增109倍以上,实际上一般可达106~107倍。

图22-1 PCR基本原理示意图
假设扩增效率为“X”,循环数为“n”,则二者与扩增倍数“y”的关系式可表示为:y=(1+X)n。扩增30个循环即n=30时,若X=100%,则y=230=1073741824(>109);而若X=80%时,则y=1.830=45517159.6(>107)。由此可见,其扩增的倍数是巨大的,将扩增产物进行电泳,经溴化乙锭染色,在紫外灶照射下(254nm)一般都可见到DNA的特异扩增区带。
第三节 PCR操作范例及反应体系的组成
一、PCR操作范例
在一个典型的PCR反应体系中需加入:适宜的缓冲液、微量的模板DNA、4×dNTPs、耐热性多聚酶、Mg2+和两个合成的DNA引物。模板DNa 94℃变性1min,引物与模板40~60℃退火1min,72℃延伸2min。在首次循环前模板预变性3~5min;在末次循环后,样品仍需继续延伸3~5min以上,确保扩增的DNA为双链DNA。为便于了解PCR反应中各成份的组成,加入量和反应条件,使人们以此为基础,对不同的研究对象逐项改变来找到最佳反应条件,特列举Perkin Elmer Cetus公司Gene Amp DNA试剂盒提供的典型反应条件供参考。
表22-1 PCR反应混合液
| 成分 | 加入体积(μl) | 最终浓度 |
| 双蒸馏水 | 53.5 | |
| 10×反应缓冲液[1] | 10.0 | [1×]Mg2+1.5mmol/l K+50mmol/L |
| 4×dNTPs(各1.25mmol/L) | 16.0 | 各200μmol/L |
| λ-DNA模板(全长48.5kD) | 10.0 | 1ng/次 |
| 引物1,2(各25bp,20μmol/L)[3,4] | 5.0 | 1.0μmol/L(100pmol) |
| Taq聚合酶储存液[2] | 0.5 | 2U/100μl |
| 总体积(pH8.3) | 100.0 | |
| 石蜡油 | 50~100.0 |
扩增条件:94℃60s,37℃60s,72℃120s,共25~30个循环。
注:[1]反应缓冲液[10×]含:100mmol/l Tris-HCl pH8.3(25℃),
15mmol/L KCl, 15mmol/L MgCl2,
0.01%(W/V)明胶(Sigma G2500)
[2]酶储存缓冲液(-20℃)含:50%甘油,100mmol/l KCl,
20mmol/L Tris-HCl ph8.0
0.1mmol/L EDTA, 1.0mmol/L DTT
200μg/ml明胶
0.5%吐温20,0.5% Nonidet P40
[3][4]引物,1,2:扩增λ-噬菌体基因中500bp的片段
引物1序列:7131~7155(5’)-GATGAGTTCGTGTCCGTACAACTGG-(3’)
引物2序列:7606~7630(5’)-GGTTATCGAAATCAGCCACAGCGCC-(3’)
注意(3’)端有2个bp互补故易生成50bp的双体
二、PCR反应系统的组成
(一)PCR缓冲液(PCrBuffer)
用于PCR的标准缓冲液见PCR操作范例。于72℃时,反应体系的pH值将下降1个单位,接近于7.2。二价阳离子的存在至关重要,影响PCR的特异性和产量。实验表明,Mg2+优于Mn2+,而Ca2+无任何作用。
1.Mg2+浓度Mg2+的最佳浓度为1.5mmol/L(当各种dNTP浓度为200mmol/L时),但并非对任何一种模板与引物的结合都是最佳的。首次使用靶序列和引物结合时,都要把Mg2+浓度调到最佳,其浓度变化范围为1~10mmol/L。Mg2+过量易生成非特异性扩增产物,Mg2+不足易使产量降低。
样品中存在的较高浓度的螯合剂如EDTA或高浓度带负电荷的离子基团如磷酸根,会与Mg2+结合而降低Mg2+有效浓度。因此,用作模板的DNA应溶于10mmol/l Tris-HCl(pH7.6)0.1mmol/L EDTA中。
dNTP含有磷酸根,其浓度变化将影响Mg2+的有效浓度。标准反应体系中4×dTNPs的总浓度为0.8mmol/L,低于1.5mmol/L的Mg2+浓度。因此,在高浓度DNA及dNTP条件时,必须相应调整Mg2+的浓度。
2.Tris -HCl缓冲液在PCR中使用10~50mmol/L的Tris –HCl缓冲液,很少使用其他类型的缓冲液。Tris缓冲液是一种双极化的离子缓冲液,pKa为8.3(20℃),△pKa为0.021/℃。因此,20mmol/l Tris pH8.3(20℃)时,在典型的热循环条件下,真正的pH值在7.8~6.8之间。
3.KCl浓度K+浓度在50mmol/L 时能促进引物退火。但现在的研究表明,NaCl浓度在50mmol/L时,KCl浓度高于50mmol/L将会抑制Taq酶的活性,少加或不加KCl对PCR结果没有太大影响。
4.明胶明胶和BSA或非离子型去垢剂具有稳定酶的作用。一般用量为100μg/ml,但现在的研究表明,加或不加都能得到良好和PCR结果,影响不大。
5.二甲基亚砜(DMSO)在使用Klenow片段进行PCR时DMSO是有用的;加入10%DM-SO有利于减少DNA的二级结构,使(G+C)%含量高的模板易于完全变性,在反应体系中加入DMSO使PCR产物直接测序更易进行,但超过10%时会抑制Taq DNA聚合酶的活性,因此,大多数并不使用DMSO。
(二)四种脱氧三磷酸核苷酸(4×dNTPs)
在PCR反体系中dNTP终浓度高于50mmol/L会抑制Taq酶的活性,使用低浓度dNTP可以减少在非靶位置启动和延伸时核苷酸错误掺入,高浓度dNTPs易产生错误掺入,而浓度太低,势必降低反应物的产量。PCR常用的浓度为50~200μmol/L,不能低于10~15μmol/L。四种dNTP的浓度应相同,其中任何一种浓度偏高或偏低,都会诱导聚合酶的错误掺入,降低合成速度,过早终止反应。
决定最低dNTP浓度的因素是靶序列DNA的长度和组成,例如,在100μl反应体系中,4×dNTPs浓度若用20μmol/L,基本满足合成2.6μg DNA或10pmol的400bp序列。50μmol/L的4×dNTPs可以合成6.6μgDNA,而200μmol/L足以合成25μg/DNA。
购自厂商的dNTP溶液一般均未调pH,应用1mol/l NaOH将dNTP贮存液pH调至7.0,以保证反应的pH值不低于7.1。市购的游离核苷酸冻干粉,溶解后要用NaOH中和,再用紫外分光光度计定量。
(三)引物的量
引物在PCR反应中的浓度一般在0.1~1μmol/L之间。浓度过高易形成引物二聚体且产生非特异性产物。一般来说用低浓度引物经济、特异,但浓度过低,不足以完成30个循环的扩增反应,则会降低PCR的产率。
(四)TaqDNA聚合酶的量
典型PCR反应混合物中,所用酶浓度为2.5U/μl,常用范围为1~4U/100μl。由于DNA模板的不同和引物不同,以及其它条件的差异,多聚酶的用量亦有差异,酶量过多会导致非特异产物的增加。
由于生产厂家所用兵配方、制造条件以及活性定义不同,不同厂商供应的TaqDNA聚合酶性能也有所不同。
Cetus公司酶定义是:1个酶单位是指在以下分析条件下,于74℃,30min内使10nmmol的dNTP掺入酸不溶性成分所需的酶。测定时间为10min,折算成30min掺入量。
分析条件为25nmol/L TAPS(三羟基-甲基-氨基丙烷磺酸钠pH9.3,25℃),50mmol/l KCl, 2mmol/L MgCl2,1mmol/L β-ME(巯基乙醇),dATP、dTTP、dGTP各200mmol/L,dCTP为100mmol/L(由不标记及α-32P标记混合),12.μg变性鲱鱼精子DNA,最终体积50μl。
(五)模板
单、双链DNA或RNA都可以作为PCR的样品。若起始材料是RNA,须先通过逆转录得到第一条cDNA。虽然PCR可以仅用极微量的样品,甚至是来自单一细胞的DNA,但为了保证反应的特异性,还应用ng级的克隆DNA,μg水平的单拷贝染色体DNA或104拷贝的待扩增片段作为起始材料,模板可以是粗品,但不能混有任何蛋白酶、核酸酶、Taq DNA聚合酶抑制剂以及能结合DNA的蛋白。
DNA的大小并不是关键的因素,但当使用极高分子量的DNA(如基因组的DNA时),如用超声处理或用切点罕见的限制酶(如Sal1和Not1)先行消化,则扩增效果更好。闭环靶序列DNA的扩增效率略低于线状DNA,因此,用质粒作反应模板时最好先将其线状化。
模板靶序列的浓度因情况而异,往往非实验人员所控制,实验可按已知靶序列量逆减的方式(1ng,0.1ng,0.001ng等),设置一组对照反应,以检测扩增反应的灵敏度是否符合要求。
(六)石蜡油
PCR扩增时建议在混合物上面铺一层石蜡油,减少PCR过程中尤其是变性时液体蒸发所造成的产物的丢失。研究表明,应用石蜡油可使扩增产量增加5倍,可能与石蜡油维持热恒定和整个反应体系中盐浓度有关。
三、电泳分析
在实际工作中常采用琼脂糖凝胶电泳。一般情况下先在电泳缓冲液或凝胶中加1%溴化乙锭(EB)(每100ml加100μl),然后将已经制备好的1%~2%琼脂糖凝胶(用电泳缓冲液配制)放入电泳槽内,加入待测样品10μl,同时用分子量标准品作标记。琼脂糖浓度应按分离DNA片段的大小进行选择,一般用1.5%~2%,电泳电压75V,待样品进行凝胶内距胶末端1cm时,切断电源,取出凝胶在紫外灯下直接观察结果。
由于溴化乙锭可与双链DNA形成结合物,在紫外灯下能发射荧光,使EB的荧光强度增强80~100倍,所以,电泳后凝胶在紫外灯下可直接观察。一般肉眼观察DNA量可达10ng,其荧光强度与DNA含量成正比。
DNA分子在凝胶中泳动速度决定于电荷效应及分子效应。前者由所带净电荷量决定,而后者与分子大小及构型有关。按照DNA分子大小,其凝胶浓度可做不同的调整。有条件的实验室也可用聚丙烯酰胺凝胶电泳(PAGE)分析扩增的DNA片段。
表22-2 电泳检测扩增结果,EB荧光显色(254nm)
| 琼脂糖(%) | kb | PAGR(%) | bp |
| 0.3 | 60~5 | 3.5 | 100~1000 |
| 0.6 | 20~1 | ||
| 0.7 | 10~0.8 | 5.0 | 80~500 |
| 0.9 | 7~0.5 | 8.0 | 60~400 |
| 1.2 | 6~0.4 | 12.0 | 40~200 |
| 1.5 | 4~0.2 | 20.0 |
第四节 影响PCR的主要因素
PCR技术必须有人工合成的合理引物和提取的样品DNA,然后才进行自动热循环,最后进行产物鉴定与分析。引物设计与合成目前只能在少数技术力量较强的研究院、所进行,临床应用只需购买PCR检测试剂盒就可开展工作,PCR自动热循环中影响因素很多,对不同的DNA样品,PCR反应中各种成份加入量和温度循环参数均不一致。现将几种主要影响因素介绍如下。
一、温度循环参数
在PCR自动热循环中,最关键的因素是变性与退火的温度。如操作范例所示,其变性、退火、延伸的条件是:94℃60s, 37℃60s, 72℃120s,共25~30个循环,扩增片段500bp。在这里,每一步的时间应从反应混合液达到所要求的温度后开始计算。在自动热循环仪内由混合液原温度变至所要求温度的时间需要30~60s,这一迟滞时间的长短取决于几个因素,包括反应管类型、壁厚、反应混合液体积、热源(水浴或加热块)以及两步骤间的温度差,在设置热循环时应充分给以重视和考虑,对每一仪器均应进行实测。
关于热循环时间的另一个重要考虑是两条引物之间的距离;距离越远,合成靶序列全长所需的时间也越长,前文给出的反应时间是按最适于合成长度500bp的靶序列拟定的。下面就各种温度的选择作一介绍。
1.模板变性温度变性温度是决定PCR反应中双链DNA解链的温度,达不到变性温度就不会产生单链DNA模板,PCR也就不会启动。变性温度低则变性不完全,DNA双链会很快复性,因而减少产量。一般取90~95℃。样品一旦到达此温度宜迅速冷却到退火温度。DNA变性只需要几秒种,时间过久没有必要;反之,在高温时间应尽量缩短,以保持Taq DNA聚合酶的活力,加入Taq DNA聚合酶后最高变性温度不宜超过95℃。
2.引物退火温度退火温度决定PCR特异性与产量;温度高特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低产量高,但过低可造成引物与模板错配,非特异性产物增加。一般先由37℃反应条件开始,设置一系列对照反应,以确定某一特定反应的最适退火温度。也可根据引物的(G+C)%含量进行推测,把握试验的起始点,一般试验中退火温度Ta(annealing temperature)比扩增引物的融解温度TTm(meltingtemperature)低5℃,可按公式进行计算:
Ta = Tm -5℃= 4(G+C)+ 2(A+T)-5℃
其中A,T,G,C分别表示相应碱基的个数。例如,20个碱基的引物,如果(G+C)%含量为50%时,则Ta的起点可设在55℃。在典型的引物浓度时(如0.2μmol/L),退火反应数秒即可完成,长时间退火没有必要。
3.引物延伸温度温度的选择取决于Taq DNA聚合酶的最适温度。一般取70~75℃,在72℃时酶催化核苷酸的标准速率可达35~100个核苷酸/秒。每分钟可延伸1kb的长度,其速度取决于缓冲溶液的组成、pH值、盐浓度与DNA模板的性质。扩增片段如短于150bp,则可省略延伸这一步,而成为双温循环,因Taq DNA聚合酶在退火温度下足以完成短序列的合成。对于100~300bp之间的短序列片段,采用快速、简便的双温循环是行之有效的。此时,引物延伸温度与退火温度相同。对于1kb以上的DNA片段,可根据片段长度将延伸时间控制在1~7min,与此同时,在PCR缓冲液中需加入明胶或BSA试剂,使Taq DNA聚合酶在长时间内保持良好的活性与稳定性;15%~20%的甘油有助于扩增2.5kb左右或较长DNA片段。
4.循环次数常规PCR一般为25~40个周期。一般的错误是循环次数过多,非特异性背景严重,复杂度增加。当然循环反应的次数太少,则产率偏低。所以,在保证产物得率前提下,应尽量减少循环次数。
扩增结束后,样品冷却并置4℃保存。
二、引物引物设计
要扩增模板DNA,首先要设计两条寡核苷酸引物,所谓引物,实际上就是两段与待扩增靶DNA序列互补的寡核苷酸片段,两引物间距离决定扩增片段的长度,两引物的5’端决定扩增产物的两个5’末端位置。由此可见,引物是决定PCR扩增片段长度、位置和结果的关键,引物设计也就更为重要。
引物设计的必要条件是与引物互补的靶DNA序列必须是已知的,两引物之间的序列未必清楚,这两段已知序列一般为15~20个碱基,可以用DNA合成仪合成与其对应互补的二条引物,除此之外,引物设计一般遵循的原则包括:
1.引物长度根据统计学计算,长约17个碱基的寡核苷酸序列在人的基因组中可能出现的机率的为1次。因此,引物长度一般最低不少于16个核苷酸,而最高不超过30个核苷酸,最佳长度为20~24个核苷酸。这样短的寡核苷酸在聚合反应温度(通过72℃)下不会形成稳定的杂合体。有时可在5’端添加不与模板互补的序列,如限制性酶切位点或启动因子等,以完成基因克隆和其他特殊需要;引物5’端生物素标记或荧光标记可用于微生物检测等各种目的。
有时引物不起作用,理由不明,可移动位置来解决。
2.(G+C)%含量引物的组成应均匀,尽量避免含有相同的碱基多聚体。两个引物中(G+C)%含量应尽量相似,在已知扩增片段(G+C)%含量时宜接近于待扩增片段,一般以40%~60%为佳。
3.引物内部应避免内部形成明显的次级结构,尤其是发夹结构(hairpinstructures)。例如:

4.引物之间两个引物之间不应发生互补,特别是在引物3’端,即使无法避免,其3’端互补碱基也不应大于2个碱基,否则易生成“引物二聚体”或“引物二倍体”(Primer dimer)。所谓引物二聚体实质上是在DNA聚合酶作用下,一条引物在另一条引物序列上进行延伸所形成的与二条引物长度相近的双链DNA片段,是PCR常见的副产品,有时甚至成为主要产物。
另外,两条引物之间避免有同源序列,尤为连续6个以上相同碱基的寡核苷酸片段,否则两条引物会相互竞争模板的同一位点;同样,引物与待扩增靶DNA或样品DNA的其它序列也不能存在6个以上碱基的同源序列。否则,引物就会与其它位点结合,使特异扩增减少,非特异扩增增加。
5.引物3’端配对DNA聚合酶是在引物3’端添加单核苷酸,所以,引物3’端5~6个碱基与靶DNA的配对要求必须精确和严格,这样才能保证PCR有效扩增。
引物设计是否合理可用PCRDESN软件和美国PRIMER软件进行计算机检索来核定。
人工合成的寡核苷酸引于最好经过色谱(层析)纯化或PAGE纯化,以除去未能合成至全长的短链等杂质。纯化引物在25%乙腈溶液中4℃保存可阻止微生物的生长;一般情况下,不用的引物应保存在-20℃冰箱中,在液体中引物能保存6个月,冻干后可保存1~2年。
三、DNA聚合酶
早在1956年Kornberg等就从大肠杆菌提取液中发现了DNA聚合酶,并且得到了DNA聚合酶Ⅰ纯品。DNA聚合酶Ⅰ是由分子量为109000的一条多肽链构成,此酶可被枯草杆菌蛋白酶分解为两个片段,一个片段分子量为76000,有聚合酶活性,并有3’→5外切酶活力,即Klenow片段(Klenow fragment)。另一个片段分子量为34000,具有5’→’3’外切酶活力。因此,DNA聚合酶具有几种功能:一是聚合作用,以DNA为模板,将dNTP中的脱氧单核苷酸逐个加到3-OH末端。二是有’3’→5’外切酶活力,能识别和消除错配的引物末端,与复制过程中校正功能有关。三是5’→3’外切酶活力,它能从5’端水解核苷酸,还能经过几个核苷酸起作用,切除错配的核苷酸。1985年Mullis 等发明了PCR方法,以Klenow片段完成β-珠蛋白的PCR后,世界上许多实验室就考虑用耐热DNA聚合酶代替Klenow片段进行PCR,使耐热多聚酶的研究得以迅速发展。人们从生活于60℃(B.Stearothermophilus)到87℃(S.Solfatavicus)的许多菌中分离纯化出耐热DNA聚合酶,但有些酶不能耐受DNA变性所需温度,所以无法应用于PCR。现就PCR反应中常用的DNA聚合酶等作一详细介绍。
1.Taq DNA聚合酶用Taq DNA聚合酶代替大肠杆菌DNA聚合酶Ⅰ的Klenow片段是使PCR普及应用的关键。Klenow片段不能耐受95℃的双链DNA变性温度,所以每次循环都要加入新酶;而Taq DNA聚合酶可以耐受93~95℃的高温,避免了不断补加多聚酶的繁琐操作,同时使退火和延伸温度得以提高,减少了非特异性产物和DNA二级结构对PCR的干扰,增进了PCR特异性、产量和敏感度,二者相比,其主要区别在于:①Klenow酶的最适温度为37℃,扩增的产物并非全是目的序列,需用探针检测。Taq酶则不仅产率高而特异性也高。它的最适温度为74~75℃。因而使退火温度可以提高,使退火严格性提高,减少错配引物的延伸。②循环后期酶量渐感不足而产生平坡。到达平玻的循环次数,Klenow酶为20个(均用1μg基因组DNA开始)而Taq酶为30个。③延伸片段长度Taq酶为10kb以内,而Klenow酶为400bp以内。
Taq酶由水栖高温菌(Thermusaquatics)YT1蓖株中分离而得。此菌于1969年由Brock分离自美国黄石公园温泉,作为栖热杆菌的标准菌株,其生长温度为70~75℃。最初从中分离到分子量60~68KDa,比活性为2000~8000U/mg的DNA聚合酶。后来Cetus公司的Kary Mullis等又分离到比活为20万U/mg的纯酶,分子量为93910。此种9.4KDa酶的最适温度为75~80℃,与单纯核苷酸的结合率(Kcat)可达150核苷酸(nt)/s酶分子。以M13模板,用富含G+C的30bp引物延伸,70℃时Kact>60nt/s;55℃可达24nt/s;37℃时为1.5nt/s,而22℃时低至0.25nt/s。高于90℃时DNA合成活性甚差,这种高温条件下,引物与模板已不能牢固结合。
在PCR反应混合液中,Taq酶于92.5℃,95℃及97.5℃保持其50%活力的时间分别为130、40及5~6min,在50次循环的PCR中当管内最高温度为95℃。每循环为20s时尚可保持65%活力。Taq 酶在95℃的半寿期为40min,故在PCR循环中选用的变性温度,不宜高于95℃。
Taq酶现已可用基因重组的方法生产,商品名为Ampli Taq(Cetus公司)。Taq酶的完整基因长2499bp,在大肠杆菌中表达生产,含832个氨基酸。在氨基酸序列上与大肠杆菌DNA聚合酶Ⅰ有38%是一致的,包括对dNTP结合,引物与模板作用区均存在于Taq酶中。
Taq酶具有依赖DNA合成的5’→’3’外切酶活性,因此,模板上有一段退火的3’-磷酸化的“阻断物”,会被逐个切除而不会阻止来自上游引物链的延伸,而对于5’-32P标记的合成寡核苷酸引物,则无论是单链或是与模板复性,都未发现降解,所以该种活性不会影响PCR结果。Taq酶没有3’→’5’外切酶活性,如果发生dNTP错误掺入,这种酶没有校正能力,因此运用Taq酶进行PCR,产物中点突变较多,对克隆等不太有利。一般错掺率为1.25×10-4~1×10-5(4×dNTPs浓度分别为200μmol/L,Mg2+为1.5mmol/L,在55℃退火)。但不含3’→5’外切酶活性对测序有利。
2.影响酶活力的因素Taq酶的活力受Mg2+离子的影响。用鲱精DNA为模板,总dNTP浓度0.7~0.8mmol/L,Mg2+为2.0mmol/L时激活能力最高。浓度超过此值产生抑制。10mmol/l MgCl2抑制活力达40%~50%。dNTP能与Mg2+结合,故游离Mg2+只是结合后剩余的量。若总dNTP浓度高至4~6mmol/L时,Taq酶活力要降低20~30%,即底物抑制。
dNTP浓度低时PCR产率及特异性均增高,适合于用扩增掺入法标记生物素及放射性元素。当100μl PCR液中含dNTP各40μmol/L时就足以合成2.6μg的DNA(dNTP消耗一半)。
表22-3 有机溶剂对Taq聚合酶活力的影响
| 物质 | 浓度 | 活力(%) |
| 乙醇 | <3% | 100 |
| 10% | 110 | |
| 尿素 | <0.5mol/L | 100 |
| 1.0mol/L | 118 | |
| 1.5mol/L | 107 | |
| DMSO | <1% | 100 |
| 10% | 53 | |
| 20% | 11 | |
| 二甲基甲酰胺 | <5% | 100 |
| 10% | 82 | |
| 20% | 17 | |
| 甲酰胺 | <10% | 100 |
| 15% | 86 | |
| 20% | 39 | |
| SDS | 0.001% | 105 |
| 0.01% | 10 | |
| 0.1% | <0.1% |
用鲱精DNA,70℃,10min内dNTP的掺入量计算,标准条件为100%。
纯9.4KDa Taq酶不含3’→5’核酸外切酶活力。误掺入率取决于dNTP浓度。但Taq酶具有DNA依赖的链移位5’→3’核酸外切酶活力。对5’→3’32P标记寡核苷酸单链,或与MB模板杂交时均只有极少的降解力。
中等浓度KCl能刺激Taq酶合成活力达50%~60%,最佳KCl浓度为50mmol/L,浓度更高有抑制作用,>200mmol/L的KCl可使酶失活。
加入50mmol/L NH4Cl或NH4Ac或NaCl,可产生中度抑制或无作用。
低浓度尿素、DMSO、DMF或甲酰胺影响不大,吐温20/NP40可消除SDS(0.01%及0.1%)的抑制作用。
3.第二代耐热DNA聚合酶Stoffel片段:Cetus公司的Stoffel将TaqDNA聚合酶的5’→3’外切酶活性片段(N端289个氨基酸)去除,称为stoffel片段。其97.5℃的半衰期从Taq DNA聚合酶的5~6min提高到20min,同时该酶片段也对两个或更多模板位点的扩增反应即复合PCR(Multiplex PCR)更为有利。
Vent™DNA多聚酶:是美国New England Biolabs公司从潜水艇排气孔(Vent)中分离的超级嗜热菌-能生长于98℃中的Thermococcus litoralis中分离纯化得到的,故名Vent酶。它的一些酶学性质较Taq DNA聚合酶更为优越,它能耐100℃高温且2h以上仍有活力,并且具有3’→5’外切酶活性的校正能力,错误扩增的机率比Taq酶降低一倍。后来该公司又从深水潜艇(2010m)排气孔分离的能在104℃生长的Pyococcus菌GB-D株植入Deep Vent DNA聚合酶基因而表达的Deep Vent DNA聚合酶,在95℃的半寿期达23h(Vent酶为6.7h,Taq酶为1h)。
4.RTth逆转录酶(rTth Reverse Transcriptase)目前逆转录-PCR(RT-PCR)的发展很快,所以对耐热的依赖于RNA的DNA多聚酶的研究也有进展。有实验表明Taq DNA多聚酶有依赖于RNA的DNA聚合酶活性,但活性较弱。Cetus公司于1991年推出一种rTth Reverse Tran-scriptase,有很好的依赖于RNA的耐热DNA聚合酶活性和依赖于DNA的耐热DNA聚合酶活性,二种活性分别依赖于Mn2+Mg2+,这样就可分别控制酶活性。利用该酶只需250ng的总RNA即可有效地进行RT-PCR,得到特异的DNA片段,从而非常有利于逆转录PCR的发展。
耐热DNA聚合酶的研究近几年来得到长足的发展,这在PCR发展中起到了重要的作用。我们相信随着进一步的研究,将使人们对耐热DNA聚合酶的认识和应用更进一步地发展。
我国的PCR研究发展很快,其关键试剂-耐热DNA聚合酶-也已有几个实验室能够分离纯化,如复旦大学遗传学研究所、华美公司、中国医学科学院基础医学研究所。后二者的菌株为Thermus aquaticus YT-1。前者则是从自己筛选的嗜热菌中分离纯化,复旦大学遗传所亦已成功地克隆了该聚合酶的基因并获得了耐热F4DNA聚合酶,其酶学性质非常接近于Taq DNA聚合酶,为我国PCR的开展提供了保证。
四、影响PCR特异性的因素
通过上述内容。可以看出有许多因素可以影响PCR的特异性,在此我们作一归纳,供大家参考:①退火步骤的严格性:提高退火温度可以减少不匹配的杂交,从而提高特异性。②减短退火时间及延伸时间可以减少错误引发及错误延伸。③引物二聚体是最常见的副产品,降低引物及酶的浓度也可以减少错误引发,尤其是引物的二聚化。④改变MgCl2(有时KCl)浓度可以改进特异性,这可能是提高反应严格性或者对Taq酶的直接作用。⑤模板中如果存在次级结构,例如待扩增的片段易自行形成发夹结构时,可在PCR混合物中的4×dNTPs中加入7-脱氮-2’-脱氧鸟苷-5’-三磷酸(7-deaza-2’-deoxyguanosine-5’-trihosphate)(de7GTP)。用de7GTP与dGTP比例为3:1的混合物(150μmol/l de7GTP +50μmol/L dGTP)代替200μmol/l dGTP,则可阻非特异性产物的生成。
五、扩增平坡
扩增反应并不是可以无穷地进行下去的,经过一定的循环周期后需扩增的片段不再按指数增多而逐渐进入平坡;进入平坡的循环次数,取决于起始时存在的模板拷贝数以及合成的DNA总量。所谓平坡就是批PCR循环的后期,合成产物达0.3~1pmol时,由于产物的堆积,使原来以指数增加的速率变成平坦的曲线。
造成PCR进入平坡的原因有:引物和dNTP等消耗完毕、Taq酶失活,这几中因素在标准反应中均不会出现。此外,还有几种可能:
1.底物过剩因DNA合成量多于反应液中存在的Taq酶,在100μl反应液中含2.5Utaq酶而DNA合成量达1μg(3nmol脱氧核苷酸)时,开始变为底物过剩。延长延伸时间或添加Taq酶,可以克服之。但不实用,因每进行下一循环就要延长延伸时间一倍及多加一倍Taq酶,才能继续保持指数增长。
2.非特异性扩增产物的竞争与上述情况密切相关,此时不需要的DNA片段与需要的片段同时竞争聚合酶,要克服这一情况是要提高反应特异性,使不需要片段不能大量积聚。
3.退火时产物的单链自己缔合两条单链的DNA片段在退火时除了与引物缔合外,也可以自行缔合,这也会阻止产品增多。当产物浓度到达10pmol/100μl时即可发生此现象,除稀释外无法克服。
4.变性在高浓度产物条件下,产物解链不完全,以及最终产物的阻化作用(焦磷酸化,双链DNA)。
总而言之,PCR的条件是随系统的而异的,并无统一的最佳条件,先选用通用的条件扩增,然后稍稍改变各参数,可以达到优化,以取得优良的特异性和产率。
第五节 PCR各处应用模式
一、兼并引物(DegeneratePrimer)PCR
密码子具有兼并性,如表22-4,单以氨基酸顺序推测编码的DNA序列是不精确的,但可以设计成对兼并引物,扩增所有编码已知顺序的核酸序列。用兼并引物时寡核苷酸中核苷酸序列可以改变,但核苷酸的数量应相同。兼并度越低,产物特异性越强,设计引物时应尽量选择兼并性小的氨基酸,并避免引物3’末端兼并,针对兼并的混合引物已成功地用于未知靶DNA的扩增、克隆和序列分析。现已成功地克隆了猪尿酸氧化酶基因、糖尿病相关肽基因和哺乳动物与禽类的嗜肝病毒基因。用脱氧肌苷(deoxyinosine;DI)引物进行PCR,可以代替编码蛋白的多种兼并密码子中的兼并碱基,DI的特异性主要受cDNA浓度影响。
表22-4 密码兼并性
| 氨基酸 | 密码子数 |
| M、W | 1 |
| C、D、E、F、H、K、N、Q、Y | 2 |
| I | 3 |
| A、G、P、T、V | 4 |
| L、R、S | 6 |
注:选择使用的肽链最好避开有4~6个密码子的氨基酸
二、套式引物(NestedPrimer)PCR
用第一套引物扩增15~30个循环,再用扩增DNA片段内设定的第二套引物扩增15~30个循环,这样可使待扩增序列得到高效扩增,而次级结构却很少扩增。用起始引物限量方法或Centricon30(Amicon)分子滤过器离心,在第二套引物加入前去除第一引物。此方法已成功地用来分析中国仓鼠卵巢细胞AS52的分子突变。AS52细胞含有单拷贝的细胞gpt(guanine phos-phribosytransferase)基因,与哺乳动物具有同源性。套式引物PCR减少了引物非特异性退火,从而增加了特异性扩增,提高了扩增效率。对环境样品中微生物检测和单拷贝的基因靶DNA的扩增是非常有效的。
若将套式PCR的内外引物稍加改变,延长外引物长度(至25~30bp),同进缩短内引物长度(15~17bp),使外引物先在高温退火温度下做双温循环扩增,然后改换至三温循环,使内引物在外引物扩增的基础上作低温火温度的三温循环直到扩增完成,这样就可以使两套引物一次同时加入,两种循环一气呵成,等于只做一次PCR,而灵敏度与套式二次PCR无异,在我们最近推出的PTc 51气流式DNA热循环仪上就可以完成全部程序。
套式一次PCR的成功,使PCR检测的全过程可以在5h内完成,使当天出检验报告成为现实,也使PCR检测走入临床有了现实的基础。
三、复合PCR(Multiplex PCR)
用多对引物同时扩增几条DNA片段的方法称为复合PCR。这一方法最初是由Chanberlain 等检测人的基因发展而来。Bej等随之发展了对环境样品中不同属细菌相关基因序列同时PCR扩增的检测方法。两种不同的军团菌(legionella)基因,一为特异嗜肺L基因(mip),另一种为L-5SrRNA基因,通过引物摇摆(staggered)添加进行复合PCR。首先mip引物PCR扩增7个循环,然后加入5SrRNA引物PCR扩增38个循环。加入不同量的LacZ和LacB基因引物进行PCR扩增可以检测大肠杆菌和与人类粪便污染有关的细菌包括E.coli大肠菌、肠源致病沙门氏菌和志贺氏菌。
在复合PCR中,所有引物Ta值应相近。如果两对引物Tq值差异超过±℃10%,会使扩增产物的量明显不同,其中一种扩增产物或目的DNA很难观察到。另外,靶DNA的长度也应相近,差别大时短片的靶DNA会优先扩增,因此,会产生不同产量的扩增产物,为此,须采用DNA摇摆扩增或加入不等量的引物方法进行解决。
四、反向PCR(Inverse PCR或Reverse PCR)
反向PCR的目的在于扩增一段已知序列旁侧的DNA,也就是说这一反应体系不是在一对引物之间而是在引物外侧合成DNA(见图22-2)。反向PCR可用于研究与已知DNA区段相连接的未知染色体序列,因此又可称为染色体缓移或染色体步移。这时选择的引物虽然与核心DNA区两末端序列互补,但两引物3’端是相互反向的。扩增前先用限制性内切酶酶切样品DNA,然后用DNA连接酶连接成一个环状DNA分子,通过反向PCR扩增引物的上游片段和下游片段;现已制备了酵母人工染色体(YAC)大的线状DNA片段的杂交探针,这对于转座子插入序列的确定和基因库染色体上DNA片段序列的识别十分重要。
该方法的不足是:①需要从许多酶中选择限制酶,或者说必须选择一种合适的酶进行酶切才能得到合理大小的DNA片段。这种选择不能在非酶切位点切断靶DNA。②大多数有核基因组含有大量中度和高度重复序列,而在YAC或Cosmid中的未知功能序列中有时也会有这些序列,这样,通过反向PCR得到的探针就有可能与多个基因序列杂交。
利用反向PCR可对未知序列扩增后进行分析,探索邻接已知DNA片段的序列,并可将仅知部分序列的全长cDNA进行分子克隆,建立全长的DNA探针。适用于基因游走、转位因子和已知序列DNA旁侧病毒整合位点分析等研究。

图22-2 反向PCR原理示意图
波浪线代表靶DNA,方块代表测翼序列,▲和△代表限制酶切位
点,寡核苷酸引物与模板互补处标有平箭头
五、不对称PCR(Asymmetric PCR)
不对称PCR的基本原理是采用不等量的一对引物产生大量的单链DNA(ss-DNA)。这两种引物分别称为限制性引物与非限制性引物;其最佳比例一般为1:50~1:100,关键是限制引物的绝对量。限制性引物太多太少,均不利于制备ss-DNA。也可用普通PCR制备靶DNA双链DNA(ds-DNA),再以ds-DNA为模板,只用其中一种过量引物进行单引物PCR制备ss-DNA。
产生的ds-DNA与ss-DNA由于分子量不同可以在电泳中分开,而得到纯ss-DNA。
不对称PCR主要为测序制备ss-DNA,尤为用cD-NA经不对称PCR进行DNA序列分析是研究真核DNA外显子的好方法。
六、标记PCR(LP-PCR)和彩色PCR
LP-PCR(Labelled Primers PCR)是利用同位素、荧光素等对PCR引物5’端进行标记,据此检测目的基因的存在与否,与常规PCR相比更为直观,省去了限制性内切酶酶切及分子杂交等繁琐步骤,而且一次可以同时分析多种基因成分,因而特别适合于大量临床标本的基因诊断。目前该方法只对PCR产物进行定性鉴定。
彩色PCR(Colorcomplement assay)直译为“着色互补性检测”,是LP-PCR的一种,彩色PCR意译更为明确:它用荧光染料标记引物的5’端。荧光染料JOE和FAM呈绿色荧光;TAMRA呈红色荧光;COUM呈蓝色荧光。不同荧光标记的引物同时参加反应,扩增后的目的基因会分别带有引物5’端的染料,通过电泳或离心沉淀,肉眼就可以根据不同荧光的色泽判断目标基因是否存在及扩增基因的类型。通常仅需2种不同颜色的引物,一种作为基因检测引物;另一种作为控制条件的内对照,即可诊断基因缺失、染色体易位或感染某种病毒。检测多种点突变时,可用更多的色彩,如多点突变的遗传病、几种可疑病毒感染、HLA位点分析都可以用彩色PCR同时检测多个位点。
七、加端PCR
加端PCR(add-PCR)是使扩增产物的5’-末端加一段DNA顺序的PCR。设计加端PCR的引物时,除与模板配对的那一部分外再加上若干碱基,这样使扩增产物的末端加上额外一段DNA,如加上一个限制酶的识别顺序或特定功能的DNA片段。Stoflet等报道在结构基因前加上噬菌体T7的启动子,当然也可用于DNA片段的末端标记或引入特定的点突变。末端可加碱基的数量与引物的长短有关,当引物足够长时扩增产物或末端甚至可以加上十几个到几十个碱基。
八、锚定PCR或固定PCR
锚定PCR(AnchoredPCR, A-PCR)主要用于分析具有可变末端的DNA序列,Loh等用A-PCR对人外周血淋巴细胞T细胞受体α-链的mRNA的多变性进行了分析。先合成cDNA,并用末端脱氧核苷酸转移酶在其3’-可变区末端加上一个PolyG尾巴。Loh等恒定区与可变区连接部位设一个引物,另一个引物是一个具5’-polyG尾巴的引物。带有PolyG尾巴的引物是一个固定点,它可以并与PolyG尾巴结合,无论其余部分序列如何,只识别片段末端,利用此法可从前述mRNA中检出至少20种不同序列,每一种都是独特的,表明A-PCR不对任何特殊序列有倾向性结果,可用于T细胞、肿瘤及其它部位抗体基因的研究。
九、玻片PCR
在聚丙烯管中可以对多种含膜板材料进行PCR,而在显微玻片上用组织细胞涂片或切片直接进行DNA扩增的方法就称为玻片PCR(Slide-PCR)。

图22-3 锚定PCR原理示意图
先将细胞涂片或呈单层细胞,然后用甲醇/醋酸(3:1,V/V)、Carnoy溶液、无水乙醇或4%多聚甲醛溶液固定5~15min。用蒸馏水冲洗,干燥,直接使用或保存于-20℃备用。在玻片上划20mm×28mm为免疫组化反应区。加入30μl PCR反应混合液,其中含10mmol/L TrispH8.3,50mmol/L KCl,1.5mmol/L MgCl2,200μmol/l dNTPs,100nmol/L引物,0.01%(V/V)明胶,0.2%BSA, 2.5u/100μl Taq酶。然后盖上22mm×40mm的盖玻片,边缘用石蜡油封好。把玻片放入PCR热循环仪金属块上,使金属块与样品呈最大程度接触,同在聚丙烯管中一样,进行30~40个循环。对于较短的扩增片段在后期循环中变性温度可降低。反应后,将致冷玻片放在氯仿中除去大部分石蜡油,但不取出盖玻片,用一个尖镊子轻轻拈起盖玻片一角,在相对的一角中PCR反应混合液呈半月形液面,用移液器回收。一般可回收25μl混合液,将反应产物进行琼脂糖电泳或用套式PCR引物按标准PCR进行重新扩增。片上扩增物可做原位杂交显示。
在Slide-PCR中,需0.1%~1%的BSA。加入BSA可以保证扩增结果,但效率不一定很高。明胶(至少0.0001%),对扩增1kb左右的靶DNA十分重要。但对小片段扩增结果影响不大。不同的样品提取方法或固定法对Slide-PCR都可行。
Silde-PCR的机理可能是在起始变性过程中一部分DNA从细胞中洗提出来,然后在细胞和玻片的水相中进行PCR。用地高辛标记的人全基因组DNA探针杂交表明在起始循环中DNA极微量,而30个循环后很丰富。常规细胞染色表明只有少量的形态改变。
Silde-PCR对于玻片上的细胞样品提供了一种较好的方法,而不必再把这些样品从玻片上括下来,使操作简便,污染减少。本方法对于原样品量极微且需病史追踪保存的(如子宫颈涂片或涂片)具有实用价值。
十、反转录PCR方法检测RNA
RNA的多聚酶链式反应(RT-PCR)是以RNA为模板,联合逆转录反应(reverse transcrip-tion, RT)与PCR,可用于检测单个细胞或少数细胞中少于10个拷贝的特异DNA,为RNA病毒检测提供了方便;并为获得与扩增特定的RNA互补的cDNA提供了一条极为有利和有效的途径。
RNA扩增包括两个步骤:①在单引物的介导下和逆转录酶的催化下,合成RNA的互补链cDNA;②加热后cDNA与RNA链解离,然后与另一引物退火,并由DNA聚合酶催化引物延伸生成双链靶DNA,最后扩增靶DNA。
在RT-PCR中关键步骤是RNA的逆转录,cDNA的PCR与一般PCR条件一样。由于引物的高度选择性,细胞总RNA无需进行分级分离,即可直接用于RNA的PCR。但RT-PCR对RNA制品的要求极为严格,作为模板的RNA分子必须是完整的,并且不含DNA、蛋白质和其它杂质。RNA中即使含有极微量的DNA,经扩增后也会出现非特异性扩增;蛋白质未除净,与RNA结合后会影响逆转录和PCR;残存的RNase极易将膜板RNA降解掉。硫氰酸胍(GaSCN)-CsCl法或酸性硫氰酸胍-酚-氯仿法可提得理想的RNA制品,尤以后者方法为佳,适合一般实验室进行。
常用的逆转录酶有两种,即禽类成髓细胞性白血病病毒(Avianmyeloblastosis virus, AMV)和莫洛尼鼠类白血病病毒(Moloney murineleukemia virus, MO-MLV)的逆转录酶(RT)。一般情况下用Mo-MLV-RT较多,但模板RNA的二级结构严重影响逆转录时,可改用AMV-RT,因后者最适温度为72℃,高于Mo-MLV-RT的最适温度(37℃),而较高的反应温度有助于消除RNA的二级结构。
一步法扩增(one step amplification)是为了检测低丰度mRNA的表达,利用同一种缓冲液,在同一体系中加入逆转录酶、引物、Taq酶、4种dNTP直接进行mRNA反转录与PCR扩增。发现Taq酶不仅具有DNA多聚酶的作用,而且具有反转录酶活性,可利用其双重作用在同一体系中直接以mRNA为模板进行反转录和其后的PCR扩增,从而使mRNA的PCR步骤更为简化,所需样品量减少到最低限度,临床小样品的检测非常有利。用一步法扩增可检测出总RNA中小于1ng的低丰度mRNA。该法还可用于低丰度mRNA的cDNA文库的构建及特异cD-NA的克隆,并有可能与Taq酶的测序技术相组合,使得自动反转录、基因扩增与基因转录产物的测序在一个试管中进行。
最近Cetus公司推出rTth逆转录酶,兼具有DNA多聚酶的活性,对于RNA的发展起了很大的推动作用。有关rTth逆转录酶法参考第四节 有关内容。
十一、定量PCR
1.DNA-PCR定量用同位素标记的探针与电泳分离后的PCR扩增产物进行杂交,根据放射自显影后底片曝光强弱可以对模板DNA进行定量。Abbot等利用这种方法对人类T细胞白血病反转录基因进行了定量研究。
PCR扩增产物用专为检测ds-DNA而设计的微量荧光计定量,利用染料H33258专与双链DNA结合而使荧光增强50倍的特性。可以从标准模板系列稀释扩增产物量曲线上读出样品中模板DNA的量或拷贝数,达到PCR定量的目的。
利用倍比稀释模板作系列稀释PCR,求出最低(PCR-EB)检测限来比较,也是常用的半定量PCR方法。
2.mRNA-PCR定量由于MRNA-PCR定量需经两个酶(RT和Taq)催化,因而影响因素较多。1989年Wang等报道了低丰度mRNA绝对定量方法。利用浓度已知且与待测靶mR-NA序列相同的内对照mRNA(其片段长短不同,便于PCR扩增后产物的分离),在同一体系中,用相同的由32P标记的引物与待测mRNA一同进行逆转录和PCR扩增,扩增产物电泳后,分别测定二者产物放射性强度,由预先制备的标准曲线推算出每个样本特异mRNA的量。Gilliland等的结果表明,在1ng总RNA中可以对小于1pg的特异mRNA进行定量。这一定量方法在肿瘤、代谢失调、基因表达调控等研究中均有重要意义。
第六节 样品处理与注意事项
一、样品处理
DNA是染色体的主要组成部分,是PCR的扩增模板。要进行PCR,研究DNA结构与功能或者用于诊断目的,首先必须从生物体内提取DNA。DNA往往以核蛋白形式存在,其分子量大(人的染色体DNA平均大小为3.0×109bp),提取DNA应尽量保持DNA完整性和纯度,即在提取中尽量避免机械张力引起的DNA分子降解,又要注意杂质及蛋白的去除,防止胞内酶解DNA。因此,提取DNA的基本过程是:用Proteinase K及SDS,在EDTA存在下,裂解细胞,消化蛋白质,使核蛋白解聚及胞内DNA酶失活,然后用酚/氯仿多次提取去除蛋白质,在DNA中若混有少量RNA,可用RNase去除,最后用乙醇沉淀得到DNA。
理论上PCR对模板DNA纯度及完整性要求并不高,细胞经过热变性使DNA释出就可以作为模板,依赖引物的选择性进行扩增。这对拷贝数很多的基因组,确实如此。但当待扩增的拷贝数甚少而无关细胞甚多时则扩增就不易成功,其原因是:①非希望的扩增增多,掩盖了所需扩增的片段,使其数量减少至不能检测到的程度。②生物样品中的杂质会抑制PCR反应,最主要的是血液和琼脂糖。例如在100μl反应液中加入1μl全血就可引起抑制,0.8μmol/L的血红素也会引起明显的抑制。对于含血液的样品,可以用渗透压溶解红细胞,离心集取细胞核,洗除血红蛋白,再用蛋白酶/表面活性剂处理的方法来解决。另一简单的方法是煮沸之,使释放DNA,并沉淀Hb,用上清液作PCR。
现将PCR前处理各种标本的基本方法介绍如下:
1.所需溶液
(1)PBs 0.85% W/V NaCl,66mmol/L Na3PO4pH7.0
(2)含表面活性剂及蛋白酶K的PCR缓冲液
50mmol/LKCl, 10mmol/L Tris-HCl(pH8.3) 2.5mmol/L MgCl2
0.1mg/ml明胶,0.45%NP40,0.45%吐温20
高压灭菌,冷冻储存。临用前加0.6μl的10mg/ml蛋白酶K(水溶液)至100μl溶液中。
(3)溶血缓冲液
0.32mol/L蔗糖,10mmol/L Tris-HCl pH7.5
5mmol/LMgCl2,1% Triton X-100
2.提取方法
(1)用聚蔗糖-泛影葡胺梯度法从血液或培养细胞分离的单核细胞(当PBC〈10%细胞数时用此程序)
①将细胞样品用PBS稀释至10ml,置15ml锥形离心管中;
②100×g离心2~5min,吸去上清;
③细胞再悬浮于10ml PBS中重新离心洗涤;
④沉淀物悬浮于溶液2中,使细胞浓度约为6×106/ml,移至1.5ml管中;
⑤50~60℃保温1h;
⑥95℃保温10min使蛋白酶变性;
⑦冷冻储存。
如果RBC多于细胞的10%,则用PBS洗1次(步骤1,2)后,悬浮于1ml溶液3,并转移至1.5ml离心管中,如程序B-2离心1次,再悬浮于溶液2中按程序A-4继续进行。
(2)全血:此法使胞膜溶解故胞浆DNA丢失,约可得20μg DNA/0.5ml血。
①0.5ml全血与0.5ml溶液3共置1.5ml管中;
②13000×g离心20s;
③吸去上清,加1ml溶液3,旋涡混合使沉淀重新悬浮;
④重复第2,3步2次;
⑤13000×g离心2s,吸去上清,悬浮于0.5ml溶液2中;
⑥按程序A5~7步进行。
(3)拭子
①用PBS预温的试子从宫颈、阴道或阴茎采样;
②拭子置入2ml PBS(含抗霉剂)于15ml离心管中,室温可保存24h,置4℃可保存更长时间。也可用旋涡混合器振荡使细胞加速游离;
③取去拭子,2000~13000×g离心5min,吸去上清;
④如含RBC则加1ml溶液3,转移至1.5ml E管中,按程序B-2开始进行;
⑤如不含RBC则加溶液2,按程序A-4进行。
(4)头发
①拔下头发,剪下头发近端0.5cm段;
②置入0.4ml溶液2中(1.5ml管);
③按程序A5~7步进行,用50μl体系作PCR。
(5)血细胞RNA用焦碳酸二乙酯(DEP)抑制RNase,NP-40溶胞但不溶核。
①用聚蔗糖-泛影葡胺或其它方法分离单核细胞;
②置2ml离心管中,加PBS至细胞中,500×g离心5min;
③配制(DEP)溶液用无水乙醇将DEP作9+1稀释,再用NP-400.5%作1:999稀释(抑制RNase);
④细胞沉淀中加200~400μl此溶液,旋涡混合;
⑤13000×g离心10s;
⑥上清转移至新管中,37℃保温20min,90℃,10min;
⑦离心,上清转移至新管。取5~10μl作反转录;
⑧如果反转录失败,可能因DEP残留,可将样品再在90℃加热5min,再做试验;
⑨本法也可用于培养细胞。
二、注意事项
PCR只需几个DNA分子作模板就可大量扩增,应注意防止反应体系被痕量DNA模板污染和交叉污染,这是造成假阳性最大的可能。下例可形象说明污染的严重性。
典型的PCR反应可在100μl反应液中扩增1012个DNA,此液倾入50nm×25m×2m的游泳池中,充分混合取0.1ml池水,其中含有40个分子的DNA,用PCR扩增即已可呈阳性,这一点对检测HIV更为重要。常规只要15个拷贝的核酸即可查出。假阳性结果往往来自痕量污染和交叉污染,尤其在待扩增靶序列浓度低的情况下,更有必要采取防备措施。
(1)DNA处理最好用硅烷化塑料管以防粘附在管壁上,所有缓冲液吸头、离心管等用前必须高压处理,常规消耗用品用后作一次性处理,避免反复使用造成污染。
(2)PCR在超净台内进行,操作前后紫外灯消毒。
超净台内设内供PCR用微量离心机、一次性手套、整套移液器和其它必须品;移液品用一次性吸头和活塞的正向排液器,防止移液器基部污染。
(3)PCR操作应戴手套并勤于更换。
(4)成套试剂,小量分装,专一保存,防止它用。配制试剂用新器具,用后作一次性处理。
(5)试剂管用前先瞬时离心(10s),使液体沉于管底,减少污染手套与加样器机会。
(6)最后加模板DNA(包括在石蜡油后),马上盖好,混匀,瞬时离心(10s),使水相与有机相分开。加入模板且忌喷雾污染,所有非即用管都应盖严。加模板DNA后应更换手套。
(7)实验设阳性、阴性对照。
第七节 PCR仪器的发展
PCR温度循环至关重要,PCR扩增仪各参数必须准确。自Perkin –Elmer Cetus公司第一台PCR扩增仪问世以来,现已有几十家不同的厂家在国内外生产和销售PCR扩增仪。在短短的几年间,扩增仪经过几代的发展,不断采用新技术,并且进一步朝方便、实用、高智能化和自动化的方向发展。
为了便于了解和选购适宜的PCR实验设备,现将部分国内外PCR扩增仪列表如下(表22-5);这些仪器主要用变温铝块、变温水浴及变温气流的方式达到热循环的目的,各有其优缺点。国产1109型DNA扩增仪则是用恒温浴机械手移位式。更接近于手工操作。PTC-51A/B体积小,智能化与自动化程序高,可以兼做套式PCR,方便实用。以上各种仪器一般都配有微电脑自动控制温度、时间及循环数,可以达到节 省劳动力的目的。在采用这些仪器作PCR试验之前,一般均应实测管内温度变化循环情况,以了解升、降温时管内因热传导造成的温度滞后情况和实际到达的最高、最低温度,用于修正设计的循环参数。温度滞后受到所用Eppendorf管材料、壁厚及形状(与铝块孔匹配程度)的影响,这对变温铝块式仪器影响更大些。对于配用制冷机式半导体元件致冷的仪器,在使用低于室温的温度来保冷PCR反应后小管时,应注意冷凝水的问题,勿使流入仪器内浸湿半导体元件而损坏仪器。
表22-5 国内外生产的几种DNA扩增仪
| 仪器型号 | 生产厂家 | 型式 | 特点 | 管数 | 报价 |
| 1109型 | 北京新技术所与军科院联合 | 机械臂 变温水浴 |
电子调温 | 40×0.5ml | 16400元/台 |
| 90A/B型 | 中科院遗传所 | 机械臂 变温水浴 |
电热 | 14000元/台 | |
| PTC-51A/B型 | 军事医学科学院 | 变温气流 | 电子调兼作套式 | 30×0.5ml | 12000元/台 |
| DNA Thermal Cycler | Perkin –ElmerCetus(美) | 变温铝块 | 压缩机致冷 | 48×0.5ml | US $ 20000.- |
| Thermocycler 60 00 180 |
B..Braun Biotech (德) |
变温水浴98℃四档 | 电热,自来水冷却 | 60×1.5ml 100×1.5ml 180×1.5ml |
DM 30000.- |
| Automatic temperature Cy-cler Single Block Twin Block | Ericomp Inc.(美) | 变温铝块25~100℃ | 电热,自来水冷却 | 29×1.5ml 58×1.5ml |
US $4985.- US $7980.- |
| Grant Autogen | Grant Instrumant Ltd(美) | 变温水浴0~99℃ | 电热,自来水冷却或加冷循环器 | 50×1.5ml or 50×1.5ml |
US $250. –plus US $ 15.-for Rack(x2) |
| Techne PHC-1 PHC-2 |
Techne Ltd.(英) | 变温铝块0~99℃三档 | 电热500W水冷100W | 54×0.5ml 54×0.5ml 24×1.5ml |
£3383. – £3997. - |
| BioOven | BioThrm Corp(美) | 变温气流 -150℃ |
115V11A | 200’s of 4×96plate | US $ 2990. - |
| Trio-Thermo-block TB-1 | Biomertra(德) | 半导体变温 | 220V | 3×20管 分别控温 |
DM12900. - |
| Micro cycler E | Eppendorf(美) | 变温铝块 | 220V/100V | 3×29管 | US |
第八节 PCR临床应用领域及特点
一、PCR应用特点
1.操作简便目前PCR技术采用耐高温Taq DNA聚合酶,并且在有电脑控制的DNA扩增仪中进行,使操作大为简化,一次加入的酶即可满足反应全过程。DNA扩增仪能自动迅速升降温度,只需把反应所需的全部材料混匀,置入仪器内,反应便依所输入的程序进行。
2.省时应用TaqDNA聚合酶时,单核苷酸掺入速率较高,75~80℃时,每个酶分子每秒钟可完成150个核苷酸的合成。PCR每一周期需数分钟,所以,一般常取用20~30个周期能使目的DNA达数到百万倍扩增的反应只要数小时即可完成。在基因分离、突变体构建、DNA测序等方面,PCR方法均较之常规法快速的多。例如,用常规方法建立cDNA库或染色体DNA库来分离基因,需花几个月,用PCR方法只需1~2个月星期;用M13法构建突变体需1~2个月,而PCR法只用数天;PCR方法扩增的目的DNA片段可直接用作序列分析,较常用的通过克隆、培养扩增、纯化制备等步骤获得测序片段更为简便。
3.灵敏度高PCR产物的生成是以指数方式增加的,所以欲扩增pg量级的起始物到μg水平或放大真核细胞单拷贝基因,通过PCR方法都是不难完成的。PCR方法可用单、双倍体细胞、一根头发、甚至单一精子进行DNA定型。
4.特异性强作为引物的寡核苷酸与模板结合的正确性是决定反应产物是否特异的关键。Taq DNA聚合酶耐高温的性质使反应中引物与模板退火的步骤可以在较高的温度下进行,结合的特异性大大增加,被扩增的目的片段也能保持很高的正确程度。
5.对原始材料质量要求低由于PCR技术有较高的灵敏度和特异性,故仅含微量(pg,ng)的目的DNA的粗制品或者总RNA,就可以用做反应起始材料来获取目的产物。部分降解的DNA材料也可以通过PCR多次反应周期,最终得到所需的全长DNA片段。
6.有一定程度的单核苷酸错误掺入由于Taq DNA聚合酶缺乏3’→5’核酸外切酶活性,因而不能纠正反应中发生的错误的核苷酸掺入,标准条件下,其错误掺入率可达1.25×10-4~1×10-5。但是,这种错误并不意味着PCR产物一定会发生序列改变。Innis MA发现,错误掺入的碱基有终止链延伸的作用倾向,这就使得发生了的错误不会再扩大。
二、PCR应用领域
单克隆抗体技术曾使免疫学理论与实践有了新的突破,近几年来PCR技术使分子生物学及相关学科发生了一次方法学的革命。在不到10年的时间内,在以下几个领域中PCR技术已具有实用价值,且其应用范围正在不断扩大中。
1.遗传病的产前诊断 用胎儿羊膜细胞,羊水或甚至母血可以检查胎儿的性别,这在与性染色体关联遗传病诊断中是必要的。对于高发的遗传病,如地中海贫血、镰刀状细胞贫血、凝血因子缺乏、DMD等已在临床应用多年,为优生优育作了贡献,对于有遗传倾向的疾病尤其是老年性疾病,如糖尿病、高血脂症、甚至肿瘤中的一部分,均是当前研究的重点,近期内可望有突破。
2.致病病原体的检测 这些外源入侵的基因,一旦阐明其部分核酸序列,就可以设计引物或探针,用PCR、PT-PCR或杂交方法来检测,其范围包括细菌、病毒、原虫及寄生虫、霉菌、立克次体、衣原体和支原体等一切微生物,PCR诊断的特点是可以选择其基因中的保守区作通用检测,也可以选定差异较大的基因部位作分型检测。既可以做一病原体的专用检测,也可以将有关病毒、细菌中不同的品种作一次多元检测。而且检测的灵敏度和特异性都远高于当前的免疫学方法,所需时间也已达到临床要求,这对于难于培养的病毒(乙肝),细菌(如结核、厌氧菌)和原虫(如梅毒螺旋体)等来说尤为适用。
3.癌基因的检测和诊断 虽然对癌基因的研究大部分还属于基础阶段,但癌变是由基因变异所导致的这一基本事实已无庸置疑,所以癌基因、抗癌基因入抗转移基因的研究,离开分子水平的诊断手段是无法进行的,临床上已可应用的例子有白血病残留细胞的定量(包括慢粒和急粒),肺癌中P53及Rb等抗癌基因的失活,神经质瘤N-myc基因的激活和表达。通过原位杂交观察特定癌基因及抗转移基因的植入和反义寡核苷酸对强表达癌基因的阻断均已成为近代基因治疗的着眼点。
4.DNA指纹、个体识别、亲子关系鉴别及法医物证 这一为公、检、法部分所瞩目的课题已经在某些国家取得法律认可。肌红蛋白小卫星基因,β-珠蛋白基因、ApoB基因等的多肽性和重复次数的差异都被应用于鉴定,其灵敏度已达到一根头发、一个细胞、一个精子取得个体特征图谱,这一领域也已发展到骨髓或脏器移植配型及动物种系的研究中。
5.动、植物检疫 灵敏、特异、快速诊断检测方法是我国进出口口岸的门卫,检查出入国门的人员、动、植物(种畜、种籽)等是否携带烈性传染病(艾滋、动物病毒、植物病毒等)病原体,食品、饲料等是否带沙门氏菌等均需要基因诊断手段将这些病菌拒之于国门之外,是提高我国综合国力的必要保证。
6.高科技生物医学领域中的应用 在转基因动植物中检查植入基因的存在。PCR技术尚可应用于基因拼接、测序等领
第九节 其它链扩增技术及应用范围
一、免疫PCR
所谓免疫(Immune PCR)就是利用抗体与DNA特异结合来检测抗原,把抗原抗体反应与PCR联合应用而建立的一种抗原检测系统。
在免疫PCR中,一个中介分子同时具有与DNA、抗体分子特异结合的能力。其一端连接DNA(标记物),另一端连接抗原-抗体复合物,形成一个特殊的抗原-抗体-DNA连接物。作为标记物的DNA分子可用PCR的扩增,存在特异的PCR产物应证明作为标记物的DNA分子已特异地与抗原-抗体复合物结合,而且表明了抗原的存在。有人采用SAP(streptavidin – protein A)嵌合体作为中介物。它具有双特异性结合能力,一端为链霉亲和素,可结合生物素;另一端为可与IgG的Fc段结合的蛋白A。这样可特异地把生物素化的DNA分子和抗原-抗体复合物连接在一起。
选用BSA作抗原进行免疫PCR实验,结果表明,可检测出580个抗原分子(9.6×10-22mol/L),而且可以完全避免其它非特异信号的干扰。与采用碱性磷酸酶的ELISA相比,其灵敏度可提高105倍,较常规的放名分析灵敏度也高出几个数量级。
免疫PCR产物在普通的琼脂糖电泳上就可以检测出来,如用更好的方法来检测PCR产物,如放射性同位素,荧光物或酶等掺入到PCR产物中,可进一步提高其灵敏度和适用性。另外,如果采用不同大小标准的DNA进行标记,在电泳时,可同时检测出多种不同的抗原分子。
PCR产物的多少与抗原结合量有关,如果用标准反应作对照,则可以对抗原的量进行估算。因此,通过改变连接物的浓度就可以改变检测系统的灵敏性。其它因素,如抗体的浓度,PCR循环周期数,PCR产物的检测方法等也同样影响系统的灵敏性。
二、转录依赖的扩增系统(Transcription-basedAmplification System , TAS)
扩增样本中的RNA,一般要先将其逆转录成cDNA,再以cDNA为模板进行PCR扩增,能否将RNA靶序列直接扩增出来呢?Kwok等人发明了TAS来解决这一问题。结合应用葡聚糖珠寡核苷酸杂交技术可进一步提高方法的特异性和效率。其原理是:制备引物A、B,引物A与待检RNA3’端互补,并有一T7RNA多聚酶的识别结合位点。逆转录酶以A为起点合成cDNA;引物B与此cDNA3’端互补,逆转录酶同时还具有RnaseH和DNA多聚酶的活性,又可利用引物B合成cDNA的第二链。RNA多聚酶以此双链cDNA为模板转录出与待检RN-一样的RNA,这些RNA又进入下轮循环。RNA多聚酶从一个模板可以转录出10~103个拷贝,因此反应中待检RNA拷贝数以10的指数方式增加,较PCR高得多。扩增产物用葡聚糖珠夹心杂交法检测:产物先与标记的探针杂交,再与包被在葡聚糖珠上的另一互补寡核苷酸(与标记探针互补的位置不同)杂交、检测。该方法同一般杂交检测技术相比,特异性要高出许多。
TAS主要特点是扩增效率极高,由于拷贝数是以10指数递增,只有6个循环,靶序列即能达到2×106个拷贝。由此而来的另一个特点是特异性很高,在一般的RNa PCR扩增中,由于逆转录酶和Taq多聚酶均无较对活性,要发生错掺,循环次数越多,错掺率越高。TAS仅需循环4~6次,将错掺率降低了4/5。用葡聚糖珠夹心杂交法,又进一步提高了特异性。目前认为TAS是扩增RNA的首选方法。
三、再生式序列复制技术(3SR)
这一反应依赖于AMV逆转录酶、RnaseH和T7RNA多聚酶的共同作用。当逆转录酶合成cDNA第一链后,RnaseH降解模板RNA,逆转录酶合成cDNA第二链,T7RNA多聚酶以此cDNA为模板,转录出与样本RNA序列相同的RNA。其RNA扩增过程与TAS相同。由于所使用的工具酶工作的适宜温度是37℃,所以只要在第一步变性、复性后,整个反应过程不再需要温度循环。具体方法如下:制备引物A、B,引物A有T7RNA多聚酶识别、结合位点。将引物、样本加入扩增缓冲液中,65℃,1min,降温至37℃,加入人工具酶,37℃保温1h,冰浴中止反应。可用葡聚糖夹心法检测扩增产物。
这一方法有几点值得注意:(1)反应是在37℃恒温中进行的;(2)产物中有RNA,反义RNA的cDNA,RNA的拷贝数高于Cdna(90:1);(3)效率高于PCR。使拷贝数扩增到105,PCR要85min,3SR仅要15min;(4)逆转录酶也具有RnaseH活性,反应又是在37℃中进行,因此推测某些病毒,如HIV-1感染的细胞内可能存在类似3SR的病毒基因扩增机制。
四、连接酶链式反应(Ligase ChainReaction,LCR)
该技术是Landegren等人于1988年为检出序列中点突变而设计、发明的。合成一对引物A、B,它们完成覆盖了靶序列。经退火与靶序列结合后,A、B间留下一个缺口(nick),加入连接酶封闭缺品,两引物成靶序列完整的互补链。如果靶序列中有点突变,引物不能与靶序列精确结合,缺口附近核苷酸的空间结构发生变化,连接反应不能进行,变性后引物仍是两个。Lan-degren用生物素标记引物A,用32P标记引物B。用亲和素包被的琼脂糖珠与连接产物反应,检测其放射性。显然,当靶序列中存在点突变时,检测结果是阴性的。用这种方式,Landegren将人β-珠蛋白βA、βC、βS三个等位基因区别开来。Wu等人又引入PCR的原理,在连接反应后,变性、退火、再连接,少量的靶序列就被扩增出来。Barany于1991年报道了耐热连接酶-Taq连接酶的发现及其在LCR中的应用,为LCR的实用化奠定了基础。实际操作时引物为4个,A、A、 A’和B、B’,分别与靶序列的正负链互补。每次连接反应的产物又可在下一轮反应中当模板,靶序列以指数形式扩增出来。用上面提到的标记检测方法,即可检测靶序列中有无点突变。
LCR的特异性首先取决于引物与模板的特异结合,其次Taq连接酶作用的特异性,即Taq连接酶是否仅连接与靶序列完全互补的引物。实验表明Taq连接酶的非特异活性是较低的(<1%)。控制模板、酶的浓度,使反应在接近Taq酶的温度下进行,还可进一步降低非特异连接率。Barany用这一技术,将极少量(<200个分子)的βA、βC和βS区别开来。
LCR的扩增效率与PCR相当。由于有很高的信噪比,其敏感性也很高。用Taq连接酶做LCR只在两个保温点的循环(94℃、1min和65℃、4min)。产物检测也非常方便、敏感。因此可以说LCR是目前检测已知序列中有无点突变的最佳方法。
五、PCR-SSCP分析技术
近几年来,在PCR基础上完善和发展起来的多种基因变异检测方法是基因分析和检测的一次技术革命。其中日本学者创建的PCR-SSCP(Single-Strand ConformationPolymorphism anal-ysis of PCR products)格外重要。它是指单链DNA分子在变性PAGE中电泳迁移率随其构象的改变而改变的性质。单链DNA分子的构象改变即可由DNA多态性引起,又可由基因突变引起。为此,有的学者试图用PCR-SSGE(Single-Strand Gel Electrophoresisof PCR products)代替原命名。
PCR-SSCP分析包括PCR扩增和单链产物电泳两个阶段。对于分析小于400bp的PCR产物十分有效,对于大于400bp的PCR产物需处理后再分析,必须注意的是PCR-SSCP分析不能确定基因变异部位和内容,泳动后必须进一步完成DNA测序。
六、结语
PCR技术以惊人的速度在研究与诊断领域得到应用,限于篇幅所限,在此不一一进行讨论了。本章 重点讨论了PCR技术发展的有关内容,尤为影响PCR的主要因素和PCR的各种反应模式及新进展,以求大家在实际工作中能够注意到这些问题,并有所创新,相信由于PCR自身高敏感性及实用性,在分子生物学研究与医学实践中PCR技术将越来越受到人们的重视。无论从哪一个角度,PCR技术从分子水平对许多传染病、遗传性疾病和肿瘤进行诊断,使法医鉴定、生物进化的研究更为简便和强化,在遗传学、分子生物学、生物工程与医学研究中都占有重要的地位。
PCR技术是以生物体内DNA复制为基础理论的,这一技术把基础理论与应用有机结合起来,给我们以辩证的思考。对于其它学科中有关理论与实践结合的问题具有指导意义。PCR技术必将为我们提供大量有关核酸的知识,丰富我们的理论,改变我们以前的认识,推动学科的向前发展。
参考文献
1.L.Z.Xu and D Larzul. The polymerase reaction:Basic Methodology andApplications. Comp.Immun. Microbiol. Infet Dis, 1991, 14(3):209~221
2.MullisK, Faloona F, Scharf S, Horn G, et al. Specific enzymatic amplification of DNAin vitro :the polymerase chain reaction:Cold Spring Habor Symp. Quant. Biol., 1986,51:263~273
3.Saiki RK, Scharf S, Faloona F, et al. Enzymatic aniplification of β-globin genomicsequences and restriction site anylysis for diagnosis of sickle cellanemia.Sciencer, 1985;230:1350~1354
4.ChienA, Edgar D B, Tela J M. Deoxyribonucleic acid polymerase from the extremethermophile thermus aquaticus. J. Bacterial, 1976;127:1550
5.SaikiRK, Gefland D H, Stoffel S, et al. Primer –directed enzymatic amplification ofDNA with a thermostable DNA polymerase. Science, 1988;239:487~489
6.黄培堂,等.PCR技术的原理与应用.科学出版社.1992
7.朱平,等.PCR聚合酶链反应操作实验指南.科学出版社,1992
8.马立人,等.PCR技术的发展和文献,内部资料.
9.金冬雁,等译.分子克隆操作指南.科学出版社,1992
10.Wang HC.PCRDESN and PCRDESNA for PCR primer design.Compt. Biol. Med, (insoftwaresurvery section),1991;21(1/2):1
11.ToddLowe, John Sharefkin, Shi Qiyang, et al. Dieffenbach,A computer program forselection of oligonucleotide primers for polymerase chain Reaction, NucleicAcids Res, 1990;18:1757~1761
12.Erlich, Eds. New York:PCR Technology. Stockon Press, 1989:17~22
13.SaikiRK, et al. Amplifications, 1989;1:4~6
14.Stoffel.Amplifications , 1991;6:14
15. EricPH, Yap, James O’ D DcGee. Slide PCR:DNa amplification from cell samples onmicroscpic glass slides, Nucleic Acids Res.,1991;19(15):4294
16. 马立人.基因诊断的发展和应用,内部资料,1993
17.Takeshi Sano , Cassandral Smith, Charles R, et al. Immuno –PCR:Very sensitive antigen detectionby means of specific antibody –DNA conjugates. Science, 1992;258:120~122
18. D YKwoh, G R Davis, K M Whitefield , et al.Transcription – hased, amplificationsystem and detection of amplified human immunodefi-ciency virus type1 with a beadbased sandwich hybridization format.Proc. Natl. Acad. Sci. USA, 1989;86:1137~1177
19.BirkenmeyerL G. Isak Mushahwar. DNA probe amplification methods. J Virol. Methods, 1991;35:117~126
20.Barany Francis. Genetic desiease dectection and DNA amplification using clonedthermostable ligase. Proc. Natl. Acad, Sci, USA,1991;88:189~193
第二十三章 DNA重组技术及其在基因诊断中的应用
第一节 工具酶
基因工程的基本技术是人工进行基因的剪切、拼接、组合。基因是一段具有一定功能的DNA分子,要把不同基因的DNA线形分子片段准确地切出来,需要各种限制性核酸内切酶(restriction endonuclease);要把不同片段连接起来,需要DNA连接酶(ligase);要结合基因或其中的一个片段,需要DNA酶(DNa polymerase)等。因此,酶是DNA重组技术中必不可少的工具,基因工程中所要用的酶统称为工具酶。
一、DNA限制性内切酶
Lurva和Human(1952)以及Bertani和Weigle(1953)发现了噬菌体λ的限制作用,即用一种λ噬菌体在一种宿主细胞生长良好,但在另一种宿主细胞中生长很差,其原因在于它的DNA受到后一种宿主的“限制”。由此发现了限制-修饰系统。
各种细菌都能合成一种或几种顺序专一的核酸内切酶。这些酶切割DNA的双链,因为它们的功能就是切割DNA,限制外源性DNA存在于自身细胞内,所以称这种核酸内切酶为限制酶。合成限制酶的细胞自身的DNA可以不受这种酶的作用,因为细胞还合成了一种修饰酶,它改变了限制酶识别的DNA顺序的结构,使限制酶不能起作用。限制-修饰系统是细胞的一种防卫手段。如果用噬菌体去感染限制-修饰系统有活性的细菌,噬菌体DNA没有先经修饰,它与先经修饰的噬菌体相比,感染效率要低几个数量级。未经修饰的噬菌体DNA进入细胞后被限制酶切成片段,片段的数目与DNA分子中限制酶的识别点数目成正比,这些片段进一步被细胞的核酸外切酶降解,就会开始裂解感染,由此产生的子代噬菌体全部带有修饰过的DNA,因此能以很高的效率去感染另一些具有相同限制-修饰系统的细菌。目前,从各种生物中分离出的限制性内切酶已超过175种,其中80多种是切割DNA双链。
(一)命名原则
限制性内切酶主要是从原核生物中提取的。现在通用的命名原则是:第一个字是细菌属名的第一个字母,第二、三个字是细菌种名的前二个字母,这些字母都用斜体字母;接下去是细菌株的第一个字母,用正体字母书写。如果同一菌株中有几种不同的内切酶时,则分别用罗马数字Ⅰ、Ⅱ、Ⅲ……来代表。现在列表举例说明如下(表23-1)。
表23-1 几种限制性内切酶命名原则举例
| 细菌原名 | 细菌种名 | 菌株名称 | 限制酶名称 |
| Arthrobacter | Luteus | AluⅠ | |
| Bacillus | amyloliquefaciens | H | BamHⅠ |
| Escherichia | Coli | RY13 | EcoRⅠ |
| Haemophilus | influeuzae | Rd | HindⅢ |
(二)分类和特性
限制性内切酶主要分成三大类。第一类限制性内切酶能识别专一的核苷酸顺序,并在识别点附近的一些核苷酸上切割DNA分子中的双链,但是切割的核苷酸顺序没有专一性,是随机的。这类限制性内切酶在DNA重组技术或基因工程中没有多大用处,无法用于分析DNA结构或克隆基因。这类酶如EcoB、EcoK等。
第二类限制性内切酶能识别专一的核苷酸顺序,并在该顺序内的固定位置上切割双链。由于这类限制性内切酶的识别和切割的核苷酸都是专一的。所以总能得到同样核苷酸顺序的DNA片段,并能构建来自不同基因组的DNA片段,形成杂合DNA分子。因此,这种限制性内切酶是DNA重组技术中最常用的工具酶之一。这种酶识别的专一核苷酸顺序最常见的是4个或6个核苷酸,少数也有识别5个核苷酸以及7个、9个、10个和11个核苷酸的。如果识别位置在DNA分子中分布是随机的,则识别4个核苷酸的限制性内切酶每隔46(4096)个核苷酸就有一个切点。人的单倍体基因组据估计为3×199核苷酸,识别4个核苷酸的限制性内切酶的切点将有(3×109/2.5×102)约107个切点,也就是可被这种酶切成107片段,识别6个核苷酸的限制性内切酶也将有(3×109/4×103)约106个切点。
第二类限制性内切酶的识别顺序是一个回文对称顺序,即有一个中心对称轴,从这个轴朝二个方向“读”都完全相同。这种酶的切割可以有两种方式。一是交错切割,结果形成两条单链末端,这种末端的核苷酸顺序是互补的,可形成氢键,所以称为粘性末端。如EcoRI的识别顺序为:
↓ |
5’……GAA | TTC……3’
3’……CTT | AAG……5’
| ↑
垂直虚线表示中心对称轴,从两侧“读”核苷酸顺序都是GAATTC或CTTAAG,这就是回文顺序(palindrome)。实线剪头表示在双链上交错切割的位置,切割后生成5’……G和AATTC……3’、3’……CTTAA和G……5’二个DNA片段,各有一个单链末端,二条单链是互补的,可通过形成氢键而“粘合”。另一种是在同一位置上切割双链,产生平头末端。例如HaeⅢ的识别位置是:
↓
5’……GG↓CC……3’
3’……CC↓GG……’
↑
在箭头所指处切割,产生的两个DNA片段是:
5’……GG CC……3’
和
3’……CC GG……5’
有时候两种限制性内切酶的识别核苷酸顺序和切割位置都相同,差别只在于当识别顺序中有甲基化的核苷酸时,一种限制性内切酶可以切割,另一种则不能。例如HpaⅡ和MspⅠ的识别顺序都是5’……GCGG……3’,如果其中有5’-甲基胞嘧啶,则只有HpaⅡ能够切割。这些有相同切点的酶称为同切酶或异源同工酶(isoschizomer)。
第三类限制性内切酶也有专一的识别顺序,但不是对称的回文顺序。它在识别顺序旁边几个核苷酸对的固定位置上切割双链。但这几个核苷酸对则是任意的。因此,这种限制性内切酶切割后产生的一定长度DNA片段,具有各种单链末端。这对于克隆基因或克隆DNA片段没有多大用处。
二、甲基化酶
细胞的限制-修饰系统中的修饰作用是由甲基化酶(methylase)来完成的。甲基化酶同限制性内切酶具有完全相同的识别顺序。甲基化酶使识别顺序中的某个碱基发生甲基化,保护DNA不被限制性内切酶切开。
真核生物中目前只发现5-甲基胞嘧啶(M5C)。M5C占整个胞嘧啶中的2~7%(果蝇和某些昆虫例外)。M5C大多以M5CpG的形式存在,不同物种或同一物种的不同组织中,M5C出现的频率也不尽相同。目前已经纯化作为商品出售的甲基化酶见表23-2。
将限制性内切酶和甲基化酶同时作用,可使有几种可能识别顺序的限制性内切酶只对其中一种识别顺序有效。例如限制性内切酶AvaⅠ的识别顺序是:
5’……CPyCGPuG……3’
3’……GPuGCPyC……5’
Py可以是任何一种嘧啶,pu可以是任何一种嘌呤。因此可以有4种识别顺序。如果同时使用甲基化酶TaqⅠ和甲基化酶HpaⅡ,则AvaⅠ的识别顺序将只是5’……CCCGAG……3’。现用图解说明(图23-1)。
如果有一个DNA片段,有AvaⅠ的3个识别顺序,当用AvaⅠ处理后可得4个片段。可是,如果先用TaqⅠ甲基化酶和HpaⅡ甲基化酶使DNA顺序中的有些碱基甲基化,然后再用AvaⅠ去切,结果只有1个识别顺序可被AvaⅠ作用,只产生2个DNA片段。

图23-1 几种限制性内切酶和甲基化的碱基
表23-2 甲基化酶及甲基化的碱基
| 甲基化酶名称 | 甲基化的碱基 |
| AluⅠ | 5’……AGC*T……3’ |
| BamHⅠ | 5’……GGATC*C……3’ |
| ClaⅠ | 5’……ATCGA*T……3’ |
| damⅠ | 5’……GA*TC……3’ |
| EcoRⅠ | 5’……GAA*TTC……3’ |
| HaeⅢ | 5’……GCC*C……3’ |
| HhaⅠ | 5’……GC*GC……3’ |
| HpaⅡ | 5’……CC*GC……3’ |
| HphⅠ | 5’……TC*ACC……3’ |
| MspⅠ | 5’……C*CGG……3’ |
| PstⅠ | 5’……CTGCA*C……3’ |
| TaqⅠ | 5’……TCGA*……3’ |
*表示甲基化
三、分子克隆化的另一些酶
(一)DNA聚合酶
(DNa polymerase)的作用是将1个脱氧三磷酸核苷酸加到引物(primer)的3’-OH上,释放出一个焦磷酸分子(ppi),如下式表示。
![]()
聚合酶主要有以下几种:
1.大肠杆菌DNA聚合酶Ⅰ大肠杆菌DNA聚合酶(E.ColiDNA polymerase)主要有3种作用:①5’→3’的聚合作用。但不是复制染色体而是修补DNA,填补DNA上的空隙或是切除RNA引物后留下的空隙。②3’→5’的外切酶活性。消除在聚合作用中掺入的错误核苷酸。③5’→3’外切酶活性。切除受损伤的DNA。它在切口平移(nick translation)中的应用,将在下面介绍。
大肠杆菌DNA聚合酶Ⅰ的Klenow片段是完整的DNA聚合酶Ⅰ的一个片段,只有在5’→3聚合酶活性和3’→5’外切酶活性,失去了5’→3外切酶活性。它可用于填补DNA单链末端成为双链。如果供给32P标记的三磷酸核苷酸,则可使DNA带上同位素标记。当用交错切割的限制酶切成带有单链粘性末端的DNA片段,要用被切成平头末端的DNA片段连接时,可以先用Klenow片段使粘性末端的单链补齐成为平头,然后在DNA连接酶作用下把两个DNA片段连接起来。
另外还有大肠杆菌DNA聚合酶Ⅱ和大肠杆菌DNA聚合酶Ⅲ。前者不能利用单链DNA或poly(dA-dT)为模板。需有镁离子和dNTP时才能表现出酶活性,无自发合成DNA的作用。后者没有5’→3外切酶活性,也不能用单链DNA作为模板。
2.噬菌体DNA聚合酶这里以T4DNA聚合酶为例。它也具有5’→3聚合酶活性,但它的外切酶活性比大肠杆菌的要高200倍。因此,它也可用来补齐单链末端或标记同位素。
(二)RNA聚合酶
RNA聚合酶(RNapolymerase)的作用是转录RNA。有的RNA聚合酶有比较复杂的亚基结构。如大肠杆菌RNA聚合酶有四条多肽链,另有一个促进新RNA分子合成的σ因子,因此它的组成的是α2ββσ。这种结构称为全酶(holoenzyme),除去了σ因子的酶称为核心酶。噬菌体RNA聚合酶则没有亚基。
真核生物的RNA聚合酶分三类。RNA聚合酶Ⅰ存在于核仁中,转录rRNA顺序。RNA聚合酶Ⅱ存在于核质中,转录大多数基因,需要“TATA”框。RNA聚合酶Ⅲ存在于核质中,转录很少几种基因如tRNA基因如5SrRNA基因。有些重复顺序如Alu顺序可能也由这种酶转录。上面提到的“TATA”框又称Goldberg –Hogness顺序,是RNA聚合酶Ⅱ的接触点,是这种酶的转录单位所特有的。它在真核生物的转录基因的5’端一侧,在转录起点上游20至30个核苷酸之间有一段富含AT的顺序。如以转录起始点为0,则在-33到27个核苷酸与-27至21核苷酸之间,有一个“TATA”框。一般是7个核苷酸。RNA聚合酶Ⅱ转录单位的典型结构如图23-2。原核生物中也类似“TATA”框的结构。RNA聚合酶作用在“TATAAT”(Pribnow)盒和“TTGA-CA”框附近。

图23-2 反转录酶的作用机理
(三)反转录酶
反转录酶(Reverse transcripatase)是以RNA为模板指导三磷酸脱氧核苷酸合成互补DNA(cDNA)的酶。哺乳类C型病毒的反转录酶和鼠类B型病毒的反转录酶都是一条多肽链。鸟类RNA病毒的反转录酶则由两上亚基结构。真核生物中也都分离出具有不同结构的反转录酶。这种酶需要镁离子或锰离子作为辅助因子,当以mRNA为模板时,先合成单链DNA(ssDNA),再在反转录酶和DNA聚合酶Ⅰ作用下,以单链DNA为模板合成“发夹”型的双链DNA(dsDNA),再由核酸酶S1切成二条单链的双链DNA。因此,反转录酶可用来把任何基因的mRNA反转录成cDNA拷贝,然后可大量扩增插入载体后的cDNA。也可用来标记cDNA作为放射性的分子探针。
(四)核酸外切酶
大肠杆菌核酸外切酶Ⅲ(exonucleaseⅢ)是从带3’-OH末端的双链DNA,按3’→5’方向切除5’单核苷酸:

大肠杆菌核酸外切酶Ⅶ则是从单链DNA的3’端和5’端切除寡核苷酸(两种形式):
(1)(2)


前一种酶需要镁离子作辅助因子才有活性;后一种酶则不需镁离子,因此即使在有螯合剂EDTA的情况下也有活性。另一种从噬菌体λ感染的大肠杆菌中提取的λ核酸外切酶是从带有5’磷酸末端的双链DNA上,逐个切除5’单核苷酸,在反应时需要镁离子:

(五)核酸酶S1
核酸酶S1(nucleaseS1)主要是降解单链DNA或单链RNA。对单链DNA的活性更高。它的用途是切除DNA片段的单链末端使之成为平头末端,切开合成dscDNA时形成的“发夹”环以及分析DNA-RNA杂合子的结构。
(六)DNA酶
DNA酶Ⅰ(DNaseⅠ)是随机水解双链或单链DNA的一种内切酶,使DNA分子降解成带有5’磷酸末端的单核苷酸和寡核苷酸的混合物:

在进行重组DNA研究时,必须注意防止DNA酶的污染,否则制备的DNA样品将会降解。因此器皿或试剂高温处理,样品中加EDTA,或放置冰上以破坏或抑制酶活性。
(七)RNA酶
RNA酶A(ribonuclease A)作用于嘧啶核苷酸的3’磷酸根上,切开与相邻核苷酸连接的5’磷酸键。另一种RNA酶T1只作用于鸟嘌呤核苷酸的3’磷酸根,切开与相邻核苷酸连接的5’磷酸键。人体的分泌物如唾液,汗液中都含有RNA酶。因此在操作RNA样品时,必须戴手套,实验用的玻璃器皿都要经250℃烘烤4h(RNA酶耐热),或用RNA酶的抑制剂处理。
(八)连接酶
最常用的是T4DNA连接酶(T4DNa ligase),催化双链DNA中相邻的3’OH与5’磷酸根之间形成磷酸二酯键,它可用来连接具有粘性末端的两个DNA片段,或连接两个平头末端的DNA片段,使之成为一个重组DNA分子。可是这种酶只能连接双链DNA而不能连接单链DNA分子。T4RNA连接酶则可在单链DNA分子或RNA分子的5’磷酸根和3’-OH之间催化生成共价键。
(九)末端转移酶
末端脱氧核苷酸转移酶(terminal deoxynucleotidetransferase)的作用是将脱氧核苷酸加到DNA分子的3’-OH末端。
(十)碱性磷酸酶
从DNA或RNA的三磷酸脱氧核糖核苷酸或三磷酸核糖核苷酸上除5’-磷酸根残基。一般的用途是用这种酶处理DNA或RNA后,在5’端上标记32P。在经限制性内切酶酶切DNA片段后,用碱性磷酸酶(alkaline phosphatase)处理可以阻止酶切的片段自身连接,这在克隆DNA片段时特别有用。
第二节 分子克隆载体
载体(vector)是指运载外源DNA有效进入受体细胞内的工具。载体同外源DNA在体外重组成DNA重组分子,在进入受体后形成一个复制子,即形成在细胞内能独自进行自我复制的遗传因子。因此,作为载体应该满足以下几方面的要求:①有某种限制酶的一个切点,最好是有许多种限制酶的切点,而且每种酶的切点只有一个;②外源DNA插入后不影响载体在受体细胞中进行自我复制,载体应对受体细胞无害,以及载体能接纳尽可能大的外源DNA片段;③有利于选择的标记基因,可以很方便地知道外源DNA已经插入,以及把接受了载体的受体细胞选出;④具有促进外源DNA表达的调控区。
重组DNA技术中最常用的载体有质粒、噬菌体λ,柯斯质粒(cosmid)和噬菌体M13。它们的受体细胞都是大肠杆菌。这四种载体的大小和结构尽管各不相同,但它们的共同特点是:①都能在大肠杆菌中自主复制,而且能连同所带的外源DNA一起复制;②都很容易同细菌DNA分开并加以纯化;③都有一段DNA对于它们自身在细菌中的增殖不是必需的。因此,外源DNA可以插入这一段DNA中,或是置换这一段DNA而不影响载体的复制。根据这一特点,载体又可分成插入型和置换型两大类。
一、质粒
质粒(plasmid)是许多种细菌中发现的染色体外的遗传因子,它是闭合环状的双链DNA分子,大小从1kb直到200kb以上。质粒所带的基因通常有利于宿主细胞。例如基因的产物是某些抗生素或对某些抗生素的抗性、能降解某些复杂的有机化合物、产生大肠杆菌素和肠毒素、产生限制酶或修饰酶等。
在天然条件下,许多种质粒是通过类似于细菌接合的过程传递给新的宿主。在实验室条件下,质粒则可通过转化过程进入受体细胞。此时,受体细胞已经过处理而处于感受态,即它的细胞暂时易于让小的DNA分子透过。受体细胞由于质粒的进入而产生了新的表型。如对某种抗生素的抗性,这样就可用这种抗生素作为选择条件,选出被质粒转化的受体细胞。
质粒复制时利用宿主细胞复制自身染色体的同一组酶系。有些质粒处于“严紧控制”之下,即它们的复制是同宿主细胞的复制偶联同步的。因此在每个细胞中的质粒只有一份拷贝,或最多只有几份拷贝。这称为“严紧型”质粒。另一些质粒则是处于“松弛控制”之下的“松弛型”质粒。每个细菌中可以有10~200份拷贝。更重要的是松弛型质粒的拷贝数,可因宿主细胞停止合成蛋白质而增加至几千份。宿主细胞不合成蛋白质时,染色体和严紧型质粒的复制都中止。但松弛型质粒仍继续进行复制。因此在增殖松弛型质粒时,总是要让宿主菌经氯霉素处理(在培养液中加入适量的氯霉素)抑制蛋白质的合成。

图23-3 pBR322的基本结构
(一)大肠杆菌质粒
应用的最广泛的质粒载体是pBR322,它属松弛型质粒,有抗氨苄青霉素和抗四环素两个抗性基因可作为标记基因,有许多种常用的限制酶的切点。它全长4352个核苷酸,排列顺序已全部测定,基本结构如图23-3。
当需要用pBR322来克隆BamHI酶切的一个DNA片段时,一般的做法是如图23-4所示。

图23-4 pBR322克隆DNA片段的程序
从图23-4可见,外源DNA片段同pBR322都经Bam HⅠ酶切,所以有相同的单链“粘性末端”,通过DNA连接酶可以构成重组DNA分子。由于pBR322的BamHⅠ酶切点在四环素的抗性基因中,所以Bam HⅠ酶切后使这个抗性基因失活。如果酶切后的质粒pBR322自身又重新连接,则恢复对四环素的抗性,转化子就仍然具有对二种抗生素的抗性。如果pBR322中插入外源DNA,则转化子失去了四环素抗性表型,而只有对氨苄青霉素的抗性,这样就可根据转化子的抗性而把重组质粒转化的细菌选出,然后扩增细菌,大量回收质粒DNA,从而达到大量扩增外源DNA的目的。
(二)真核生物中的质粒
真核生物中的酵母是国内外广泛研究的载体-受体系统之一。这是一个共价闭环DNA分子(cccDNA),平均周长2μm,所以称为2μm DNA质粒,在每个酵母细胞里约有100个拷贝。已有人把2μm DNA同pBR322 DNA构建成双功能质粒,可在大肠杆菌和酵母菌中复制。这种质粒带有啤酒酵母的二个基因(his 3和Leu 2),所以很容易用酵母的营养缺陷型菌株来选出。
二、噬菌体和病毒载体
噬菌体λ是最主要的一种载体。自从1974年以来,已用野生型λ改造和构建出一系列噬菌体载体。
噬菌体λ是温和噬菌体。基因组是长约50kb的双链DNA分子。在噬菌体λ颗粒中,DNA是线状双链分子带有单链的互补末端。末端长12个核苷酸,这称为粘性末端,简写COS。当噬菌体感染宿主细胞后,双链DNA分子通过COS而成环状。在感染早期,环状DNA分子进行转录。在此期间,噬菌体有两条复制途径可供选择:一是裂解生长。环状DNA分子在宿主细胞里复制若干次,合成了大量的噬菌体基因产物,形成子代噬菌体颗粒,成熟后使细菌裂解,释放出许多新的有感染能力的病毒颗粒。另一是溶源性生长。噬菌体DNA整合进宿主菌的基因组,然后象细菌染色体上的基因一样进行复制,并传递给下一代细菌。
(一)噬菌体λ载体的构建
野生型噬菌体λDNA全长约50kb,上有65种限制酶酶切点,除ApaⅠ、NaeⅠ、NarⅠ、NheⅠ、Sna BⅠ、XbaⅠ和XhoⅠ等7种限制酶各有一个切点外,其余都多于2个。有些酶切点在λ增殖所必需的基因区域内。因此,噬菌体λ必须经过改造才能用作载体。现在用的λ载体大都除去了某种限制酶的酶切点。因此,作为载体的噬菌体λ都短于野生型。
噬菌体λ载体有两种类型:①插入型。由于改建后的噬菌体λDNA都短于野生型,所以可插入外源DNA。只要插入的位置不影响噬菌体增殖。而且噬菌体DNA缺失越长,插入片段就可越大。②置换型。噬菌体λ的基因组可分为三个区域,左侧区包括使噬菌体DNA成为一个成熟的、有外壳的病毒颗粒所需的全部基因,全长约20kb。右侧区内包含所有的调控因子、与DNA复制及裂解宿主菌有关的基因,这个区域约长12kb。中间区域约长18kb,这一段DNA可以被外源置换而不会影响噬菌体λ裂解生长的能力。置换型噬菌体λ是使用最广泛的载体。
噬菌体λ裂解生长的能力同包装在头蛋白中的λDNA的大小有关。当DNA的长度短于野生型的78%或超过105%时,噬菌体的活性就急剧下降。因此要求λ载体DNA和外源DNA长度之和在39~53kb之间。
置换型载体DNA用选定的限制酶完全酶切后,要设法除去中间片段,只留下左臂和右臂以便用外源DNA片段连接,包装成重组噬噬体。这是因为左臂和右臂与中间片段间都有单链“粘性末端”,在连接酶作用下可以重新恢复原来的结构,从而影响了同外源DNA的连接。区分重组噬菌体形成的噬菌斑和重新恢复的载体噬菌体形成的噬菌斑的方法是用Xgal蓝色噬菌斑试验。有些噬菌体载体的中间片段带有编码β半乳糖苷酸的基因。当这种噬菌体感染lac宿主细胞并在含有Xgal(5溴4氯3吲哚βD半乳糖苷)的培养基上生长时,半乳糖苷酸与Xgal反应的产物为不溶性的靛蓝染料。因此,含有中间片段的重新恢复的噬菌体形成蓝色噬菌斑;而同外源DNA连接的重组噬菌体形成的噬菌斑是无色透明的。
(二)单链噬菌体载体
最常用的单链噬菌体载体是M13和它的改建噬菌体。M13是丝状噬菌体,有长约6500个核苷酸的闭环DNA基因组。M13附着在大肠杆菌的F性菌毛上,所以它们只能感染雄性细菌,即F’或Hfr细菌。当噬菌体进入细菌细胞后,单链的噬菌体DNA转变成双链复制型(RF)。从细胞中分离的RF可用作克隆双链DNA的载体。当每个细菌细胞里积聚了200到300份RF型拷贝时,M13开始不对称的合成,即只大量合成DNA双链中的一条链。单链DNA掺入成熟的噬菌体颗粒,颗粒不断地从感染细胞上芽生。M13感染虽不杀死细胞,但细胞的生长受到一定的抑制,所以形成混浊的噬菌斑。
M13的基因组中除有一段507个核苷酸,其余都含有与其复制有关的遗传信息。因此,只有在这一段中可插入外源DNA而不致影响噬菌体的活性。用M13作为分子克隆载体的优点是从细菌中释放出来的噬菌体颗粒只含单链DNA,其中包含了克隆DNA片段的二条互补链中的一条,因此可用来作为对DNA测序的模板。另外,可用来产生单链的DNA探针以选择和分离互补的RNA。M13的RF型是双链DNA,便于限制酶的识别和切割,克隆进双链的外源DNA。从细菌培养液中大量抽取单链DNA。问题是插入M13的外源DNA超1000bp时就不稳定,在噬菌体增殖时会出现缺失。一般说,插入300~400bp是相当稳定的。
(三)猴病毒40(SV40)
猴病毒40(SV40)的基因组常用来作为克隆载体,把外源DNA转入哺乳类细胞。猴病毒40是球形动物病毒,直径40nm,呈20面体,有一个共价闭环的双链DNA基因组,全长5244bp。它在猴肾中增殖。被SV40感染的细胞都会出现SV40的T抗原。早已证明完整的小鼠染色体β珠蛋白基因(包括所有的间插顺序和两侧顺序)整合在SV40中后,在被感染的猴肾细胞中都能正确地转录和翻译。表明猴肾细胞的拼接系统能有效地处理小鼠β珠蛋白的初级转录本。
可是,SV40作为克隆载体有其局限性:①SV40基因组的晚期功能区的裂解性,不利于外源DNA的重组和表达;②早期功能区与病毒的致癌性有关,使用时有顾虑;③重组DNA片段的大小受体限制。
(四)逆转录病毒
逆转录病毒是RNA病毒,它有三个基因:gag-编码病毒的核心蛋白;pol-编码逆转录酶;env-编码病毒的被膜糖蛋白。有的逆转录病毒还带有癌基因(vonc),即有的逆转录病毒有致癌作用。近年来,已设计构建成一些缺陷型病毒(defective virus)使逆转录病毒成为有用的基因载体,成功地把抗药性基因转入了人体造血前体细胞,并在细胞中表达。Hock等选用了缺失编码病毒外壳蛋白基因的逆转录病毒,因此不能合成自身的外壳,但它有识别外壳蛋白进行包装的信号(一段尚未鉴定的DNA顺序)。用这种缺陷的逆转录病毒去感染某种细胞株,这种细胞株包含有辅助病毒(helpervirus)。辅助病毒能合成蛋白外壳,但缺失了识别蛋白外壳进行包装的信号,因此它不能包装成病毒颗粒。当用逆转录病毒感染细胞株后,逆转录病毒的RNA进入辅助病毒的外壳蛋白,成为病毒颗粒。这时把受感染的细胞同骨髓细胞一起培养,包装在辅助病毒外壳蛋白中的逆转录病毒RNA,进入骨髓细胞,病毒DNA插入宿主细胞基因组,基因的活性得到表达。这时,由于骨髓细胞里面没有辅助病毒,所以整合进宿主基因组的逆转录病毒,不再有外壳蛋白可供包装,因此也就无法增殖,而只能被“陷”在宿主基因组中,通过细胞分裂而传给下一代子细胞。
三、柯斯质粒
1978年Collins和Hohn构建一种新型的大肠杆菌克隆载体,命名为cosmid(柯斯质粒)。它是用正常的质粒同噬菌体λ的cos位点构成。例如,柯斯质粒pHC79系由质粒pBR322和噬菌体λ的cos位点的一段DNA构成(图23-5),全长43.kb。在包装时,cos位点打开而产生噬菌体λ的粘性末端。由于pHC79有pBR322DNA,所以也就有氨苄青霉素抗性和四环素抗性两个标记。图23-5说明了克隆基因时有用的限制酶切点。所以可以说柯斯质粒是一类特殊的重组质粒。

图23-5 柯斯质粒pHC79
设计构建的柯斯质粒一般长4~6kb。其上的cos位点的一个重要作用是识别噬菌体的外壳蛋白。凡具有cos位点的任何DNA分子只要在长度相当于噬菌体基因组,就可以同外壳蛋白结合而被包装成类似噬菌体λ的颗粒。因此,插入柯斯质粒的外源DNA可大于40kb。重组的柯斯质粒可象噬菌体λ一样感染大肠杆菌,并在细菌细胞中复制。如把宿主菌在含氯霉素的培养基中生长,柯斯质粒可以扩增到宿主细胞DNA总量的50%左右。
采用柯斯质粒作载体的困难是:①载体自身只相当于可以插入片段的1/10左右,因此往往会出现载体同载体自身连接,结果在一个重组分子内可有几个柯斯质粒载体连在一起。但用碱性磷酸酶处理,可阻止载体分子自身连接;②大小不等的外源片段相互连接后插入同一个载体分子,结果使在基因组内本来不是相邻的片段错乱地连接成一个片段,会影响实验结果的分析,后来专门选出30~45kb的外源DNA插入载体DNA,此时,每个载体只可能插入一个外源片段,因为如果二处片段,则将超过包装成噬菌体颗粒的限度;③细菌的菌落体积远大于噬菌斑,因此如用柯斯质粒制备基因文库,则筛选所需的含某一DNA片段的菌落很费时间。现虽建立了高密度菌落筛选法,但由于柯斯质粒制成的基因文库常常不太稳定,插入的大片段外源DNA有可能通过同宿主基因组交换而致丢失等,所以最常使用的还是噬菌体载体。
现将上面提到的四种载体作一比较(表23-3)
表23-3 四种载体的比较
| 质粒 | λ噬菌体 | 柯斯质粒 | 单链噬菌体 | |
| 克隆DNA大片段 | ±* | + | + | - |
| 构建基因组文库 | - | + | + | - |
| 构建cDNA文库 | + | - | - | - |
| 常规的亚克隆化 | + | - | - | - |
| 构建新型的DNA结构 | + | - | - | - |
| 序列分析 | + | - | - | + |
| 单链探针 | +** | - | - | + |
| 外源基因在大肠杆菌中的表达 | + | - | - | - |
* 外源DNA如超过10kb,则重组质粒的转化率和DNA得率都非常低
** 已有个别质料可用于此目的
四、其他载体
现在提到的分子载体有的不是用于克隆某基因,而是作为外源基因进入受体细胞的运载工具。
(一)转座子载体
这里主要提一下有关果蝇转座因子(P因子)作为基因载体。因为这是很有希望的真核生物基因工程的载体,果蝇的P因子约长3kb,每端各有反向重复顺序,当它插入基因组时,可以激活或灭活近旁的基因,当它从基因组上切下来时,也可能把近旁的基因或DNA顺序一起切下而引起突变。现在已能把带有某种限制酶切点的P因子克隆到质粒pBR322中,然后在P因子酶切点上插入外源DNA。经过扩增后,将这种重组DNA用微量注射仪直接注入果蝇的受精卵中。结果所克隆的基因能随P因子插入受体细胞的基因里,并且得到表达。
(二)人工微小染色体
包括人体在内的高等生物基因工程中遇到的一个难题是缺乏合适的基因载体。要求载体对受体细胞没有危害,能安全、稳定地转给后代,使基因的性状得到连续的表达。这对校正某种遗传缺陷或改进某种性状都是十分有用的。目前一些实验室正致力于构建人工微小染色体(microchromosome)。
构建染色体应包括:基因、复制起点、着丝粒和端粒。染色体上需带有基因是不言而喻的。复制起点是染色体复制所不可缺少的。着丝粒保证复制后的染色体均等地分配到两个子细胞中。端粒具有某种特定结构以保证染色体的个体性。
首先,构建的是酵母的人工微小染色体。天然的酵母染色体为150~1000kb。人工构建的微小染色体长55kb,在细胞内很稳定,只是每个细胞里的拷贝数很少。比如已构成的人工微小染色体为7~15kb,每个细胞里的拷贝数虽然增多,但不够稳定。
人工构建酵母微小染色体的具体步骤见图23-6。从图中可以看到,先用质粒pBR322为材料,连接酵母的标记基因Leu2(亮氨酸)后去转化大肠杆菌,然后再接上酵母染色体上分离得到的着丝粒CEN3,再去转化大肠杆菌以增殖重组质粒,取得下一步实验用的DNA。接下去是连接从酵母(真核生物)中分离得到的ARS1。ARS是指自主复制顺序(autonomouslyreplicat-ing sequence),这个顺序中可能包含着复制起点。目前已从非洲爪蟾的线粒DNA,衣藻和烟草叶绿体和核DNA中分离ARS。最后一个步骤是接上染色体端粒。用的是四膜虫(Te-trahymena)的rDNA末端(Tr末端)。这样构建成的质粒去转化酵母细胞后,在细胞内断开成为线状重组DNA分子,可以象天然染色体一样地复制和分离,这就是酵母线状质粒YLp4。

图23-6 构建酵母人工微小染色体的步骤
第三节 DNA重组实验中常用的技术
一、质粒DNA的提取及鉴定
(一)质粒DNA的提取及鉴定
1.
(1)将2ml含相应抗生素的LB液体培养基加入到通气良好的15ml的试管中,接入一单菌落,于37℃剧烈振荡培养过夜。
(2)将1.5ml培养物倒入1.5ml离心管中,用台式离心机于4℃以12000g离心5min,将剩余的培养物贮存于4℃。
(3)吸尽培养液,使细菌沉淀尽可能干燥。
2.碱裂解法小量抽提质粒
(1)将细菌沉淀[上述步骤(3)所得]重悬于100μl预冷的溶液Ⅰ(50mmol/L葡萄糖,25mmol/lTris –HCl pH8.0, 10mmol/L EDTA)中,剧烈振荡。
(2)加200μl新配制的溶液Ⅱ(0.2mol/l NaOH, 1%SDS),缓和振荡,水浴5min。
(3)加150μl预冷溶液Ⅲ(50mol/L KAC 60ml, 冰乙酸11.5ml,水28.5ml),缓和振荡,冰浴5min。
(4)4℃以12000g离心5min,将上清转移到另一离心管中。
(5)可作不可作:加等量饱和酚,氯仿,振荡混匀,重复2,(4)。
(6)用2倍体积无水乙醇室温沉淀双链DNA,振荡混合,于室温放置2min。
(7)4℃以12000g离心5min。
(8)小心吸尽上清液,将离心管倒置于一张纸巾上,再将附于管壁的液滴除尽。
(9)用75%乙醇于4℃洗涤DNA,同上离心去上清真空抽干。
(10)加50μl的1×TE(含20μg/ml无DNA酶的胰RNA酶),振荡,贮存于-20℃。
(二)质粒DNA的大量制备
(1)同上1.(1)
(2)将1ml含菌液倒入含相应抗生素的Lb 100ml中,37℃振荡培养至A590=1.0(5~6h)。
(3)加氯霉素(170μg/ml)扩增,37℃温箱中培养过夜。
(4)收集菌液于离心管中,冰浴10min。3000rpm,离心10min,去上清。
(5)加溶液Ⅰ5ml悬浮菌体,将悬液倒入高速离心管中,摇匀,冰浴5min。
(6)加溶液Ⅱ10ml轻轻混匀,室温下5min。
(7)加溶液Ⅲ7.5ml轻轻混匀,冰浴30min。15000rpm,4℃离心20min。
(8)取上清液于高速离心管中,加2倍体积的无水乙醇,混匀,入-20℃3~5h。
(9)15000rpm4℃ 离心20min。
(10)弃上清,将离心管倒放入真空泵中抽干(10~15min)。
(11)用5ml1×TE溶解,加入RNase A 15~20μl,42℃水浴4h于过夜。
(12)加入5ml饱和酚,混匀,4000~5000rpm离心5min,取上清液入5ml离心管内。
(13)分别加入2.5ml饱和酚,2.5ml氯仿,混匀后同样离心收集上清。
(14)加等体积氯仿/异戊醇(24:1)混匀,同样离心收集上清。
(15)加入1/10体积的3mol/l NaAc及2倍体积的无水乙醇于-20℃3~5h。
(16)10000rpm4℃离心20min。
(17)弃上清,加入75%乙醇洗涤2次。
(18)离心弃上清,真空抽干,加入适量1×TE溶解质粒DNA。
(三)质粒DNA的鉴定
1.酶切反应
(1)在0.5mlEppendorf管中加重蒸水6μl,10×Buffer1μl,DNA 2μl,酶1μl,混匀,37℃水浴1h以上。
(2)取反应物点样,观察酶切效果。
(3)酶切完全后,70℃5min终止反应。
2.琼脂糖电泳
(1)配制所需浓度琼脂糖凝胶。
(2)在待测的DNA样品中加1/5体积的溴酚蓝指示剂,混匀后点样。
(3)打开电源开关,5V/cm电泳。
(4)在UV灯下观察电泳结果。
二、DNA的重组
(一)DNA的酶切与连接
(1)酶切反应
同质粒DNA的鉴定,只不过是质粒DNA换为载体DNA。若大量酶切,则成比例增加。
(2)加2倍体积的预冷无水乙醇和1/10体积的3mol/l NaAc混匀,-20℃2h以上。
(3)15000rpm离心15min,弃上清。
(4)加入75%乙醇洗涤2次,离心弃上清,真空抽干。
(5)加入适量1×TE溶解。如此可得线性化载体DNA。
(6)测定DNA的含量。
(7)加入线性载体DNA和含量3~4倍于载体的待插入DNA片段,连接缓冲液及T4连接酶适量至总体积为20μl,在12~14℃反应12~16h。
(8)连接反应液可置-20℃保存,供转化用。
(9)关于待插入DNA片段的获得参见附注。
(二)大肠杆菌感受态的制备及重组DNA的转化
1.感受态的制备
(1)接种单菌落于2mlLB培养液中, 37℃过夜。
(2)取0.25ml过夜菌入25ml LB培养液中,37℃振摇4~6h至A590=0.4~0.6。
(3)倒入50ml管内,水浴10min,以2500~3000rpm离心5min,弃上清。
(4)缓慢加入75mmol/L预冷CaCl25ml悬浮菌体,冰浴20min,同上离心弃上清。
(5)缓慢加入75mmol/L预冷CaCl21.0ml轻轻混匀后分装在1.5ml Eppendorf管中,每管200μl,冰浴1~2h。
2.重组DNA的转化
(1)将3只Eppendorf管按下列转化项目作好标记,然后按下述进行:
| 转化项目 | 受体菌 | DNA | 总体积 |
| DNA对照组 | 10μl | 200μl | |
| 受体菌对照组 | 200μl | 200μl | |
| 转化组 | 190μl | 10μl | 200μl |
(2)冰浴30min至1h。中间摇动3次,以防受体菌沉底。
(3)42℃90s。
(4)37℃水浴5min。
(5)加入无相应抗生素的Lb200μl,混匀后,37℃水浴30~60min。
(6)分别取3组反应物各50μl在含相应抗生素的固体LB培养基平皿上涂布,室温下干燥,然后倒置于37℃温箱中培养过夜。
(三)转化子DNA的快速鉴定-快速细胞破碎法
(1)挑取转化平板上的单菌接种于含相应抗生素的2ml LB中,37℃振荡培养至A590值为0.6~0.8。
(2)取1ml菌液至1.5ml Eppendorf管中,9000rpm离心9min,去尽上清。
(3)加入70μlCracking Gel缓冲液[1mol/L Tris –HCl(pH6.8)10ml,20%SDS10ml, 250mmol/L EDTA 1.6ml,蔗糖27.2g, 1.2%溴酚蓝1.67ml,加双蒸水至200ml],混匀后,37℃水浴30min以上。
(4)15000rpm离心15min。
(5)吸取上清点样电泳,观察。
(四)转化子DNA的酶切鉴定
1.转化子DNA的快速少量抽提
(1)同本节 二.(三).1.
(2)菌液移至5mlEppendorf 管中,9000rpm,离心9min,去上清。
(3)加溶液Ⅰ100μl,溶液Ⅱ200μl,溶液Ⅲ150μl,混匀,冰浴10min。
(4)15000rpm离心15min。
(5)吸取上清,加入异丙醇1ml混匀,置室温15~30min。
(6)15000rpm离心15min,弃上清,加入75%乙醇洗涤2次。
(7)离心弃上清,真空抽干,加入适量1×TE溶解DNA。
(8)取少量DNA电泳,观察浓度。
2.转化子DNA的小量酶切鉴定同质粒DNA的小量酶切鉴定,见本节 一(三)。
(五)重组子DNA的进一步鉴定
可用Southern印迹杂交法或斑点杂交法等进一步鉴定,详见本节 四。
[附]电泳洗脱法回收酶切DNA片段
(1)用合适的酶切割DNA并电泳。
(2)于紫外灯下从凝胶上切下所要的DNA带,装入含1×TBE缓冲液的透析代内,用夹子封好袋口,并检查有无漏孔。
(3)将透析袋(纵长)与两极间的边线垂直放于电泳槽内电泳,4~5V/cm电泳至DNA贴紧袋壁。
(4)取出透析袋,挤出凝胶块,吸出袋内液体放入1.5ml的离心管内,10000rpm离心5min。
(5)吸出上清放入离心管内,加入等体积的饱和酚和等体积的氯仿,振荡混匀,10000rpm离心5min,吸出上清放入新的离心管内。
(6)加入1/10体积的3mol/L AaAc,2倍体积预冷的无水乙醇,于-20℃放置4~5h。
(7)于4℃,10000rpm离心15min,弃上清。
(8)用75%的酒精洗涤2次,每次均于4℃,10000rpm离心5min,弃上清。
(9)真空抽干,并用适量1×TE溶解沉淀。如此即得所需DNA片段。
三、地高辛配基随机标记DNA探针法
(一)概述
基因诊断是以核酸分子杂交技术为基础,在核酸水平检测人类遗传性疾病的基因缺陷和一些传染病病原体的方法。其基本过程是:制备DNA探针,标记探针,检测样本。开展这项工作的关键是要得到高灵敏度、高特异性的探针。以往人们是用放射性同位素来标记探针DNA。近年来,非同位素标记方法发展很快,已有取代同位素标记法的趋势。地高辛配基随机标记DNA探针法,是较为成功的一种非同位素标记方法。其原理是:用化学方法把类固醇类半抗原地高辛分子连接在dUTP上(Dig-dUTP)。用随机引物及DNA多聚酶,以探针DNA为模板,合成互补DNA,化学修饰过的dUTP同时掺入到标记的DNA探针中。杂交后用碱性磷酸酶标记的抗地高辛单抗与标记探针DNA中的Dig-dUTP结合,加入显色底物,在碱性磷酸酶作用下,转变成深棕色或蓝色的化合物。
1.标记 本试剂盒采用随机引物标记方法,可标记少至10ng,多至3μg的DNA。能在新合成的DNA链每20~25个核苷酸,掺入一个Dig-dUTP,反应时间约为1h。
2.杂交 按标准杂交方法进行。可以采用尼龙膜或硝酸纤维素膜。用过的杂交液可冻存于-20℃,重复使用。
3.免疫学检测 封阻后,检测反应的第一步,抗体结合物与标记DNA结合,出现杂交的半抗原-标记DNA,显色反应起始是在碱性pH条件下加入无色的显色剂X-磷酸盐和NBT,在几分钟内便开始出现蓝色,显色反应的过程持续3d。典型的例子是在24h后终止显色反应。用二甲基甲酰胺洗掉尼龙膜上的颜色后,尼龙膜可重新用于杂交。
4.应用 地高辛配基标记DNA探针及检测试剂盒,能检测0.1pg的同源DNA,能检测1μg哺乳动物DAN中的单拷贝基因,与放射性标记系统比较,此试剂盒能快速得到实验结果(从DNA的标记和杂交至见到检测结果24h内能完成),而且消除了放射性的不安全问题。这试剂的灵敏度与特异性使它适用于所有的杂交技术(包括DNA-印迹转移,菌落杂交,噬菌斑杂交及原位杂交)以替代同位素标记和放射自显影术。
(二)试剂盒成份
1.无标记对照DNA1 此管内有20μl pBR328 DNA100μg/ml,pBR328分别用BamHⅠ,BglⅠtHinfⅠ消化,它们的混合比例为2:3:3,共有16个Pbr328片段,这些片段的大小分别为:4907,2176,1766,1230,1033,653,517,453,298,234,234,220和154×2bp。
2.无标记对照DNA2 此管内有20μl pBR328 DNA200μg/ml,已用EcoRⅠ线性化。
3.DNA稀释缓冲液 有两管,每管1ml[成分为:Tris-HCl(10mmol/L),EDTA(1mmol/L),pH8.0(20℃)]内含鲑鱼精DNA(50μg/ml)。
4.标记对照DNA 此管内有50μl线性化pBR328DNA,按标记方法已标记有地高辛配基dUTP,含20μg模板DNA,每毫升含5μg合成的标记DNA。
5.六聚核苷酸混合物
6.标记用混合底物 此管内有50μl10倍浓度的dNTP标记用混合底物,含dATP(1mmol/L)dCTP(1mmol/L),dGTP(1mmol/L),dTTP(0.65mmol/L)和Dig-dUTP(0.35mmol/L),pH6.5(20℃)。
7.DNA聚合酶Ⅰ大片段(标记级) 此管内有25μl DNA聚合酶Ⅰ大片段(Klenow),2U/μl。
8.(Dig)AP结合物 此管内有200μl多克隆羊抗地高辛配基Fab-片段,结合有碱性磷酸酶750U/ml。
9.NBT 有两管,每管1.25ml,是溶于70%(V/V)二甲基甲酰胺的硝基蓝四唑盐溶液(75mg/ml)。
10.X-磷酸盐 有两管,每管0.9ml,是溶于二甲基甲酰胺的5-溴-4-氯-3-吲哚磷酸盐的甲苯胺溶液(50mg/ml)。
11.封阻试剂 有两瓶,每瓶有50g粉剂。
(三)需配制的溶液
EDTA(0.2mol/L),pH8.0(20℃);LiCl(4mol/L);70%(V/V)乙醇;Tris-HCl(10mmol/L);ED-TA(1mmol/L),pH8.0(20℃);10%(V/V)N-十二烷基肌氨酸钠盐;10%(V/V)SDS;20×SSC:3mol/l NaCl;0.3mol/L柠檬酸三钠;pH7.0Tris-HCl(100mmol/L);NaCl(150mmol/L);pH7.5Tris–HCl(100mmol/L);NaCl(100mmol/L);MgCl2(50mmol/L)pH9.5(20℃)。
(四)操作方法
1.标记DNA探针 每次标准的反应可标记10ng至3μg线性的DNA,也可标记更大量的DNA,但所有的成分和体积要相应增加。
(1)DNA探针热变性,煮沸10min,迅速冷却于冰/乙醇中5min以上,待用。
(2)取Eppendorf管(1.5ml)置于冰上,加下列及试剂:
新鲜变性的DNA 1-3μg
六聚核苷酸混合物 2μl(管5)
dNTP标记用混合底物 2μl(管6)
加无菌重蒸水至 19μl
DNA聚合酶Ⅰ大片段(Klenow) 1μl(管7)
(3)在37℃保温至少60min,可到20h。
(4)煮沸5min,终止反应。
(5)15000rpm离心30s,置于冰上待用。
2.预杂交 按100cm2膜用20~40ml预杂交溶液,预杂交时使溶液处于流动状态。
预杂交液组成:5×SSC
0.5%(W/V)封阻试剂(管11)
0.1%(W/V)N-十二烷酰肌氨酸钠
0.02%(W/V)SDS
膜放入塑料袋,灌入预杂交液,排除气体后密封,在65℃预杂交过夜。
3.杂交 按100cm2膜用2.5ml杂交液,杂交时偶尔摇动杂交袋,使里面的溶液重新分配。
杂交液组成: 50%甲酰胺(V/V)
5%(W/V)封阻试剂
5×SSC
0.1(W/V)N-十二烷酰肌氨酸钠
0.02%(W/V)SDS
新变性标记DNA(150ng/ml)
杂交液取代预杂交液,替换间膜不能干,成功地替换应是膜与塑料袋间形成一层杂交液膜。于42℃杂交过夜(16~20h)。
4.洗膜按100cm2膜用250ml洗膜液计算。
(1)在室温下用2×SSC/0.1%(W/V)SDS溶液漂洗,5min,2次。
(2)在65℃条件下用0.1×SSC/0.1%SDS溶液漂洗,10min,2次。
(3)在室温下用2×SSC溶液漂洗1次。
5.免疫测定
(1)配制溶液
缓冲液1:Tris-HCl(100mmol/L);NaCl(150mmol/L)pH7.5(20℃)
缓冲液2:0.5%(W/V)封阻试剂(管11),配制于缓冲液1中(封阻试剂不会快速溶解,因此应预早1h前配制此溶液,将试剂溶于50~70℃,此溶液保持混浊)。
缓冲液3:Tris-HCI(100mmol/L);NaCI(100mmol/L);MgCI2(500mmol/L)pH9.5(20℃)。
缓冲液4:Tris-HCl(10mmol/l);EDTA(1mmol/L);pH8.0(20℃)
显色溶液:新鲜配制,在10ml缓冲液3中,加45μlNBT溶液(管9)和35μlX-磷酸盐缓冲液(管10)。
2. 显色过程
A.膜在缓冲液1中短暂洗涤(1min)。
B.在100ml缓冲2中保温30min。
C.再用缓冲液1短暂洗涤。
D.用缓冲液1稀释的抗体结合物(管8)至150U/L(1:5000);稀释后的抗体结合物在4℃只能稳定12h。
E.膜在20ml稀释的抗体结合物溶液中保温30min。
F.用100ml缓冲液1洗膜,以除去未结合的抗体结合物,15min,2次。
G.膜在缓冲液3中平衡2min。
H.在黑暗条件下,膜与10ml显色溶液放入塑料袋内密封或放入合适的盒子内,几分钟内开始出现颜色,一般显色反应在1天后全部完成。当颜色显影时,不可振荡或搅拌。
I.当要求的点或带已被检测时,可用50ml缓冲液4洗膜5min终止反应。
J.摄相。
说明:上述各反应均在室温下进行,除了显色反应外,均需振荡或搅拌。
(五)排除实验中问题的方法
1.DNA不能有效地被标记时考虑
(1)用酚/氯仿抽提和/或乙醇沉淀,重新纯化DNA。
(2)标记反应的保温时间延长(增至20h)。
(3)DNA变性或许不完全,这时对大片段DNA特别重要。
2.不能达到预期的灵敏度时考虑
(1)DNA标记率。
(2)增加标记DNA的浓度或增加杂交时间。
(3)显色反应的时间可延长至3d。
3.若显色时背景过深,可采取
(1)在杂交溶液中减少标记DNA量。
(2)增加杂交溶液的体积,使膜随意漂浮在溶液中。
(3)某些类型的尼龙膜可能产生深色背景,因此可采用其它类型的尼龙膜或改用硝酸纤维素膜。
(4)在杂交和检测过程中增加封阻试剂的浓度。
四、核酸的分子杂交
核酸分子的固相杂交是将待测核酸样品结合在某种固相支持物上,然后与溶液中的标记探针进行杂交。目前使用最多的固相支持物是硝酸纤维膜。这里重点介绍直接点样技术,转移技术及其它常用的杂交技术。
(一)斑点杂交的直接点样法
斑点杂交或叫打点杂交(dot-blot hybridization),其主要特点是事先不用限制内切酶消化或用凝胶电泳分离核酸样品,操作简便,灵敏度高。一个点样品只含0.25~1pg的DNA也能检测到。但不知道杂交片段的大小(碱基对数)。
1.DNA的打点法(DNa Dot Blot)
(1)膜的处理:戴上干净手套,取出硝酸纤维膜,按需要剪成一定大小,量好各样点间距离,用软铅笔标记。
(2)DNA变性:将DNA溶液于1×TE(pH8.0)缓冲液中或蒸馏水中,取一定量DNA样品加于小塑料管中,在100℃沸水中煮10min,迅速入冰水中。
(3)点样:用塑料或硅化玻璃或微量加样器取1~5μl变性DNA,将滴管放在硝酸纤维膜上,使DNA慢慢吸在滤膜上,点样完后凉干。
(4)固定:将凉干的滤膜夹在滤纸中,于80℃干烤2~3h,然后进行杂交。
2.RNA的打点法(RNa Dot Blot)
(1)膜的处理:同DNA的打点法。
(2)RNA变性:将提取的RNA与50μl 20×SSC/甲醛(30μl20×SSC加20μl甲醛)混合,65℃水浴15min。
(3)点样:同DNA的打点法。
(4)固定:同DNA的打点法。
(二)DNA的吸印转移法(Southern Blot)
DNA经过限制性内切酶消化和凝胶电泳后,放入碱性溶液中使其变性,将变性后的单链DNA从凝胶中按原来位置和顺序用滤纸吸印转移到硝酸纤维膜上,然后再与标记探针杂交。此方法比较准确地保持了特异DNA序列在电泳图谱中的位置,而且能测定分子量。
试剂:变性液:0.5mol/L NaOH, 1.5mol/L NaCl
中和液:1mol/l Tris-HCl, 1.5mol/L NaClpH8.0
20×SSC:0.3mol/L柠檬酸钠,3mol/l NaCl
1.电泳 取DNA约5μg加限制性内切酶进行酶切,电泳鉴定酶切完全后,取酶消化后的DNA点样于0.8%~1.2%的凝胶上,以0.8~1V/cm电压电泳过夜,在溴酚蓝离凝胶前缘0.5cm处停止电泳。将电泳后的凝胶翻转,紫外灯照射10~20min后拍照。
2.变性与中和 将电泳后的凝胶放入变性液中25℃振荡60min。蒸馏水洗胶1min,将凝胶放入中和液中25℃振荡60min。
3.转移 取托盘一只,放入10×SSC溶液约500~1000ml,托盘上搭一块比凝胶稍宽的长方形玻璃,取一长方形Wateman paper(滤纸)搭在桥上,两边浸入10×SSC溶液中,仔细去掉玻璃与滤纸之间的气泡(用玻棒在滤纸上滚动)。将凝胶放在滤纸上,去掉凝胶与滤纸之间的气泡。将硝酸纤维膜放入2×SSC溶液中浸湿后放在凝胶上(如NC膜浸湿不均匀,则考虑更换NC膜,操作时手切勿触及NC膜),去掉凝胶与NC膜之间的气泡。将一张滤纸(长和宽均比NC膜小1mm)放在NC膜上,仔细去掉气泡。将吸水纸切成与滤纸大小,重叠放在滤纸上,再压一重物约500~1000g。转膜24h,中间更换吸水纸。

图23-7 Southern转膜示意图
4.固定用2×SSC溶液洗膜5min去掉残余凝胶,让膜自然凉干。将凝胶放入EB液中30min,取出在UV灯下观察是否有DNA残余。80℃烤膜2h,然后将膜封入塑料袋进行杂交。
(三)RNA的吸印转移法(Northern blot)
在RNA凝胶电泳之前,先用乙二醛等变性剂处理RNA,再在适宜条件下电泳使充分变性的RNA直接吸印到硝酸纤维膜上。固定后除去变性剂,然后进行杂交。
试剂:
乙二醛:4mol/L(约为30%),经过阴阳离子交换树脂纯化,使pH为5.5~6.0
磷酸缓冲液:80mmol/L pH6.5~7.0
磷酸缓冲液:10mmol/L pH6.5~7.0
Tris-HCl:20mmol/L pH7.8
二甲基亚砜:分析纯
20×SSC:0.3mol/L柠檬酸钠,3mol/l NaCl
1.RNA变性 吸取1μl 80mmol/L磷酸缓冲液,1μl RNA样品(最多100μg),2μl,4mol/l 乙二醇,4μl二甲基亚砜。混匀后,50℃水浴1h,然后放入冰中。
2.电泳 变性结束后,加入含有50%甘油的10mmol/L磷酸缓冲液2μl和少量溴酚蓝,混匀后点样于1.0%的凝胶上,以4~5V/cm电压电泳。凝胶电泳液为10mmol/L磷酸缓冲液,pH6.5~7.0。
3.转移 变性处理后的RNA可以转移并结合到硝酸纤维膜上,转移过程和转移变性与DNA相同。
4.固定 用20×SSC转移RNA。膜夹在两层干净滤纸中凉干后,80℃烤膜2h
5.乙二醛附加物消除 RNA膜固定后,放入20mmol/l Tris-HCl中,100℃处理5~10min,去除乙二醛,然后进行杂交。
(四)硝酸纤维膜固相杂交
核酸样品经过直接点样或转移到硝酸纤维膜上,固定后,可以进行杂交反应。在杂交溶液中,硝酸纤维膜上变性的核酸样品和变性后的探针在一定的条件下形成双链杂交核酸分子。然后进行酶标显色。
试剂及操作方法见本节 三。
五、真核细胞基因组DNA的制备
从不同组织细胞或血细胞中提取DNA是进行基因诊断的先决条件。制备DNA的原则是既要将蛋白质、脂类、糖类等物质分离干净,又要保持DNA分子的完整。蛋白酶K的应用使这两个原则得到了保证。在提取DNA的反应体系中,SDS是离子型表面活性剂,主要作用是:(1)溶解膜蛋白而不破坏细胞膜;(2)解聚细胞中的核蛋白;(3)与蛋白质结合,使蛋白质变性而沉淀下来。蛋白酶K可将蛋白降解成小的多肽和氨基酸,使DNA分子尽量完整地分离出来。具体方法如下:
(一)白细胞DNA的制备
(1)采集外周静脉血10ml,加1.7ml ACD(柠檬酸0.48g、柠檬酸钠1.32g、葡萄糖1.47g、加水至100ml,0.6kg/cm2灭菌30min)抗凝。
(2)将血液放入已灭菌的50ml塑料离心管内,加30mlSTMT[0.32mol/L蔗糖、10mmol/lTris-HCl(pH7.5)、5mmol/L MgCl2、1%Triton –X 100],轻轻上下振荡至透明,红细胞完全溶解。
(3)冰浴10min,离心,3000rpm,10min。弃上清,STMT重复处理1~3次。
(4)弃上清,白色沉淀物加10mlSTE[0.1mol/L NaCl、10mmol/l Tris-HCl(pH8.0)、1mmol/L EDTA(pH8.0)],先少量,充分混匀,然后加10mg/ml蛋白酶K100μl,20%SDS30μl,摇匀,置37℃水浴15~20h。
(5)用等体积饱和酚抽提,3000rpm离心5min。
(6)用大口钝缘吸管小心吸取上层水相,加饱和酚和氯仿-异戊醇(24:1)抽提,3000rpm离心5min 。
(7)小心吸取上层水相,用等体积氯仿-异戊醇(24:1),抽提,3000rpm离心5min。
(8)小心吸取上层水相,加入1/10体积3mol/l NaAc,2.5体积预冷无水乙醇混匀,-20℃过夜。
(9)将白色絮状沉淀物用玻璃棒挑出,放入Eppendorf管内,加1ml 75%乙醇4℃静置1h,离心,10000rpm10min。
(10)弃上清,用蜡膜将管口封好,针刺数个小孔,真空抽提(10~15min)。
(11)加200μl1×TE溶解,置4℃保存。
(12)对所提DNA用紫外分光光度计进行定量和纯度检测。
(13)取2~4μl DNA样品,经琼脂糖凝胶(Agarose)电泳,检查所提DNA的质量及降解情况。
(二)组织DNA的制备
(1)将200mg组织在冰浴条件下用消毒剪刀充分剪碎,加4ml 1×RSB缓冲液(10mmol/L Tris, pH7.4;10mmol/lNaCl;25mmol/L EDTA,pH7.4)放入10ml带盖的塑料管中。
(2)加SDS至浓度为1%(可加0.4ml10%SDS),混匀。由于DNA从核中释放出来,样品变得粘稠。
(3)加10mg/ml蛋白酶k 44μl,终浓度为100μl/ml,37℃保温1~3d,直到组织完全解体。中间可振动样品管几次。加0.4ml 5mol/L NaCl。
(4)用等体积饱和酚、1/2体积饱和酚和1/2体积氯仿-异戊醇及等体积氯仿-异戊醇(24:1)各抽提一次,3000rpm离心5min,用大口钝缘吸管小心吸取上层水相。
(5)加2.5倍体积预冷无水乙醇沉淀DNA。用一玻璃棒收集白色纤维丝状的大片段DNA,并移入一新管,吸干DNA中的无水乙醇。
(6)DNA溶于4ml 0.1×SSC中,4℃过夜可作进一步纯化。
(7)加20μlRNase A(10mg/ml),37 ℃保温5h。加0.4ml5mol/L NaCl。
(8)同上法用饱和酚、氯仿-异戊醇抽提,乙醇沉淀离心,弃上清。
(9)75%乙醇洗涤2次,离心,弃上清,真空抽干。适量1×TE溶解,保存在4℃。
六、转移基因
最常用的将克隆重组的DNA片段导入哺乳动物细胞的方法是用磷酸钙介导的转染。转染的DNA可能是通过吞饮作用进入细胞质,然后进行细胞核。
(1)配制下列溶液
①2×HEPES-缓冲盐溶液(HBS)
②2mol/L CaCl2
③0.1×TE(pH8.0)用0.22μm滤器过滤除菌,分装贮存于4℃。
④DNA:将DNA(约20μg/106细胞)溶于0.1×TE(pH8.0),使用浓度为40μg/ml。为使转化效率达到最高,质粒DNA应用CsCl-溴化乙锭密度梯度平衡离心法纯化。如果所用DNA量较少,应加入载体DNA将DNA浓度调至40μg/ml。实验室制备的真核载体DNA转染效率通常要比商品化的牛胸腺DNA、鲑鱼精DNA高。载体DNA用前应通过乙醇沉淀或氯仿抽提进行灭菌。
(2)转染前24h用胰蛋白酶进行消化以获得对数生长期的细胞,以1~2×105细胞/cm2的密度重新种入60mm组织培养皿中。在37℃、5%~7%CO2及一定湿度的培养箱中培养20~24h。
(3)每转染一个60mm培养皿中的单层细胞,须依如下方法制备磷酸钙-DNA共沉淀物:取步骤一所制备的DNA[40μg/ml,溶于0.1×TE(pH8.0)]220μl,2×HBs 250μl,放入一次性使用的灭菌5ml塑料管中,缓慢加入31μl 2mol/l 氯化钙(温和混合30s左右)。于室温育20~30min,其间将形成细小沉淀。温育结束时,用吸管将混合液吹打一次,使沉淀物悬浮。
通常采用的另一方案是将氯化钙和DNA的稀释混合液加入2×HBS溶液中,逐滴加入并小心混合250μl按步骤一制备并溶于氯化钙(250mmol/L)的DNA。按照前述方法温育之。
如果需要转染更为大量的细胞,上述两种反应混合液的体积均可翻一番或翻两番。如果体积翻两番,则须使用更大的塑料管,一般在25cm2细胞培养瓶或60mm细胞培养皿上,可将0.5ml磷酸钙-DNA共沉淀物加入5ml培养液中,而在90mm细胞培养皿上,一般将1ml沉淀物加入10ml培养液中。
已经发表的方案中,混合各组分的方式与速率大不相同。其中有一些认为除了温和振摇之外,其它措施均无济于事,并建议用电动移液装置吹出的空气来混合溶液。其它一些方案则规劝在加入DNA溶液时连续而缓慢地混匀,然后再温和振荡。其目的是为了避免急速形成粗沉淀物,以致降低转化效率。实际上,除了混合的速度之外,还有其它若干因素包括DNA的浓度和大小(让高分子量DNA从细针头中通过,可将之剪切变小)、缓冲液的精确pH(有些工作者配制了几批pH范围从6.95至7.1不等的HBS缓冲液,逐批试验沉淀物的质量及转染效率)。如果必须使转染效率达到最高,就要花时间针对特定的系统优化上述几种因素。一旦得到一批灵验的试剂,只需依照前面方法进行配制和贮存,即可在长期内获得可重复的结果。
(4)将磷酸钙-DNA悬液转移至细胞单层上的培养液中[在60mm培养皿中,可将0.5ml悬液加入5ml培养液中],轻轻左右晃动一下培养皿使培养液得以混合,此时可见培养液成黄橙色浑浊状。另一方法是吸出培养液,直接把沉淀物加到细胞上,将细胞置于室温温育15min,然后再将培养液加回到培养皿中,此时细胞上有许多细小颗粒。采用以上两种方法,都要在37℃、5%~7%CO2及一定湿度的培养箱中将转染细胞培养长达24h[时间的长短取决于后续处理步骤的不同,见步骤(5)]。
(5)然后,转染细胞可依以下任一种方法处理:
①如果不进行其它处理(如用氯喹、甘油或丁酸钠等试剂处理,见后),可在细胞培养16~24h后,吸出培养液和沉淀物,用PBS将单层细胞再洗一次。然后按下述③d操作。
②在许多情况下,同时用氯喹处理细胞,可提高DNA摄入率。氯喹可能是通过抑制溶酶体水解酶类对DNA的降解而起作用的。氯喹浓度及其处理时间不能超越细胞对其毒性作用的耐受能力。因此必须通过预实验来决定适于所用特定型别细胞的最佳氯喹浓度。但对于大部分型别的细胞,用终浓度为100μmol/L的氯喹处理3~5h,都可取得良好效果。可在磷酸钙-DNA共沉淀物加入细胞之前或之后(见步骤(4)介绍的其它方法),直接将氯喹二磷酸贮存液(过滤除菌并贮于-20℃用金属泊密封的管中,100mmol/L)稀释(1:100)于培养液中。在氯喹处理过程中,细胞呈现泡状是正常的。经用DNA和氯喹处理3~5h后,弃去培养液和沉淀,用PBS洗,然后按下述d操作。
③用甘油短暂处理细胞,同样可提高转化效率或导入DNA的瞬时表达水平。这一步骤可以在氯喹处理之后进行。由于不同细胞对甘油的毒性作用的敏感性相差悬殊,因此每种型别的细胞都必须通过预实验决定最佳处理时间(从30s至3min)。耐受甘油的细胞可以暴露于含磷酸钙-DNA共沉淀物(含或不含氯喹)的生长液3~5h后进行休克。
a. 吸出生长液,用PBS将单层细胞洗1次;
b.在单层细胞中加入1.5ml溶于1×HBS的15%甘油,在37℃培养0.5~3min;
c.吸出甘油,用PBS将单层细胞洗1次;
d.加入5ml预加温的完全生长液,放入培养箱中继续培养24~60h后,检测DNA的瞬时表达或将细胞重新种入适当的选择性培养基中,分离稳定的转化体。
④业以表明,丁酸钠也可以在猴源和人源细胞中增强带SV40早期启动子/增强子的重组质粒的表达。可直接在生长液中加入有关试剂,也可以使经过甘油休克的细胞接受丁酸钠处理。须视细胞型别的不同,采用不同浓度的丁酸钠(500mmol/L贮存液,在化学通风橱中用NaOH中和丁酸制备而成),例如:
CV-110mmol/L
NIH-3T3 7mmol/L
HelaS3 5mmol/L
CHO 2mmol/L
不加完全生长液,然后重复步骤d。
(6)转移基因表达和细胞集落形成
①瞬时表达:在转染后48~60h收获细胞,进行RNA或DNA杂交分析。新合成的蛋白质可以用放射免疫测定Western印迹,体内代谢标记-免疫沉淀或者细胞提取液中酶活性的测定等方法来进行分析,如果测定中有重复品或者转染细胞要经过多种不同条件或在一段时间历程以内取不同时间进行处理,就要避免皿与培养皿之间转染效率的偏差。在这些情况下,最好转染大片的单层细胞(90mm培养皿),培养24h后用胰蛋白酶进行消化,再分接到若干较小的培养皿上。
②稳定转化:在非选择性培养基中培养18~24h,使所转移基因得到表达之后,用胰蛋白酶消化细胞,种入适当的选择性培养基中。这种培养基在2~3周内每2~4d须更换1次,以便除去死细胞残骸并使抗性细胞集落得以生长。
可以克隆单个细胞集落,增殖后进行测定。可以用冰预冷的甲醇将仍保留在培养皿内的细胞固定15min,再于室温用10%Giemsa染色15min,最后用自来水冲洗,这样即可得到细胞集落数的永久记录。Giemsa染液可用PBS或水现用现配,并用Whatman 1号滤纸过滤。
重新接种细胞以便取得分隔良好的细胞集落所要求稀释倍数,主要由稳定转化的效率来决定。这一效率可以相差若干个数量级,它起决于:a.受体细胞的型别(即使同一细胞系,克隆不同或传代数不同,也表现出显著差异);b.导入基因的特性及其转录调控信号强弱;c.转染中所用供体DNA的量。
第四节 遗传病与肿瘤的基因诊断
从DNA水平上寻找确诊遗传病的指标或探讨遗传病和肿瘤的病因等方面,已取得很大成绩,这对产前诊断,早期确诊和突变基因携带者的检出等都有重要意义。所用的方法大体有以下几种。
一、分离基因进行结构分析
利用DNA离体转化,制备探针,制备基因文库进行筛检,最后鉴定载体中插入DNA片段的特性等一系列技术,可以设法分离出目的基因或某一特定的DNA顺序。然后通过DNA核苷酸顺序分析可以弄清楚某些疾病的病因。比如,人体癌基因的分离和研究癌基因同原癌基因在DNA的结构与功能上的差别,对了解细胞癌变的机制起了很大的作用。分离目的基因或专一DNA顺序更常用的是制备分子杂交探针,通过Southern印迹杂交或Northern印迹杂交等,了解某些遗传病患者基因结构上的差别,从而找到可靠的诊断方法。比如,患者的基因是否缺失,重排以及是否存在限制性片段长度的多肽现象等。
二、DNA限制性片段多态性连锁分析
DNA限制性片段长度多态性(restricitionfragment length polymorphism, RFLPs)连锁分析法是指由于缺失、重排或碱基置换的结果,使DNA分子中原有的某种限制性内切酶的识别位点发生改变,或是消失或是增加,所以酶切后生成的DNA片段的长度也随之改变。这种DNA限制性片段长度的变化往往同某种疾病的连锁关系,因而可作为这种疾病的诊断指标。
如果所分析的DNA分子不太大,比如人体线粒体DNA,长16569bp。在这种DNA分子上每种限制酶的识别点不过几个到几十个,因此,当某种限制酶的识别点发生改变并经过这种酶切后,可清楚地看到DNA电泳带的图型发生改变,条带或者增加或是减少,条带所处的位置也有变化。可是,遗传病病例分析时所用的是基因组DNA,而基因组DNA从限制酶酶切后至少会生成100万个片段,多的可达1000万个片段。如果其中有一、二个片段发生改变,不可能从电泳凝胶上直接观察分辨。此时就必定要用合适的探针。某个目的基因或某一特定的DNA片段,在同酶切后的DNA作分子杂交后,可在曝光的X线片上看到RFLP。图23-8是用分子杂交法检测RELP示意图。

图23-8 分子印迹杂交法则 RFLPs的示意图
这是通过限制酶A识别点的改变出现DNA的RFLP,再以合适的DNA片段作为分子杂交的探针,在探针上标记了放射性同位素,同分别经酶A,酶B完全酶切的DNA作印迹杂交。在曝光后的X线片上可看到不同的杂交带图型。①是正常个体,经酶A和酶B切后的DNA同探针杂交,都只看到一条带。②是一个杂合子即隐性突变基因携带者的杂交图式,由于它的一条染色体的DNA分子中酶A的识别点发生改变,酶切后的DNA片段较原来的长,所以出现一长一短两个片段。③是突变基因纯合子,也就是患者,酶A和B的酶切片段虽然是各有一个,但A的片段比正常的个体长,所以杂交带出现的位置也有改变。从图23-8可以看出研究RFLP的两个重要因素,一是要制备合适的探针,二是要用尽可能多的各种限制性内切酶进行酶切和杂交。
1974年首次用RFLP作为遗传学分析的方法。1978年简悦威和Dozy等第一次用人体β珠蛋白基因作为探针,同限制酶Hpa Ⅰ酶切的DNA做杂交,发现了DNA的RFLP与镰形细胞贫血之间的关系(表23-4)。
表23-4 DNA的RFLP与镰形细胞贫血的关系
| Hb基因型 | Hpa Ⅰβ珠蛋白基因片段(kb) | 总计 | 13.0kb片段的频率 | ||||
| 7.6/7.6 | 7.6/7.0 | 7.0/13.0 | 7.6/13.0 | 13.0/13.0 | |||
| 黑人AA | 8 | 6 | 2 | 15 | 0.03 | ||
| AS | 5 | 1 | 1 | 9 | 16 | 0.31 | |
| SS | 4 | 11 | 15 | 0.87 | |||
| 白人AA | 12 | 12 | |||||
| 亚洲人AA | 15 | 15 | |||||
由此可以看出,HpaⅠβ珠蛋白基因13.0kb片段可作为检出镰形细胞贫血及携带者的一种指标。1981年Geever等根据镰形细胞贫血是β珠蛋白第6个密码子的一个核苷酸置换的结果,用限制酶DdeⅠ酶切DNA后与β珠蛋白基因杂交。结果是:Hb基因型AA的正常个体有175bp和201bp二条带。SS个体即患者只有一条带,是正常人两个DNA片段长度之和,即376bp。AS杂合子则有三条带:175bp、201bp、376bp。其原因是第6个密码子中的A被T置换,使Hb A变成了HbS。限制酶DdeI的识别顺序为C↓TNAG,当A变成T后,该部位DNA顺序变成CTNTG,从而丢失了一个DdeI识别位点,所以HbA的2个DdeI片段(175bp、201bp)变成了HbS的一个DdeI片段(175+201=376bp)。
除了用基因作探针直接检测基因内的核苷酸变化引起的RFLP外,还有两种途径:一是用基因作探针,检测该基因两侧顺序中核苷酸变化引起的RFLP,确定这些RFLP与遗传病之间有无连锁关系。另一种是用克隆的专一DNA顺序作探针,检测基因两侧顺序DNA的RFLP与遗传病的连锁关系。迄今用上述三种方法已查明近30种遗传病可通过RFLP来检测。表23-5、6、7为部位举例。
表23-5 用基因作探针检测基因内的结构变化来直接分析遗传病
| 遗传病 | 探针 | 年代 |
| 抗凝血酶Ⅲ缺乏症 | 抗凝血酶Ⅲ基因 | 1983 |
| α1抗胰蛋白酶缺乏症 | 合成的寡核苷酸 | 1983 |
| 动脉粥样硬化症 | 载脂蛋白A-基因 | 1983 |
| 糖尿病 | 胰岛素基因 | 1983 |
| Ehlers-Danlos综合症 | α(1)胶原蛋白基因 | 1983 |
| 生长激素缺乏症 | 生长激素基因 | 1981 |
| 乙型血友病 | 凝血因子ⅠⅩ基因 | 1983 |
| 遗传性胎儿血红蛋白持存症 | β珠蛋白基因 | 1979,1983 |
| HPRT缺乏症 | HPRT基因 | 1983 |
| 自毁容貌综合征 | HPRT基因 | 1983 |
| 成骨不全 | 原α1(1)胶原蛋白基因 | 1983 |
| 视网膜母细胞瘤 | Rb基因 | 1983 |
| 镰形细胞贫血 | 合成的寡核苷酸 | 1983 |
| 地中海贫血 | β珠蛋白基因 | 1981 |
| α和β珠蛋白基因 | 1978,1980 | |
| 甲型血友病 | 凝血因子Ⅷ基因 | 1985 |
表23-6 用克隆的DNA片段作探针检测连锁的RFIP间接分析遗传病
| 遗 传 病 | 探 针 | 探针与疾病基因座位间距离(cm)* | 年 代 |
| 脆性X综合征 | PN1,VK21,U6-2 | <5 | 1989 |
| 慢性进行性舞蹈病 | G8 | <10 | 1983 |
| Menkes钢发症 | L1,28 | 16 | 1983 |
| 肌营养不良 | |||
| 良性假肥大型 | XJ和per+87系列 | ?/FONT> | 1983 |
| 假肥大型 | XJ和per+87系列 | ?/FONT> | 1986 |
| 强直性肌营养不良 | 补体C3基因 | 7 | 1983 |
| 类固醇-硫酸酯酶-X链锁甲癣 | λRC8 | 25 | 1983 |
| 视网膜劈裂症(Retinoschisis) | λRC8 | 15 | 1983 |
表23-7 用基因作探针检测紧密连锁的RFLP间接分析遗传病
| 遗传病 | 基因探针 | 年代 |
| 糖尿病(Ⅱ型) | 胰岛素基因 | 1981,1983 |
| 生长激素缺乏症(Ⅰ型) | 生长激素基因 | 1982 |
| 高甘油三酯血症 | 载脂蛋白A-1基因 | 1983 |
| 苯酮尿症 | 苯丙氨酸羟化酶基因 | 1983 |
除了遗传病与RFLP之间的关系的资料,还发现人体癌基因Ha-ras的Bam HI片段的长度可在6.75~8.7kb之间变动。这种RFLP是由于Ha–ras基因有一段可变串联重复顺序(vari-able tandem replication,VTR)。重复顺序长28bp、重复次数可以不同,所以造成BamHⅠ片段的长度变化。图23-9中左图箭头是某种酶的切点,黑框代表可变串联重复顺序。右图代表某种酶切割后,不同个体显示的电泳图谱。1/1、2/2、3/3代表1、2、3等位基因的纯合子;1/2、1/2、2/3代表三种可能的杂合子,由于重复顺序数目不同改变了该酶的切点位置,因而形成不同长度的DNA片段。除Ha-ras癌基因外,成人多囊肾(adult polycystic kidney)基因旁也出现VTR,现已用它作携带者及产前诊断。

图23-9 可变串联重复顺序(VTR)示意图
三、聚合酶链反应
1988年Higuchi等报道,可以从人的单根毛发的毛囊细胞中抽提DNA,并结合运用DNA聚合酶链反应(polymerase chain reaction,PCR)技术,分析了单根毛发细胞中抽提的线粒体DNA的D环区(D-loopregion)的“DNA”指纹图”。
PCR技术由Mullis等首创(详见第二十二章 )。它又称为DNA体外扩增技术,是用DNA聚合酶在体外扩增一段DNA顺序达百万倍以上。这样就可直接观察而不用印迹杂交法。这项技术的基本原理是,将有待扩增的DNA分子加热变性成为单链,然后加入按欲扩增DNA片段两端核苷酸顺序合成的一对引物和耐高温的DNA聚合酶,这样就可以单链DNA分子为模板合成了它的互补链。接着再加热使DNA双链解链。由于这类DNA聚合酶是耐高温的,所以在热变性处理后仍保持酶活性,在有引物分子存在的条件下又继续合成该DNA片段。如此循环往复20~30多个周期,微量的DNA分子可增加10万~100万个拷贝。
这种技术在医学上有很大的用途。先是Saiki等(1985)将其用于镰形表细胞性贫血的快速诊断。继而Chehab等将其用于Barts胎儿水肿综合征的前诊断(缺失纯合型)。我国吴冠芸、曾溢滔、蔡仕萍、张基增等在不同实验室将PCR结合寡核苷酸探针法用于已知点突变的β地中海贫血的产前诊断,并不断简化技术。目前PCR技术已用于许多疾病的诊断及产前诊断(如血友病、假肥大性肌营养不良、α1抗胰蛋白酶缺乏症、艾滋病等)。原则上已知DNA顺序的基因及突变性质的遗传病都可以应用此技术。此外,PCR还可用于直接做DNA顺序分析。
第五节 “DNA指纹”与法医鉴定
1979年Teffreys根据β珠蛋白基因座位近旁出现的RFLP频率同测定的核苷酸总数,推算出人体基因组的遗传异质性约为每100个核苷酸中有一个差异。后在人体DNA随机片段的文库中分离出高度变异的超变区。从1982年起,分别在人的胰岛素基因,α类珠蛋白基因,肌动蛋白基因和C-Ha-ras-1基因中陆续发现了这些超变区。这是一些很短的顺序或称“小卫星顺序”串联重复所组成。不同等位基因的重复数目也不相同。只要用重复顺序内不含切点的限制性内切酶切割,就可产生长度不等的限制性片段。
短的重复顺序分别长16、17、32、33、37、41、62、64和376bp,但这些重复顺序几乎都共有一种“核心顺序”。“核心顺序”长10~15bp。如果人工合成很短的重复顺序作为DNA分子杂交的探针,同经限制性内切酶酶切的人体DNA作Southern印迹杂交,可以得长度不等的杂交带。杂交带的数目的分子量大小几乎不可能有两个人会完全相同的,因此把这种杂交带的图型称为“DNA指纹”(DNafinger-printing),意思是DNA的杂交带型同指纹一样,也是每个人所特有的。
表23-8比较了用两种探针进行印迹杂交后,出现杂交带的长度和数目。根据计算,如果只用一种探针,则A个体DNA所呈现的杂交带型,同样出现在B个体DNA中的概率为3×10-11。如果同时用两种探针进行比较,则两个个体完全相同的概率小于5×10-19。目前全世界人口为50亿,即5×109。因此,两个个体的DNA杂交带型完全相同的可能性极小。
表23-8 随机匹配的个体间“DNA指纹”相同的概率
| 探针 | DNA片段大小(k) | 每一个体中片段出现的数目±SD | A个体中的片段也出现于B个体的概率 |
| A | 10~20 | 2.8±1.0 | 0.11 |
| 6~10 | 5.1±1.3 | 0.18 | |
| 4~6 | 5.9±1.6 | 0.28 | |
| B | 10~20 | 2.9±1.0 | 0.08 |
| 6~10 | 5.1±1.1 | 0.20 | |
| 4~6 | 6.7±1.2 | 0.27 |
1985年Teffreys等将“DNA指纹”应用于法医鉴定。他们从血斑、精斑或新鲜毛发根部抽提微量DNA后作印迹杂交。从4年前的精斑、血斑样品中仍能提取出来未降解的DNA,特别是设计出一些方法可从妇女阴道分泌物中,把混在里面的精子分离出来。从中提取DNA后可明确无误地鉴定谁是精子的供体。为法医鉴定提供一种新的有效方法。
参考文献
1.Drake JW, etal.Updating the theory of mutation. American Scientist, 1983; 71:621
2.Jukes TH, et al. Evolutionarynucleotide replacements in DNA.Nature, 1979;281:605
3.赵寿元.自然科学年鉴.上海翻译出版公司,1987
4.Maniatis T, etal. Moleculer cloning: A laboratory Manual. Cold Sping Harbor Laboratory, 1982
5.Myers RM, et al. Dctection ofsingle base substitutions by ribonuclease cleavage at mismatches in RNA:DNAduplexes. Sicence, 1985;230:1242
6.Mullis K, et al. Specificenzymatic amplificaton of DNAin vitro. The polymerase chain reaction. ColdSpring Harbor Symposia on Qantitative Biol,1986; L1:263
7.金冬雁,等译.分子克隆实验指南.北京:科学出版社,1992
8.孙乃恩,等编著.分子遗传学.南京:南京大学出版社,1993
9.邱泽生,主编.基因工程.北京:首都师范大学出版社,1992
10.张昌颖,主编.核酸生物化学.北京:人民卫生出版社,1993
11.杜传书,刘祖洞,主编.医学遗传学.第二版,北京:人民卫生出版社,1992
附录
附录一 免疫细胞化学常用试剂介绍
一、固定剂
大多数神经激素、肽类物质为水溶性,在用于免疫细胞化学研究之前,常需固定。但肽类和蛋白质的物理、化学性质不同,因而对不同的固定方法或固定剂的反应也不尽相同。某些固定剂甚至可同时破坏和/或保护同一抗原的不同抗原决定簇。因此,在进行免疫细胞化学研究之前,很有必要了解所要研究的物质(蛋白质或肽类)的化学性质,并根据需要来选择适宜的固定剂(或固定方法)以及改进固定条件。
目前,免疫细胞化学研究中常用的固定剂仍为醛类固定剂,其中以甲醛类和戊二醛最为常用。在此,简要介绍几种目前较为常用和推荐的固定剂,以供读者选用。
1. 4%多聚甲醛-0.1mol/L磷酸缓冲液(pH7.3)
试剂:多聚甲醛40g
0.1mol/L磷酸缓冲液至1000ml
配制方法:称取40g多聚甲醛,置于三角烧瓶中,加入500~800ml 0.1mol/L磷酸缓冲液(Phosphate Buffer以下简称PB),加热至60℃左右,持续搅拌(或磁力搅拌)使粉末完全溶解,通常需滴加少许1n NaOH才能使溶液清亮,最后补足0.1mol/L的PB于1000ml,充分混匀。
该固定剂较适于光镜免疫细胞化学研究,最好是动物经灌注固定取材后,继续浸泡固定2~24h。另外,该固定剂较为温和,适于组织标本的较长期保存。
2. 4%多聚甲醛-磷酸二氢钠/氢氧化钠
试剂:A液:多聚甲醛40g
蒸馏水400ml
B液:Na2HPO4·2H2O16.88g
蒸馏水300ml
C液:NaOH 3.86g
蒸馏水200m
配制方法:A液最好在500ml的三角烧瓶中配制(方法同前),至多聚甲醛完全溶解后冷却待用。注意,在溶解多聚甲醛时,要尽量避免吸入气体或溅入眼内。B液和C液配制好后,将B液倒入C液中,混合后再加入A液,以1nNaOH或1N HCl 将pH调至7.2~7.4,最后,补充蒸馏水至1000ml充分混合,4℃冰箱保存备用。
该固定剂适于光镜和电镜免疫细胞化学研究,用于免疫电镜时,最好加入少量新鲜配制的戊二醛,使其终浓度为0.5%~1%。该固定剂较温和,适于组织的长期保存。组织标本于该固定液中,4℃冰箱保存数月仍可获得满意的染色效果。
3. Bouin’s液及改良Bouin’s液
试剂:饱和苦味酸
40%甲醛 250ml
冰醋酸50ml
配制方法:先将饱苦味酸过滤,加入甲醛(有沉淀者禁用),最后加入冰醋酸,混合后存于4℃冰箱中备用。冰醋酸最好在临用前加入。改良Bouin’s液即不加冰醋酸。
该固定液为组织学、病理学常用固定剂这一,对组织的穿透力较强,固定较好,结构完整。但因偏酸(pH为3~3.5),对抗原有一定损害,且组织收缩较明显,故不适于组织标本的长期保存。此外,操作时,应避免吸入或与皮肤接触。
4.Zamboni’s(Stefanini’s)液
试剂:多聚甲醛 20g
饱和苦味酸 150ml
Karasson-Schwlt’s PB 至1000ml
配制方法:称取多聚甲醛20g,加入饱和苦味酸150ml,加热至60℃左右,持续搅拌使充分溶解、过滤、冷却后,加Karasson-Schwlt’s PB至1000ml充分混合(Karasson –Schwlt’s磷酸缓冲液的配制配制方法见后)。
该固定液适于电镜免疫细胞化学,对超微结构的保存较纯甲醛为优,也适于光镜免疫细胞化学研究,为实验室常用固定剂之一。我们在应用中,常采用2.5%的多聚甲醛和30%的饱和苦味酸,以增加其对组织的穿透力和固定效果,保存更多的组织抗原。固定时间为6~18h。
5.PLP液PLP液即过碘酸盐-赖氨酸-多聚甲醛固定液(Periodate-Lysine-paraform-alde-hyde fixative)
试剂:过碘酸钠
赖氨酸盐酸盐(或盐酸赖氨酸):
多聚甲醛
蒸馏水
配制方法:
(1)贮存液A(0.1mol/L赖氨酸-0.5mol/l Na3PO4,pH7.4):称取赖氨酸盐酸盐1.827g溶于50ml蒸馏水中,得0.2mol/L的赖氨酸盐酸盐溶液,然后加入Na2HPO4至0.1mol/L,将pH调至7.4,补足0.1mol/L的PB至100ml,使赖氨酸浓度也为0.1mol/L,4℃冰箱保存,最好两周内使用。此溶液的渗透浓度为300mOs mmol/L/kg。
(2)贮存液B(8%多聚甲醛溶液):称8g多聚甲醛加入100ml蒸馏水中,配成8%多聚甲醛液(方法见前)。过滤后4℃冰箱保存。
(3)临用前,以3份A液与1份B液混合,再加入结晶过碘酸钠(NaIO4),使NaIO4终浓度为2%。由于AB两液混合,pH从约7.5降至6.2,故固定时不需再调pH值。固定时间为6~18h。
该固定剂较适于富含糖类的组织,对超微结构及许多抗原的抗原性保存较好。其机制是借助于过碘酸氧化组织中的糖类形成醛基,通过赖氨酸的双价氨基与醛基结合,从而与糖形成交联。由于组织抗原绝大多数都是由蛋白质和糖两部分构成,抗原决定簇位于蛋白部分,故该固定剂有选择性地使糖类固定,这样既稳定了抗原,又不影响其在组织中的位置关系。Mclean和Nakane等认为,最佳的混合是:含0.01mol/L的过碘酸盐、0.075mol/L的赖氨酸、2%的多聚甲醛及0.037mol/L的磷酸缓冲液。
6.Karnovsky’s液(pH7.3)
试剂:多聚甲醛 30g
25%戊二醛 80ml
0.1mol/L PB至1000ml
配制方法:先将多聚甲醛溶于0.1mol/L PB中,再加入戊二醛,最后加0.1mol/L的PB至1000ml,混匀。
该固定剂适于电镜免疫细胞化学,用该固定液在4℃短时固定,比在较低浓度的戊二醛中长时间固定能更好地保存组织的抗原性和细微结构。固定时最好先灌注固定,接着浸泡固定10~30min,用缓冲液漂洗后即可树酯包埋或经蔗糖溶液后用于恒冷切片。
7.0.4% 对苯醌 (Parabenzoquinone)
试剂:对苯醌 4.0g
0.01mol/L PBS1 000ml
配制方法:称取4.0g对苯溶于1000ml 0.01mol/L的PBS即可。
对苯醌对抗原具有较好的保护作用,但对超微结构的保存有一定影响,故常与醛类固定剂混合使用。一般要求临用前配制,且避免加热助溶,因加热或放置时间过长,固定液变为棕色至褐色,会使组织标本背景增加,影响观察。此外,对苯醌有剧毒,使用时避免吸入或与皮肤接触。
8.PFG液(Parabenzoquinone-Formaldehyde-Glutaraldehydefixative, PFG)
试剂:对苯醌20g
多聚甲醛15g
25%戊二醛 40ml
0.1mol/L二甲酸钠缓冲液至1000ml
配制方法:先以500ml左右的二甲酸钠缓冲液溶解对苯醌及多聚甲醛,然后加入戊二醛,最后加入二甲酸钠缓冲液至1000ml充分混合。
对苯醌与戊二醛及甲醛联合应用,即可阻止醛基对抗原的损害,又不影响超微结构的保存,故适于多种类抗原的免疫细胞化学,尤其是免疫电镜的研究。
9.碳二亚酰胺-戊二醛(ECD-G)液
试剂:0.05mol/L PB500ml
0.01mol/L PBS 500ml
Tris 约14g
浓HCl 少许
ECD 10g
25%戊二醛3.5ml
配制方法:先以约500ml的PB与相同体积的PBS混合,加入Tris(使其终浓度为1.4%)溶解,以浓HCl调pH至7.0,再将事先称取好的ECD和戊二醛加入混合液,振摇后计时,用pH计检测,约2~3min时,pH降至6.6,再以1N的NaOH在4min内调pH至7.0,此时,将该混合固定液加入盛有细胞(经PBS漂洗过)的器皿中,在23℃固定7min后,以PBS洗去固定液,即可进一步处理。
ECD即乙基-二甲基氨基丙基碳亚胺盐酸盐[1-ethyl-3(3-dimethyl-aminoprpyl)-carboi-imidehydrochloride],简称乙基-CDI,常用于多肽类激素的固定,对酶等蛋白质的固定也有良好效果。ECD单独应用时,边缘固定效应重,但与戊二醛、Tris及PB联合应用,效果明显改善,细胞质仍可渗透,利用细胞中抗原的定位,超微结构保存较好。目前认为是一种用于培养细胞电镜水平免疫细胞化学研究的很好的固定剂。
10.四氧化锇(锇酸Osmic Acid, OsO4)
配制:将洗净装有OsO4的安瓿中加热后,迅速投入装有溶剂的棕色瓶中,使安瓿遇冷自破。也可用钻石刀在安瓿上划痕,洗净后再放入瓶中,盖好瓶塞,用力撞击安瓿,待其破后加溶剂稀释。为保证充分溶解,应在用前几天配制。
(1)2% OsO4水溶解:取OsO41g溶于重蒸水中。此液常作为储备液,于冰箱中密封保存。
(2)1% OsO4-PB:
试剂:A、2.26%NaH2PO4·2H2O4.15ml
B2.52%8.5ml
C、5.4% 葡萄糖 5ml
D、OsO4 0.5g
配制方法:先分别配好A、B、C三种液体,取A液41.5ml与B液8.5ml混合,将pH调至7.3~7.4,取A-B混合液45ml再与5ml C液混合即为0.12mol/L PBG。
(3)1%OsO4/0.1mol/L二甲胂酸钠缓冲液(pH7.2~7.4):
试剂:2% OsO4水溶液 10ml
0.2mol/L二甲胂酸钠缓冲液(pH7.2~7.4)10ml
配制方法:取2%OsO4储备液10ml与等量0.2mol/L、pH7.2~7.4的二甲胂酸钠缓冲液充分混合即可。
OsO4是电镜研究所必需的试剂,常用于后固定。尽管OsO4主要为脂类固定剂,但也可与肽类及蛋白质起作用,形成肽-蛋白质或肽-脂交联。过氧化物酶的反应产物经OsO4处理后,电子密度增高,适于电镜研究。但由于OsO4的反应产物对光及电子有较明显的吸收能力,因此在免疫细胞化学染色前常需去除,去锇在光镜水平常用1%的高锰酸钾,在电镜水平则常用H2O2来处理。
以上介绍了目前免疫细胞化学中常用的一些固定液。关于固定液种类还很多,如70%~90%的酒精、丙酮、醋酸酒精(含0.1%~1%醋酸的70%~90%的酒精等),这些溶液都能促使蛋白质凝固。它们最初只是光学显微镜通用的固定液,但在免疫细胞化学上用其它方法不成功时,也可试用。总之,掌握一个原则,免疫细胞化学中,含重金属的固定液禁用(但Zenker-Formalin可进行短时的固定)。目前多数认为,对生物标本较好的固定措施是:用4℃的Karnovsky’s液灌注固定10~30min后,接着在pH7.3、0.1mol/L的二甲胂酸钠缓冲液中漂洗过液,这种短时冷固定处理,有助于超微结构和许多肽类抗原的保存。对其它较难保存的抗原可尝试PFG、PLP及Zamboni’s液等混合固定液。
二、缓冲液
免疫细胞化学中应用的缓冲液种类较多,即使是同种缓冲液,其浓度、pH、离子强度等也常常不同。在此介绍几种最常用的缓冲液的配制。
1.0.2mol/L(pH7.4)磷酸盐缓冲液(PhosphateBuffer, PB)
试剂: NaH2PO4·2H2O
Na2HPO4·12H2O
配制方法:配制时,常先配制0.2mol/L的 NaH2PO4和0.2mol/L的Na2HPO4,两者按一定比例混合即成0.2mol/L的磷酸盐缓冲液(PB),根据需要可配制不同浓度的PB和PBS。
(1)0.2mol/L的 Na2HPO4;称取Na2HPO4.12H2o 31.2g(或 NaH2PO4·H2O 27.6g)加重蒸水至1000ml溶解。
(2)0.2mol/L的 Na2HPO4:称取NaHPO4.·12H2o 71.632g(或 Na2HPO4·7H2O 53.6g或 Na2HPO4·2H2o 35.6g)加重蒸水至1000ml溶解。
(3)0.2mol/LpH7.4的PB的配制:取19ml 0.2mol/L的 NaH2PO4和81ml 0.2mol/L的 Na2HPO4·12H2O,充分混合即为0.2mol/L的PB(pH约为7.4~7.5)。若pH偏高或偏低,可通过改变二者的比例来加以调整,室温保存即可。
2.0.01mol/L磷酸盐缓冲生理盐水(PhosphateBuffered Saline, PBS)
试剂:0.2mol/L PB 50ml
NaCl 8.5~9g(约0.15mol/L)
重蒸水 至1000ml
配制方法:称取NaCl 8.5~9g及0.2mol/L的PB 50ml,加入1000ml的容量瓶中,最后加重蒸水至1000ml,充分摇匀即可。若拟配制0.02mol/L的PBS,则PB量加倍即可,依此类推。
PB和PBS是免疫细胞化学实验中最为常用的缓冲液,0.01mol/L的PBS主要用于漂洗组织标本、稀释血清等,其pH应在7.25~7.35之间,否则需要调整。0.1mol/L的PB常用于配制固定液、蔗糖等。一般情况下,0.2mol/l PB的pH值稍高些,稀释成0.01mol/L的PBS时,常可达到要求的pH值,若需调整pH,通常也是调PB的pH。
3.Karasson –Schwlt’s磷酸盐缓冲液
试剂: NaH2PO4·H2O3.31g
Na2HPO4·7H2O 33.77g
重蒸水 至1000ml
配制方法:同前
该缓冲液主要用于配制Zamboni’s固定液。
4.0.5mol/L pH7.6的Tris- HCl缓冲液。
试剂:Tris(三羟甲基氨基甲烷)60.57g
1N HCl 约420ml
重蒸水 至1000ml
配制方法:先以少量重蒸水(300~500ml)溶解Tris,加入HCl后,用1N的HCl或1N的NaOH将pH调至7.6,最后加重蒸水至1000ml。此液为储备液,于4℃冰箱中保存。免疫细胞化学中常用的Tris-HCl缓冲液浓度为0.05mol/L,用时取储备液稀释10倍即可。
该液主要用于配制Tris缓冲生理盐水(TBS)、DAB显色液。
5.Tris缓冲生理盐水(TrisBuffered,Saline,TBS)
试剂:0.5mol/L Tris-HCl缓冲液 100ml
NaCl 3.5~9g(0.15mol/L)
重蒸水至1000ml
配制:先以重蒸水少许溶解NaCl,再加Tris-HCl缓冲液,最后加重蒸水至1000ml,充分摇匀使Tris终浓度为0.05mol/L。
TBS主要用于漂洗标本,常用于免疫酶技术中。
6.Tris-TBS(PBS)
试剂:Triton X-100 10ml(1%)或3ml(0.3%)
0.5mol/L Tris缓冲液(pH7.6)1000ml(50ml)或(0.2mol/L的PB)
NaCl8.5~9g
重蒸水 至1000ml
配制方法:先以重蒸水少许溶解NaCl后,加入Triton X-100及Tris缓冲液或(PB),最后加重蒸水至1000ml,充分摇匀。
该液常用浓度为1%及0.3%,前者主要用于漂洗标本,后者主要用于稀释血清。
7.0.1mol/L(pH7.4)二甲胂酸缓冲液
试剂:0.2mol/L二甲胂酸钠500ml
0.1N HCl28ml
蒸馏水 至1000ml
配制方法:先称取二甲胂酸钠(MW:214)42.8g,加蒸馏水至1000ml,使0.2mol/L的二甲胂酸钠溶液;再取HCl 1.7ml加蒸馏水至1000ml ,配成0.1N,最后 取0.2mol/L二甲胂酸钠溶液500ml及0.1n HCl 28ml混合,加蒸馏水至1000ml,即为0.1mol/L的二甲胂酸钠缓冲液。
8.几种常用的不同pH值缓冲液的配制表
(1)0.2mol/L磷酸盐缓冲液(pH5.7~8.0)
| pH | 0.2mol/L NaH2PO4(ml) | 0.2mol/L Na2HPO4(ml) |
| 5.7 | 93.5 | 6.5 |
| 5.8 | 92.0 | 8.0 |
| 5.9 | 90.0 | 10.0 |
| 6.0 | 87.7 | 12.3 |
| 6.1 | 85.0 | 15.0 |
| 6.2 | 81.5 | 18.5 |
| 6.3 | 77.5 | 22.5 |
| 6.4 | 73.5 | 26.5 |
| 6.5 | 68.5 | 31.5 |
| 6.6 | 62.5 | 37.5 |
| 6.7 | 56.5 | 43.5 |
| 6.8 | 51.0 | 49.0 |
| 6.9 | 45.0 | 55.0 |
| 7.0 | 39.0 | 61.0 |
| 7.1 | 33.0 | 67.0 |
| 7.2 | 28.0 | 72.0 |
| 7.3 | 23.0 | 67.0 |
| 7.4 | 19.0 | 81.0 |
| 7.5 | 16.0 | 84.0 |
| 7.6 | 13.0 | 87.0 |
| 7.7 | 10.5 | 89.5 |
| 7.8 | 8.5 | 91.5 |
| 7.9 | 7.0 | 93.0 |
| 8.0 | 5.3 | 94.7 |
(2)0.05mol/L Tris-HCl缓冲液(pH7.19~9.10)
| pH | 0.2mol/L Tris(ml) | 0.2mol/L HCl(ml) | H2O |
| 7.19 | 10.0 | 18.0 | 12.0 |
| 7.36 | 10.0 | 17.0 | 13.0 |
| 7.54 | 10.0 | 16.0 | 14.0 |
| 7.66 | 10.0 | 14.0 | 15.0 |
| 7.77 | 10.0 | 14.0 | 16.0 |
| 7.87 | 10.0 | 13.0 | 17.0 |
| 7.96 | 10.0 | 12.0 | 18.0 |
| 8.05 | 10.0 | 11.0 | 19.0 |
| 8.14 | 10.0 | 10.0 | 20.0 |
| 8.23 | 10.0 | 9.0 | 21.0 |
| 8.32 | 10.0 | 8.0 | 22.0 |
| 8.41 | 10.0 | 7.0 | 23.0 |
| 8.51 | 10.0 | 6.0 | 24.0 |
| 8.62 | 10.0 | 5.0 | 25.0 |
| 8.74 | 10.0 | 4.0 | 26.0 |
| 8.92 | 10.0 | 3.0 | 27.0 |
| 9.10 | 10.0 | 2.0 | 28.0 |
(3)0.2mol/L醋酸盐缓冲液(pH3.6~5.6)
| pH | 0.2mol/L醋酸(ml) | 0.2mol/L醋酸钠(ml) |
| 3.6 | 46.3 | 3.7 |
| 3.8 | 44.0 | 6.0 |
| 4.0 | 41.0 | 9.0 |
| 4.2 | 36.8 | 13.2 |
| 4.4 | 30.5 | 19.5 |
| 4.6 | 25.5 | 24.5 |
| 4.8 | 20.0 | 30.0 |
| 5.0 | 14.8 | 35.2 |
| 5.2 | 10.5 | 39.5 |
| 5.4 | 8.8 | 41.2 |
| 5.6 | 4.8 | 45.2 |
(4)0.1mol/L二甲胂酸钠缓冲液(pH5.0~7.4)
| pH | 0.2mol/L二甲胂酸钠(ml) | 0.2N HCl(ml) | 蒸馏水 |
| 5.0 | 25 | 23.5 | 51.5 |
| 5.2 | 25 | 22.5 | 52.5 |
| 5.4 | 25 | 21.5 | 53.5 |
| 5.6 | 25 | 19.6 | 55.5 |
| 5.8 | 25 | 17.4 | 57.5 |
| 6.0 | 25 | 14.8 | 60.3 |
| 6.2 | 25 | 11.9 | 63.1 |
| 6.4 | 25 | 9.2 | 65.8 |
| 6.6 | 25 | 6.7 | 68.3 |
| 6.8 | 25 | 4.7 | 70.3 |
| 7.0 | 25 | 3.2 | 71.8 |
| 7.2 | 25 | 2.1 | 72.9 |
| 7.4 | 25 | 1.4 | 73.6 |
注:HCI可由NCO3代替,配制成二甲胂酸钠-HNO3缓冲液。
(5)0.2mol/L碳酸盐缓冲液(pH9.2~10.7)
| pH | 0.2mol/L Na2CO3(ml) | 0.2mol/L NaHCO3(ml) |
| 9.2 | 4.0 | 46.0 |
| 9.3 | 7.5 | 42.5 |
| 9.4 | 9.5 | 40.5 |
| 9.5 | 13.0 | 37.0 |
| 9.6 | 16.0 | 34.0 |
| 9.7 | 19.5 | 30.5 |
| 9.8 | 22.0 | 28.0 |
| 9.9 | 25.0 | 25.0 |
| 10.0 | 27.5 | 22.5 |
| 10.1 | 30.0 | 20.0 |
| 10.2 | 33.0 | 17.0 |
| 10.3 | 35.5 | 14.5 |
| 10.4 | 38.5 | 11.5 |
| 10.5 | 40.5 | 9.5 |
| 10.6 | 42.5 | 7.5 |
| 10.7 | 45.0 | 5.0 |
三、显色液
免疫细胞化学中,由于抗原-抗体反应所形成的复合物本身无色,无法直接观察,因而需借助于某些化学基团的呈色作用,使其得以显示,以利于在显微镜下观察。常用的显色液有:
1.DAB(Diaminobenzidine)显色液
DAB即3,3-二氨基苯联胺
试剂:DAB(常用四盐酸盐) 50mg
0.05mol/L TB 100ml
30% H2O2 30~40μl
配制方法:先以少量0.05mol/L(pH7.6)的TB溶解DAB,然后加入余量TB,充分摇匀,使DAB终浓度为0.05%,过滤后显色前加入30%的H2O230~40μl,使其终浓度为0.01%。
DAB显色液主要用于免疫过氧化物酶法(如酶标法、PAP法等),其终产物可直接在光镜下观察,也可经OsO4处理后,增加反应产物的电子密度,用于电镜观察。但有几点需注意:DAB溶解要完全,否则未溶解的颗粒沉积于标本上影响观察;DAB浓度不易过高,否则显色液呈棕色,增加背景染色,另外DAB有致癌作用,故操作时应戴手套,尽量避免与皮肤接触,用后及时彻底冲洗,接触DAB的实验用品最好经洗液浸泡24h后使用。
2.4-氯-1-萘酚(4-Cl-1-Naphthol)显色液
配方1:4-Cl-1-萘酚100mg
纯乙醇 10ml
0.05mol/L TB(pH7.6)190ml
30% H2O2 10μl(0.003%)
配制方法:先将4-Cl-1-萘酚溶解于乙醇中,然后加入Tb 19ml,用前加入30% H2O2使其终浓度为0.005%,切片显色时间通常为5~20min。
配方2:4-Cl-1-萘酚
N-二甲基甲酰胺(DMF)
0.05mol/L TB(pH7.6)
30% H2O2
配制方法:先将4-Cl-1-萘酚加入DMF中,加热溶解使呈乳白色,再加入TB,乳白色变为絮状,在7.5℃加热5min后加入H2O2,搅动使絮状消失,趁热过滤,当降至略低于50℃时才放入组织标本(注意:温度过高易损伤标本,过低则易重新出现沉淀)。显色时间通常为5min左右。
4-Cl-1-萘酚的终产物显示蓝色。
多数认为最好去除白色沉淀(如上述),但Larsson等认为,白色沉淀可作为背景,使阳性部位更易观察。由于酒精可溶解4-Cl-1-萘酚显色的组织标本,勿用酒精脱水。
3.3-氨基-9-乙基卡唑(3-amino-9-ethylcarbozole,AEC)显色液
试剂:AEC 20mg
二甲基甲酰胺(DMF)2.5ml
0.05mol/L醋酸缓冲液(pH5.5)50ml
30%H2O225ml
配制方法:先将AEC溶于DMF中,再加入醋酸缓冲液充分混匀。临显色前,加入30%H2O2。切片显色时间为5~20min。
该显色液作用后,阳性部分呈深红色,加以苏木精或亮绿等作为背景染色,则效果更佳。由于终产物溶于酒精和水,故需用甘油封固。
4.TMB显色液
试剂:TMB
HCl
亚硝基铁氰化钾
无水酒精
配制方法:
(1)醋酸盐缓冲液:取1.0mol/L的HCl 190ml加入1.0mol/L的醋酸钠400ml中混合,再加蒸馏水稀释至1000ml,用醋酸或NaOH将pH调至3.3。
(2)A液:取上述缓冲液5ml,溶解100mg亚硝基铁氰化钾,加蒸馏水92.5ml混合。
(3)B液:称取5mg TMB加入2.5ml无水酒精中,可加热至37℃~40℃直到TMB完全溶解。
(4)孵育液:放入标本前数秒,取2.5ml B液及97.5ml A溶于试管中充分混合。(液体在20min内应保持清亮的黄绿色,否则可能已有污染)。酶反应时,加入终浓度为0.005%的H2O2。
(5)主要显色步骤:组织标本在蒸馏水(或PBS)中漂洗数次(每次约10~15min)后放入未加H2O2的孵育液中作用20min(19℃~30℃),然后向孵育液中放入H2O2(每100ml孵育液中加0.3%的H2O2 1.0~5.0ml)继续孵育液20min左右(19℃~23℃),捞出标本漂洗数次(共30min左右)。在0~4℃条件下可在漂洗液放置4h直至贴片、脱水,封片。也可在贴片前在1%的中性红中负染2~3min,也可在1%派诺宁(pH3.3~3.5)中负染5min后贴片、脱水、封片。
TMB即四甲基联苯胺(Tetrabenzidine)是一种脂溶性较强的基团,因此容易进入细胞与细胞器中的HRP反应,且由于这种高度的脂溶性,使其易形成多聚体,在HRP活性部位产生粗大的、深兰色沉淀物,这使得TMB成为组化实验中的一种很好的发色团。同时反应产物的沉淀,使得HRP的活性部位更加暴露,利于酶氧化反应进行。TMB的反应产物为深蓝色,利于光镜观察,且反应产物越聚越大,常超出单个细胞器的范围(而DAB则被限制在其内),故TMB反应的检测阈较低。由于上述优点,目前TMB常用于光镜及超微结构水平的HRP及HRP-WGA神经投射的研究。需要注意的是:TMB显色液中的A液和B液应在2h内新鲜配制。另外,TMB是一种较强的皮肤刺激剂,并有致癌的潜在可能,故使用时应带手套及在通风条件下操作。
5.NBT显色液
试剂A液:5%NBT:称取0.5gNBT溶于10ml 70%的DMF(二甲基甲胺)内,充分混合,常存于4℃,也可装成小份,-20℃保存,用前复温。
B液:5% BCIP:称取BCIp 0.5g溶于10ml 100%的DMF内,混匀。4℃或分装存于-20℃,用前恢复至室温。
C.显色液:取A液40μl,加入到盛有10ml的0.1mol/lTris-HCl(pH9.5,钤0.1mol/L NaCl、5mmol/LMgCl2)管内,充分混匀;再加入B液40μl,轻轻混合即可。最好用前新鲜配制。
NBT即四唑氮蓝(Nitro-Blue-Tetrazolium),MW=818,为深蓝色无定形微溶物质。BCIP即5-溴-4-氯-3-吲哚-磷酸盐(5-bromo-4-chloro-3-indolyl-phosphate)。当二者存在时,在碱性磷酸酶(Alkaline phosphatase, AP)作用下,NBT被还原形成显微镜下可见的蓝色或紫色沉淀。
四、粘附剂
在免疫细胞化学工作中,由于标本(如切片)的脱落常影响工作的质量的速度,故粘附剂的选择和使用就显得较为重要。
1.铬矾明胶液
试剂:铬矾0.5g
明胶(Gelatine) 5g
H2O ~1000ml
方法:在1000ml的烧杯或烧瓶中,以500~800ml H2O加温溶解明胶,待其完全溶解后,再加入铬矾。注意温度过高易使明胶烧糊,包被玻片时最好控制水温在70℃。如有明显残渣,过滤后使用。
2.
试剂:40%甲醛2.5ml
明胶0.5g
蒸馏水 至100ml
配制方法:用少许蒸馏水(约80ml)加热溶解明胶,待完全溶化后,加入甲醛,最后补充蒸馏水至100ml混匀即可。
3.多聚赖氨酸(Poly-L-Lycine,PLL)
试剂:多聚赖氧酸 5g
蒸馏水 ~1000ml
配制方法:称取PLL,溶于H2O,充分混合即可,此液浓度为0.5%,可适当稀释配成0.01~0.5%浓度。4℃保存,也可-20℃备用。PLL可反复冰冻,效果无明显影响,工作液常再稀释10~50倍。
4.Vectabond试剂该试剂是Vector公司新进推出的一种新型玻片粘附剂。该试剂与一般的粘附剂不同,它是通过对玻璃表面起化学修饰作用,改变其表面的化学物理特性,使组织切片牢固地贴于玻璃片上,贴上后不易脱落,保留时间较久。一个试剂盒(7ml)可配成350ml工作液(用丙酮配)。处理载玻片前(事先酸处理),用染色缸装好各种液体,按下列程序进行:
干净载玻片→丙酮5min→Vectabond试剂工作液(7ml Vectabond+ 350ml丙酮):将载玻片用镊子夹住浸入Vectabond试剂1~2次→dH2O,2×5min→干燥(37℃过夜)→用铝箔包好,室温存放备用。
注意:避免污染(尘埃等)。
综上述方法处理的载片一般可存放半年以上。
五、封固剂
1.甘油-TBS及甘油-PBS

配制方法:按比例将甘油和TBS(或PBS)充分混合后,置4℃,冰箱静止;待气泡排除后方可使用。
2.甘油-明胶(冻)
试剂:明胶 10g
甘油 12ml
蒸馏水 100ml
香草酚 少许
配制方法:称取1g明胶于温热(约40℃)的蒸馏水中,充分溶解后过滤,再加入12ml甘油混合均匀。少许香草酚是为了防腐。
3.液体石蜡液体石蜡因含杂质少,很少引起非特异性荧光,故常用于荧光组化及免疫荧光法时标本的封固。
4.DPX
试剂:Distrene 10g
酸二丁 5ml
二甲苯 35ml
DPX为中性封固剂,用于多种染色方法匀不易褪色,但组织收缩较明显,故应尽量使其为均匀的一薄层。DPX现有商品出售,可直接应用。若感过于粘稠,也可加少量二甲苯稀释后应用。注意:二甲苯不可加得太多,二甲苯挥发后,片子上出现许多干燥的空泡,影响观察,遇有这种情况,可用二甲苯浸泡掉盖玻后重新封固。
六、酶消化液
1.0.1%胰蛋白酶
试剂:胰蛋白酶 0.1gm
0.1%氯化钙(pH7.8) 100ml
配制方法:先配制0.1%的CaCl2,用0.1mol/L的NaOH将其pH调至7.8,然后加入蛋白酶溶解之。用前将胰蛋白酶消化液在水浴中予热至37℃(载有标本的玻片也在TBS中予热至同样样温度)。该消化液时间约为5~30min。
2.0.4%胃蛋白酶
试剂:胃蛋白酶 400mg
0.1N HCl 100ml
配制方法:同胰蛋白酶。消化时间在37℃约为30min。
3.0.06% Pronase
试剂:Pronase 0.06g
0.05mol/L TB(pH7.5) 100ml
配制方法:同前。
在免疫细胞化学染色中,有时经Formalin过度固定的标本,常会产生过量的醛基,遮盖抗原,影响一抗与抗原的结合。用蛋白酶溶液消化,可起到暴露抗原部分的作用。消化时间应根据不同组织而异,总之,在保持组织形态不被破坏的前提下,宜尽量延长消化时间。以上三种酶消化液中,以第一种最为常用。
七、其它
1.蔗糖溶液免疫细胞化学中应用的蔗精,常用浓度为5%~30%。一般光镜研究,仅用20%蔗糖处理已足矣,若制备电镜标本,在冰冻前最好经上行蔗糖(5%、10%、15%、20%及20%蔗糖-5%甘油等)处理,以确保其良好的细微结构。
(1)20%蔗糖液:
试剂:蔗糖 20g
0.1mol/L PB(pH7.5) 至100ml
配制方法:先以少许0.1mol/L的PB溶解蔗糖,再加0.1mol/l PB至100ml充分混合,置4℃冰箱保存。
该液多用于纯光镜研究。标本在刚放入浓度如此高的蔗糖液,常浮在上面,当标本沉到底部时即可。通常光镜标本浸泡在20%蔗糖液中过夜。都能达到要求。
(2)20%蔗糖-5%甘油:
试剂:蔗糖 20g
甘油 5ml
0.1mol/L PB至100ml(约95ml)
配制方法:先用少许PB溶解蔗糖后,再加入甘油,充分混匀,最后补足PB至100ml,于4℃保存备用。
该液主要用于电镜标本的处理,常浸泡过夜(其它浓度的蔗糖中常分别为2h左右)。
蔗糖是一种廉价的防冻剂,兼有脱水的作用,它可减小标本在冰冻切片时冰晶形成的数量和大小,应用较为方便。若无试剂蔗糖(Sucrose)也可用普通蔗糖(Cane Sugar)。配制好的蔗糖溶液,放置时间超过一个月时,应重新配制。
2.T riton X-100(聚乙二醇辛基苯基醚)免疫细胞化学中,Triton X-100常用浓度为1%和0.3%,但通常是先配制成30%的Triton X-100储备液,临用时稀释至所需浓度。
30% Triton X-100的配制:
试剂:Triton X-100 28.2ml
0.1mol/L PBS(pH7.3)或0.05mol/l TBS(pH7.4)72.8ml
配制方法:取Triton X-100及PBS(或TBS)混合,置37℃~40℃水浴中2~3h,使其充分溶解混匀。用前取该储备液稀释至所需浓度。
Triton X-100是一种非离子型表面活性剂(或称清洁剂),分子量为646.86(C34H62O11)。它能溶解脂质,以增加抗体对细胞膜的通透性。1%的Triton X-100常用于漂洗组织标本,0.3%的Triton X-100则常用于稀释血清,配制BSA等。
3.甲醇-H2O2液
试剂:纯甲醇 10ml
30% H2O2 0.1ml
配制方法:吸取30%的H2O20.1ml,加入100ml纯甲醇中,充分混匀即可,使H2O2终浓度为0.3%(也有的用0.03%、0.5%等)。
甲醇-H2O2处理组织标本,具有封闭内源性过氧化物酶活性的作用,但其具体机制至今仍不详。通常处理时间在室温约为5~30min。注意,用H2O2处理标本,对某些抗原的抗原性有影响,故建议在使用新的抗血清或抗原时,最好同时设立非处理对照组。
4.常用生理盐液
常用生理盐液的成分(g/1000ml)
| Kerbs | Kerbs-Hen-selsit | Locke | Tyrode | Ringer | |
| NaCl | 5.54 | 6.92 | 9.00 | 8.00 | 6.50 |
| KCl | 0.36 | 0.35 | 0.42 | 0.20 | 0.14 |
| MgCl2 | - | - | - | 0.10 | - |
| MgSO4·7H2O | 0.29 | 0.29 | - | - | - |
| CaCl2 | 0.28 | 0.28 | 0.24 | 0.20 | 0.12 |
| NaH2PO4 | - | - | - | 0.05 | 0.01 |
| KH2PO4 | 0.16 | 0.16 | - | - | - |
| NaHCO3 | 2.10 | 2.10 | 0.15 | 1.00 | 0.20 |
| Glucose | 2.10 | - | 1.00 | 1.00 | 2.00 |
| Pyruvic acid | 0.43 | - | - | - | - |
| Fumaric acid | 0.62 | - | - | - | - |
| Glutamic acid | 0.72 | - | - | - | - |
配制方法:精确称取各种药品(如上表),加入500ml重蒸水中,待完全溶解后,补足重蒸水至1000ml,充分混匀即可。
在免疫细胞化学实验中,某些物质不宜经固定剂作用或经固定剂作用后仍易丢失,而需浸泡在生理盐液中。这些生理盐液的成分与正常哺乳动物血清的成分相似,能使组织离体后能处于尽量接近生理状态时的环境。Glucose通常是在用前临时加入。有的(如Kerbs液)在使用时通常需通入含CO2/O2为2.5~5%/97.5~95%的气体。这些生理盐液中的CO2和二碳酸盐,主要起缓冲作用,Glucose主要是提供离体组织有限的代谢所需的能量。
附录二 原位杂交组织化学常用试剂及处理
一、杂交前准备
(一)DEPC水是经DEPC处理过的灭菌蒸馏水。
DEPC即二乙基焦碳酸酯(diethylprocarbonate),可灭活各种蛋白质,是RNA酶的强抑制剂。原位杂交在杂交及其以前的各步处理中,所有液体试剂都应经DEPC处理。方法是:取市售DEPc 1ml,加入1L待处理水(蒸馏水等)中,经猛烈振摇后,于室温静止数小时,然后高压灭菌,以除去降解DEPC(DEPC分解为CO2和乙醇)。有些试剂可直接加入DEPC,终浓度一般为0.1%~0.4%,原则上在杂交及其以前的步骤中,所有液体试剂均需用DEPC处理,或用DEPC水配制,包括乙醇的稀释。此外,接触标本以及标本有关的空中的洗涤也需DEPC水洗涤。
注意:①DEPC是一种潜在的致癌物质,在操作中应尽量在通风的条件下进行,并避免接触皮肤。②含有Tris缓冲液的溶液中,不能加入DEPC。
(二)载玻片的处理
组织原位杂交,常在载玻片上进行,故载玻片的洗涤至关重要,必须保持清洁,并且不能有任何核酸的污染。处理方法如下:
(1)先经洗衣粉浸泡过夜,次日自来水冲洗后,泡酸数小时以上,取出后再用流水冲洗,双蒸水冲洗2~3次,置160℃以上烤箱中烧烤4h以上,或经15磅高压灭菌20min。经以上处理可清除载片上的核酸酶。
(2)HCl处理法

(三)硅化
【方法1】(1)将一扎新的盖玻片散开,在通风条件下于0.1mol/L的HCI中煮20min,等其冷却后,倒掉盐酸。
(2)用去离子水沉漂洗玻片,竖放在架子上自然干燥。
(3)硅化盖玻片:通风条件下,将单块的盖玻片在二甲二氯硅浣(dimethyldichorsilane,DMDC)液中浸几下,竖入在架子上干燥。
(4)收集干燥的盖玻片于一可耐热的petri氏盘(或培养皿)中,用去离子水漂洗数次,彻底清洗。
(5)用铝箔将装有盖玻片的培养皿包好,于180℃烘烤4h过夜。取出待冷至室温后,即可进行后续处理。
附:2%DMDC

配制:按比例两者充分混匀,静止待气泡消失即可使用。
用途:硅化玻片(载片、盖片均可)。
【方法2】将经过洗净的玻璃盖片分散开放在一金属网中,并将该网放入一接有真空泵的干燥器中。同时,在干燥器中放一盛有约1m二甲二氯硅浣(dimethyldiorosilane,DMDC)的小烧杯。盖好干燥器(确保密闭),抽真空约5min,然后让空气冲入。取出盛有盖片的金属网架,用锡箔纸包埋,于250℃以上烘烤4h以上,最好过夜。冷却后备用。
本法可用于玻璃及塑料器皿的硅化。塑料器皿只能于60℃烧干。
【方法3】APES(氨丙基三乙氧基硅浣)法

【方法4】
(1)49ml氯仿与1mg二甲二氯硅浣(DMDC)配液;
(2)倒入每个拟硅化的试管或离心管中,浸泡5min后用乙醇或重蒸水冲洗;
(3)玻璃器皿使用前位于180℃以上烘烤2h以上,塑料器皿应于60℃烘烤过夜。
注意:DMDC有毒且高度挥发,应于通风环境操作并戴口罩、手套,避免接触皮肤或吸入。
(四)载片的包被(粘贴)
1.沾附剂
(1)多聚赖氨酸(poly-L-Lycine,PLL)
储备液(0~5%)

按上述剂量充分混合,即为浓度为5mg/ml(0.5%)的PLL液。常分装成1ml的包装,-20℃存放。该液为储备液,可反复冻融,无明显影响。用前充分混合。
工作液(0.01%):

充分混合,静止待气泡消失。
(2)明胶液

配法:先称取明胶溶于500~800ml DEPC水中,加热搅拌助溶,待明胶完全溶解以后,加入甲明矾溶解后即可使用。注意,包被玻片时,明胶液温度最好保持在60℃左右,效果最佳。方法同PLL包被玻片。
2.多聚赖氨酸包被玻片的制备方法(其它包被剂相同)
(1)将事先准备好的经160℃以上烘烤,并冷却至室温的玻片(载片或盖片),在0.05%(也有用0.1%)的PLL液中上下浸蘸几下,分散开竖放在架子上,于空气中自然干燥,4℃备用。注意:①浸蘸时,务必使整个玻片完全浸于液体中,否则,包被不完全会产生标本脱落现象;②干燥过程中注意避免尘埃污染;③按上法处理的玻片通常可存放在一定时间(室温1月以上,4℃更长),但仍建议尽早使用。
(2)多聚赖氨酸1mg溶于10ml灭菌的去离子水或1mmol/L的Tris-HCl缓冲液中(pH7.0),将其涂布于玻片上,待干燥后即可使用。该法包被的玻片可用于细胞涂片和切片。
(3)将PLL工作液滴至盖玻片上5μl/片,用另一盖玻片以推血涂片方法推片,或用另一盖玻片紧贴于其上,相互磨擦以使两盖玻片相对的一面涂布上PLL。该法制备的玻片,只有一面是包被有PLL,故制备时,待其晾干后,应作好记号,然后保存后备用。
多聚赖氨酸可用于多种核酸杂交,方法简单,结果可靠,有许多其它方法不可比拟的优点。配制好的液体可存放于4℃或室温,但时间过长会解聚而失效,故建议使用时尽量新鲜配制。
(4)Vectabond粘附剂
该试剂是Vector公司新近推出的一种新型粘附剂。它与其它粘附剂的主要区别是:一般的粘附剂是通过物理性覆盖在玻片表面,天长日久,可能由于包被不完全或局部脱落而致切片等标本易于脱落。而Vectabond试剂是通过化学性作用,改变玻璃表面的分子结构,使标本贴附牢固,不易脱落,且保持时间长久,耗量小,价格便宜,一个包装7ml可配成350ml工作液使用。操作程序:
标本(铺片、切片等)→丙酮(5min)→Vectabond试剂工作液(5min)→dH2O(2×5min)→干燥(温箱,数小时过夜)→用铝箔包好,室温备用。
注意:制备和保存过程中避免污染。
经上述处理的载玻片一般可存放半年以上(4℃可更长)。
(五)硅鱼精子DNA的制备
(1)在50ml灭菌聚乙烯管中加入1g鲑精DNA,加入15ml DEPC水使其浸泡5min至2h;
(2)加入2.5ml 2mol/L HCl,室温放置,DNA形成白色沉淀,充分振摇至沉淀物相互缠绕在一起,用吸头尖端使之形成一球团状(2~3min);
(3)加入5.0ml 2mol/L的NaOH。摇动小管使DNA悬浮、溶解,将小管置50℃15min助溶;
(4)用DEPC水将混合物稀释至175ml(总体积),充分混合,注意确保管内已无颗粒状;
(5)加入20ml/l 1mol/L的Tris-HCl缓冲液(pH7.4);
(6)用2mol/L的HCl滴定至DNA溶解pH为7.0~7.5;
(7)用无菌微孔滤膜过滤液体,去除颗粒。260nm测定溶液的OD值,方法是:取20μl DNA液混合于980μl水中,混匀后测定,吸收值乘以50即为DNA浓度(μg/ml);
(8)制备好的DNA液储于-20℃备用,用前取出冻融后煮沸。
二、关于探针的标记
(一)cRNA探针的同位素标记
1.标记液(转录标记)

2.转录缓冲液

※:用地高辛或生物素标记时,用UTP替代。
3.标记终止液

4.标记探针水解液

先用dH2O悬浮探针,再加入后两种试剂,轻轻振摇混合,于60℃条件下反应。
5.探针水解时间

注:LO-探针初始长度(kb)
Lf-探针的终长度(kb)
K-0.11kb/min
6.探针水解终止液

每次加入充分混合,临用前配。
7.探针沉淀液

每次加入,充分混合,新鲜配制。
(二)寡聚核苷酸3’端标记(cRNA探针)
1.标记反应液

2.终止液:0.2mol/L EDTA
3.探针沉淀液

(三)cRNA探针非同位素标记(地高辛及生物素)
1.标记液

△:生物素标记时为10mmol/L的生物素-11-UTP
※:为检测标记率而加。
2.转录标记终止液
(1)0.2mol/L EDTA:用于地高辛标记法
(2)生物素标记终止液:

(四)DNA探针标记常用试剂的配制
(1)10 ×缺口平移缓冲液:200mmol/l Tris-HCl,pH7.4含50mmol/L MgCl2;100mmol/Lβ-巯基乙醇、1mg/ml BSA。
(2)缺口平移反应终止液:200mmol/L NaCl;10mmol/l Tris-HCl,pH7.4;11mmol/L EDTA; 0.5% SDS。
(3)DNaseⅠ:干粉状DNaseⅠ(2000~3000u/mg)溶于20mmol/l Tris-HCl, pH7.5中(1mg/ml),10μl分装,-20℃保存一年。
(4)10×DNA聚合酶Ⅰ(Klenow片段)缓冲液:500mmol/l Tris-HCl,pH6.6;100mmol/L Mg-Cl2;10mmol/L DTT;0.5mgBSA。
(5)10×激酶缓冲液:500mmol/L Tris-HCl,pH7.4,50mmol/L MgCl2;20mmol/LDTT; 1.0mmol/L亚精胺。
(6)10×随机引物标记缓冲液;500mmol/l Tris-HCl,pH6.6;100mmol/L MgCl2;10mmol/Lβ-巯基乙醇;500μg/ml BSA。
(7)1×加尾缓冲液:100mmol/L二甲胂化钾,pH7.0,1mmol/l CoCl20.2mmol/L DTT。
(8)1mol/L MgCl2:MgCl247.60g溶于500ml水中,100ml分装,高压灭菌,室温保存。
(9)0.25mol/L EDTA(Ph8.0):EDTA 52.02g溶于400ml水中,调pH至8.0,加水至500ml,100ml分装,高压灭菌,室温保存。
(10)4mol/L醋酸钠:取无水醋酸钠82g溶于200ml水中,用醋酸调pH至6.5,加水至250ml,高压灭菌,或0.45μm膜过滤,室温保存。
(11)10% SDS:10g SDS(十二烷基硫酸钠)溶于50ml水中,加水至100ml,分装后室温保存。
(12)20×SSC:取NaCl 175.3g;柠檬酸钠88.2g;加水至1000ml,用10mol/l NaOH调pH至7.0;高压灭菌,室温保存。
(13)无菌水:100ml去离子水或双蒸水,分装,高压灭菌,室温保存,开瓶后仅限一周使用。
(14)10×激酶缓冲液:500mmol/L Tris-HCl,pH7.4;100mmol/L MgCl2;50mmol/lDTT;10mmol/L亚精胺(非必需)。
(15)T4多聚核苷酸激酶:10u/μl,保存在甘油中,-20℃。
(16)TE缓冲液(Tris/EDTA):Tris,10mmol/l pH7.4(0.5ml 2mol/L贮存液),1.0mmol/l ED-TA,pH8.0(20μl 0.5mol/L)贮存液,加水至100ml,室温保存。
(17)2mol/L Tris-HCl pH7.4:Tris242.2g溶于850ml,加浓HCl 75ml ,边加边缓慢搅动,至pH7.4,于加水至1000ml。
(18)1mol/L DTT(二硫苏糖醇):3.0g DTT溶于20ml水中,分装,于-20℃贮存。
(19)0.5mol/L EDTA(乙二胺四乙酸二钠盐):在烧杯中先加入300ml水,加入93.5g EDTA-Na2·2H2O,充分混匀,加10mol/l NaOH调pH至8.0,加水至500ml。
(20)10mol/L NaOH:200g NaOH溶于450ml水中,混匀,再加水至500ml。
(21)5mol/L NaCl:292.25g NaCl,加水至1000ml。
(22)1mol/L HCl:加86.2ml浓盐酸至913.8ml水中。
(23)1mol/L CaCl2:147g CaCl2:2H2O,溶于1000ml水中,高压灭菌,室温保存。
三、固定剂
进行原位杂交的组织或细胞标本常需经固定处理。尽管许多化学物质对组织/细胞有固定作用,但核酸原位杂交的理想固定液应具备如下特点:①能很好地保持组织细胞的状态;②对核酸无抽提、修饰及降解作用;③不改变被检核酸分子在组织细胞内的定位;④对核酸及探针的杂交过程无阻碍作用;⑤固定液本身对杂交信号无遮蔽、掩盖作用,如不使本底增加等;⑥理化性质稳定、价格低廉。
1.4%多聚甲醛(Paraformaldehyde,PFA)

配法:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH值至7.0,使呈清亮状(滴加),再加入约500ml 2×PBS※,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
注意:①配制时应在通风条件下操作,并避免接触皮肤和吸入(戴手套及口罩),因PFA有较强的固定作用及毒性,对粘膜及皮肤有固定及毒性,刺激作用;②加热时,温度不宜过高,常为60~65℃,否则,PFA降解失效;③配制好的PFA虽可存放一定时间,但过久的液体,固定效果下降,建议尽早使用。
附:固定液用PBS的配制:

配法:按上述比例称取试剂,溶于DEPC水(也可用蒸馏水加DEPC)500~800ml中,过滤后,加水定容至1000ml,高压灭菌。通常配制成10×PBS的储备液,2×PBS和1×PBS可用DEPC水稀释获得。
除用DEPC水配制PFA外,也有用灭菌蒸馏水或经DEPC处理的0.01~0.1mol/L的PBS配制的,方法及注意事项同上。
4% PFA是目前原位杂交组织化学技术中最常用的固定液,它能较好地保持组织及细胞内的RNA,同时对形态保持也较好。通常组织块固定4~12h,载片固定时间在10~15min以内,RNA含量较为恒定。过度延长固定时间会引起细胞内生物大分子的过度交联,影响探针的穿透力,降低杂交效率。
2.甲醛
①10%甲醛(Formaldehyde,FA)

量取二者充分混合而可。较适于检测RNA的组织及细胞固定,也可用于新鲜冰片切片后固定。
②10%福尔马林试剂:

较适于固定细胞。
③10%中性福尔马林
市售甲醛 100ml
Na2HPO44g
NaH2PO46.5g
DEPC水 ~1000ml
常用于石蜡样品切片的固定。
10%的甲醛由于有促进DNA双链分子交联的作用,干扰DNA变性,故不适于DNA杂交。在组织或细胞原位杂交中,可通过使用含50%甲酰胺的杂交液使DNA变性解链而解决。这类固定液在DNA/RNA杂交中有较好的效果。
3.4%戊二醛效果较40%差。
4.0.1%戊二醛常用于固定组织,适于新鲜组织冰冻切片及石蜡切片的后固定,常用于检测DNA的原位组织杂交方法。
5.乙醇/醋酸(或冰醋酸)将乙醇与醋酸按3:1的体积比充分混合即可。该液较适于固定细胞的原位杂交,尤其检测DNA时。
乙醇/醋酸虽广泛应用于原位杂交中,但RNA保留较差,可本底很低,即背景染色淡。
6.甲醇/醋酸(3:1)用前按体积比3:1比例充分混合即可。
7.甲醇/丙酮(1:1)适于培养细胞的原位杂交技术。
8.4%多聚甲醇-0.5%~1%戊二醛溶液在pH7.4磷酸缓冲液中,用于免疫电镜样品固定。
四、LB培养基
(一)液体LB培养基(Luria-Bertani培养基)

配制:取一1000ml的烧杯,将事先称取好的试剂加入杯内,加H2O约500~800ml搅拌使其溶解完全。用5N的NaOH调pH至7.0,加入H2O定容至1000ml。15磅高压灭20min。
(二)琼脂糖平板培养基
细菌培养用琼脂(或琼脂糖)15g
液体培养基(如LB)~1000ml
按浓度比例,将琼脂加入液体培养基(如LB)中,稍加搅拌,用纱布或纸封好瓶口,15磅高压灭菌20min。
五、小量质粒提取主要液体
1.溶液Ⅰ

2.溶液Ⅱ

3.溶液Ⅲ(3mol/L醋酸钠)

加热溶解后,再用冰醋酸(约40ml)调pH至4.8,补足H2O至200ml。
六、杂交前处理
1.蛋白酶(Proteinawe K, Pro.K) 蛋白酶K主要用于杂交前标本处理,其作用是使组织达到一定消化,利于检测分子的穿透,从而提高检测方法的敏感性,但各种组织在不同条件下消化程度不一,因此,具体应用时,应根据组织种类、温度确定反应时间及酶的浓度。过度消化可使组织形态结构遭到明显破坏,核酸分子也会受到影响。通常是将其配成储备液(1mg/ml),临用前,再配成工作液(约0.025mg/ml)。配制方法:

精心称药,将二者充分混合后,分装成小份,-20℃存放,用时再取出冻融,余者弃去。
(2)工作液(临用前配):

取储备液(1mg/ml)按1:40稀释,充分混合,即得约含Pro.K为25mg/ml的工作液。

(3)关于P-K缓冲液的配制:

称取上述试剂,充分混合即可。
②1mol/L 的Tris-HCl(pH8.0):

先将Tris于800ml ddH2O中溶解,用HCl将pH调至8.0,ddH2O定溶于1000ml,高压灭菌,室温备用即可。
③0.5mol/L的EDTA:

称取EDTA溶于约600ml ddH2O中,常需60℃持续搅拌以助溶,滴加NaOH至pH接近8.0时,EDTA才开始溶解。待完全溶解后,冷却至室温,NaOH调pH至8.0,ddH2O定溶至1000ml,高压灭菌,室温备用。
2.甘氨酸
(1)1mol/L甘氨酸:

称取甘氨酸75g溶于ddH2O或DEPC水中,最后补足ddH2O定容至1000ml,高压灭菌备用。该液为储备液,-20℃储存。
(2)甘氨酸工作液(0.1mol/L):

将二者按1:10比例稀释,即得甘氨酸工作液。一般要求临用前新鲜配制。
甘氨酸有终止蛋白酶K作用的作用,以防过度消化。
3.0.25%醋酸-0.25%醋酸酐

配制:按上述配方,先以少许DEPC水溶解NaCl,然后加入三乙醇胺及浓HCl。DEPC水定容至约1000ml(997.5ml),临用前,一边摇动溶液一边加入醋酸酐,充分混合。注意操作时避免浓HCl 溅出,最好在通风条件下进行。
生物体内有些组织,如神经组织中的蛋白质,对带负电荷的核酸探针较易吸附。经该液乙酰化处理后,可使切片标本表现带上负电荷,有排斥带负电的核酸探针,减少非特异吸附,降低反应背景的作用。
4.RNA酶溶液

取RNA酶A溶解于100ml DEPC水中,分装成小份(1ml,10mg/ml),-20℃储存。

临用前,取RNA酶A储备液,用2×SSC溶解配成工作液(0.01mg/ml).
5.0.2%

取2ml Triton X-100加入998ml PBS中,充分振荡使其充分混合。
七、杂交用液
1.SSC(Standard Saline Citrate, SSC)
通常配成10×,20×,50×的储备液,如下:

配制:先称取上述两种试剂,溶于约800ml ddH2O中,滴加10N的NaOH,将pH值调至7.0,补足ddH2O至1000ml,加入终浓度为0.1%~0.2%的DEPC,分装后高压灭菌,可室温保存。
该液主要用于配制予杂交液及杂交后的各种洗脱液,以保持一定的离子强度。此外,在用于杂交的湿盒内也常用5×的SSC以保持一定湿度。
2.Denhardt’s液
通常配成10×,50×或100×的储备液

配制:称取上述试剂,溶于800ml左右灭菌ddH2O中,定容至1000ml后,过滤后于-20℃保存备用。
该液用于配制杂交液及予杂交液等。
3.杂交液及予杂交液

※:临用前加;△予杂交液不加
配制:先以去离子甲酰胺与SSC于室温混合,加入硫酸葡聚糖于50℃促溶,依次加入其它成份。硫酸葡聚糖在室温常需数小时才能完全溶解。有时需旋涡振荡。定容后充分混合。根据使用方便可分装(最好用铝箔将瓶子包好)存于4℃,可达数月。注意,杂交缓冲液在使用前切忌污染。
变性被打断的无关DNA(常为鲑精DNA或鲱精DNA)可在予杂交及杂交前加入。此外,有许多物质如肝素、多聚腺甘酸、醋酸钠等多种成份,可根据需要加入杂交液中,上述配方所列只是不可缺少的基本成份。
配制好的杂交液不宜反复冻融,否则易产生硫酸葡聚糖沉淀现象。使用前最好加热至50℃,使其充分溶解后再加入探针分子。至于探针的浓度视实验目的、探针类型及标记方法而异。通常RNA探针分子浓度为0.5~2μg/ml,DNA探针浓度为1μg/ml,此外,如使用35S标记的探针,还需加入终浓度为100mmol/L的二硫苏糖醇(Dithiothreitol,DTT)至杂交液及杂交后的洗脱液中。
八、杂交后漂洗溶液
无论用何种标记方法及何种信号显示方法,在杂交后洗脱则是大同小异。在此,归纳几种带有共同性及常用的洗脱液。

该液常用于杂交后的初次洗脱,故离子强度(张力)较高。

该液常用于杂交后的第二次洗脱,离子强度较低,经过上述两套洗脱液洗后,有的还可用2×SSC,10%(0.1%)SDS洗脱。

主要是洗去残留的RNA,降低背景。用于以RNA为探针的原位杂交方法中。
4.Dig标记探针杂交后处理液

用ddH2O溶液并定容至1000ml。

用ddH2O溶解并定容至1000ml。

配制同上。

左旋咪唑有消除内源性磷酸酶的作用。
九、原位杂交信号显示
目前应用原位杂交方法中,信号的显示主要有放射自显影,酶底物及免疫金银等方法,在此归纳有关的主要试剂。
1.A-B显影液

称取上述试剂,按配方分别溶于50ml ddH2O中,于显影前,在室温将两者(A液及B液)按1:1混合,稍加摇动促进混合,即可将贴有切片标本的切片放入显影液,于室温避光(可暗室)反应5~15min。显影时间和温度相关,需自己根据情况摸索。终止反应只需将显影液倒出,自来水冲洗即可。倒出的AB显影液可暂时不扔,光镜下观察,若明显显影不够,还可重新或继续显影。AB显影液要求临用前配制,在显影时才将AB二液混合。否则,A液过久会产生黄色沉淀,增加背景。
AB液用于免疫金银法中,使金标记颗粒信号放大,形成棕黑色沉淀。
2.DAB-H2O显色液

配制方法见附录一。
该液用于标本被标记上辣根过氧化物酶(HRP)的方法。产物为棕黄色。
3.NBT-BCIP显色液

配制方法,详见附录一。
该液用于有碱性磷酸酶标记物的方法中。产物为紫蓝色。
4.Kodak D-19显影液

配制:先将500ml水中加温50℃,按上述配方顺序加药,同时充分搅拌,每加一种药完全溶解后,再加另一种药品,否则,所配的显影液易产生混浊而效果差,最后补足水至1000ml充分混合,室温或4℃避光保存。最好包上纸。
该液用于放射自显影时的显影。
5.Kodak F-5定影液(酸性坚膜定影液)

※:28%醋酸为3份冰醋酸和8份水混合液。
配制:同Kodak D-19显影液。
附录三 全血细胞培养染色体技术常用试剂配制
一、国内实验室应用试剂配制
(一)培养液
(1)RPMI1640培养液:称取RPMI培养基9.8g,碳酸氢钠1.9g、青霉素100u/ml,加双蒸水至1000ml,调节 pH7.2~7.4无菌过滤冻存备用。
(2)小牛血清商品:成都生物制品厂。
(3)植物凝集素(PHA):自制或成品(重庆药检所)。
(4)pH调整液:5%NaHCO3溶液高压灭菌(8磅15min),0.1N稀盐酸液100ml。
(5)秋水仙素:10mg/ml无菌过滤高压灭菌(8磅10min)。
(6)磷酸缓冲液:pH7.4。
磷酸氢二钠28.8g(H2O)、磷酸二氢钾2.67g(无水),溶于1000ml双蒸水中,加肝素,终浓度为100u/ml。
(7)Giemsa染色液:
Giemsa粉剂 1g
甘油66ml
在研钵中,加入少量甘油油仔细研磨然后放甘油全部加磨,60℃温箱中保温2h,冷却后加入甲醇66ml。装入有色瓶中混合待用。染色时用pH7.4磷酸缓冲液稀释10倍,随配随用。
(二)固定液
(1)甲酸:冰乙酸3:1混合即用。
(2)PBS缓冲液配制:
NaCl 16gNa2HPO4(12H2O)5.65g
KCl 0.4g KH2PO40.4g
加双蒸水至1000ml pH7.0。
取5%胰酶(生理盐水配制)1ml加入50ml PBS液中(最终浓度为0.025%),4℃冰箱待用。
二、细胞培养(Bhatl B和McGee JOD,1990)
1.完全培养基
RPMI76.0ml
胎牛血清 20.0ml
植物凝集素2.0ml
抗生素/抗菌素溶液(100×)1.0ml
L-谷氨酰胺(100×) 1.0ml
2.BudR(5’-Bromo-2-deoxyuridine,5’-溴-2-脱氧尿嘧啶)溶解10mg/ml BudR于dH2O中,0.2μm滤膜过滤除菌,分装后-20℃储存,BudR要在柔光(弱光)下操作。
3.胸腺嘧啶(Thymidine,Thd)按250μg/ml溶解于dH2O中,过滤后分装储存于-20℃。
4.Colcemid(Sigma)5.0μg/ml溶于dH2O中,过滤后分装储存于-20℃。
5.KCl(0.75mol/L)溶解560mg于100ml dH2O中,新鲜配制37℃保存。
6.固定剂甲醇冰醋酸按3:1(V/V)混合即可,现用现配,置冰上待用。
7.缺口平移试剂盒(Amersham和BRL公司)
8.生物素7-dATP(BRL)
9.糖原(BRL)
10.RNA酶A(Sigma)
(1)储备液
称取RNA酶A 1g溶于100ml醋酸钠中,置沸水中煮10min,分装后储于-20℃。
(2)工作液
用储备液按1:100稀释。
11.20×SSC
NaCl 175g
柠檬酸三钠 88g
dH2O1000ml
固定试剂溶解后,dH2O定容至1000ml,调pH至7.4,高压灭菌。
12.杂交液(高深度,HMmix)
去离子甲酰胺 6.0ml
100×Denhardt’s液1.0ml
50%硫酸葡聚糖 2.0ml
1%人或鲑精DNA※20×SSC
※:临用前加入,终浓度为100~200μg/ml。
该液为高浓度杂交液, 存于4℃。
13.PBT液
BSA 5%
TristonX-100/(PBS) 0.1%
注:BSA液用前应用Whatman 3mm滤纸过滤。
14.兔抗生物素(α-生物素)单克隆抗体
用PBT液1:100稀释。
该单抗现可从英国Dako公司购得。
15.金(10~20nm)标羊抗兔二抗
用PBT液1:50稀释。
16.银溶液(Janesen)
17.Hoedst33258(Sigma)
储备液(100×)
Hoedst染料 5mg
甲醇 10ml
工作液:用2×SSC 1:100稀释储备液。
附录四 实验室常用技术参数资料
一、核酸及蛋白质常用数据
1.
| 化合物 | 分子量 | λmax(pH7.0) | 1摩尔溶液(pH7.0)中λmax时的最大吸收值 | OD280/OD260 |
| ATP | 507 | 259 | 15400 | 0.15 |
| CTP | 483 | 271 | 9000 | 0.97 |
| GTP | 523 | 253 | 13700 | 0.66 |
| UTP | 484 | 262 | 10000 | 0.38 |
| dATP | 494 | 259 | 15200 | 0.15 |
| dCTP | 467 | 271 | 9300 | 0.98 |
| dGTP | 507 | 253 | 13700 | 0.66 |
| dTTP | 482 | 267 | 9600 | 0.71 |
2.常用核酸的长度与分子量
| 核酸 | 核苷酸数 | 分子量 |
| λDNA | 48502(双链环状) | 3.0×107 |
| pBR322 | 4363(双链) | 2.8×106 |
| 28SrRNA | 4800 | 1.6×106 |
| 23SrRNA | 3700 | 1.2×106 |
| 18SrRNA | 1900 | 6.1×105 |
| 19SrRNA | 1700 | 5.5×105 |
| 5SrRNA | 120 | 3.6×104 |
| tRNA(大肠杆菌) | 75 | 2.5×104 |
3.常用核酸蛋白换算数据
(1)重量换算
1μg=10-6g 1pg=10-12g
1ng=10-9g 1fg=10-15g
(2)分光光度换算:
1A260双链DNA=50μg/ml
1A260单链DNA=30μg/ml
1A260单链RNA=40μg/ml
(3)DNA摩尔换算:
1μg 100bp DNA=1.52pmol=3.03pmol末端
1μg pBR322 DNA=0.36pmol
1pmol 1000bp DNA=0.66μg
1pmol pBR322=2.8μg
1kb双链DNA(钠盐)=6.6×105道尔顿
1kb单链DNA(钠盐)=3.3×105道尔顿
1kb单链RNA(钠盐)=3.4×105道尔顿
(4)蛋白摩尔换算:
100pmol分子量100,000蛋白质=10μg
100pmol分子量50,000蛋白质=5μg
100pmol分子量10,000蛋白质=1μg
氨基酸的平均分子量=126.7道尔顿
(5)蛋白质/DNA换算:
1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质
10,000MW蛋白质=270bp DNA
30,000MW蛋白质=810bp DNA
50,000MW蛋白质=1.35kb
100,000MW蛋白质=2.7kb DNA
4.常用蛋白质分子量标准参照物
| (1)高分子量标准参照 | (2)中分子量标准参照 | (3)低分子量标准参照 | |||
| 肌球蛋白 | 分子量 | 磷酸化酶B | 97,400 | 碳酸酐酶 | 31,00 |
| 肌球蛋白 | 212,000 | 牛血清白蛋白 | 66,200 | 大豆脻蛋白酶 | 21,500 |
| β-半乳糖甘酶B | 116,000 | 谷氨酶脱氢酶 | 55,000 | 抑制剂 | |
| 磷酸化酶B | 97,400 | 卵白蛋白 | 42,700 | 马心肌球蛋白 | 16,900 |
| 牛血清白蛋白 | 66,200 | 醛缩酶 | 40,000 | 溶菌酶 | 14,400 |
| 过氧化氢酶` | 57,000 | 碳酸酐酶 | 31,000 | 肌球蛋白(F1) | 8,100 |
| 醛缩酶 | 40,000 | 大豆脻蛋白酶 | 21,500 | 肌球蛋白(F2) | 6,200 |
| 抑制剂 | 肌球蛋白(F3) | 2,500 | |||
| 溶菌酶 | 14,400 | ||||
5.常用DNA分子量标准参照物
| λDNA/HindⅢ | λDNA/EcoRⅠ | λ/HindⅢ+EcoRⅠ | pBR322/HaeⅢ | |
| 23130 | 21226 | 21227 | 587 | 123 |
| 9416 | 7421 | 5148 | 405 | 104 |
| 6557 | 5804 | 4973 | 504 | 89 |
| 4361 | 5643 | 4268 | 458 | 80 |
| 2322 | 4843 | 3530 | 434 | 64 |
| 2027 | 3530 | 2027 | 267 | 57 |
| 564 | 1904 | 234 | 51 | |
| 125 | 1584 | 213 | 21 | |
| 1375 | 192 | 18 | ||
| 974 | 184 | 11 | ||
| 831 | 124 | 7 | ||
| 564 | ||||
| 125 | ||||
续上表
| pBR322/HinfⅠ | φχ174/HinfⅠ | φχ174/Hae Ⅲ | φχ174/TapⅠ | |
| 1631 | 726 | 140 | 1353 | 2914 |
| 517 | 713 | 118 | 1078 | 1175 |
| 506 | 553 | 100 | 872 | 404 |
| 396 | 500 | 82 | 603 | 327 |
| 344 | 417 | 66 | 310 | 231 |
| 298 | 413 | 48 | 281 | 141 |
| 221 | 311 | 42 | 271 | 87 |
| 220 | 249 | 40 | 234 | 54 |
| 154 | 200 | 24 | 194 | 33 |
| 75 | 151 | 118 | 20 | |
| 72 | ||||
二、常用缓冲液
1.分子克隆常用缓冲液
2.磷酸缓冲液
(1)25℃下0.1mol/L磷酸钾缓冲液的配制※
| pH | 1mol/L K2HPO4(ml) | 1mol/L KH2PO4(ml) |
| 5.8 | 8.5 | 91.5 |
| 6.0 | 13.2 | 86.8 |
| 6.2 | 19.2 | 80.8 |
| 6.4 | 27.8 | 72.2 |
| 6.6 | 38.1 | 61.9 |
| 6.8 | 49.7 | 50.3 |
| 7.0 | 61.5 | 38.5 |
| 7.2 | 71.7 | 28.3 |
| 7.4 | 80.2 | 19.8 |
| 7.6 | 86.6 | 13.4 |
| 7.8 | 90.8 | 9.2 |
| 8.0 | 94.0 | 6.2 |
(2)25℃下0.1mol/L磷酸钠缓冲液的配制※
| pH | 1mol/L Na2HPO4(ml) | 1mol/L NaH2PO4(ml) |
| 5.8 | 7.9 | 92.1 |
| 6.0 | 12.0 | 88.0 |
| 6.2 | 17.8 | 82.2 |
| 6.4 | 25.5 | 74.5 |
| 6.6 | 35.2 | 64.8 |
| 6.8 | 46.3 | 53.7 |
| 7.0 | 57.7 | 42.3 |
| 7.2 | 68.4 | 31.6 |
| 7.4 | 77.4 | 22.6 |
| 7.6 | 84.5 | 15.5 |
| 7.8 | 89.6 | 10.4 |
| 8.0 | 93.2 | 6.8 |
※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch方程计算其pH值:
pH=pK’+1g([质子受体]/[质子供体])
在此,pK’=6.86(25℃)。
3.电泳缓冲液
测序凝胶加样缓冲液
98%去离子甲酰胺
10mol/L EDTA(pH8.0)
0.025%二甲苯青FF
0.025%溴酚蓝
甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处理。不过,一旦略呈黄色,则应用在磁力搅拌器上将甲酰胺与Dowex XG8混合床树脂共同搅拌1小时进行去离子处理,并用Whatman 1号滤纸过滤2次,去离子甲酰胺分装成小份,充氮存于-70℃。
常用的电泳缓冲液
| 缓冲液 | 使用液 | 浓贮存液(每升) |
| Tris-乙酸(TAE) | 1×:0.04mol/L Tris-乙酸 | 50×:242gTris碱 |
| 0.001mol/L EDTA | 57.1ml冰乙酸 | |
| 100ml 0.5mol/L EDTA(pH8.0) | ||
| Tris-磷酸(TPE) | 1×:0.09mol/L Tris-磷酸 | 10×:10gTris碱 |
| 0.002mol/L EDTA | 15.5ml85%磷酸(1.679g/ml) | |
| 40ml 0.5mol/L EDTA(pH8.0) | ||
| Tris-硼酸(TBE)a | 0.5×0.045mol/L Tris-硼酸 | 5×:54gTris碱 |
| 0.001mol/L EDTA | 27.5硼酸 | |
| 20ml 0.5mol/L EDTA(pH8.0) | ||
| 碱性缓冲液b | 1×:50mmol/L NaOH | 1×:5ml 10mol/L NaOH |
| 1mmol/L EDTA | 2ml 0.5mmol/L EDTA(pH8.0) | |
| Tris-甘氨酸c | 1×:25mmol/L Tris | 5×:15.1gTris |
| 250mmol/L 甘氨酸 | 94g苷氨酸(电泳级)(pH8.3) | |
| 0.1% SDS | 50ml 10% SDS(电泳级) |
说明:
①TBE溶液长时间存放后会形成沉淀物,为避免这一问题,可在室温下用玻璃瓶保存5×溶液,出现沉淀后则予以废弃。
以片都以1×TBE作为使用液(即1:5稀释浓贮液)进行琼脂糖凝胶电泳。但0.5×的使用液已具备足够的缓冲容量。目前几乎所有的琼脂糖胶电泳都以1:10稀释的贮存液作为使用液。
进行聚丙烯酰胺凝胶垂直槽的缓冲液槽较小, 故通过缓冲液的电流量通常较大,需要使用1×TBE以提供足够的缓冲容量。
②碱性电泳缓冲液应现用现配。
③Tris-甘氨酸缓冲液用SDS聚丙烯酰胺凝胶电泳。
2×SDS凝胶加样缓冲液:
100mmol/L Tris·HCl(6.8)
200mmol/L二硫苏糖醇(DTT)
4%SDS(电泳级)
0.2%溴酚蓝
20%甘油
不含DTT的2×SDS凝胶加样缓冲液可保存于室温,应在临用前取1mol/L贮存液现加于上述缓冲液中。
4.凝胶加样缓冲液
| 缓冲液类型 | 6×缓冲液 | 贮存温度 |
| Ⅰ | 0.25%溴酚蓝 | 4℃ |
| 0.25%二甲苯青FF | ||
| 40%(W/V)蔗糖水溶液 | ||
| Ⅱ | 0.25溴酚蓝 | 室温 |
| 0.25%二甲苯青FF | ||
| 15%聚蔗糖(Ficoll400) | ||
| Ⅲ | 0.25%溴酚蓝 | 4℃ |
| 0.25%二甲苯青FF | ||
| 30%甘油水溶液 | ||
| Ⅳ | 0.25%溴酚蓝 | 4℃ |
| 40%(W/V)蔗糖水溶液 | ||
| 碱性加样缓冲液: | ||
| 300mmol/L NaOH | ||
| 6mmol/L EDTA | ||
| Ⅴ | 18%聚蔗糖(Ficoll400) | 4℃ |
| 0.15%溴甲酚绿 | ||
| 0.25%二甲苯青FF |
使用以上凝胶加样缓冲液的目的有三:增大样品密度;以确保DNA均匀进入样品孔内;使样品呈现颜色,从而使加样操作更为便利,含有在电块中能以可预知速率向阳极泳动的染料。溴酚蓝在琼脂糖中移动的速率约为二甲苯青FF的2.2倍,而与琼脂糖浓度无关。以0.5×TBF作电泳液时,溴酚蓝在琼脂糖中的泳动速率约与长300bp的双链线状DNA相同,而二甲苯青FF的泳动则与长4kb的双链线状DNA相同。在琼脂糖浓度为0.5%~1.4%的范围内,这些对应关系受凝胶浓度变化的影响并不显著。
选用哪一种加样染料纯属个人喜恶。但是,对于碱性凝胶应当使用溴甲酚绿作为示踪染料,因为在碱性pH条件下其显色较溴酚更蓝为鲜明。
5.各种pH值的Tris缓冲液的配制
| 各种pH值的Tris缓冲液的配制 | |
| 所需pH值(25℃) | 0.1mol/L HCl的体积 |
| 7.1 | 45.7 |
| 7.2 | 44.7 |
| 7.3 | 43.4 |
| 7.4 | 42.0 |
| 7.5 | 40.3 |
| 7.6 | 38.5 |
| 7.7 | 36.6 |
| 7.8 | 34.5 |
| 7.9 | 32.0 |
| 8.0 | 29.2 |
| 8.1 | 26.2 |
| 8.2 | 22.9 |
| 8.3 | 19.9 |
| 8.4 | 17.2 |
| 8.5 | 14.7 |
| 8.6 | 12.4 |
| 8.7 | 10.3 |
| 8.8 | 8.5 |
| 8.9 | 7.0 |
某一特定pH值的0.05mol/LTris缓冲液的配制:将50ml 0.1mol/L Tris碱溶液与上表所示相应体积(单位:ml)的0.1ml/L HCl混合,加水将体积调至100ml
(2)温度对50mmol/LTris·HCl液pH值的影响
| 4℃ | 25℃ | 37℃ |
| 8.1 | 7.5 | 7.2 |
| 8.2 | 7.6 | 7.3 |
| 8.3 | 7.7 | 7.4 |
| 8.4 | 7.8 | 7.5 |
| 8.5 | 7.9 | 7.6 |
| 8.6 | 8.0 | 7.7 |
| 8.7 | 8.1 | 7.8 |
| 8.8 | 8.2 | 7.9 |
| 8.9 | 8.3 | 8.0 |
| 9.0 | 8.4 | 8.1 |
| 9.1 | 8.5 | 8.2 |
| 9.2 | 8.6 | 8.3 |
| 9.3 | 8.7 | 8.4 |
| 9.4 | 8.8 | 8.5 |
(6)常用缓冲液的pKa值
| 缓冲液 | 分子量 | pKa值 | 缓冲范围 |
| Trisa | 12.1 | 8.08 | 7.1~7.9 |
| HEPESb | 283.3 | 7.47 | 7.2~8.2 |
| MPOSc | 209.3 | 7.15 | 6.6~7.8 |
| PIPESd | 304.3 | 6.76 | 6.2~7.3 |
| MESe | 195.2 | 6.09 | 5.4~6.8 |
a:三羟甲基氨基甲烷;b:N-2-羟乙基哌嗪-N’-2-乙磷酸;c:3-(N-吗啉代)丙磺酸;d:N,N’-双(2-乙磺酸)哌嗪;e:2-(N-吗啉代)乙磺酸。
7.温度对常用缓冲液pH的影响
| 缓冲体系 | pKa(20℃) | △pKa/10℃ |
| Mes | 6.15 | -0.110 |
| Ada | 6.60 | -0.110 |
| PiPes | 6.80 | -0.085 |
| Aces | 6.90 | -0.200 |
| Bes | 7.15 | -0.160 |
| Mops | 7.20 | -0.013 |
| Tes | 7.50 | -0.200 |
| Hepes | 7.55 | -0.014 |
| Tricine | 8.15 | -0.210 |
| Tris | 8.30 | -0.310 |
| Bicine | 8.35 | -0.180 |
| Glycylglycine | 8.40 | -0.280 |
三、常用酶的配制
1.溶菌酶
用水配制成50mg/ml的溶菌酶溶液,分装成小份并保存于-20℃。每一小份一经使用后便予丢弃。
2.蛋白水解酶类
| 贮存液 | 贮存温度 | 反应浓度 | 反应缓冲液 | 温度 | 预处理 | |
| 0.01mol/L Tris(pH7.8) | ||||||
| 链霉蛋白酶a | 20mg/ml | -20℃(溶于水) | 1mg/ml | 0.01mol/L EDTA | 37℃ | 自消化b |
| 0.5% SDS | ||||||
| 0.01mol/L Tris(pH7.8) | ||||||
| 蛋白酶Kc | 20mg/ml | -20℃(溶于水) | 50μg/ml | 0.005mol/L EDTA | 37~56℃ | 无须预处理 |
| 0.5% SDS | ||||||
a:链霉蛋白酶是从链球菌(Streptomycesgriseus)中分离到的一种丝氨酸酶和酸性蛋白酶的混合物。
b:自消化可消除DNA酶和RNA酶的污染,经自消化的链酶蛋白酶的配制方法如下:把该酶的粉末溶解于10mmol./lTris·HCl(pH7.5)、10mmol/l NaCl中,配成20mg/ml浓度,于37℃温育1h。经消化的链霉蛋白酶分装成小份放在密封试管中,保存-20℃。
c:蛋白酶K是一种枯草蛋白酶类的高活性蛋白酶,从林伯氏白色念球菌(Tritirachium album Limber)中纯化得到。该酶有两个Ca2+结合位点,它们离酶的活性中心有一定距离,与催化机理并无直接关系。然而,如果从该酶中除去Ca2+,由于出现远程的结构变化,催化活性将丧失80%左右,但其剩余活性通常已足以降解在一般情况下污染酸制品的蛋白质。所以,蛋白酶K消化过程中通常加入EDTA(以抑制依赖于Mg2+的核酸酶的作用)。但是,如果要消化对蛋白酶K具有较强耐性的蛋白,如角蛋白一类,则可能需要使用含有1mmol/l Ca2+而不含EDTA的缓冲液。在消化完毕后、纯化核酸前要加入EGT(pH8.0)至终浓度为2mmol/L,以鳌合Ca2+。
3.无DNA酶的RNA酶
将胰RNA酶(RNA酶A)溶于10mmol/l Tris·HCl(pH7.5)、15mmol/l NaCl中,配成10mg/ml的浓度,于100℃加热15min,缓慢冷却至室温,分装成小份保存于-20℃。
四、常用抗生素溶液
| 抗生素 | 贮存液a | 工作浓度 | ||
| 浓度 | 保存条件 | 严紧型质粒 | 松弛型质粒 | |
| 氨苄青霉素 | 50mg/ml(溶于水) | -20℃ | 20μg/ml | 60μg/ml |
| 羧苄青霉素 | 50mg/ml(溶于水) | -20℃ | 20μg/ml | 60μg/ml |
| 氯霉素 | 34mg/ml(溶于乙醇) | -20℃ | 25μg/ml | 170μg/ml |
| 卡那霉素 | 10mg/ml(溶于水) | -20℃ | 10μg/ml | 50μg/ml |
| 链霉素 | 10mg/ml(溶于水) | -20℃ | 10μg/ml | 50μg/ml |
| 四环素b | 5mg/ml(溶于乙醇) | -20℃ | 10μg/ml | 50μg/ml |
a:以水为溶剂的抗生素贮存液通过0.22μm滤器过滤除菌。以乙醇为溶剂的抗生素溶液无须除菌处理。所有抗生素溶液均应放于不透光的容器保存。
b:镁离子是四环素的拮抗剂,四环素抗性菌的筛选应使用不含镁盐的培养基(如LB培养基)。
五、常用贮存液的配制
1.30%丙烯酰胺溶液
【配制方法】
将29g丙烯酰胺和1g N,N’-亚甲双丙烯酰胺溶于总体积为60ml的水中。加热至37℃溶解之,补加水至终体积为100ml。用Nalgene滤器(0.45μm孔径)过滤除菌,查证该溶液的pH值应不大于7.0,置棕色瓶中保存于室温。
【注意】
丙烯酰胺具有很强的神经毒性并可以通过皮肤吸收,其作用具累积性。称量丙烯酰胺和亚甲双丙烯酰胺时应戴手套和面具。可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能会含有少量未聚合材料。
一些价格较低的丙烯酰胺和双丙烯酰胺通常含有一些金属离子,在丙烯酰胺贮存液中加入大约0.2体积的单床混合树脂(MB-1Mallinckrodt),搅拌过夜,然后用Whatman 1号滤纸过滤以纯化之。
在贮存期间,丙烯酰胺和双丙烯酰胺会缓慢转化成丙烯酰和双丙烯酸。
2.40%丙烯酰胺
【配制方法】
把380g丙烯酰胺(DNA测序级)和20g N,N’-亚甲双丙烯酰胺溶于总体积为600ml的蒸馏水中。继续按上述配制30%丙烯酰胺溶液的方法处理,但加热溶解后应以蒸馏水补足至终体积为1L。
【注意】
见上述配制30%丙烯酰胺的说明,40%丙烯酰胺溶液用于DNA序列测定。
3.放线菌素D溶液
【配制方法】
把20mg放线菌素D溶解于4ml 100%乙醇中,1:10稀释贮存液,用100%乙醇作空白对照读取OD440值。放线菌素D(分子量为1255)纯品在水溶液中的摩尔消化系数为21,900,故而1mg/ml的放线菌素D溶液在440nm处的吸光值为0.182,放线菌素D的贮存液应放在包有箔片的试管中,保存于-20℃。
【注意】
放线菌素D是致畸剂和致癌剂,配制该溶液时必须戴手套并在通风橱内操作,而不能在开放在实验桌面上进行,谨防吸入药粉或让其接触到眼睛或皮肤。
药厂提供的作治疗用途的放线菌素D制品常含有糖或盐等添加剂。只要通过测量贮存液在440nm波长处的光吸收确定放线菌素D的浓度,这类制品便可用于抑制自身引导作用。
4.0.1mol/L腺苷三磷酸(ATP)溶液
【配制方法】
在0.8ml水中溶解60mgATP,用0.1mol/L NaOH调至pH值至7.0,用蒸馏水定容1ml,分装成小份保存于-70℃
5.10mol/L乙酸酰溶液
【配制方法】
把770g乙酸酰溶解于800ml水中,加水定容至1L后过滤除菌。
6.10%过硫酸铵溶液
【配制方法】
把1g过硫酸铵溶解于终量为10ml的水溶液中,该溶液可在4℃保存数周。
7.BCIP溶液
【配制方法】
把0.5g的5-溴-4-氯-3-吲哚磷酸二钠盐(BCIP)溶解于10ml 100%的二甲基甲酰胺中,保存于4℃
8.2×BES缓冲盐溶液
【配制方法】
用总体积90ml的蒸馏水溶解1.07g盐溶液BES[N,N-双(2-羟乙基)-2-氨基乙磺酸]、1.6g NaCl和0.027g Na2HPO4,室温下用HCl调节 该溶液的pH值至6.96、然后加入蒸馏水定容至100ml,用0.22μm滤器过滤除菌,分装成小份,保存于-20℃。
9.1mol/L CaCl2溶液
【配制方法】
在200ml蒸馏水中溶解54gCaCl2·6H2O,用0.22μm滤器过滤除菌,分装成10ml小份贮存于-20℃。
【注意】
制备感受态细胞时,取出一小份解冻并用蒸馏水稀释至100ml,用Nalgene滤器(0.45μm孔径)过滤除菌,然后骤冷至0℃。
10.2.5mol/L CaCl2溶液
【配制方法】
在20ml蒸馏水中溶解13.5gCaCl2·6H2O,用0.22μm滤器过滤除菌,分装成1ml小份贮存于-20℃。
11.1mol/L二硫苏糖醇(DTT)溶液
【配制方法】
用20ml 0.01mol/L乙酸钠溶液(pH5.2)溶解3.09g DTT,过滤除菌后分装成1ml小份贮存于-20℃。
【注意】
DTT或含有DTT的溶液不能进行高压处理。
12.脱氧核苷三磷酸(dNTP)溶液
【配制方法】
把每一种dNTP溶解于水至浓度各为100mmol/L左右,用微量移液器吸取0.05mol/l Tris碱分别调节 每一dNTP溶液的pH值7.0(用pH试纸检测),把中和后的每种dNTP溶液各取一份作适当稀释,在下表中给出的波长下读取光密度计算出每种dNTP的实际浓度,然后用水稀释成终浓度为50mmol/L的dNTP,分装成小份贮存于-70℃。
| 碱基 | 波长(nm) | 消化系数(ε)[L/(mol·cm)] |
| A | 259 | 1.54×104 |
| G | 253 | 1.37×104 |
| C | 271 | 9.10×103 |
| T | 260 | 7.40×103 |
比色杯光径为1cm时,吸光度=εM
13.0.5mol/l EDTA(pH8.0)溶液
【配制方法】
在800ml水中加入186.1g二水乙二胺四乙酸二钠(EDTA-Na·2H2O),在磁力搅拌器上剧烈搅拌,用NaOH调节 溶液的pH值至8.0(约需20g NaOH颗粒)然后定容至1L,分装后高压灭菌备用。
【注意】
EDTA二钠盐需加入NaOH将溶液的pH值调至接近8.0,才能完全溶解。
14.溴化乙锭(10mg/ml溶液)
【配制方法】
在100ml水中加入1g溴化乙锭,磁力搅拌数小时以确保其完全溶解,然后用铝箔包裹容器或转移至棕色瓶中,保存于室温。
【注意】
小心:溴化乙锭是强诱变剂并有中度毒性,使用含有这种染料的溶液时务必戴上手套,称量染料时要戴面罩。
15.2×HEPES缓冲盐溶液
【配制方法】
用总量为90ml的蒸馏水溶解1.6g NaCl、0.074g KCl、0.027g Na2PO4·2H2O、0.2g葡聚糖和1gHEPES,用0.5mol/lNaOH调节 pH值至7.05,再用蒸馏水定容至100ml。用0.22μm滤器过滤除菌,分装成5ml小份,贮存于-20℃。
16.IPTG溶液
【配制方法】
IPTG为异丙基硫代-β-D-半乳糖苷(分子量为238.3),在8ml蒸馏水中溶解2g IPTG后,用蒸馏水定容至10ml,用0.22μm滤器过滤除菌,分装成1ml小份贮存于-20℃。
17.1mol/L乙酸镁溶液
【配制方法】
在800ml水中溶解214.46g四水乙酸镁,用水定容至1L过滤除菌。
18.1mol/L MgCl2溶液
【配制方法】
在800ml水中溶解203.4gMgCl2·6H2O,用水定容至1L,分装成小份并高压灭菌备用。
【注意】
MgCl2极易潮解,应选购小瓶(如100g)试剂,启用新瓶后勿长期存放。
19.β-巯基乙醇(BME)溶液
【配制方法】
一般得到的是14.4mol/L溶液,应装在棕色瓶中保存于4℃。
【注意】
BME或含有BME的溶液不能高压处理。
20.NBT溶液
【配制方法】
把0.5g氯化氮蓝四唑溶解于10ml 70%的二甲基甲酰胺中,保存于4℃。
21.酚/氯仿溶液
【配制方法】
把酚和氯仿等体积混合后用0.1mol/L Tris·HCl(pH7.6)抽提几次以平衡这一混合物,置棕色玻璃瓶中,上面覆盖等体积的0.01mol/l Tris·HCl(pH7.6)液层,保存于4℃。
【注意】
酚腐蚀性很强,并可引起严重灼伤,操作时应戴手套及防护镜,穿防护服。所有操作均应在化学通风橱中进行。与酚接触过的部位皮肤应用大量的水清洗,并用肥皂和水洗涤,忌用乙醇。
22.10mmol/L苯甲基磺酰氟(PMSF)溶液
【配制方法】
用异丙醇溶解PMSF成1.74mg/ml(10mmol/L),分装成小份贮存于-20℃。如有必要可配成浓度高达17.4mg/ml的贮存液(100mmol/L)。
【注意】
PMSF严重损害呼吸道粘膜、眼睛及皮肤,吸入、吞进或通过皮肤吸收后有致命危险。一旦眼睛或皮肤接触了PMSF,应立即用大量水冲洗之。凡被PMSF污染的衣物应予丢弃。
PMSF在水溶液中不稳定。应在使用前从贮存液中现用现加于裂解缓冲液中。PMSF在水溶液中的活性丧失速率随pH值的升高而加快,且25℃的失活速率高于4℃。pH值为8.0时,20μmmol/l PMSF水溶液的半寿期大约为85min,这表明将PMSF溶液调节 为碱性(pH>8.6)并在室温放置数小时后,可安全地予以丢弃。
23.磷酸盐缓冲溶液(PBS)溶液
【配制方法】
在800ml蒸馏水中溶解8gNaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,用HCl调节 溶液的pH值至7.4加水定容至1L,在15lbf/in2(1034×105Pa)高压下蒸气灭菌20min。保存于室温。
24.1mol/L乙酸钾(pH7.5)溶液
【配制方法】
将9.82g乙酸钾溶解于90ml纯水中,用2mol/L乙酸调节 pH值至7.5后加入纯水定容到1L,保存于-20℃。
25.乙酸钾溶液(用于碱裂解)
【配制方法】
在60ml 5mol/L乙酸钾溶液中加入11.5ml冰乙酸和28.5ml水,即成钾浓度为3mol/L而乙酸根浓度为5mol/L的溶液。
26.3mol/L乙酸钠(pH5.2和pH7.0)溶液
【配制方法】
在80ml水中溶解408.1g三水乙酸钠,用冰乙酸调节 pH值至5.2或用稀乙酸调节 pH值至7.0,加水定容到1L,分装后高压灭菌。
27.5mol/L NaCl溶液
【配制方法】
在800ml水中溶解292.2gNaCl加水定容至1L,分装后高压灭菌。
28.10%十二烷基硫酸钠(SDS)溶液
【配制方法】
在900ml水中溶解100g电泳级SDS,加热至68℃助溶,加入几滴浓盐酸调节 溶液的pH值至7.2,加水定容至1L,分装备用。
【注意】
SDS的微细晶粒易扩散,因此称量时要戴面罩,称量完毕后要清除残留在称量工作区和天平上的SDS,10%SDS溶液无须灭菌。
29.20×SSC溶液
【配制方法】
在800ml水中溶解175.3gNaCl和88.2g柠檬酸钠,加入数滴10mol/l NaOH溶液调节 pH值至7.0,加水定容至1L,分装后高压灭菌。
30.20×SSPE溶液
【配制方法】
在800ml水中溶解17.5gNaCl、27.6g NaH2PO4·H2O和7.4g EDTA,用NaOH溶液调节 pH值至7.4(约需6.5ml 10ml/L NaOH),加水定容至1L,分装后高压灭菌。
31.100%三氯乙酸溶液
【配制方法】
在装有500g TCA的瓶中加入227ml水,形成的溶液含有100%(M/V)TCA。
32.1mol/L Tris溶液
【配制方法】
在800ml水中溶解121.91gTris碱,加入浓HCl调节 pH值至所需值。
pH HCl
7.4 70ml
7.6 60ml
8.0 42ml
应使溶液冷至室温后方可最后调定pH值,加水定容至1L,分装后高压灭菌。
【注意】
如1mol/L溶液呈现黄色,应予丢弃并置备质量更好的Tris。
尽管多种类型的电极均不能准确测量Tris溶液的pH值,但仍可向大多数厂商购得合适的电极。
Tris溶液的pH值因温度而异,温度每升高1℃,pH值大约降低0.03个单位。例如:0.05mol/L的溶液在5℃、25℃、和37℃时的pH值分别为9.5、8.9和8.6。
33.Tris缓冲盐溶液(TBS)(25mmol/l Tris)
【配制方法】
在800ml蒸馏水中溶解8gNaCl、0.2g KCl和3g Tris碱,加入0.015g酚并用HCl调至pH值至7.4,用蒸馏水定容至1L,分装后在151bf/in2(1.034×105Pa)高压下蒸汽灭菌20min,于室温保存。
34.X-gal溶液
【配制方法】
X-gal为5-溴-4-氯-3-吲哚-β-D半乳糖苷。用二基甲酰胺溶解X-gal配制成的20mg/ml的贮存液。保存于一玻璃管或聚丙烯管中,装有X-gal溶液的试管须用铝箔封裹以防因受光照而被破坏,并应贮存于-20℃。X-gal溶液无须过滤除菌。
杂交试验中用于降低背景的封闭剂
| 试剂 | 用途 |
| Denhardt试剂 | Northern杂交 |
| 使用RNA探针的杂交 | |
| 单拷贝序列的Southern杂交 | |
| 将DNA固定于尼龙膜上的杂交 | |
| Denhardt试剂通常配制50×贮存液,过滤后保存于-20℃。可将该贮存液10倍稀释于预杂交液(常为含有0.5%SDS和100μg/ml经变性被打断的鲑精DNA的6×SSC或6×SSPE)中。50×Denhardt液中含5g聚蔗糖(Ficoll,400型,Pharmacia)、5g聚乙烯吡咯烷酮和5g牛血清白蛋白(组分V”Sigmal),加水至终体积为500ml。 | |
| BLOTTO | Grunstein-Hogness杂交 |
| Benton-Davis杂交 | |
| 除单拷贝序列Southern杂交以外的所有Southern杂交 | |
| 斑点印迹 | |
| 1×BLOTT(牛乳转移技术优化液,Bovine Lacto Transfer Technique Optimizer),是含5%胶脂奶粉和0.02%叠氮钠的水溶液,应保存于4℃。使用前可用预杂交液稀释25倍。BLOTTO不应与高浓度的SDS并用,因为后者会导致牛奶中蛋白质析出。如果杂交背景不合要求,可在杂交液中加入NP-40至终浓度为1%。BLOTTO不能用作Northern杂交的封闭剂,因为这一封闭剂中可能含有RNA酶,其活性之高使人无法接受。 | |
| 注意:叠氮钠有毒性,取用时需戴手套小心操作。含叠氮钠的溶液应予明确标记。 | |
| 肝素 | Southern杂交 |
| 原位杂交 | |
| 肝素(Sigma H-7005,从猪中提取的二级产品或相当等级的产品)用4×SSPE或4×SSC溶解配制成50mg/ml的浓度,保存于4℃。肝素在含有葡聚糖硫酸酯的杂交液中用作封闭剂的浓度为500μg/ml,在不含葡聚糖硫酸酯的杂交液中的浓度为50μg/ml。 | |
| 经变性并被打断的鲑精DNA | southern和Northern杂交 |
| 把鲑鱼精子DNA(Sigma,Ⅲ,盐钠)溶解于水配制成10mg/ml的浓度,必要时于室温磁力搅拌2~4h助溶。把溶液中NaCl的浓度调至0.1mol/L,并用酚和酚/氯仿各抽提一次,回收水相。合DNA溶液快速通17号皮下注射针头12次,以剪切DNA。加入2倍体积用冰预冷的乙醇沉淀DNA。离心回收DNA并重溶于水,配制成10mg/ml的浓度,测定溶液的OD260值并计算出精确的DNA浓度,然后煮沸10min,分装成小份保存于-20℃。使用前置沸水浴中加热5min,然后迅速在冰浴中骤冷。预杂交液中应含有100μg/ml经变性并被打断的鲑鱼精子DNA | |
六、常用凝胶的技术参数
1.葡聚糖凝胶的某些技术数据
| 种类 | 干颗粒直径(μ) | 分子量分级范围 | 床体积毫升/克干分子筛 | 得水值 | 溶胀最少平衡时间(h) | 柱头压力(kPa)(2.5cm直径柱) | ||
| 肽及球形蛋白质 | 葡聚糖(线性分子) | 室温 | 沸水浴 | |||||
| Sephadex G-10 | 40~ 120 | ~700 | ~700 | 2~ 3 | 1.0±0.1 | 3 | 1 | |
| Sephadex G-10 | 40~ 120 | ~1500 | 1500 | 2.5~3.5 | 1.5±3.5 | 3 | 1 | |
| Sephadex G-25 | ||||||||
| 粗级 | 100~300 (≈5~100目) |
|||||||
| 中级 | 50~150 (≈100~200目) |
1,000~5,000 | 100~5,000 | 4~6 | 1.5±0.2 | 6 | 2 | |
| 细级 | 20~800(≈200~400目) | |||||||
| 超细 | 10~40 | |||||||
| Sephadex G-50 | ||||||||
| 粗级 | 100~200 | |||||||
| 中级 | 50~150 | 1,500~ | 500~ | |||||
| 细级 | 20~80 | 30,000 | 10,000 | 9~11 | 5.0±0.3 | 6 | 2 | |
| 超细 | 10~40 | |||||||
| Sephadex G-75 | ||||||||
| 40~120 | 3,000~ | 1,000~ | ||||||
| 超细 | 10~40 | 70,000 | 950,000 | 12~15 | 7.5±0.5 | 24 | 3 | 3.92~15.86 |
| Sephadex G-100 | ||||||||
| 40~120 | 4,000~ | 1,000~ | ||||||
| 超细 | 10~40 | 1,500,000 | 150,000 | 15~20 | 10.0±1.0 | 48 | 5 | 2.35~9.41 |
| Sephadex G-150 | ||||||||
| 40~120 | 5,000~ | 1,000~ | 20~30 | |||||
| 超细 | 10~40 | 400,000 | 150,000 | 18~22 | 15.0±1.5 | 72 | 5 | 0.88~3.53 |
| Sephadex G-200 | ||||||||
| 40~120 | 5000~ | 1000~ | 30~40 | |||||
| 10~40 | 800,000 | 200,000 | 20~25 | 20.0±2.0 | 72 | 5 | 0.39~1.57 | |
2.聚丙烯酰胺凝胶的技术数据
| 型号 | 排阻的下限(分子量) | 分级分离范围(分子量) | 膨胀后的床体积(ml/g干凝胶) | 膨胀所需最少时间(室温,h) |
| Bio-gel-P-2 | 1,600 | 200~2,000 | 3.8 | 2~4 |
| Bio-gel-P-4 | 3,600 | 500~4,000 | 5.8 | 2~4 |
| Bio-gel-P-6 | 4,600 | 1,000~5,000 | 8.8 | 2~4 |
| Bio-gel-P-10 | 10,000 | 5,000~17,000 | 12.4 | 2~4 |
| Bio-gel-P-30 | 30,000 | 20,000~50,000 | 14.9 | 10~12 |
| Bio-gel-P-60 | 60,000 | 30,000~70,000 | 19.0 | 10~12 |
| Bio-gel-P-100 | 100,000 | 40,000~100,000 | 19.0 | 24 |
| Bio-gel-P-150 | 150,000 | 50,000~150,000 | 24.0 | 24 |
| Bio-gel-P-200 | 200,000 | 80,000~200,000 | 34.0 | 48 |
| Bio-gel-P-300 | 300,000 | 100~400,000 | 40.0 | 48 |
3.琼脂糖凝胶的技术数据
| 型号 | 琼脂糖含量 %(W/W) |
排阻的下限 (分子量) |
分级分离的范围(分子量) | 生产厂家 |
| Sepharose 4B | 4 | 0.3×106~3×106 | Pharmacia | |
| Sepharose 2B | 2 | 2×106~25×106 | ||
| Sagavac 10 | 10 | 2.5×105 | 1×104~2.5×105 | Seravac |
| Sagavac 8 | 8 | 7×105 | 2.5×104~7×105 | |
| Sagavac 6 | 6 | 2×106 | 5×104~2×106 | |
| Sagavac 4 | 4 | 15×106 | 2×105~15×106 | |
| Sagavac 2 | 2 | 150×106 | 5×105~15×107 | |
| Bio-gel A-0.5M | 10 | 0.5×106 | <1×104~0.5×106 | Bio-Rad |
| Bio-gel A-1.5M | 8 | 1.5×106 | <1×104~1.5×106 | |
| Bio-gel A-5M | 6 | 5×106 | 1×104~5×106 | |
| Bio-gel A-15M | 4 | 15×106 | 4×104~15×106 | |
| Bio-gel A-50M | 2 | 50×106 | 1×105~50×106 | |
| Bio-gel A-150M | 1 | 150×106 | 1×106~150×106 |
4.各处凝胶所允许的最大操作压
| 凝胶 | 最大静水压(kPa) |
| Sephadex | |
| G-10 | 9.8 |
| G-15 | 9.8 |
| G-25 | 9.8 |
| G-50 | 9.8 |
| G-75 | 4.9 |
5.琼脂糖凝胶浓度与线性DNA分辨范围
| 凝胶浓度(%) | 线性DNA长度(bp) |
| 0.5 | 1000~30000 |
| 0.7 | 800~12000 |
| 1.0 | 500~10000 |
| 1.2 | 400~7000 |
| 1.5 | 200~3000 |
| 2.0 | 50~2000 |
6.染料在变性聚丙烯酰胺凝胶中的迁移速度
| 凝胶浓度(%) | 溴酚蓝 | 二甲苯青FF |
| 5.0 | 35bp | 140bp |
| 6.0 | 26bp | 106bp |
| 8.0 | 19bp | 75bp |
| 10.0 | 12bp | 55bp |
| 20.0 | 8bp | 28bp |
7.染料在非变性聚丙烯酰胺凝胶中的迁移速度
| 凝胶浓度(%) | 溴酚蓝 | 二甲苯青FF |
| 3.5 | 100bp | 460bp |
| 5.0 | 65bp | 260bp |
| 8.0 | 45bp | 160bp |
| 12.0 | 20bp | 70bp |
| 15.0 | 15bp | 50bp |
| 20.0 | 12bp | 45bp |
七、氨基酸的特性
| 氨基酸名称 | 三字母缩写 | 单字母缩写 | 质量 | 侧链电离的pHa值 | 结构式 |
| 丙氨酸(alanine) | Ala | A | 89.09 |  |
|
| 精氨酸(arginine) | Arg | R | 174.2 | 12.48 |  |
| 天冬酰氨(asparagine) | Asn | N | 132.1 |  |
|
| 天冬氨酸(aspartic acid) | Asp | D | 133.1 | 3.86 |  |
| 半胱氨酸(systeine) | Cys | C | 121.12 |  |
|
| 谷氨酰胺(glutamine) | Gln | Q | 146.15 |  |
|
| 谷氨酸(glutamic acid) | Glu | E | 147.13 | 4.25 |  |
| 甘氨酸(glycine) | Gly | G | 75.07 |  |
|
| 组氨酸(histidine) | His | H | 155.16 | 6.0 |  |
| 异亮氨酸(isoleucine) | lle | I | 131.17 |  |
|
| 亮氨酸(leucine) | Leu | L | 131.17 |  |
|
| 赖氨酸(lycine) | Lys | K | 146.19 |  |
|
| 甲硫氨酸(methionine) | Met | M | 149.21 |  |
|
| 苯丙氨酸(phenylanaline) | Phe | P | 165.19 |  |
|
| 脯氨酸(proline) | Pro | P | 115.13 |  |
|
| 丝氨酸(serine) | Ser | S | 105.06 |  |
|
| 苏氨酸(threonine) | Thr | T | 119.12 |  |
|
| 色氨酸(tryptophan) | Trp | W | 204.22 | ||
| 酪氨酸(tyrosine) | Tyr | Y | 181.19 | 10.07 |  |
| 缬氨酸(valine) | Val | P | 117.15 |  |
八、遗传密码
密码子的第二位
| 密码子的第一位(5’端) | U | C | A | G | 密码子的第三位(3端’) | ||||||
| U | UUU | Phe | UCU | Ser | UAU | Tyr | UGU | Gys | U | ||
| UUC | Phe | UCC | Ser | UAC | Tyr | UGG | Gys | C | |||
| UUA | Leu | UCA | Ser | UAA | 终止(赭石) | UGA | 终止(乳白) | A | |||
| UUG | Leu | UGG | Ser | UAG | 终止(琥珀) | UGG | Trp | G | |||
| C | CUU | Leu | CCU | Pro | CAU | His | CGA | Arg | U | ||
| CUC | Leu | CCC | Pro | CAC | His | CGC | Arg | C | |||
| CUA | Leu | CCA | Pro | CAA | Gln | CGA | Arg | A | |||
| CUG | Leu | CCG | Pro | CAG | Gln | CGC | Arg | G | |||
| A | AUU | Ile | ACU | Thr | AAU | Asn | AGU | Ser | U | ||
| AUC | Ile | ACC | Thr | AAC | Asn | AGC | Ser | C | |||
| AUA | Ile | ACA | Thr | AAA | Lys | AGA | Arg | A | |||
| AUG | Met | ACG | Thr | AAG | Lys | AGC | Arg | G | |||
| G | GUU | Val | GCU | Ala | GAU | Asp | GGU | Gly | U | ||
| GUC | Val | GCC | Ala | GAC | Asp | GGC | Gly | C | |||
| GUA | Val | GCA | Ala | GAA | Glu | GGA | Gly | A | |||
| GUG | Val | GCG | Ala | GAG | Glu | GGG | Gly | G | |||
九、常用酸碱技术参数
1.
| 溶质 | 分子式 | 分子量 | mol/L | g/L | 重量(%) | 比重 | 配制mol/L溶液的加入量(ml/L) |
| 冰乙酸 | CH3COOH | 60.05 | 17.40 | 1045 | 99.5 | 1.050 | 57.5 |
| 乙酸 | 60.05 | 6.27 | 376 | 36 | 1.045 | 159.5 | |
| 甲酸 | HCOOH | 46.02 | 23.40 | 1080 | 90 | 1.200 | 42.7 |
| 盐酸 | HCl | 36.50 | 11.60 | 424 | 36 | 1.180 | 86.2 |
| 2.90 | 105 | 10 | 1.050 | 344.8 | |||
| 硝酸 | HNO3 | 63.02 | 15.99 | 1008 | 71 | 1.420 | 62.5 |
| 14.90 | 938 | 67 | 1.400 | 67.1 | |||
| 13.30 | 837 | 61 | 1.370 | 75.2 | |||
| 高氯酸 | HclO3 | 100.50 | 11.65 | 1172 | 70 | 1.670 | 85.8 |
| 9.20 | 923 | 60 | 1.540 | 108.7 | |||
| 磷酸 | H2PO4 | 80.00 | 18.10 | 1445 | 85 | 1.700 | 55.2 |
| 硫酸 | H2P`O4 | 98.10 | 18.00 | 1776 | 96 | 1.840 | 55.6 |
| 氢氧化铵 | NH4OH | 35.00 | 14.80 | 251 | 28 | 0.898 | 67.6 |
| 氢氧化钾 | KOH | 56.10 | 13.50 | 757 | 50 | 1.520 | 74.1 |
| 1.94 | 109 | 10 | 1.090 | 515.5 | |||
| 氢氧化钠 | NaOH | 40.00 | 19.10 | 763 | 50 | 1.530 | 52.4 |
| 2.75 | 111 | 10 | 1.110 | 363.4 |
2.各种浓度的酸碱贮存液的近似pH值
| 溶质 | 1Na | 0.1Na | 0.01Na | 0.001Na |
| 乙酸 | 0.40 | 2.90 | 3.40 | 3.90 |
| 盐酸 | 0.10 | 1.07 | 2.02 | 3.01 |
| 硫酸 | 0.30 | 1.20 | 2.10 | |
| 柠檬酸 | 2.10 | 2.60 | ||
| 氢氧化铵 | 11.80 | 11.30 | 10.80 | 10.30 |
| 氢氧化钠 | 14.05 | 13.07 | 12.12 | 11.13 |
| 碳酸氢钠 | 8.40 | |||
| 碳酸钠 | 11.50 | 11.00 |
J a.N为光量浓度[1N≈(1mol/L)×离子价数]。
十、放射性核素数据
1.放射性核素衰变表
| 3H | 35S | 32P | 125I | 131I | |||||
| 时间(年) | 剩余活性(%) | 时间(年) | 剩余活性(%) | 时间(年) | 剩余活性(%) | 时间(年) | 剩余活性(%) | 时间(年) | 剩余活性(%) |
| 1 | 94.5 | 2 | 98.4 | 1 | 95.3 | 4 | 95.5 | 0.2 | 98.3 |
| 2 | 89.3 | 5 | 96.1 | 2 | 90.8 | 8 | 91.2 | 0.4 | 96.6 |
| 3 | 84.4 | 10 | 92.3 | 3 | 86.5 | 12 | 87.1 | 0.6 | 95.0 |
| 4 | 79.8 | 15 | 88.7 | 4 | 82.5 | 16 | 83.1 | 1.0 | 91.8 |
| 5 | 75.4 | 20 | 85.3 | 5 | 78.5 | 20 | 79.4 | 1.6 | 87.2 |
| 6 | 71.3 | 25 | 82.0 | 6 | 74.8 | 24 | 75.8 | 2.3 | 81.2 |
| 7 | 67.4 | 31 | 78.1 | 7 | 71.2 | 28 | 72.4 | 3.1 | 76.7 |
| 8 | 63.7 | 37 | 74.5 | 8 | 67.8 | 32 | 69.1 | 4.0 | 71.0 |
| 9 | 60.2 | 43 | 71.0 | 9 | 64.7 | 36 | 66.0 | 5.0 | 65.2 |
| 10 | 56.9 | 50 | 67.0 | 10 | 61.2 | 40 | 63.0 | 6.1 | 59.3 |
| 11 | 53.8 | 57 | 63.6 | 11 | 58.7 | 44 | 60.2 | 7.3 | 53.4 |
| 12 | 50.9 | 65 | 59.6 | 12 | 55.9 | 48 | 57.4 | 8.1 | 50.0 |
| 12.3 | 50.0 | 73 | 56.0 | 13 | 53.2 | 52 | 54.8 | ||
| 81 | 52.5 | 14 | 50.7 | 56 | 52.4 | ||||
| 87.1 | 50.0 | 14.3 | 50.0 | 60 | 50.0 | ||||
2.放射性测定单位
| 单位 | 定义 | 换算 |
| 吸收放射线剂量(拉得rad) | 100尔格/克(电离辐射传给单位质量物质的能量) | 0.87rad=1r |
| 伦琴(r) | 使1克空气产生1.6×1012离子对的X或γ-射线的照射剂量 | r/0.87=1rad |
| 居里(Ci) | 每秒放射性衰变3.7×1010个原子的量 | 1Ci=103mCi=106μCi |
| 毫居(mCi) | 千分之一居里 | 1mCi=10-3Ci=103μCi |
| 微居(μCi) | 百万分之一居里(每分钟衰变2.2×106次) | 1μCi=10-6Ci=10-3MCi |
| 伯克莱尔(Bq) | 每秒衰变1个原子的量 | 1Bq=3.7×10-10Ci |
| 千伯克莱尔(kBq) | 1kBq=103Bq | |
| 百万伯克莱尔(MBq) | 1MBq=106Bq | |
| 兆伯克莱尔(GBq) | 1GBq=109Bq | |
| 每分钟衰变数(dpm) | 每分钟衰变的原子数 | 2.2×106dpm=1μCi |
| 每分钟计数(cpm) | 测量仪测出每分钟β粒子数 | Cpm=dpm×计数器效率 |
十一、原子量
| 符号 | 原子序数 | 原子量 | |
| 锕(actinium) | Ac | 89 | 227.02 |
| 铝(aluminium) | Al | 13 | 26.98 |
| 镅(americium) | Am | 95 | (243) |
| 锑(antimony) | Sb | 51 | 121.75 |
| 氩(argon) | Ar | 18 | 39.94 |
| 砷(arsenic) | As | 33 | 74.92 |
| 砹(astatine) | At | 85 | (210) |
| 钡(barium) | Ba | 56 | 137.33 |
| 锫(berkelium) | Bk | 97 | (247) |
| 铍(beryllium) | Be | 4 | 9.01 |
| 铋(bismuth) | Bi | 83 | 208.98 |
| 硼(boron) | B | 5 | 10.81 |
| 溴(bromine) | Br | 35 | 79.90 |
| 镉(cadmium) | Cd | 48 | 112.41 |
| 钙(calcium) | Ca | 20 | 40.08 |
| 锎(californium) | Cf | 98 | (251) |
| 碳(carbon) | C | 6 | 12.01 |
| 铈(cerium) | Ce | 58 | 140.12 |
| 铯(cesium) | Cs | 55 | 132.90 |
| 氯(chlorine) | Cl | 17 | 35.45 |
| 铬(chromium) | Cr | 24 | 51.99 |
| 钴(cobalt) | Co | 27 | 58.93 |
| 铜(copper) | Cu | 29 | 63.54 |
| 锔(curium) | Cm | 96 | (247) |
| 镝(dysprosium) | Dy | 66 | 162.50 |
| 锿(einsteinium) | Es | 99 | (252) |
| 铒(erbium) | Er | 68 | 167.26 |
| 铕(euroqium) | Eu | 63 | 151.96 |
| 镄(fermium) | Fm | 100 | (257) |
| 氟(fluorine) | F | 9 | 18.99 |
| 钫(francium) | Fr | 87 | (223) |
| 钆(gadolinium) | Gd | 64 | 157.52 |
| 镓(galium) | Ga | 31 | 69.72 |
| 锗(germanium) | Ge | 32 | 72.59 |
| 金(gold) | Au | 79 | 196.96 |
| 铪(hafnium) | Hf | 72 | 178.49 |
| 氦(helium) | He | 2 | 4.00 |
| 钬(holmium) | Ho | 67 | 164.93 |
| 氢(hydrogen) | H | 1 | 1.00 |
| 铟(indium) | In | 49 | 114.82 |
| 碘(iodine) | I | 53 | 126.90 |
| 铱(iridium) | Ir | 77 | 192.22 |
| 铁(iron) | Fe | 26 | 55.84 |
| 氪(krypton) | Kr | 36 | 83.80 |
| 镧(lanthanum) | La | 57 | 139.90 |
| 铹(Lawrencium) | Lr | 103 | (260) |
| 铅(lead) | Pb | 82 | 207.2 |
| 锂(lithium) | Li | 3 | 6.94 |
| 镥(lutetium) | Lu | 71 | 174.96 |
| 镁(Magnesium) | Mg | 12 | 24.30 |
| 锰(manganse) | Mn | 25 | 54.93 |
| 钔(mendelevium) | Md | 101 | (258) |
| 汞(molybdenum) | Hg | 80 | 200.59 |
| 钼(molybdenum) | Mo | 42 | 95.94 |
| 钕(neodymium) | Nd | 60 | 144.24 |
| 氖(neon) | Ne | 10 | 20.17 |
| 镎(neptunium) | Np | 93 | 237.04 |
| 镍(nickel) | Ni | 28 | 58.69 |
| 铌(niobium) | Nb | 41 | 92.00 |
| 氮(nitrogen) | N | 7 | 14.00 |
| 锘(nobelium) | No | 102 | (259) |
| 锇(osmium) | Os | 76 | 190.2 |
| 氧(oxygen) | O | 8 | 15.99 |
| 钯(palladium) | Pd | 46 | 106.42 |
| 磷(phosphorus) | P | 15 | 30.94 |
| 铂(platium) | Pt | 78 | 195.08 |
| 钚(piutonium) | Pu | 94 | (244) |
| 钋(polonium) | Po | 84 | (209) |
| 钾(potassium) | K | 19 | 39.09 |
| 镨(praseodymium) | Pr | 59 | 140.90 |
| 钜(promethium) | Pm | 61 | (145) |
| 镤(protactinium) | Pa | 91 | 231.03 |
| 镭(radium) | Ra | 88 | 226.02 |
| 氡(radon) | Rn | 86 | (222) |
| 铼(rhenium) | Re | 75 | 186.20 |
| 铑(rhodium) | Rh | 45 | 102.90 |
| 铷(rubidium) | Rb | 37 | 85.46 |
| 钌(ruthenium) | Ru | 44 | 101.07 |
| 钐(samarium) | Sm | 62 | 150.36 |
| 钪(scandium) | Sc | 21 | 44.95 |
| 硒(sillicon) | Se | 34 | 78.96 |
| 硅(sillicon) | Si | 14 | 28.08 |
| 银(sliver) | Ag | 47 | 107.86 |
| 钠(sodium) | Na | 11 | 22.98 |
| 锶(strontium) | Sr | 38 | 87.62 |
| 硫(sulfur) | S | 16 | 32.06 |
| 钽(tantalum) | Ta | 73 | 180.94 |
| 锝(technetium) | Tc | 43 | (98) |
| 碲(tellurium) | Te | 52 | 127.60 |
| 铽(terbium) | Tb | 65 | 158.92 |
| 铊(thallium) | Tl | 81 | 204.38 |
| 钍(thorium) | Th | 90 | 232.03 |
| 锡(tin) | Sn | 50 | 118.69 |
| 铥(thulium) | Tm | 69 | 168.93 |
| 钛(titanium) | Ti | 22 | 47.88 |
| 钨(tungsten) | W | 74 | 183.85 |
| unhilhexium | (Unh) | 106 | (263) |
| unnilpentium | (Unp) | 105 | (262) |
| unnilquadium | (Unq) | 104 | (261) |
| unnilseptium | (Uns) | 107 | (262) |
| 铀(uranium) | U | 92 | 238.02 |
| 钒(vanadium) | V | 23 | 50.94 |
| 氙(xenon) | Xe | 54 | 131.29 |
| 镒(ytterbium) | Yb | 70 | 173.04 |
| 钇(yttrium) | Y | 39 | 88.90 |
| 锌(zinc) | Zn | 30 | 65.38 |
| 锆(zirconium) | Zn | 40 | 91.22 |
圆括号中的数字是该元素最稳定的同位素的质量数。
(吴康)
本书常用缩写词
| 缩写 | 全称 | 中文 |
| AA | autoantibody | 自身抗体 |
| AAF | aminoacetylfluorescence | 氨乙酰基荧光 |
| Ab | antibody | 抗体 |
| ABC | avidin-biotin peroxidase complex | 抗生物素(亲合素)-生物素-过氧化物酶复合物 |
| ACh | acetycholine | 乙酰胆碱 |
| AChR | acetycholine receptor | 乙酰胆碱受体 |
| AChRAb | acetycholine receptor antibody | 乙酰胆碱受体抗体 |
| ACIF | anti-complement immunofluorescent method | 抗补体免疫荧光法 |
| α-1-ACt | alpha(α)-1-anti-chymotrypsin | α-1-抗糜蛋白酶 |
| ACTH | adrenocorticotropin hormone | 促肾上腺皮质激素 |
| AD | Alzheimer’s disease | 老年性痴呆 |
| ADDC | antibody dependent cytotoxic cell | 抗体依赖细胞毒细胞 |
| ADH | antidiuretic hormone | 抗利尿激素 |
| AEC | 3-amino-9-ethyl-carbazole | 3-氨-9-乙基咔唑 |
| AFP | alpha(α)-fetal-protein | 甲胎蛋白 |
| AHA | anti-histone antibody | 抗组蛋白抗体 |
| AKP | alkaline phosphatase | 碱性磷酸酶 |
| ALP | Alkaline Phosphatase | 碱性磷酸酶 |
| AMA | anti-mitochondrial antibody | 抗线粒体抗体 |
| ANA | anti-nuclear antibody | 抗核抗体 |
| ANCA | anti-neutrophil cytetoplasmic anti-autoantibody | 抗中性粒细胞胞浆抗自身抗体 |
| APUD | amine content and /or amine precursor uptake and de-carboxylation | 含氨和/或氨前体并能脱羧的细胞 |
| AO | Acrine Orange | 吖啶橙 |
| ARs | arsanilic acid | 对氨苯砷酸 |
| α-1-AT | alpha(α)-1-anti-trypsin | α-1-抗胰蛋白酶 |
| BCDF | B cell differetiation factor | B细胞分化因子 |
| BCGF | B cell growth protein | B细胞生长因子 |
| BGP | bone growth protein | 骨生长蛋白 |
| BGP | brain-gut peptides | 脑肠肽 |
| BMP | bone marphogenic protein | 骨形成蛋白 |
| BMZ | basement membrane zone | 基底膜带 |
| BRAB | bridged avidin-biotin technique | 桥抗生物素-生物素技术 |
| BrdU | 5-bromo-2-deoxyuridine | 5-溴尿脱氧核苷 |
| BSA | bovine serum albumin | 牛血清白蛋白 |
| CA | catecholamine | 儿茶酚胺 |
| CAg | cytoplasmic antigen | 胞质抗原 |
| CAH | chronic active hepatitis | 慢性活性性肝炎 |
| CALLA | common acute lymphocytic leukaemia antigen | 普通急性淋巴细胞性白抗原 |
| cAMP | cyclic guanosine monophosphate | 环化-磷酸鸟苷 |
| CEA | Carcinoma embryonicantigen | 癌胚抗原 |
| CDI | carbodiimide | 碳二亚胺 |
| CGRP | calcitonin gene-related peptide | 降钙素基因相关肽 |
| CHAc | choline acetylase | 胆碱乙酰化酶 |
| ChE | cholinesterase | 乙酰胆碱酯酶 |
| CIg | cytoplasmic immunoglobulin | 胞浆免疫球蛋白 |
| CK | cytokeratin | 细胞角蛋白 |
| CLA | common leukocyte antigen | 白细胞共同抗原 |
| CMV | cytomegalovirus | 巨细胞病毒 |
| CNS | central nervous system | 中枢神经系统 |
| Con.A | concanavalin A | 刀豆素A |
| CPK | creation phosphokinase | 肌酸磷酸激酶 |
| CPM | counts per minute | 每分钟计数 |
| cRNA | complementary RNA | 互补RNA |
| CRP | c-reation protein | C-反应蛋白 |
| CSF | cerebrospinal fluid | 脑脊液 |
| CT | Cholera toxin | 霍乱毒素 |
| CT-HRP | cholera-toxin-horseradish peroxidase | 霍乱毒素辣根过氧化物酶 |
| CUC | Chronic ulcerous colonitis | 慢性溃疡性结肠炎 |
| CVD | cerebrovascular disease | 脑血管病 |
| DA | dopamine | 多巴胺 |
| DAB | diaminobezidin | 二氨基联苯氨 |
| DBA | Dolichos bifows agglutinin | 双花扁豆凝集素 |
| DBH | dopamine-β-hydroxylase | 多巴胺-β羟化酶 |
| DEAE | diethyl-amino-ethyl-dextran | 二乙氨乙基葡聚糖 |
| DEPC | diethyl pyrocarbonate | 焦碳酸二乙酯 |
| DDC | dopamine decarboxylase | 多巴胺脱羧酶 |
| Des | desmine | 结蛋白 |
| DIF | direct immunofluorescent method | 直接免疫荧光法 |
| Dig | digoxigenin | 地高辛 |
| DMDC | dimethydichlorasilane | 二甲基二氯硅烷 |
| DMF | dimethyformamide | 二甲基甲酰胺 |
| DMSO | dimethyl sulfoxide | 二甲基亚砜 |
| DNA | deoxyribonucleic acid | 脱氧核糖核酸 |
| DNP | dinitrophenyl aminopropionitrile imide ester | 二硝基苯氨基丙氰亚酰氨酸酯 |
| DRC | dendric reticulum cell | 树突状网状细胞 |
| dsDNA | double stranded DNA | 双链DNA |
| DTT | dithiothreitol | 二硫苏糖醇 |
| DYN | dynorphin | 强啡肽 |
| EBV | Epistein-Barr virus | E-B病毒 |
| ECD-G1 | 1-ethyl-3(3-dimethy-aminopropyl)carbodiimide-HCL-Glutaldehyde | 碳二亚酰胺-戊二醛 |
| ECM | extracellular matrix | 细胞外基质 |
| ED50 | median effective dose | 半数有效剂量 |
| EDTA | ethylendiaminotetraacetic acid | 乙二氨四乙酸 |
| EK | epidermal keratin | 表皮角蛋白 |
| ELISA | enzyme-liked immunosorbent assay | 酶联免疫吸附分析 |
| EM | electron microscope | 电镜 |
| ENK | enkephalin | 脑啡肽 |
| L-ENA (L-NK) |
Leu-enkephalin | 亮氨酸-脑啡肽 |
| M-ENK (M-NK) |
met-enkephalin | 甲硫氨酸-脑啡肽 |
| ENS | enteric nervous system | 肠神经系统 |
| β-EP | β-endorphin | β-内啡肽 |
| FA | formaldehyde | 甲醛 |
| Fab | antigen-binding fragment | 抗原结合片段 |
| FACs | fluorescent actived cell sortor | 荧光激活细胞计数器 |
| FAV | flat agranular vesicle | 扁平无颗粒囊泡 |
| FB | fast blue | 快蓝 |
| Fc | crystallizable fragment | 可结晶片段 |
| FCC | follicular centre cell | 滤泡中心细胞 |
| FCM | flow cytometer | 流式细胞计数仪 |
| FCP | feature count point | 特征计数点 |
| FDA | fluorescin diacetate | 二醋酸酯荧光素■[此处缺少一些内容]■ |
| FSH | follicle-stimulating hormone | 卵泡刺激素 |
| FTA | fluorescent treponemal antibody | 荧光梅素螺旋体抗体 |
| FTA-ABS | fluorescent treponemal antibody absorption test | 荧光梅毒螺旋体抗体吸收实验 |
| GAB | gold-labelled antibody | 金标抗体 |
| GABA | gamma(γ)-amino-butyric acid | γ-氨基丁酸 |
| GALT | gut –associated lymphoid tissue | 胃肠道相关淋巴组织 |
| GAR | goat anti-rabbit serum | 羊抗兔血清 |
| GCA | gastrin cell antibody | 胃泌素细胞抗体 |
| GFAP | glial fibrillary acidic protein | 胶质纤维酸性蛋白 |
| GFL | green fluorescence | 绿色荧光 |
| GH | growth hormone | 生素激素 |
| GLAD | gold-labelled antigen detection method | 金标抗原检测法 |
| GMA | glycol methacrylate | 乙二醇甲基丙烯酸酯 |
| GOD | glucose oxidase | 葡萄糖氧化酶 |
| GP | gold particle | 金颗粒 |
| HAV | hepatitis A virus | 甲型肝炎病毒 |
| HBV | hepatitis B virus | 乙型肝炎病毒 |
| HBV-DNA | hepatitis B virus DNA | 乙型肝炎病毒DNA |
| HC | Huntington’s chorea | 亨廷顿氏舞蹈症 |
| HCG | human chorionic gonadotropin | 人绒毛膜促性腺激素 |
| HE | hemotoxylin and eosin staining | 苏木精-伊红染色 |
| HEMA | 2-hydroxyethyl methacrylate | 羟乙基甲基丙烯酸酯 |
| HGH | human growth factor | 人生长激素 |
| 5-HIAA | 5-hydroxyindoleacetic acid | 5-羟吲哚乙酸 |
| HLA | human leukocyte antigen | 人类白细胞抗原 |
| HMA | hepatocyte membrane antibody | 肝细胞膜抗体 |
| HP | horizontal plate | 水平面 |
| HPL | human placenta lactogen | 人胎盘催乳素 |
| HPRI | human placental ribonuclease inhibitor | 人胎盘核糖核酸抑止剂 |
| HRP | horseradish peroxidase | 辣根过氧化物酶 |
| HSA | human sreum albumin | 人血清白蛋白 |
| 5-HT | 5-hydroxytryptamine(serotonin) | 5-羟色氨 |
| HTLV | human T-lymphocyte virus | 人T-淋巴细胞病毒 |
| LCAb | islet cell antibody | 胰岛细胞抗体 |
| ICAM | intercellular adhersion molecule | 细胞间粘附因子 |
| ICC | immunocytochemistry | 免疫细胞学 |
| IDD | insulin dependent diabetes | 胰岛素依赖性糖尿病 |
| IDRC (IRC) |
interdigitate reticulum cell | 指突状网状细胞 |
| IEL | intraepithelial lymphocyte | 上皮内淋巴细胞 |
| IF | intermediate filament | 中间丝 |
| Ig | immunoglobulin | 免疫球蛋白 |
| IGS | immunogold staining | 免疫金染色 |
| IGSS | immunogold –silver staining | 免疫金-银染色 |
| IHC | immunohistochemistry | 免疫组织化学 |
| IIF | indirect immnnofluotesent method | 间接免疫荧光法 |
| IRIA | indirect radioimmunoassay | 间接放射免疫分析 |
| LAB | labelled avidin-biotin technique | 标记抗生物素(亲合素)-生物素技术 |
| LBT | Lupus Band Test | 狼疮带实验 |
| LC | Langerhan’s cell | 朗格罕氏细胞 |
| LCA | Lens culinaris agglutinin | 扁豆凝集素 |
| LCR | ligose chain reaction | 连接链式反应 |
| LDH | lactate dehydrogenase | 乳酸脱氢酶 |
| LFA | leukcyte function- associated antigen | 白细胞功能相关抗原 |
| LGV | large granular vesicle | 有颗粒大囊泡 |
| LH | luteinizing hormone | 黄体生成素 |
| LHRH | luteinizing hormone relasing hormone | 黄体生成素释放激素 |
| LHRF | luteinizing hormone relasing factor | 黄体生成素释放因子 |
| β-LPH | β-lipotropic hormone | β-促脂素 |
| LPL | lamina propria T lymphcyte | 固有层T淋巴细胞 |
| LPO | lactiperoxidase | 乳过氧化物酶 |
| MAG | myelin associated glycoprotein | 髓鞘相关糖蛋白 |
| MG | myasthenia gravis | 重症肌无力 |
| β-MG | β-microglobin | β-微球蛋白 |
| MBP | myelic basic protein | 髓磷酯碱性蛋白 |
| MBPAb | myelic basic protein antibody | 髓磷酯碱性蛋白抗体 |
| McAB | monoclonal antibody | 单克隆抗体 |
| MF | microfilament | 微丝 |
| Mg | myohemoglobin | 肌红蛋白 |
| MHC | man histocompatibility complex | 人类组织相溶性复合物 |
| mRNA | messenger ribonucleic acid | 信使核糖核酸 |
| MS | multiple sclerosis | 多发性硬化症 |
| MSH | melanocyte stimulating hormone | 黑色素细胞刺激素 |
| MsIg | membrane superfacial immuno-globulin | 膜表面免疫球蛋白 |
| NA | noradrenalin | 去甲肾上腺素 |
| NAChR | nicotinic acetylcholine receptor | 烟碱型乙酰胆碱受体 |
| NADH | nicotinamide adenine dinucleotide diaphorase | 尼克酰胺腺嘌呤二核苷酸黄递酶 |
| NANC | non-adrenergic-non-cholinergic | 非肾上腺素能非胆碱能 |
| NE | norepinephrine | 去甲肾上腺素 |
| NF | neurofilament | 神经丝 |
| NK | natural killer | 自然杀伤细胞 |
| NNE | non-neuronal enolase | 非神经元性烯醇化酶 |
| NP | neuropeptide | 神经肽 |
| NPY | neuropeptide Y | 神经肽Y |
| NSE | neuron-specific enolase | 神经元特异性烯醇化酶 |
| NT | neurotensin | 神经降压肽 |
| OD | optical density | 光密度 |
| 6-OHDA | 6-hydroxydopamine | 6-羟多巴胺 |
| ORF | open reading frame | 开放读框 |
| ORT | optimum renaturation temperature | 最适复性温度 |
| OT | oxytocin | 催产素 |
| PAG | protein A-gold technique | 蛋白A-金技术 |
| PAP | perbxidase anti-peroxidase complex | 过氧化物酶-抗氧化物酶复合物 |
| PB | phosphate buffer | 磷酸缓冲液 |
| PBS | phosphate buffered saline | 磷酸盐缓冲液 |
| PCA | gastric parietal cell antibody | 胃壁细胞抗体 |
| PcAb | polyclonal antibody | 多克隆抗体 |
| PCR | polymerase chain reaction | 聚合酶链反应 |
| PD | Parkinson’s disease | 帕金森氏症(震颤麻痹) |
| PEG | polyethylene glycol | 聚乙二醇 |
| PFA | paraformaldehyde | 多聚甲醛 |
| PG | prostaglandin | 前列腺素 |
| pH | symbol for expression of hydrogenion cincentration | 表示氢离子浓度的符号 |
| PHA | phaseolus vulgaris agglutinin | 菜豆凝集素 |
| PHA | phytohemagglutinin | 植物凝集素 |
| PHSA | poly human serium antigen | 多聚人血清蛋白 |
| pI | propidium Iodide | 磺化吡啶 |
| PLL | poly-L-Lysine | (左旋)多聚赖氨酸 |
| PLP | paraformaldehyde-lysine peroxidase | 多聚甲醛-赖氨酸-过磺酸盐混合固定剂 |
| PNA | peanut agglutinin | 花生凝集素 |
| POM | proopiomelanocortin | 前促黑激素 |
| PP | placenta protein | 胎盘蛋白 |
| PP | pancreas polypeptide | 胰多肽 |
| PR | progesteron receptor | 孕激素受体 |
| PSA | Pisum sativum agglutinin | 豌豆凝集素 |
| PSS | progressive systemic sclerosis | 进行性全身性硬化 |
| PVP | polyvinypyrolidone | 聚乙烯吡咯烷酮 |
| PB200 | rhodamin B200 | 诺丹明B200 |
| RCA | Ricinus communis agglutinin | 蓖麻凝集素 |
| RFL | red fluorescence | 红色荧光 |
| RH | reactive hyperplasia | 反应性增生 |
| RIA | Radioimmunoasay | 放射免疫分析 |
| RIA-CPB | RIA-competitive protein binding | 放免-竞争性蛋白结合 |
| RANA | rheumatoid anti-nuclea antigen | 类风湿性关节 炎抗核抗原 |
| RPGN | rapid progressive nephritis | 进行性肾小管肾炎 |
| RPM | rolls per minute | 每分钟转速 |
| RRA | radioreceptoassay | 放射受体分析 |
| RT-PCR | reverse transiption-PCR | 反转录-PCR |
| RSA | rabbit serum albumin | 兔血清白蛋白 |
| R-Sc | Reed-Sternberg’s cell | 瑞-司氏细胞 |
| Z/R | Reinheit Zahl | 光密度比值 |
| SAV | small agranular vesicle | 无颗粒小泡 |
| SBA | soybean agglutinin | 大豆凝集素 |
| SC | secretory component | 分泌成份 |
| SCV | small clear vesicle | 清亮小泡 |
| SDS | sodium decdecyl sulfate | 十二烷基硫酸钠 |
| SGV | samll granular vesicle | 有颗粒小泡 |
| SIg | secretory immunoglobulin | 分泌型免疫球蛋白 |
| SIS | skin immunosystem | 皮肤免疫系统 |
| SJA | Sophora japonica agglutinin | 槐凝集素 |
| SLE | systemic lupus erythematosus | 全身性红斑狼疮 |
| SMA | smooth muscle Ab | 平滑肌抗体 |
| SN | small nuclea | 小核 |
| SMA | smooth muscle antibody | 平滑肌抗体 |
| S/N | signal/noise(ratio) | 信/噪(比) |
| SOM | somatostatin | 生长抑素 |
| SP | silver particle | 银颗粒 |
| SP | substance P | P物质 |
| SPA | staphylococal protein A | 金黄色葡萄球菌蛋白A |
| SSPE | subacute sclerosing nencephalitis | 亚急性硬化性脊脑炎 |
| TAS | transcription based amplification system | 转录依赖扩增系统 |
| TBS | Tris bufferred saline | Tris缓冲生理盐水 |
| TE | Trypanosona Equiperdum | 马疫锥虫 |
| β-TG | β-thromboglobulin | β-血栓蛋白 |
| TG | thyroid globulin | 甲状腺球蛋白 |
| TGF | transforming growth factor | 转化生长因子 |
| TH | tyrosine hydroxylase | 酪氨酸羟化酶 |
| TMB | tetramethylbenzidine | 四甲基联苯氨 |
| TRH | thyrotropin releasing hormone | 促甲状腺素释放素 |
| T(M)RITC | tetramethylrhodamine –isothiocyanate | 异硫氰酸四甲基诺丹明 |
| TSH | thyroxin stimulating hormone | 促甲状激素 |
| UEA | Ulex Europaeus agglutinin | 荆豆凝集素 |
| Vim | vimentin | 波纹蛋白 |
| VIP | vasoactive intestinal polypeptide | 血管活性肠肽 |
| VP | Vertical plane | 垂直面 |
| WGA | wheat germ agglutinin | 麦胚凝集素 |
